近红外荧光分子探针在胃癌分子成像中的应用研究
贺 玲, 屈亚威, 王伟岸, 夏悯馨, 刘海峰
1.安徽医科大学,安徽 合肥 230032;2.武警总医院消化内科
近红外荧光分子探针在胃癌分子成像中的应用研究
贺 玲1,2, 屈亚威2, 王伟岸2, 夏悯馨2, 刘海峰2
1.安徽医科大学,安徽 合肥 230032;2.武警总医院消化内科
目的 评估3种近红外荧光分子探针在胃癌分子成像中的靶向性和荧光效应,为胃癌荧光分子成像筛选可用的靶向分子探针。方法 选用3种近红外荧光分子探针(IntergriSenseTM750、FolateRsenseTM680、MMPSenseTM750FAST),并以吲哚菁绿作为对照组,经裸鼠胃癌皮下移植瘤模型尾静脉注射探针后进行活体荧光分子成像,量化分析肿瘤部位荧光信号强度。离体荧光分子成像观察探针的生物分布和代谢。成像结束后,对移植瘤进行组织学及3种探针相应分子靶点(αvβ3、FRα、MMP)免疫组织化学检测。结果 活体荧光分子成像结果显示探针(IntergriSenseTM750、FolateRsenseTM680、MMPSenseTM750FAST)均在荷瘤鼠肿瘤部位出现浓聚,浓聚高峰分别在注射后1 h、1 h、24 h。与对照组相比,上述3种分子探针有较好的靶向性和信噪比。离体荧光分子成像证实探针主要经肝、肾代谢。免疫组化表明3种探针对应的分子靶点在裸鼠胃癌皮下移植瘤均有表达。结论 以上3种探针可用于胃癌荧光分子成像。αvβ3、FRα、MMP可作为胃癌荧光分子成像的靶点。
近红外;荧光分子成像;胃癌;探针;鼠模型
目前,早期胃癌及癌前病变的检测主要依赖白光内镜观察病变及活检后的病理定性,而多数早癌形态结构变化不明显且病变活检定位缺乏准确性,导致漏诊率很高[1]。近年来,将荧光分子成像(fluorescence molecular imaging, FLI)与消化内镜融合形成的荧光分子内窥成像技术得到了迅猛发展,有望成为早期胃癌检测技术的新突破。荧光内窥成像通过静脉注射或表面喷洒荧光探针靶向病变区域,然后用相应的设备激发使病变部位“发光”,进而捕捉到荧光信号并对病变进行观察和检测,使得在内镜下进行消化道肿瘤分子诊断成为可能,其效果相当于在体免疫组织化学检查,同时也能指导肿瘤的靶向治疗[2]。
要想实现荧光分子内窥成像在早期胃癌诊断中的临床转化,必须有能和肿瘤细胞或细胞间质靶向性结合的荧光分子探针。因此开发特异性强、靶向性好、无毒的荧光探针成为研究热点。另外,对比可见光波段的荧光成像,近红外荧光成像拥有更强的组织穿透性和更高的信噪比[3]。故本实验选用近红外窗的3种商业化靶向性荧光探针(IntergriSenseTM750、FolateRsenseTM680、MMPSenseTM750FAST),利用临床可用的非靶向性荧光探针吲哚菁绿(indocyanine green, ICG)作对照,对胃癌裸鼠皮下移植瘤模型进行活体和离体FLI,并对肿瘤组织进行相应的抗原抗体免疫组化检测,从而验证这3种探针在胃癌分子成像中的靶向性和荧光效应,为日后研发临床可用的胃癌靶向性荧光分子探针助力。
1 材料与方法
1.1 材料
1.1.1 主要试剂:IntergriSenseTM750、FolateRsenseTM680、MMPSenseTM750FAST探针购自美国PerkinElmer公司;ICG购自辽宁天医生物制药公司;PBS、RPMI 1640培养基购自美国Gbico公司;异氟烷购自山东科源制药公司;鼠抗人αvβ3单抗原液购自美国NOVUS公司;鼠抗人MMP2单抗、鼠抗人FRα单抗购自北京西雅金桥生物公司。
1.1.2 主要仪器:IVIS®Spectrum小动物活体成像仪购自美国PerkinElmer公司,小动物气体麻醉装置购自美国Caliper公司。
1.1.3 细胞株:人胃癌细胞SGC-7901购自中国医学科学院细胞中心,由军事医学科学院放射与辐射医学研究所肿瘤药理室传代、保存。
1.1.4 实验动物:4~6周龄Bal b/c裸鼠,SPF级,体质量18~22 g,雌性,购自北京维通利华公司。受试动物饲养于无菌的独立送风IVC笼中,用专门为小鼠配制的消毒饲料、瓜子、纯净水饲喂。
1.2 实验方法
1.2.1 细胞培养:SGC-7901细胞接种于含100 g/L胎牛血清的RPMI 1640培养基(含青霉素100 U/ml,链霉素100 U/ml),置于体积分数为5%的CO2、37 ℃培养箱中培养,2.5 g/L胰蛋白酶消化、传代。
1.2.2 裸鼠胃癌皮下移植瘤模型构建:将处于对数期的SGC-7901细胞用胰酶消化、离心(1 200 r/min,5 min),生理盐水洗涤后重悬,调整细胞浓度为3×107ml-1。16只裸鼠分别于右侧腋下接种0.2 ml单细胞悬液,待肿瘤长至0.8~1.0 cm备用。
1.2.3 成像前准备:(1)配制探针:IntergriSenseTM750、FolateRsenseTM680、MMPSenseTM750FAST、ICG冻干粉溶于无菌PBS中,4 ℃避光保存;(2)麻醉:异氟烷持续吸入麻醉至裸鼠四肢无力。
1.2.4 活体FLI:16只荷瘤鼠,分4组,每组4只,每组荷瘤鼠依次尾静脉注射2 nmol/100 μl IntergriSenseTM750、FolateRsenseTM680、MMPSenseTM750FAST、ICG,注射探针前、后1 h、3 h、7 h、24 h、48 h利用IVIS®Spectrum进行FLI,Living Image软件分析图像,以肿瘤部位为中心,直径10 mm的圆形区域划感兴趣区域(region of interest, ROI),测量各时间点ROI的平均荧光信号强度。
1.2.5 离体FLI:待以上荷瘤鼠体内探针完全代谢后(约4 d),重新分别尾静脉注射2 nmol/100 μl IntergriSenseTM750、FolateRsenseTM680、MMPSenseTM750FAST、ICG,各探针在瘤体浓聚高峰时和探针注射后48 h分别处死各组荷瘤鼠,剥离瘤体及主要脏器(心、肝、脾、双肾),用PBS洗涤后,再用上述方法立即进行FLI,测量其平均荧光信号强度。
1.2.6 组织学检查:离体FLI结束后,肿瘤组织经病理学检查,明确组织类型,并行各探针对应靶点免疫组化(immunohistochemistry,IHC)检测验证各探针的特异性。
2 结果
2.1 活体FLI 连续动态FLI结果显示,尾静脉注射各探针后,随着时间的推移,与ICG相比,3种靶向性探针逐渐在皮下移植瘤浓聚,小动物活体成像仪能在瘤体探测到明显的荧光信号,与邻近正常组织对比明显。量化瘤体平均荧光信号强度可见3种探针(IntergriSenseTM750、FolateRsenseTM680、MMPSenseTM750FAST)在肿瘤浓聚高峰时间不一,依次为探针注射后1 h、1 h、24 h。而ICG注射后主要聚集在肝脏,48 h后完全排出体外,持续成像没有在瘤体探测到明显的特异性荧光信号(见图1~2)。
2.2 离体FLI 探针在瘤体浓聚高峰时以及探针注射后48 h对肿瘤及主要脏器(心、肝、脾、双肾)进行离体FLI,量化各脏器平均荧光信号强度,获得各探针在裸鼠胃癌移植瘤模型的代谢及组织分布情况。MMPSenseTM750FAST和IntergriSenseTM750经肝、肾同时代谢,而FolateRsenseTM680主要经肾脏代谢,探针注射后48 h在瘤体仍能探测到荧光信号,但均较代谢器官(肝脏或肾脏)弱。ICG主要聚集在肝脏,注射后48 h经肝、肾代谢后完全排出体外(见图3~4)。
2.3 组织学检查结果 裸鼠胃癌皮下移植瘤进行组织学和3种靶向性探针所对应靶点(αvβ3、FRα、MMP)的IHC检测。HE染色证实该移植瘤为胃癌,3种特异性荧光探针IntergriSenseTM750、FolateRsenseTM680和MMPSenseTM750FAST各自对应的分子靶点αvβ3、FRα和MMP在移植瘤均有不同程度表达(见图5)。
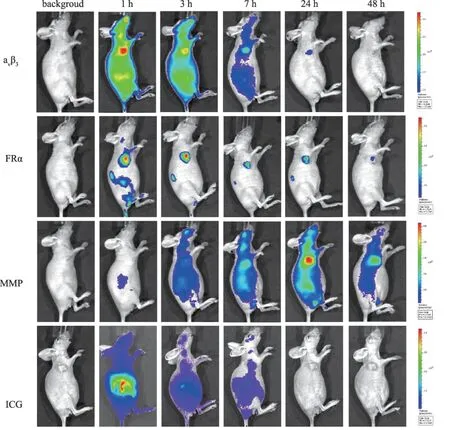
图1 裸鼠胃癌皮下移植瘤模型活体荧光分子成像图Fig 1 Subcutaneous xenograft models in vivo fluorescence imaging
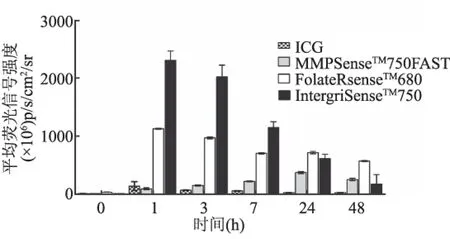
图2 特异性荧光探针与ICG在肿瘤部位平均荧光信号强度随时间变化图
Fig 2 The fluorescence intensity of the specific probes and ICG in the tumor site changes over time
3 讨论
基于荧光靶向性探针的胃癌荧光分子成像能在病变形态结构改变前,从分子水平识别和描述病变的在体黏膜特征[6]。胃癌发生、发展过程中有一些高表达的分子可以作为肿瘤诊断的候选靶点,比如胃癌特异性抗原(MG7、MGb2)[4-5],细胞表面的一些特异性受体(如:整合素[6]、表皮生长因子受体[7]、血管内皮生长因子受体[8]、肝细胞生长因子受体[9]等),或蛋白水解酶(基质金属蛋白酶[10]、组织蛋白酶B[11]等)及一些小分子受体(叶酸受体α[12])等。荧光分子探针能与这些靶点特异性结合高亮肿瘤从而实现病变的荧光检测。目前基于靶向性荧光分子探针的胃癌成像仍停留在动物和人离体组织标本研究阶段。2012年,Hoetker等[13]用荧光染料AlexaFlour488标记西妥昔单抗构建了靶向表皮生长因子受体(epidermal growth factor receptor, EGFR)的荧光探针,经尾静脉注射该探针到裸鼠胃癌皮下移植瘤模型体内,利用共聚焦激光显微内镜(confocal laser endomicroscopy, CLE)在荷瘤鼠瘤体上观察到西妥昔单抗组荧光强度明显高于对照组,并在亚细胞水平定位了EGFR的分布。MG7抗原是第四军医大学课题组发现的一种特异性较高的胃癌相关抗原,在胃癌组织中表达率高达94%,在胃癌患者血清中的检出率为83.6%,是极具早期诊断价值的胃癌分子标志物[4]。2013年,Li等[4]将AlexaFlour488标记的抗MG7单克隆抗体与新鲜人胃癌组织及正常胃组织体外共孵育后利用CLE检测,结果显示23例胃癌组织标本中22例有特异性荧光信号,而非癌组织标本则无或仅有弱荧光信号。
荧光内窥成像技术向临床转化的最大阻碍就是靶向性荧光探针在人体应用的安全性。因此,开发临床可用的靶向性探针将会是胃癌荧光内窥成像研究中的重要方向。整合素αvβ3作为细胞黏附分子和细胞表面受体,它在胃癌表面和新生血管内皮细胞中的表达上调,通过特定的信号转导通路削弱细胞与细胞之间或细胞与基质之间的黏附并影响肿瘤细胞的生长和凋亡,参与肿瘤血管生成、侵袭和转移[6]。整合素能促进基质金属蛋白酶(matrix metalloproteinases,MMP)的表达,MMP通过降解肿瘤周围的基质而促进细胞转移,其活性增强或表达上调与胃癌浸润转移有着密切关联[10]。叶酸受体α(folate receptor α, FRα)是一种细胞表面蛋白,已被证实为一种新的肿瘤标记物,在多种实体瘤(包括胃癌)中高表达[12]。另外,由于活体内的血红蛋白、水和脂质对600~900 nm的近红外荧光的吸收率最低,与可见光相比,近红外荧光成像拥有更深的组织穿透性且自体荧光干扰少[10]。
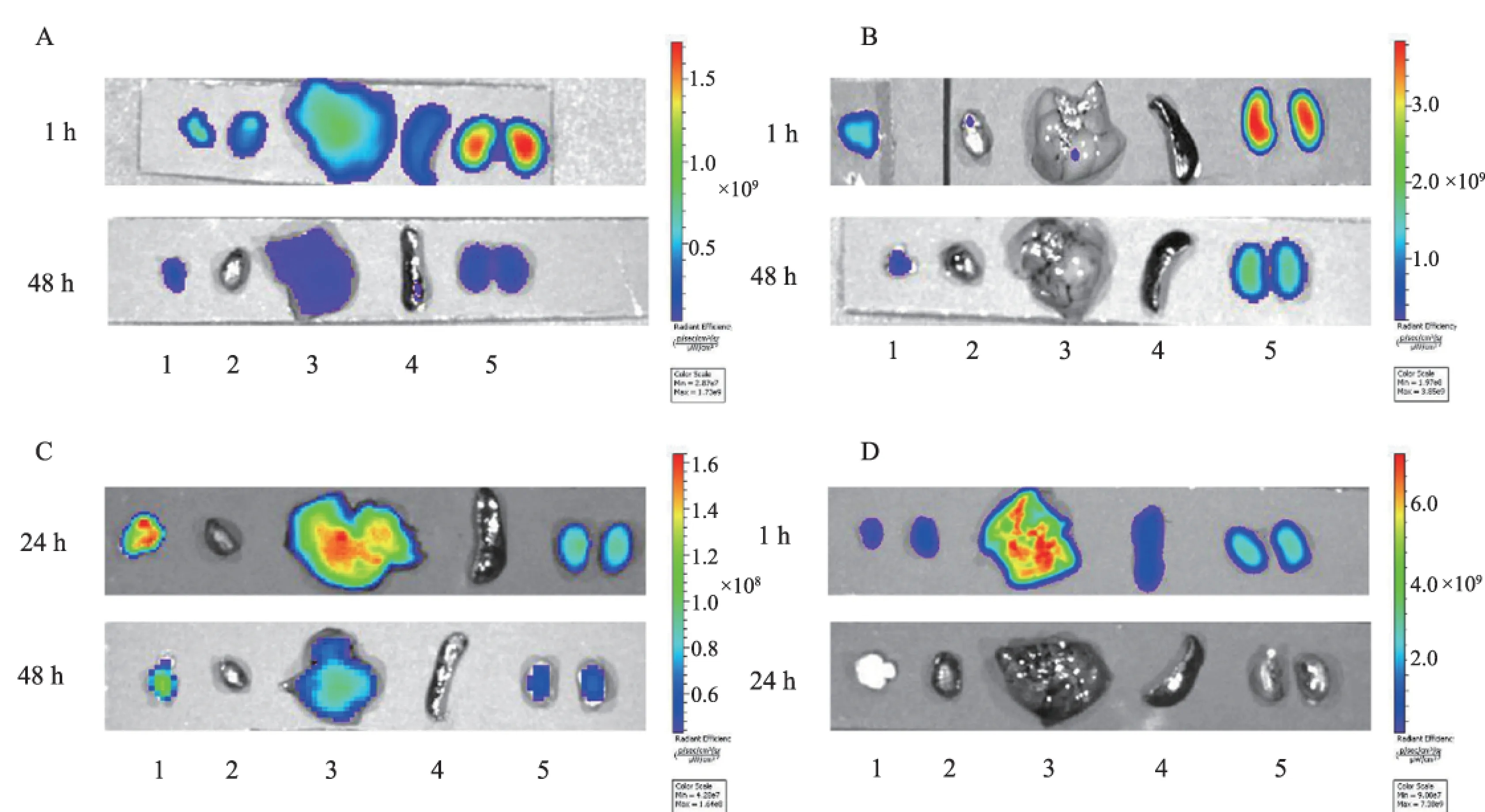
注:图中1、2、3、4、5分别指肿瘤、心脏、肝脏、脾脏、双肾。图3 组织离体FLI图 A: αvβ3; B: FRα; C: MMP; D: ICGFig 3 Ex vivo FLI of tissue A: αvβ3; B: FRα; C: MMP; D: ICG
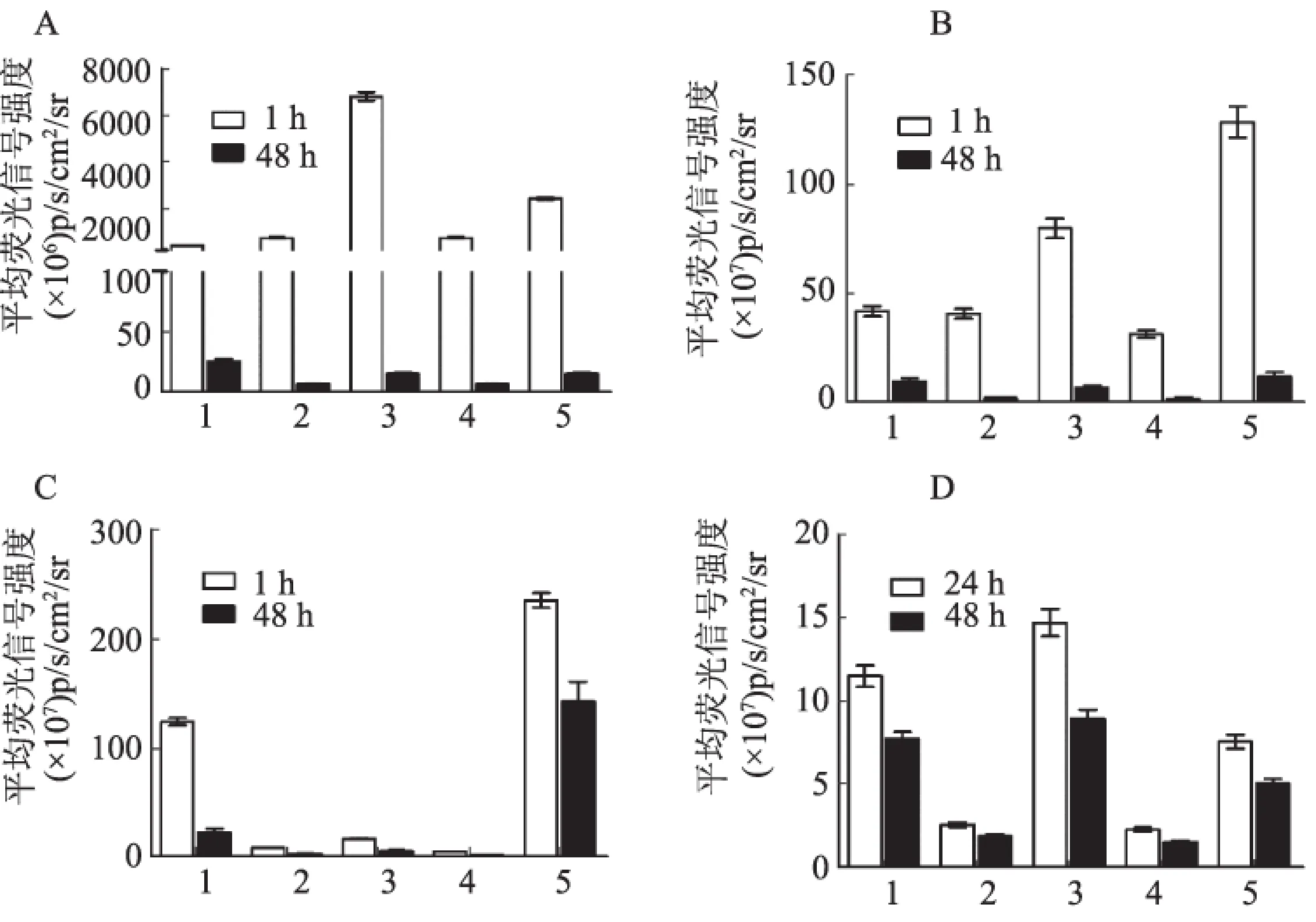
注:图中1、2、3、4、5分别指肿瘤、心脏、肝脏、脾脏、双肾。
图4 探针在瘤体浓聚高峰时以及探针注射后48 h的组织分布图 A: ICG; B: IntergriSenseTM750; C: FolateRsenseTM680; D: MMPSenseTM750FAST
Fig 4 The distribution of the probe at the peak tumor concentration and 48 hours after the injection of the probe A: ICG; B: IntergriSenseTM750; C: FolateRsenseTM680; D: MMPSenseTM750FAST
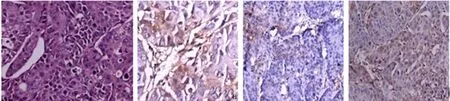
图5 裸鼠胃癌皮下移植瘤HE染色和免疫组化结果图(400×) A: HE; B: αvβ3; C: FRα; D: MMP
Fig 5 HE staining and immunohistochemical analysis of transplanted tumors in nude mice (400×) A: HE; B: αvβ3; C: FRα; D: MMP
本实验选用αvβ3、FRα、MMP作为胃癌荧光分子成像的目标靶点,利用与上述靶点对应的近红外靶向荧光分子探针(IntergriSenseTM750、FolateRsenseTM680、MMPSenseTM750FAST)进行胃癌的荧光诊断成像。活体FLI和离体FLI结果显示,尾静脉注射各探针后,探针立即全身分布,与ICG相比,3种靶向性探针逐渐在皮下移植瘤浓聚,小动物活体成像仪能在瘤体探测到明显的荧光信号,与邻近正常组织对比明显。量化分析ROI平均荧光信号强度证实探针IntergriSenseTM750、FolateRsenseTM680、MMPSenseTM750FAST在肿瘤浓聚高峰时间不一,依次为注射后1 h、1 h、24 h。注射后48 h在瘤体仍能探测到荧光信号,但均较代谢器官(肝脏或肾脏)弱。而ICG注射后主要在肝脏聚集,48 h后经肝脏代谢、经肾脏完全排出体外,持续成像没有在瘤体探测到明显的特异性荧光信号。本实验首次证明,这3种特异性荧光分子探针对胃癌具有良好的靶向性,并且成像清晰、定位准确。免疫组化提示,各探针对应靶点在裸鼠皮下移植瘤中表达均阳性。结合荧光分子成像和免疫组化结果证实FRα、αvβ3和MMP可以作为荧光分子成像诊断胃癌的特异性靶点,这3种近红外商业探针也可应用于胃癌的荧光诊断研究。
荷瘤鼠持续活体FLI和离体脏器FLI证实上述靶向探针在注射后48 h,除移植瘤外,其他部位仍可见强度不一的荧光信号,提示与瘤体未结合的探针仍未完全排除体外,这可能与探针分子量大,代谢缓慢,血清半衰期长有关。如果探针全身应用后易在体内积累,会增加背景噪音,降低肿瘤病变的信噪比,影响活体成像效果。在后续研究中,可以以这些靶点为基础,筛选出分子量更小的配体(如短肽[14]、核酸适体[15]等),与荧光物质结合,构建出药代动力学及组织分布特性更优秀的胃癌靶向性荧光探针。目前,胃癌荧光分子成像依旧处于临床前研究阶段,而食管和结肠瘤变已有人在体FLI研究成果报道[16-18]。相信在不久的将来,胃癌荧光分子诊断也会取得突破性进展。
[1]李兆申, 邹文斌. 如何提高内镜下早期胃癌的诊断水平[J]. 胃肠病学和肝病学杂志, 2016, 25(6): 601-604. Li ZS, Zou WB. Optimizing early gastric cancer detection under gastroscopy [J]. Chin J Gastroenterol Hepatol, 2016, 25(6): 601-604.
[2]Li M,Wang TD. Targeted endoscopic imaging [J]. Gastrointest Endosc Clin N Am, 2009, 19(2): 283-298.
[3]Goetz M, Wang TD. Molecular imaging in gastrointestinal endoscopy [J]. Gastroenterology, 2010, 138(3): 828-833, e1.
[4]Li Z, Zuo XL, Li CQ, et al. In vivo molecular imaging of gastric cancer by MG7 antigen with confocal laser endomicroscopy [J]. Endoscopy, 2013, 45(2): 79-85.
[5]Qiao R, Liu C, Liu M, et al. Ultrasensitive in vivo detection of primary gastric tumor and lymphatic metastasis using upconversion nanoparticles [J]. ACS Nano, 2015, 9(2): 2120-2129.
[6]Boger C, Warneke VS, Behrens HM, et al. Integrins alphavbeta3 and alphavbeta5 as prognostic, diagnostic, and therapeutic targets in gastric cancer [J]. Gastric Cancer, 2015, 18(4): 784-795.
[7]Higaki E, Kuwata T, Nagatsuma AK, et al. Gene copy number gain of EGFR is a poor prognostic biomarker in gastric cancer: evaluation of 855 patients with bright-field dual in situ hybridization (DISH) method [J]. Gastric Cancer, 2016, 19(1): 63-73.
[8]Chen J, Zhou SJ, Zhang Y, et al. Clinicopathological and prognostic signifcance of galectin-1 and vascular endothelial growth factor expre-ssion in gastric cancer [J]. World J Gastroenterol, 2013, 19(13): 2073-2079.
[9]Hwang DW, Bahng N, Ito K, et al. In vivo targeting of c-Met using a non-standard macrocyclic peptide in gastric carcinoma [J]. Cancer Lett, 2017, 385: 144-149.
[10]Ding S, Eric Blue R, Chen Y, et al. Molecular imaging of gastric neoplasia with near-infrared fluorescent activatable probes [J]. Mol Imaging, 2012, 11(6): 507-515.
[11]Gao W, Xua J, Wang F, et al. Mitochondrial proteomics approach reveals voltage-dependent anion channel 1 (VDAC1) as a potential biomarker of gastric cancer [J]. Cell Physiol Biochem, 2015, 37(6): 2339-2354.
[12]Assaraf YG, Leamon CP, Reddy JA. The folate receptor as a rational therapeutic target for personalized cancer treatment [J]. Drug Resist Updat, 2014, 17(4-6): 89-95.
[13]Hoetker MS, Kiesslich R, Diken M, et al. Molecular in vivo imaging of gastric cancer in a human-murine xenograft model: targeting epidermal growth factor receptor [J]. Gastrointest Endosc, 2012, 76(3): 612-620.
[14]Zhang D, Jia H, Wang Y, et al. A CD44 specific peptide developed by phage display for targeting gastric cancer [J]. Biotechnol Lett, 2015, 37(11): 2311-2320.
[15]Song Y, Zhu Z, An Y, et al. Selection of DNA aptamers against epithelial cell adhesion molecule for cancer cell imaging and circulating tumor cell capture [J]. Anal Chem, 2013, 85(8): 4141-4149.
[16]Sturm MB, Joshi BP, Lu S, et al. Targeted imaging of esophageal neoplasia with a fluorescently labeled peptide: first-in-human results [J]. Sci Transl Med, 2013, 5(184): 184ra61.
[17]Burggraaf J, Kamerling IM, Gordon PB, et al. Detection of colorectal polyps in humans using an intravenously administered fluorescent peptide targeted against c-Met [J]. Nat Med, 2015, 21(8): 955-961.
[18]Liu J, Zuo X, Li C, et al. In vivo molecular imaging of epidermal growth factor receptor in patients with colorectal neoplasia using confocal laser endomicroscopy [J]. Cancer Letters, 2013, 330(2): 200-207.
(责任编辑:马 军)
Application of near infrared fluorescent molecular probe in molecular imaging of gastric cancer
HE Ling1,2, QU Yawei2, WANG Weian2, XIA Minxin2, LIU Haifeng2
1.Anhui Medical University, Hefei 230032; 2.Department of Gastroenterology, General Hospital of Chinese People’s Armed Police Forces, China
Objective To evaluate the targeting ability and fluorescence efficiency of three kinds of near infrared fluorescent probes in molecular imaging of gastric cancer, and to screen useful molecular probes for fluorescence molecular imaging of gastric cancer. Methods Three kinds of near infrared fluorescent molecular probes (IntergriSenseTM750, FolateRsenseTM680, MMPSenseTM750FAST) were used to detect and quantify the fluorescent signal intensity of tumor tissue by in vivo fluorescent molecular imaging after injecting of the above probes to subcutaneous xenograft models of gastric cancer. The biodistribution and metabolism of these probes were performed by exvivo fluorescence molecular imaging. After fluorescence molecular imaging, the histologic examination of the transplanted tumor tissue and the immunohistochemical detection of the corresponding molecular targets (αvβ3, FRα, MMP) were performed. Results In vivo fluorescence molecular imaging showed that three kinds of probes (IntergriSenseTM750, FolateRsenseTM680, MMPSenseTM750FAST) were concentrated in the tumor-bearing tumor, and the peak was 1 hour, 1 hour and 24 hours after injection, respectively. Furthermore, compared with control group, the region of interest of the three targeted fluorescect probes were better. In vitro fluorescence molecular imaging confirmed that the probes was mainly metabolized by the liver and kidney.Immunohistochemistry confirmed that three molecular targets were expressed in subcutaneous xenografts models. Conclusion The above mentioned molecular probes can be used for the fluorescence molecular imaging of gastric cancer. αvβ3, FRα and MMP can be used as targets for imaging of gastric cancer.
Near infrared; Fluorescence molecular imaging; Gastric cancer; Probe; Mouse model
10.3969/j.issn.1006-5709.2017.07.019
国家自然科学基金项目(81471700)
贺玲,硕士研究生,研究方向:消化道消肿瘤荧光分子成像的研究。E-mail: 18516889540@163.com
刘海峰,研究方向:消化道肿瘤的早期诊断研究。E-mail:haifengliu333@163.com
R735.2
A
1006-5709(2017)07-0786-05
2017-03-21

