杠板归总黄酮抗大鼠肝纤维化作用的机制研究
曹后康,高 雅,黄思茂,张可锋,2
(1.桂林医学院药学院,广西 桂林 541004;2.甘肃中医药大学药学院,甘肃 兰州 730000)
杠板归总黄酮抗大鼠肝纤维化作用的机制研究
曹后康1,高 雅1,黄思茂1,张可锋1,2
(1.桂林医学院药学院,广西 桂林 541004;2.甘肃中医药大学药学院,甘肃 兰州 730000)
目的在明确杠板归总黄酮(TFP)抗二甲基亚硝胺(DMN)诱导的大鼠肝纤维化(HF)药效基础上,探索TFP抗HF的作用机制。方法将90只SD大鼠随机均分为正常组、模型组、秋水仙碱(0.1 mg·kg-1)组和TFP(200、100、50 mg·kg-1)组。除正常组外,其余各组大鼠均腹腔注射体积分数为0.5%的DMN溶液(2 mL·kg-1),隔天1次,连续8周。从造模d 1起,各给药组分别给予相应剂量的药物进行干预,正常组和模型组给予等体积的溶媒,每天1次。8周后实验结束,取血和肝组织。取相同位置的肝组织,苏木精-伊红(HE)染色观察肝组织病变程度;比色法检测血清ALT、AST、SOD和MDA含量或活性;酶联免疫吸附实验(ELISA)检测血清HA、LN、PCⅢ和Ⅳ-C含量;ELISA法检测肝组织TNF-α、IL-1β和IL-6的含量; 蛋白免疫印迹法(Western blot)检测肝组织α-SMA、TGF-β1、JAK2、STAT3、p-JAK2和p-STAT3蛋白表达。结果与模型组比较,TFP(200、100、50 mg·kg-1)能明显改善肝组织病变,降低ALT、AST、HA、LN、PCⅢ和Ⅳ-C表达,降低MDA水平,增加SOD活性,同时减少TNF-α、IL-1β和IL-6释放,抑制α-SMA、TGF-β1、p-JAK2和p-STAT3表达。结论TFP能够抗DMN诱导的大鼠HF,其机制可能与抗氧化作用,抑制TGF-β1表达,调控JAK2/STAT3信号通路,并抑制炎症反应有关。
杠板归总黄酮;肝纤维化;二甲基亚硝胺;抗氧化;TGF-β1;JAK2/STAT3信号通路;炎症反应
肝纤维化(hepatic fibrosis,HF)本是一种常见的肝脏自我修复过程,但在长期炎症或肝损伤等诱因下,肝星状细胞(hepatic stellate cell,HSC)被持续激活并转化为肌成纤维细胞,同时活化的HSC大量增殖并分泌过量的细胞外基质(extracellular matrix,ECM),致使ECM合成与降解平衡失调,导致ECM大量沉积,最终导致肝组织正常结构与功能被破坏,即形成HF[1]。研究表明[2],HF的进程始终都伴有炎症反应,各种炎症因子与信号通路之间相互作用,形成级联放大效应,不断加重肝损伤和HF。Janus激酶2/信号转导和转录激活子3(janus kinase 2/signal transducer and activator of transcription 3, JAK2/STAT3)信号通路是一条由细胞因子刺激的信号转导通路,主要参与细胞的增殖、分化、凋亡以及免疫调节等生物学过程。在HF研究中发现,JAK2/STAT3信号通路激活后,可上调肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等炎症因子表达,并进一步活化HSC,加速HF的发展进程[3]。因此,JAK2/STAT3通路及相关炎症因子是不断加重HF的主要因素之一,通过抑制JAK2/STAT3通路信号转导,可作为缓解HF的重要途径。
HF是肝脏炎症发展为肝硬化或肝癌的必经之路,抑制HF进展是防止慢性肝病发展为不可逆肝硬化或肝癌的有效手段,但HF发病机制复杂,涉及众多细胞因子或信号通路,且存在交互作用,目前临床尚无公认的有效抑制HF的药物[4]。
本研究阳性药物秋水仙碱能够通过抗炎等途径抑制HF[5],但存在肾毒、骨髓抑制等潜在的严重副作用[6],限制了其临床应用。中药治疗具有多层次、多靶点和多通路的特点,并且副作用小,对于防治慢性疾病有着独特的优势[7],例如,中药三七总皂苷可通过抑制JAK2/STAT3通路及其它多种途径缓解HF[8]。杠板归为蓼科蓼属植物杠板归(Polygonum perfoliatum L.)的干燥地上部分,具有清热解毒、利水消肿、止咳的功效,主治咽喉肿痛、肺热咳嗽、湿热泻痢等[9]。本课题组前期研究表明,杠板归总黄酮(total flavonoids extracted from Polygonum perfoliatum L,TFP)可通过抑制炎症反应缓解小鼠肝损伤,并且能够缓解二甲基亚硝胺(dimethylnitrosamine, DMN)诱导的HF,但具体机制未明确[10-11]。本实验在明确TFP抗HF的药效基础上,通过观察TFP对JAK2/STAT3通路及相关炎症因子的影响,揭示TFP抗HF作用机制。
1 材料与方法
1.1实验动物清洁级8~10周龄♂SD 大鼠,体质量200 g~300 g,购于桂林医学院实验动物中心。
1.2杠板归总黄酮的制备[11]取2 kg杠板归生药粉碎,过80目筛,体积分数为0.75的乙醇回流提取2次,料液比1 ∶10(g ∶mL),每次1.5 h,合并提取液,过滤,减压蒸馏,浓缩得杠板归总黄酮浸膏,加蒸馏水混匀后,盐酸调pH值为5。D101 型大孔吸附树脂进行纯化,上样流速为4 mL·min-1,然后静置12 h,先后用3倍树脂体积的体积分数为0.3的乙醇和4倍体积的体积分数为0.7的乙醇洗脱,流速3 mL·min-1,将体积分数为0.7的乙醇洗脱液收集并浓缩至浸膏(纯度83.52%)。
1.3试剂D101型大孔吸附树脂(河北翔泰蓝星精细化工有限公司);二甲基亚硝胺(DMN,天津市化学试剂研究所,纯度99%);秋水仙碱粉剂(美国 Sigma公司)。谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malonaldehyde,MDA)试剂盒(南京建成生物工程研究所);透明质酸(hyaluronic acid,HA)、层黏连蛋白(laminin,LN)、Ⅲ型前胶原(procollage type Ⅲ,PCⅢ)、Ⅳ型胶原(collage type Ⅳ,Ⅳ-C)、TNF-α、白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)试剂盒(武汉伊莱瑞特生物科技有限公司);RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE蛋白上样缓冲液(南通市碧云天生物技术研究所);α-平滑肌肌动蛋白(α-SMA)、转化生长因子-β1(TGF-β1)、JAK2、STAT3、p-JAK2和p-STAT3抗体(美国 CST公司);PVDF膜(美国 Bio-Rad公司);抗β-actin单抗(天锡傲锐东源生物科技有限公司);辣根酶标记的二抗(北京中杉金桥生物技术有限公司);Super ECL Plus超敏发光液(北京普利莱基因科技有限公司)。
1.4动物分组与处理90只大鼠适应性喂养1周后,随机分为6组,即正常组、模型组、秋水仙碱(0.1 mg·kg-1)组和TFP(200、100、50 mg·kg-1)组,每组15只。实验期间,大鼠自由饮食,温度18~22℃,自然光照。除正常组外,其余各组大鼠均腹腔注射体积分数为0.5%的DMN生理盐水溶液(2 mL·kg-1),隔天注射1次,连续8周。从造模d 1起,灌胃体积按照体质量计算(10 mL·kg-1),药物配制成相应浓度,各给药组分别给予相应剂量的药物进行干预,正常组和模型组给予等体积的溶媒,每天1次。8周后实验结束,末次给药后,禁食不禁水12 h,腹腔注射质量浓度为3 g·L-1戊巴比妥钠生理盐水溶液(10 mL·kg-1)麻醉,腹主动脉取血,4 500 r·min-1离心15 min后,取上层血清,-20 ℃保存;固定位置取肝组织,于-80 ℃保存。
1.5病理学指标检测固定位置取肝组织,经中性甲醛固定、脱水、石蜡包埋、切片(厚4 μm)、脱蜡、苏木精-伊红(HE)染色等常规制作HE染色切片,光学显微镜下观察肝组织病理学变化。
1.6血清学指标检测按照试剂盒说明,测定血清中ALT、AST、SOD、MDA、HA、LN、PCⅢ和Ⅳ-C含量。
1.7炎症因子检测取相同位置肝组织,制备10%肝组织匀浆,ELISA检测TNF-α、IL-1β和IL-6的含量。
1.8检测肝组织中HF相关蛋白表达情况每组随机选取5只大鼠肝组织,固定位置取肝组织60 mg,放入玻璃匀浆器中,加入含1% PMSF的RIPA组织裂解液1 mL,于冰上充分匀浆,然后4℃,15 000 r·min-1离心15 min,取上清液,BCA试剂盒测定蛋白含量。加入蛋白上样缓冲液,95℃水浴变性5 min。配制10%分离胶,5% 浓缩胶,样品上样,进行SDS-PAGE电泳,分离蛋白(5%浓缩胶电压80 V,10%分离胶电压110 V);恒流150 mA条件下转膜3 h,将分离蛋白转移至PVDF膜;将PVDF膜放入5%脱脂牛奶封闭2 h,TBST洗涤3次,每次10 min,加入一抗, 4℃孵育过夜;TBST洗涤3次,每次10 min,然后放入辣根过氧化物酶标记的二抗,室温孵育2 h,再用TBST 洗涤3次,每次10 min,增强化学发光法显色,胶片曝光,显影,定影,胶片扫描后使用Quantity One 4.6软件分析蛋白灰度,以β-actin为内参,计算目标蛋白相对表达量。

2 结果
2.1TFP对DMN诱导的HF大鼠肝组织病理学影响正常组大鼠肝小叶结构完整,无炎症细胞浸润,未见纤维结缔组织等病理变化。模型组肝小叶结构严重紊乱,假小叶形成,大量肝细胞坏死,较多炎症细胞浸润,汇管区出现纤维结缔组织增生。与模型组比较,秋水仙碱组和TFP组大鼠肝细胞坏死得到显著缓解,肝小叶结构基本完整,炎性浸润较轻,假小叶和纤维结缔组织增生明显减少(Fig 1)。
2.2TFP对DMN诱导的HF大鼠血清中ALT、AST、SOD和MDA的影响与正常组比较,模型组血清中ALT、AST和MDA含量或活性明显升高(P<0.01),SOD活性明显降低(P<0.01);经TFP干预后,与模型组比较, ALT、AST和MDA含量或活性明显降低(P<0.05或P<0.01),SOD活性明显升高(P<0.05或P<0.01),见Tab 1。
2.3TFP对DMN诱导的HF大鼠血清中HA、LN、PCⅢ和Ⅳ-C含量的影响与正常组相比,模型组血清中HA、LN、PCⅢ和Ⅳ-C含量明显上升(P<0.01);与模型组比较,TFP能降低HA、LN、PCⅢ和Ⅳ-C含量(P<0.05或P<0.01),见Tab 2。

Fig 1 Effect of TFP on hepatichistopathology in HF rats(HE,×200)
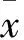
Tab 1 Effect of TFP on serum ALT, AST, SOD and MDA in HF rats(±s,n=15)
##P<0.01vsnormal;*P<0.05,**P<0.01vsmodel
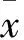
Tab 2 Effect of TFP on serum HA, LN, PCⅢ and Ⅳ-C in HF rats(±s,n=15)
##P<0.01vsnormal;*P<0.05,**P<0.01vsmodel
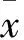
Tab 3 Effect of TFP on hepatic TNF-α, IL-1β and IL-6 in HF rats(±s,n=15)
##P<0.01vsnormal;*P<0.05,**P<0.01vsmodel

Fig 2 Effect of TFP on relative protein expression in liver tissues of HF rats(±s,n=5)
2.4TFP对DMN诱导的HF大鼠肝组织中炎症因子TNF-α、IL-1β和IL-6含量的影响与正常组相比,模型组大鼠肝组织TNF-α、IL-1β和IL-6含量明显上升(P<0.01);与模型组比较,TFP可明显降低TNF-α、IL-1β和IL-6表达(P<0.05或P<0.01),见Tab 3。
2.5TFP对肝组织α-SMA、TGF-β1、p-JAK2和p-STAT3表达的影响Fig 2结果显示,与正常组比较,模型组大鼠肝组织中α-SMA、TGF-β1、p-JAK2和p-STAT3表达明显升高(P<0.01);与模型组相比,TFP可明显抑制α-SMA、TGF-β1、p-JAK2和p-STAT3表达(P<0.05或P<0.01)。
3 讨论
本实验采用的大鼠腹腔注射DMN诱导HF模型,具有成模时间短、重复性好和持续时间长等特点,因此成为研究抗肝纤维化药物的首选模型[12]。当肝脏受到损伤时,肝细胞膜通透性增加,肝细胞内的ALT和AST溢出进入血液,因此血清中ALT和AST的活性与肝损伤程度呈一致性[13]。研究表明[14],当肝脏发生纤维化病变时,HA、LN、PCⅢ和Ⅳ-C含量与HF程度同步提高,可作为评价HF病变程度的指标。在本研究中,模型组大鼠血清ALT、AST、HA、LN、PCⅢ和Ⅳ-C含量明显升高,且肝组织病理检查也显示出现大量纤维结缔组织增生,表明DMN诱导大鼠HF模型建立成功。TFP可明显降低大鼠ALT、AST、HA、LN、PCⅢ和Ⅳ-C水平,并改善肝组织病变。以上研究表明,TFP能够抗DMN诱导的大鼠HF,具有明显的保肝作用。
氧自由基和过氧化物作为危害机体健康的物质,可严重破坏细胞结构,造成组织损伤,MDA是体内主要脂质过氧化物产物,与氧化应激水平密切相关;SOD是重要的抗氧化酶,能够有效清除自由基,抑制脂质过氧化物的产生,对机体产生防御作用[15]。TFP能够提高SOD活性,降低MDA含量,表明TFP可能通过增强肝脏抗氧化能力,从而发挥保肝作用。
TGF-β1贯穿HF过程的始终,能够持续激活HSC,不断刺激HSC分泌ECM,加重HF病情,是目前所知最强的致HF细胞因子[16]。α-SMA作为HSC的活化标志物,能够反映HSC活化水平。研究表明,TNF-α、IL-1β、IL-6等炎症因子与JAK2/STAT3信号通路有着密切的关系[17],磷酸化的JAK2和STAT3介导信号转导,在诱导多种炎症因子大量表达的同时,炎症因子可通过正反馈激活JAK2/STAT3通路,从而不断产生大量炎症因子,持续活化HSC,导致肝组织不断损伤,加重HF病情[18]。因此,抑制JAK2/STAT3通路激活可作为缓解HF的有效途径。实验结果表明,模型组大鼠肝组织α-SMA水平明显升高,TGF-β1、TNF-α、IL-1β、IL-6、p-JAK2和p-STAT3表达明显上升,JAK2/STAT3通路被激活。TFP干预可明显下调α-SMA、TGF-β1、TGF-β1、TNF-α和IL-1β表达,并抑制JAK2/STAT3通路激活,改善肝组织病变。
在HF中,氧化应激、TGF-β1和JAK2/STAT3通路异常表达呈现一致性[19-20],但三者之间是否存在直接调控关系,尚未见报道。本实验结果显示,杠板归总黄酮可有效改善DMN诱导的大鼠HF,其机制可能与抗氧化、抑制TGF-β1表达和JAK2/STAT3通路及相关炎症因子有关,其之间的相互作用关系,可作为本研究下一步深入探索的方向。
(致谢:本实验是在桂林医学院药物研究所完成,感谢王刚、陈雪梅、葸博婷等同学提供的帮助!)
[1] Huang Y, Deng X, Liang J. Modulation of hepatic stellate cells and reversibility of hepatic fibrosis[J].ExpCellRes, 2017,352(2): 420-6.
[2] 黄小华, 孙 永, 沈 能, 等. 双亲姜黄素衍生物减轻大鼠肝纤维化与抗炎抗氧化作用的研究[J]. 中国药理学通报, 2015,31(4): 470-5.
[2] Huang X H, Sun Y, Shen N, et al. The amphiphilic curcumin derivative attenuates liver fibrosis by anti-inflammatory and antioxidant effect[J].ChinPharmacolBull, 2015,31(4): 470-5.
[3] Jiang H, Gao J R, Wang Y Z, et al. Panax notoginsengsaponins ameliorates experimental hepatic fibrosis and hepatic stellate cell proliferation by inhibiting the Jak2/Stat3 pathways[J].JTraditChinMed, 2016,36(2): 217-24.
[4] Seifert L, Deutsch M, Alothman S, et al. Dectin-1 regulates hepatic fibrosis and hepato-carcinogenesis by suppressing TLR4 signaling pathways[J].CellRep, 2015,13(9): 1909-21.
[5] Lange U, Schumann C, Schmidt K L, et al. Current aspects of colchicine therapy-classical indications and new therapeutic uses[J].EurJMedRes, 2001,6(4): 150-60.
[6] Hung I F, Wu A K, Cheng V C, et al. Fatal interaction between clarithromycin and colchicine in patients with renal insufficiency: a retrospective study[J].ClinInfectDis, 2005,41(3): 291-300.
[7] 邓雪红, 邢小燕, 李 光, 等. Th1/Th2失衡与缺血/再灌注损伤及中药多靶点调节的应用前景分析[J]. 中国药理学通报, 2015,31(9): 1185-9.
[7] Deng X H, Xing X Y, Li G, et al. Th1 /Th2 imbalance in ischemia-reperfusion injury and the application prospects of traditional Chinese medicine with multi-target effect[J].ChinPharmacolBull, 2015,31(9): 1185-9.
[8] Hui J,Gao J,Wang Y,et al. Panax notoginseng saponins ameliorates experimental hepatic fibrosis and hepatic stellate cell proliferation by inhibiting the Jak2/Stat3 pathways[J].JTraditChinMed, 2016,36(2): 217-24.
[9] 国家药典委员会. 中华人民共和国药典[S].北京: 中国医药科技出版社, 2015年版, 一部: 166-7.
[9] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China[S]. Beijing: China Medical Science Press, 2015, Volume Ⅰ: 166-7.
[10]韦日明, 高 雅, 张可锋, 李迎迎. 杠板归总黄酮对小鼠酒精性肝损伤的保护作用[J].南方农业学报, 2016,47(4): 664-9.
[10]Wei R M, Gao Y, Zhang K F, Li Y Y. Protective effect of total flavonoids extracted fromPolygonumknotweedL. on mice with alcoholic liver injury[J].JSouthernAgric, 2016,47(4): 664-9.
[11]高 雅, 李 豪, 钟明利, 等. 杠板归总黄酮抗肝纤维化大鼠的作用及其机制研究[J]. 华西药学杂志, 2015,30(2):181-3.
[11]Gao Y, Li H, Zhong M L, et al. Study on the effect and mechanism of Polygonumperfoliatum total flavonoids on hepatic fibrosis in the rats[J].WestChinaJPharmSci, 2015,30(2):181-3.
[12]Sferra R, Vetuschi A, Pompili S, et al. Expression of pro-fibrotic and anti-fibrotic molecules in dimethylnitrosamine-induced hepatic fibrosis[J].PatholResPract, 2017,213(1): 58-65.
[13]Khoury T, Chen S, Abu Rmeileh A, et al. Acute liver injury?induced by levetiracetam and temozolomide co-treatment[J].DigLiverDis, 2017,49(3): 297-300.
[14]Zhang H C, Hu R F, Zhu T, et al. Primary biliary cirrhosis degree assessment by acoustic radiation force impulse imaging and hepatic fibrosis indicators[J].WorldJGastroenterol, 2016,22(22): 5276 -84.
[15]Dillioglugil M O, Kir H M, Demir C, et al. Effect of pentylenetetrazole and sound stimulation induced single and repeated convulsive seizures on the MDA, GSH and NO levels, and SOD activities in rat liver and kidney tissues[J].BrainResBull, 2010,83(6): 356-9.
[16]He Y H, Li Z, Ni M M, et al. Cryptolepine derivative-6h inhibits liver fibrosis in TGF-β1-induced HSC-T6 cells by targeting the Shh pathway[J].CanJPhysiolPharmacol, 2016,94(9): 987-95.
[17]Weng L H,Zhang H,Li X,et al. Ampelopsin attenuates lipopolysaccharide-induced inflammatory response through the inhibition of the NF-κB and JAK2/STAT3 signaling pathways in microglia[J].IntImmunopharmacol, 2017,44:1-8.
[18]Robert S, Gicquel T, Bodin A, et al. Characterization of the MMP/TIMP imbalance and collagen production induced by IL-1β or TNF-α release from human hepatic stellate cells[J].PLoSOne, 2016,11(4): e0153118.
[19]Ding Y F, Wu Z H, Wei Y J, et al. Hepatic inflammation-fibrosis-cancer axis in the rat hepatocellular carcinoma induced by diethylnitrosamine[J].JCancerResClinOncol, 2017,143(5):821-34.
[20]Qu W,Huang H,Li K,Qin C. Danshensu-mediated protective effect against hepatic fibrosis induced by carbon tetrachloride in rats[J].PatholBiol(Paris), 2014,62(6): 348-53.
ResearchonmechanismofeffectoftotalflavonoidsextractedfromPolygonumperfoliatumL.onanti-hepaticfibrosisinrats
CAO Hou-kang1, GAO Ya1, HUANG Si-mao1, ZHANG Ke-feng1,2
(1.CollegeofPharmacy,GuilinMedicalUniversity,GuilinGuangxi541004,China;2.CollegeofPharmacy,GansuUniversityofChineseMedicine,LanzhouGansu730000)
AimBased on the effect of total flavonoids extracted fromPolygonumperfoliatumL.(TFP) against dimethylnitrosamine(DMN)-induced hepatic fibrosis(HF), to investigate the anti-fibrotic mechanism of TFP.MethodsNinety SD rats were divided into normal group, model group, colchicines(0.1 mg·kg-1) group, and TFP(200, 100, 50 mg·kg-1) group. Except the rats of normal group, other rats were injected intraperitoneally with volume fraction 0.5% DMN solution(2 mL·kg-1) for eight weeks, once every two days. From the first day of modeling, each administration group was given the corresponding dose of drugs to intervene, and the normal group and model group were given an equal volume of solvent, once a day. At the end of the eighth week, the blood and liver tissues were collected. Liver tissue was taken at a fixed position, and the degree of liver tissue was observed by HE staining. The contents of serum ALT, AST, SOD and MDA were measured using colorimetric method; the levels of serum HA, LN, PCⅢand Ⅳ-C were detected using enzyme-linked immunosorbent assay(ELISA); the levels of TNF-α, IL-1β and IL-6 in liver tissues were detected by ELISA; the expression of α-SMA, TGF-β1, p-JAK2 and p-STAT3 were detected by Western blot.ResultsCompared with the model group, TFP(200, 100, 50 mg·kg-1) could improve the liver tissue lesions, reduce the expression of ALT, AST, HA, LN, PCⅢ, IV-C and MDA, increase SOD activity, reduce the levels of TNF-α, IL-1β and IL-6, and inhibit the expression of α-SMA, TGF-β1, JAK2, STAT3, p-JAK2 and p-STAT3.ConclusionTFP could inhibit DMN-induced HF of rats, which may be involved with antioxidant and inhibiting expression of TGF-β1, JAK2/STAT3 signaling pathway and inflammatory response.
total flavonoids extracted fromPolygonumperfoliatumL.(TFP); hepatic fibrosis; dimethylnitrosamine; antioxidant; transforming growth factor-β1; JAK2/STAT3 signaling pathway; inflammatory response
时间:2017-8-20 16:47 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170820.1647.044.html
2017-05-20,
2017-07-15
国家自然科学基金资助项目(No 81460602)
曹后康(1993-),男,硕士生,研究方向:肝病药理学,E-mail: 1298420377@qq.com; 张可锋(1982-),男,硕士,副教授,研究方向:生药质量及活性成分药效学,通讯作者,E-mail:xueshengcailiao@163.com
10.3969/j.issn.1001-1978.2017.09.022
A
:1001-1978(2017)09-1303-06

