乳癖消颗粒对乳腺增生大鼠雌激素信号转导机制的影响*
河北中医学院
康立英 李杰茹 韩聚强 李 斯(石家庄 050200)
乳癖消颗粒对乳腺增生大鼠雌激素信号转导机制的影响*
河北中医学院
康立英 李杰茹 韩聚强 李 斯(石家庄 050200)
目的:观察乳癖消颗粒对乳腺增生模型大鼠体内雌激素(E2)含量、乳腺组织雌激素受体(ER)及细胞外信号调节激酶(ERK)蛋白表达的影响,探讨乳癖消颗粒对雌激素信号转导通路的影响。方法:用雌孕激素联合造模制成大鼠乳腺增生模型,按照随机分配的原则将所用实验大鼠分为5组,即正常对照组,模型组对照组、乳癖消颗粒低、高剂量组和他莫昔芬阳性对照组。放免法检测血清E2的含量,采用蛋白免疫印迹方法检测乳腺组织ER、ERK蛋白的表达。结果:乳癖消颗粒高、低剂量均可降低乳腺增生模型大鼠血清E2含量及乳腺增生组织ER、ERK的表达。结论:乳癖消颗粒通过影响乳腺增生大鼠体内E2含量及乳腺组织中ER和ERK蛋白表达而调节雌激素信号转导机制。
乳腺增生;乳癖消颗粒;ERK;雌激素;雌激素受体;雌激素信号转导;他莫昔芬
乳腺增生病是女性乳腺疾病中的常见病和多发病,已严重影响了女性的生活质量,并且已被列为乳腺癌的癌前病变,因此早诊断、早治疗是防治乳癌的关键之一。乳癖消具有消除结块,缓解肿胀疼痛,活血化瘀,清热解毒等功效,在多年的临床应用中,乳癖消对乳腺增生的临床疗效得到了多方面的肯定,但作用机制尚未完全明了,有待于对其分子机制进行更深入的探讨。本研究通过观察分析乳癖消颗粒对乳腺增生模型大鼠血清中的雌激素(E2)水平, 以及乳腺组织中雌激素受体(ER)、细胞外信号调节激酶(ERK)表达的情况来探讨乳癖消治疗乳腺增生的分子作用机制,为临床用药提供相关的理论基础。
1 材料与方法
1.1 动物与主要试剂 50只雌性未孕SD大鼠(体质量180~220 g)购自河北医科大学实验动物中心。乳癖消颗粒(6 g生药/8 g,哈尔滨泰华药业股份有限公司),苯甲酸雌二醇注射液(上海通用药业股份有限公司),黄体酮注射液(浙江仙琚制药股份有限公司),枸橼酸他莫昔芬(苏州第一制药有限公司),兔抗大鼠ER多克隆抗体、兔抗大鼠ERK多克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗兔IgG均购自北京中山生物技术有限公司。
1.2 动物分组及给药 未孕雌性SD大鼠50只,适应性喂养1周后,随机选出10只作为正常组对照组,给予肌肉注射生理盐水10 mL/kg;其余大鼠用于复制乳腺增生模型,造模方法[1]:苯甲酸雌二醇0.5 mg/kg肌肉注射,每天1次,连续25 d,随后黄体酮4 mg/kg,肌肉注射,每天1次,连续5 d。造模成功后,将40只大鼠随机分为:模型对照组、他莫昔芬阳性对照组(1.8 mg/kg)、乳癖消颗粒高剂量组(5.2 g/kg),乳癖消颗粒低剂量组(1.3 g/kg),每组10只,分别给予相应剂量的药物灌胃,每天1次,连续30 d;正常对照组和模型组大鼠给予生理盐水灌胃,每天1次,连续30 d。实验结束后断尾采血,3 000 r/min离心10 min,取血清,低温保存(-20℃)备用。取右侧乳腺组织立即置于液氮中速冻,而后转移至-80℃冰箱冻存备用。
1.3 血清E2水平检测 采用放射免疫法测定各组大鼠血清E2含量,观察大鼠血清激素水平变化情况。
1.4 Western blot法检测乳腺组织中ER、ERK蛋白表达 将大鼠乳腺组织剪碎后和预冷的细胞裂解液一并置于匀浆器内充分研磨,待组织完全裂解后,1 000~2 000 r/min离心8 min,取上清液,然后4℃,13 000 g离心10 min后取上清液,用BCA试剂盒测定蛋白含量,紫光分光光度剂测蛋白浓度。各组取出50 μg总蛋白样品进行10%SDS-PAGE电泳。电转移均在冷的转移缓冲液中进行。转移结束后,将硝酸纤维膜用溴酚蓝染色,标记相对分子质量标准的参照位置。所用的硝酸纤维膜采用5%的脱脂奶粉TBS溶液封闭2 h,分别加入ER多克隆抗体(1∶300)、ERK多克隆抗体(1∶500)和GAPDH抗体(1∶1 000)置于4℃冰箱孵育过夜,用TBST洗膜3次,接着二抗室温孵育2 h,然后用TBST洗膜3次,每次10 min。添加显色液,避光,显色并直至出现条带时放入双蒸水中终止反应。
结果分析:电泳后用数码相机照相,采用Quantity One生物电泳图像分析系统(Bio-Rad公司)对区带进行定量分析,计算目的蛋白的相对密度值时笔者采用GAPDH作为内参。目的蛋白相对密度值的计算采用以下公式。目的蛋白相对密度值=目的蛋白光密度值/GAPDH光密度值。
2 结果
2.1 乳癖消颗粒对乳腺增生大鼠血清E2含量的影响 数据显示:与正常对照组大鼠相比,乳腺增生模型组大鼠血清中E2水平明显增高 (P<0.05);乳癖消颗粒高、低剂量组、他莫昔芬组大鼠血清E2含量明显低于模型组(P<0.05),详见表1。

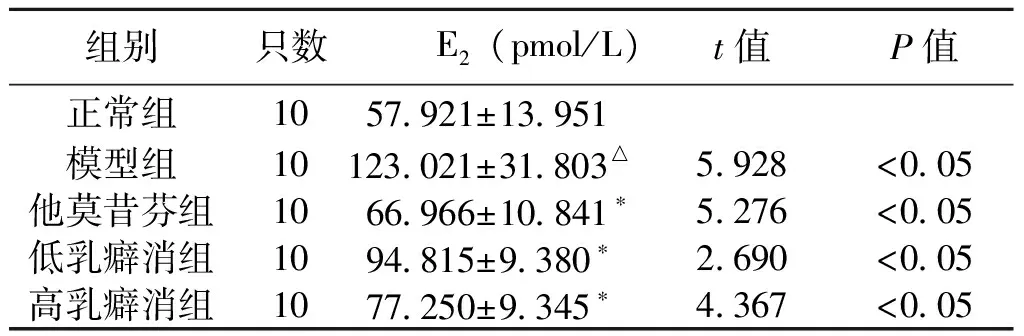
组别只数 E2(pmol/L)t值P值正常组1057921±13951 模型组10123021±31803△5928<005他莫昔芬组1066966±10841∗5276<005低乳癖消组1094815±9380∗2690<005高乳癖消组1077250±9345∗4367<005
注: 与正常组对比,△P<0.05;与模型组比较,*P<0.05
2.2 乳癖消颗粒对乳腺增生小鼠乳腺组织ER表达的影响 模型组大鼠乳腺组织ER表达量明显高于正常对照组(P﹤0.01);乳癖消颗粒高、低剂量组及他莫昔芬组明显降低模型大鼠乳腺组织中ER蛋白的表达(P<0.01)。结果见表2和图1。
2.3 乳癖消颗粒对乳腺增生大鼠乳腺组织ERK蛋白表达的影响 模型组大鼠乳腺组织中ERK蛋白表达量明显高于正常对照组(P<0.01);乳癖消颗粒各组及他莫昔芬组明显减弱乳腺组织中ERK的蛋白的表达(P<0.01)。结果见表2和图2。

图1 Western blot法检测各组大鼠乳腺组织中ER的表达水平
(A:正常组,B:模型组,C:乳癖消低剂量组,D:乳癖消高剂量组,E:他莫昔芬组)
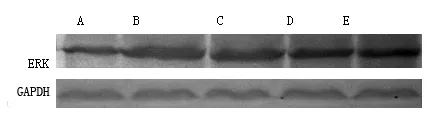
图2 Western法检测各组大鼠乳腺组织中ERK的表达水平
(A:正常对照组,B:模型组,C:乳癖消低剂量组,D:乳癖消高剂量组,E:他莫昔芬组)
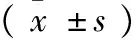
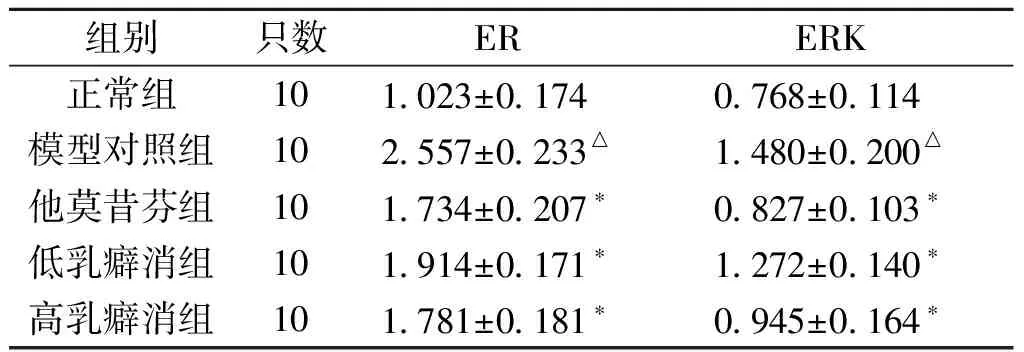
组别只数ERERK正常组101023±0174 0768±0114 模型对照组102557±0233△1480±0200△他莫昔芬组101734±0207∗0827±0103∗低乳癖消组101914±0171∗1272±0140∗高乳癖消组101781±0181∗0945±0164∗
注:与正常组比较,△P<0.01;与模型组比较,*P<0.01
3 讨论
性激素影响乳腺的生长发育,其对乳腺组织发挥生物效应需要相应受体介导。正常情况下雌激素E2与ER结合形成二聚体,激活核内雌激素反应元件发挥雌激素效应,进而对乳腺上皮细胞的增生和代谢进行调控。[2]当E2水平过度升高时,过多的E2与ER受体结合,致使乳腺导管及腺泡上皮细胞增生过度,同时通过降低细胞免疫功能减弱乳腺组织的自我修复力,引起乳腺增生。增生的上皮细胞通过激素受体系统致乳腺组织ER合成增加,提高其对雌激素的敏感性,进而促使乳腺上皮细胞增生。[3]有研究报道,雌、孕激素分泌紊乱[4-5]、雌、孕激素受体过量表达与乳腺增生症的发生有密切的关系。[6-8]本研究中,模型对照组大鼠的血清E2含量和乳腺组织中的ER蛋白表达均较正常组明显升高(P<0.01),而与模型对照组比较,乳癖消颗粒高、低剂量组大鼠的E2含量和ER表达显著降低(P<0.05,P<0.01),提示乳癖消颗粒可以降低E2水平,减弱ER表达,从而抑制雌激素对乳腺组织的作用,从而限制了乳腺组织的增生。近年来,研究表明E2可激活乳腺上皮细胞中丝裂原激活蛋白激酶(MAPK)的活性,雌激素诱导乳腺上皮细胞增生可能部分或全部由活化的MAPK级联反应信号途径所介导。有报道显示,乳腺癌细胞中丝裂原活化蛋白激酶信号转导通路较正常乳腺组织中明显升高。[9]ERK是MAPK家族的信号通路中之一。ERK的过度表达及激活,可能与乳腺增生的发生、发展相关,针刺、中药可能通过抑制ERK蛋白的过度表达来抑制乳腺增生。[10-11]本实验中模型对照组大鼠的ERK蛋白表达明显高于空白对照组(P<0.01),而乳癖消颗粒高、低剂量组大鼠的ERK蛋白表达显著低于模型对照组(P<0.01),显示乳癖消颗粒治疗乳腺增生可能是通过影响雌激素信号转导通路,继而达到治疗效果。
[1] 王忠超,李敏,张彬,等.蒙药乳腺-Ⅰ号对乳腺增生大鼠抗氧化能力、乳腺组织雌激素受体和孕激素受体表达的影响[J].吉林大学学报(医学版),2012,38(6):1 052-1 057[2]刘聪,岳永花,郝旭亮.乳腺增生发病机制的研究进展[J].医学综述,2012,18(5):704-706
[3]LialiarisTS,KouskoukisA,GeorgiouG, et al. Expression of 6 common antigenic markers in invasive ductal breast carcinoma: potential clinical implications[J]. Appl Immunohistochem Mol Morphol, 2011,19(2):106-111
[4]姜云云,叶光明,沐韦,等.乳癖消减方抗实验性大鼠乳腺增生作用[J].中国实验方剂学杂志,2013,19(12):269-272
[5]李杰茹,傅天,韩聚强. 乳癖消颗粒对乳腺增生大鼠抗氧化能力及雌孕激素比值的影响[J].河北中医药学报,2016,31(4):32-34
[6]ThakkarJP,MehtaDG. A review of an unfavorable subset of breast cancer: estrogen receptor positive progesterone receptor negative[J]. The oncologist, 2011,16(3):276-285
[7]GutierrezC,SchiffR. HER2: biology,detection,and clinical implications[J].Archives of pathology laboratory medicine,2011,135(1):55-62
[8]黄君华, 谭旭东. 雌、 孕激素受体在乳腺增生组织中的表达及意义[J].海南医学院学报,2014,20(1):32-33+37
[9]孙慧,张静,孙保存,等.雌激素及雌激素受体拮抗剂对乳腺癌信号传导通路中MEK-2和p-ERK病理形态的影响[J].中国肿瘤临床,2008,35(4):219-223
[10]龚东方,谢娟,唐纯志.针刺对乳腺增生模型大鼠雌激素、雌激素受体及其信号传导的干预作用[J].广州中医药大学学报,2009,26(5):450-453
[11]张婷婷,王苹,张建伟,等.当归芍药散加味方对乳腺增生模型大鼠乳腺上皮组织ERK表达的影响[J].福建中医药,2015,3(46):46-48
(2017-06-07 收稿)
Effect ofRuPiXiaoGranula on Estrogen Signal Transduction Mechanism ofRats with Mammary Gland HyperplasiaHebei University of Chinese Medicine
KANGLi-yingLIJie-ruHANJu-qiangLISi
(Shijiazhuang 050200)
Objective: to observe the effect ofRuPiXiaoGranula on E2content, estrogen receptor (ER) of breast tissue and extracellular signal-regulated kinase (ERK) albumen expression in rats with mammary gland hyperplasia, and to explore the effect of the granula on estrogen signal transduction path. Methods: model rats with mammary gland hyperplasia made by estrogen associated with progestogen, were randomly divided into 5 groups: control group, model group, high dose ofRuPixiaogroup, low dose group, Tamoxifen positive group. Radio immunoassay (RIA) method was taken to detect E2content in serum, and western blotting taken to detect ER and EKR expressions. Results: both high and low dose group could decrease E2content, ER and EKR expressions in rats with mammary gland hyperplasia. Conclusion:RuPiXiaoGranula can regulate the estrogen signal transduction mechanism through affecting E2content, ER and EKR expressions in rats with mammary gland hyperplasia.
mammary gland hyperplasia;RuPiXiaoGranula; ERK; estrogen; ER; estrogen signal transduction; Tamoxifen
*河北省科技厅计划项目:No.152777131;河北中医学院青年自然基金项目:No.QNZ2015012
韩聚强,男,副教授。
R285.5
A
1007-5615(2017)04-0004-03

