青藏高原珍稀大型真菌亚东木耳菌丝发酵条件研究
李兆坤, 王凤寰, 陈 彬, 蒋思萍, 徐爱国
(1.北京工商大学 食品学院, 北京 100048; 2.西藏自治区高原生物研究所, 西藏 拉萨 850001)
青藏高原珍稀大型真菌亚东木耳菌丝发酵条件研究
李兆坤1,2, 王凤寰1,*, 陈 彬2,*, 蒋思萍2, 徐爱国2
(1.北京工商大学 食品学院, 北京 100048; 2.西藏自治区高原生物研究所, 西藏 拉萨 850001)
为了更好地开发利用西藏珍稀大型真菌亚东木耳,对亚东木耳菌丝生长和次级代谢条件进行研究。考察了不同培养基成分和培养条件对亚东木耳菌丝生长速度、生物量和次级代谢产物产量的影响。结果表明,可溶性淀粉、酵母浸粉和CaCl2分别为亚东木耳生长代谢的较佳碳源、氮源和无机盐,维生素B1、B2对菌丝生长无明显促进作用。较佳培养温度为26 ℃,较佳培养时间为63 d,菌丝生长较佳初始pH值为7.0,较佳次级代谢初始pH值为6.0。HPLC图谱分析结果表明,次级代谢产物种类多达200余种,其中初始pH值和温度条件对次级代谢多样性的影响较为明显。
大型真菌; 亚东木耳; 培养条件; 次级代谢; HPLC分析
大型真菌是菌物界真菌门肉眼可见的一类真菌,菌物种类繁多,全世界约有150多万种,按功能一般分为药用真菌和食用真菌[1]。有一些大型真菌(如猴头菇,香菇等)既可食用又具有医疗保健作用,即为食药兼用真菌[2]。从工业生产角度来说,研究食药用大型真菌的发酵和次级代谢,对于开发菌丝体粉末保健品、食品添加剂以及含有次级代谢产物的药品具有重要意义。
亚东木耳是一种珍稀的食药兼用野生经济真菌,因产于西藏亚东县而得名,近几年备受关注。亚东木耳生长在峨眉蔷薇(Rosa omeiensis)科枯树枝上,经鉴定属于黑耳属(Exidiasp.)真菌[3],且味道鲜美、营养丰富,被誉为“植物肉、素中之荤”。2012年,亚东木耳的市售价格已达到4 000元/kg,成为当地居民增收的一个重要渠道,但同时也出现了过渡采挖现象,导致其产量逐渐下降。为了更好地利用该野生菌资源,对亚东木耳菌丝进行人工培养并进一步研究其活性次级代谢,具有重要意义。
目前尚未见亚东木耳菌丝培养研究的相关报道。本研究拟考察碳源、氮源、无机盐、生长因子、培养基初始pH值、培养温度、培养时间等条件对亚东木耳菌丝生长和次级代谢的影响,以期获得了亚东木耳快速生长的营养和环境条件以及适宜的菌丝次级代谢培养条件;利用高效液相色谱分析技术对亚东木耳菌丝次级代谢产物多样性进行定性分析。
1 材料与方法
1.1 材料与试剂
菌种,亚东木耳(Exidiasp.),从西藏亚东县采集长有亚东木耳子实体的树枝,通过无菌操作将子实体表面消毒、切成碎片后,转接到PDA培养基上,25 ℃下培养出无污染、生长健壮的菌丝体,经多次纯化获得原始菌种材料[4]。经分子生物学鉴定亚东木耳属于黑耳属(Exidiasp.)真菌。
葡萄糖、麦芽糖、可溶性淀粉、乳糖、蔗糖、酵母浸粉、牛肉膏、蛋白胨、水解乳蛋白均为生化试剂,北京奥博星生物技术有限责任公司;(NH4)2SO4、KNO3、KCl、CaCl2、ZnCl2、MgSO4、FeSO4、Fe2(SO4)3均为分析纯,北京化工厂;维生素B1、B2均为实验试剂;乙腈(色谱纯),赛默飞世尔科技(中国)有限公司;乙酸乙酯(分析纯)、甲醇(分析纯),北京化工厂;马铃薯、超纯水。
1.2 仪器与设备
BSA- CW型电子天平,赛多利斯科学仪器有限公司;YXQ- LS- 100SII型立式压力蒸汽灭菌器,上海博讯实业有限公司;DL- CJ- 2N型洁净工作台,苏净集团苏州安泰空气技术有限公司;LRH- 250F型生化培养箱,上海一恒科学仪器有限公司;DHG- 9246A型真空干燥箱,上海精宏实验设备有限公司;RE- 5205型旋转蒸发器,上海亚荣生化仪器厂;KQ5200E型超声波清洗器,昆山市超声仪器有限公司;LaboStar 7 TWF UV型超纯水器,Evoqua Water Technologies Company;1100型高效液相色谱仪(四元梯度泵,检测器,Agilent1100工作站),Agilent公司;Symmetry C18型色谱柱,Waters公司。
1.3 培养基
平板培养基:PDA(马铃薯葡萄糖琼脂培养基)[5]。
种子培养基:改良的PD(马铃薯葡萄糖)培养基,在马铃薯葡萄糖培养基的基础上加入酵母粉0.2%,MgSO40.1%,维生素B110 mg/L[6]。
基本培养基:葡萄糖20 g/L,酵母粉2 g/L,KH2PO41 g/L,MgSO41 g/L,维生素B10.01 g/L,固体培养基含有琼脂1.5%[7]。
1.4 实验方法
1.4.1 培养基因素对菌丝生长和次级代谢影响实验
分别以可溶性淀粉、蔗糖、麦芽糖、乳糖作为碳源,替换基本培养基(固体)中的葡萄糖[8],于平板中间接种约0.5 cm见方的菌块,26 ℃下静置培养。一周后每3 d测量菌丝半径一次,并观察菌丝形态,考察不同碳源对菌丝生长速率的影响。在500 mL三角瓶中,配制200 mL基本培养基,分别以可溶性淀粉、蔗糖、麦芽糖、乳糖作为碳源,替换基本培养基(液体)中的葡萄糖,自然pH值,于26 ℃恒温箱内静置培养55 d,考察不同碳源对菌丝生长量及次级代谢的影响。
分别以牛肉膏、蛋白胨、水解乳蛋白、(NH4)2SO4,KNO3作为氮源,替换基本培养基(固体)中的酵母粉[9],培养及测量方法同碳源对菌丝生长影响实验,考察不同氮源对菌丝生长速率的影响。分别以牛肉膏、蛋白胨、硫酸铵、硝酸钾作为氮源替换基本培养基(液体)中的酵母粉,其他条件同上,考察不同氮源对菌丝生长量及次级代谢的影响。
分别以KCl、CaCl2、ZnCl2、FeSO4、Fe2(SO4)3,替换基本培养基(液体)中MgSO4,其他条件同上,考察不同无机盐对菌丝生长量及次级代谢的影响。
配制PDA培养基,加入不同生长因子(维生素B1、B2),无生长因子培养基作为空白对照。于平板中央接种约0.5 cm见方的菌块,26 ℃下静置培养。1周后每3 d测量菌丝半径1次,并观察菌丝形态。实验均作3组平行。
1.4.2 环境因素对菌丝生长及次级代谢影响实验
在500 mL三角瓶中,加入200 mL基础培养基,用1 mol/L的HCl溶液或1 mol/L NaOH溶液,调节培养基初始pH值分别为4.0,5.0,6.0,7.0,8.0五个梯度,每个梯度设置两组平行,接种菌龄30 d菌种。置于26 ℃恒温箱中静置培养55 d,考察培养基初始pH值对菌丝生长及其次级代谢的影响。
分别设置20,22,24,26,28,30 ℃五个温度梯度,自然pH值,其他条件同初始pH值,考察温度对菌丝生长及次级代谢的影响。
利用米饭作为固体培养基进行发酵。设置时间为35,42,49,56,63 d五个时间梯度,室温下静置培养,考察不同培养时间对次级代谢的影响。以上实验均作3组平行。
1.4.3 菌丝收集及代谢产物处理
菌丝收集:采用6层纱布过滤并剥落黏质菌丝的方法。菌丝自然风干至质量不变时,称重。
菌丝发酵液的处理:用与发酵液同等体积的乙酸乙酯萃取3次,乙酸乙酯相进行减压浓缩,得到浓缩液。待溶剂挥干,用50~60 ℃沸程石油醚处理,去除低极性次级代谢物(油脂类),38 ℃真空干燥36 h后称重。将干菌丝用5 mL甲醇浸泡后超声(200 W,10 min)提取3次,得到的提取液浓缩后与发酵浓缩液合并。
固体发酵基质处理:用甲醇- 氯仿- 乙酸乙酯混合溶液 (三者体积比为1∶1∶1)浸泡基质,超声浸提15 min,重复3次。浸提液经减压浓缩得到浓缩液,并用乙酸乙酯进行萃取,乙酸乙酯相经减压浓缩得到代谢产物粗提取物。
1.4.4 菌丝发酵次级代谢产物高效液相分析
根据次级代谢产物质量加入相应体积的甲醇进行溶解,使代谢产物样品质量浓度均为0.02 g/mL。每个样品中加入50 μL质量浓度为0.1 mg/mL的亚东木耳次级代谢产物YE- 1(纯度>95%)作为参照物。样品溶液经0.45 μm有机膜过滤后进行液相色谱分析[10]。
C18色谱柱(4.6 mm×250 mm,5 μm),流动相乙腈/水体系(乙腈比例变化为:0~40 min 5%~30%,40~70 min 30%~54%,70~86 min 54%~74%,86~92 min 74%~78%,92~105 min 90%~100% ,105~125 min 100%),流速0.8 mL/min、检测波长235 nm、柱温30 ℃、进样量10 μL。
2 结果与分析
2.1 不同因素对菌丝生长的影响
2.1.1 不同培养基成分对菌丝生长的影响
在菌丝生长过程中,前5~7 d为环境适应期,生长较缓慢,7 d后大多数菌丝已萌发进入生长状态。葡萄糖和麦芽糖作为简单碳源,对菌丝快速生长最为有利,但最终菌丝强度稍弱,生物量较低,而可溶性淀粉作为大分子底物,可为菌丝生长提供长效碳源,更利于生物量的积累。在液体培养基中,以可溶性淀粉作为碳源获得最大生物量,为0.427 g(见表1)。

表1 不同碳源对菌丝生长的影响
++++菌丝强度强,+++菌丝强度较强,++菌丝强度较弱,下表同。菌丝强弱包括菌丝粗细和菌丝致密程度。
菌丝在不同氮源中生长速度差异较大,菌丝生长速度由快到慢依次为酵母粉、硝酸钾、牛肉膏、蛋白胨、水解乳蛋白,菌丝强弱依次为酵母浸粉=蛋白胨>硫酸铵>牛肉膏≥水解乳蛋白>硝酸钾,其中在硝酸钾为氮源的平板琼脂培养基上,菌丝几乎呈透明态,极其稀疏细弱。液体发酵实验同样表明酵母粉是亚东木耳菌丝培养的最适氮源。培养到48 d时,酵母和牛肉膏培养基中菌丝最先出面,到55 d停止培养时,酵母浸粉培养基中菌丝已覆盖整个液面,培养基颜色呈深褐色,在此氮源条件下菌丝达到最大干重为0.294 g(见表2)。
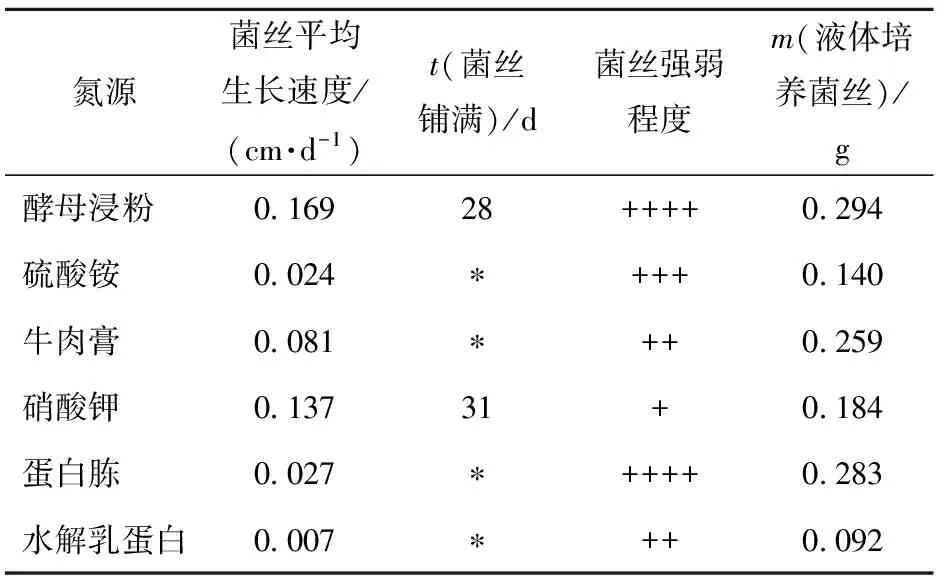
表2 不同氮源时菌丝生长情况
*表示截止到最终记录日期菌丝未长满。
在CaCl2培养基中达到最大生物量为0.292 g,相对于其他实验金属离子来说, Ca2+最适合亚东木耳菌丝生长。而当培养基中加入Fe、Zn微量元素时,菌丝不生长(见表3),一种可能原因是微量元素含量过高抑制菌丝生长,另一种可能是两种微量元素本身对菌丝有抑制作用,可通过加入不同浓度微量元素进一步验证。
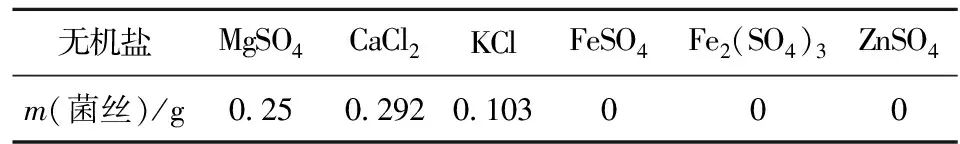
表3 不同无机盐下的菌丝质量
有文献报道,B族维生素对担子菌菌丝生长多有促进作用[11-13],本实验测定维生素B1、B2对亚东木耳生长的影响。在亚东木耳菌丝培养过程中,两种B族维生素作为生长因子,菌丝长势相差不大(见图1),因此认为维生素B1、B2对亚东木耳菌丝生长速度和菌丝强弱没有影响。

图1 维生素B1、B2培养基中菌丝生长趋势Fig.1 Growth trend of hyphae in culture mediums including vitamin B1 and B2
2.1.2 环境因素对菌丝生长的影响
在pH值小于7.0时,菌丝生长量呈递增趋势,pH值为7.0时,菌丝生长量最大,pH值为8.0时菌丝量略有下降,因此pH值7.0为菌丝生长的最适宜初始pH值(见表4)。
根据观察,菌丝生长到20 d,不同温度条件下的生长状态已有明显区别。24,26,28 ℃时液面下菌丝已开始结成大块絮状,22 ℃时菌丝略有结絮现象,较小成片,而30 ℃时菌丝只是在原菌种基础上生长少量。由此可知,亚东木耳在26 ℃条件下最适宜生长(见表4)。
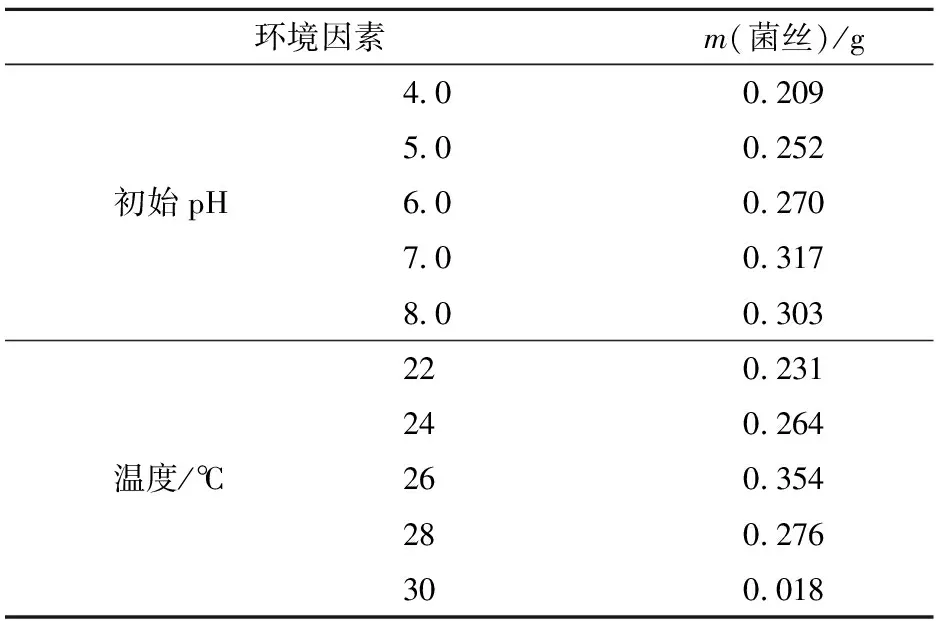
表4 不同初始pH值和温度下菌丝质量
2.2 不同因素对菌丝次级代谢的影响
2.2.1 不同培养基成分对菌丝次级代谢的影响
可溶性淀粉、酵母浸粉、CaCl2分别为获得最多次级代谢产物的碳、氮源和无机盐(见表5)。与菌丝生物量结果比较发现,该结果与菌丝生物量结果一致,说明菌丝生长状况好时,其次级代谢也越充分。
2.2.2 环境因素对菌丝次级代谢的影响
初始pH值为6.0条件下次级代谢产物产量最大,与菌丝生物量结果不一致(见表4、表6),不同初始pH值时的菌丝生物量和次级代谢产物产量结果表明,中性偏碱性条件更适合亚东木耳菌丝生长,中性偏酸性条件更适合菌丝代谢。菌丝在26 ℃时最大次级代谢产物量为0.063 g(见表6),与菌丝生物量结果一致,因此,26 ℃为亚东木耳最适生长和次级代谢温度。
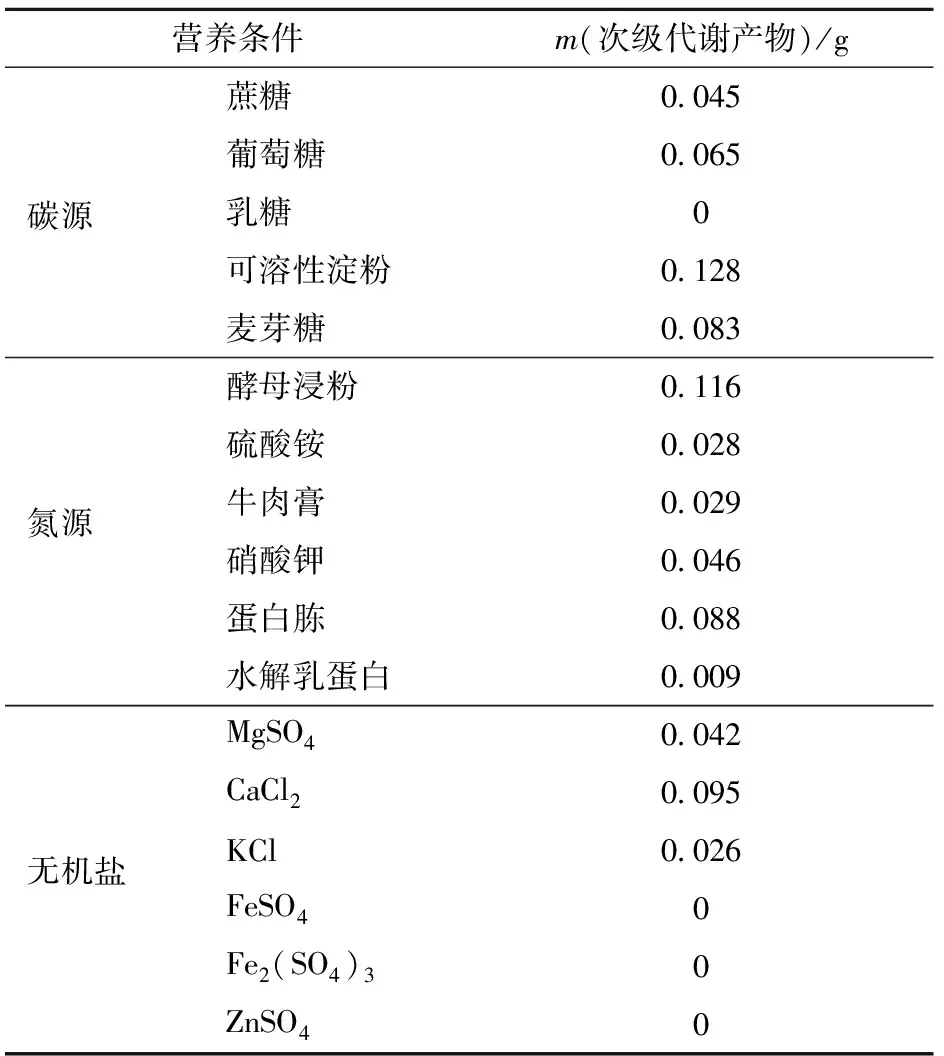
表5 不同营养条件下次级代谢产物质量

表6 不同环境条件下次级代谢产物质量
时间因素中,利用熟米饭基质对大型真菌进行固体发酵培养,避免液体培养中由于时间过长而导致的水分大量蒸发,此方法所得产物称为菌质。真菌在该基质上可快速布满并进行代谢,产生各种生理活性物质,同时其胞外酶系又可以对基质中的化学成分进行生物转化,从而使菌质中有丰富的化学成分[14]。在考察时间范围内,菌丝代谢物产量随时间增加而增加,虽然63 d内次级代谢产物量呈现上升趋势,但培养到63 d时,基质水分已严重下降,不利于菌丝继续生长代谢。利用大米发酵亚东木耳,63 d为较合适的培养时间。
2.3 菌丝次级代谢HPLC图谱分析
对不同环境因素下次级代谢产物进行HPLC图谱分析,在相同色谱条件下比较其代谢产物差异性。取各单因素实验中次级代谢产物质量最多的样品作为研究对象,即时间单因素实验,取49,56,63 d条件下得到的3组样品作为分析对象;初始pH值单因素实验,取pH值为5.0,6.0,7.0条件下得到的3组样品作为分析对象;温度单因素实验,取24,26,28 ℃条件下得到的3组样品作为分析对象。
在235 nm波长处有紫外光吸收的亚东木耳次级代谢产物十分丰富(见表7),200 mL发酵液提取出的次级代谢产物中,高效液相色谱可检测到多达200余种化合物。温度因素中26 ℃条件下峰数量最多;初始pH值为7.0条件下峰数量最多;时间因素中35 d和42 d时峰数量分别为167个和186个,与表7中列出的49 d的202个峰数量相差较大,而56 d和63 d的样品峰数量与49 d的相差不大,因此,可推知菌丝在49 d时代谢已较为充分。
以亚东木耳发酵产物中分离纯化得到的化合物YE- 1作为标准品,其峰作为参照峰,计算相对保留时间α(公式α=tdi/tds,其中tdi为不定峰i的保留时间,tds为参照物的保留时间),由此可得到同一因素不同水平下图谱中相同峰信息[15]。
以相似峰数量与各条件中最多峰数的比值作为相似峰百分比(见表8),用于说明同一因素不同水平间代谢差异性。从表8中可知,温度单因素中相同峰百分比为29.6%,初始pH值单因素中相同峰百分比为21.5%,其代谢差异性相对较大,说明初始pH值和温度因素对亚东木耳次级代谢多样性影响较为显著。
HPLC图谱能够在一定程度上反映不同因素、水平下代谢产物的多样性,从而对大型真菌培养及代谢产物的获得具有一定指导意义。由于本实验中样品为发酵原产物,化合物种类数量庞大,进行图谱分析有一定困难,因此,采用HPLC法只能实现定性分析,且不可避免地存在主观误差[16]。
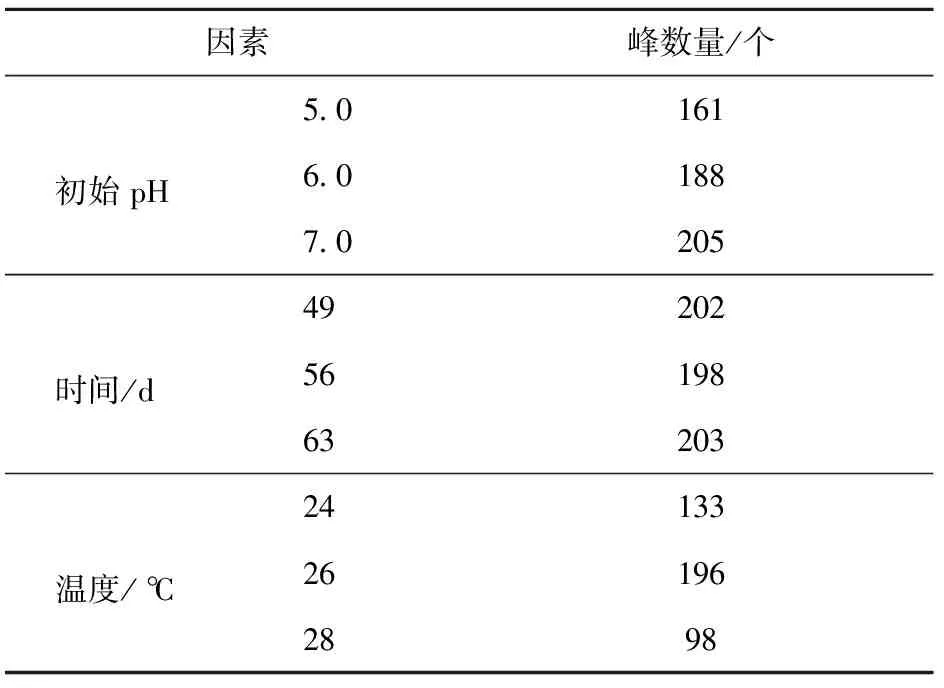
表7 不同环境因素下所有峰数量

表8 不同影响因素下相同峰数量及与总峰数比值
3 结 论
探索了食药两用大型真菌亚东木耳菌丝生长代谢的优化条件。研究表明,菌丝生长和代谢的优化条件为:碳源为可溶性淀粉,氮源为酵母浸粉,无机盐为CaCl2,温度为26 ℃,菌丝代谢初始pH值为6.0,菌丝生长初始pH值为7.0,时间为63 d。温度和初始pH值对亚东木耳菌丝次级代谢差异性影响较为显著,因此,通过适当控制亚东木耳的培养温度和初始pH值有利于获得丰富的次级代谢产物。文献报道,亚东木耳具有一定的寄主专一性[3]。实验表明,亚东木耳生长周期漫长,因此要获得其适宜的培养条件,还需要进一步探究。
[1] 王多,文涛. 中国大型真菌分类学研究进展[J]. 安徽农业科学,2011,39(34):20947-20948. WANG D, WEN T. Research progress of taxonomy of macro-fungi in China[J]. Journal of Ahnui Agri Sci, 2011, 39(34): 20947-20948.
[2] 贾身茂, 袁瑞奇, 孔维丽,等. 药用真菌之概念[J]. 中国食用菌, 2015(1): 82-88. JIA S M, YUAN R Q, KONG W L, et al.Concept of medicinal mushroom[J]. Chinese Edible Fungi, 2015(1): 82-88.
[3] 熊卫萍, 王磊, 李国杰, 等. 西藏“亚东黑木耳”的分类地位研究[J]. 食用菌学报, 2013, 20(1): 45-51. XIONG W P, WANG L, LI G J, et al. Taxonomic status of Yadong-hei-mu-er, a wild edible mushroom from Tibet[J]. Acta Edulis Fungi, 2013, 20(1): 45-51.
[4] 史强强, 党军, 苑祥, 等. 黄绿蜜环菌菌种分离及人工培养研究[J]. 食品工业科技, 2015, 36(20): 180-182. SHI Q Q, DANG J, YUAN X, et al.Study on the separation and domestication ofArmillarialuteorivensstrain[J]. Science and Technology of Food Industry, 2015,36(20): 180-182.
[5] KIM H O, LIM J M, JOO J H, et al. Optimization of submerged culture condition for the production of mycelial biomass and exopolysaccharides byAgrocybecylindracea[J]. Bioresource Technology, 2005, 96(10):1175-1182.
[6] XU H, SUN L P, SHI Y Z, et al. Optimization of cultivation conditions for extracellular polysaccharide and mycelium biomass byMorchellaesculenta, As51620[J]. Biochemical Engineering Journal, 2008, 39(1):66-73.
[7] 朱锦福, 刁治民, 王生财,等. 不同营养条件对黄蘑菇菌丝生长的影响[J]. 青海科技, 2004, 11(6):28-30. ZHU J F, DIAO Z M, WANG S C, et al. Effect on thehyphae growth ofArmillarialuteorivensunder different nutritional conditions[J]. Qinghai Science and Technology, 2004, 11(6): 28-30.
[8] 郑秀莲. 姬松茸母种培养基的优化试验[J]. 食用菌, 2013, 35(4):33-34. ZHENG X L. The mother medium optimized forAgaricusblazei[J]. Edible Fungi, 2013, 35(4): 33-34.
[9] 曾东方, 陈玢, 高孟文. 不同氮源对松茸菌丝生长的影响[J]. 食用菌, 2010, 32(4):10-11. ZENG D F, CHEN F, GAO M W. Effect on the hyphae growth ofTricholomamatsutakein different nitrogen sources[J]. Edible Fungi, 2010,32(4): 10-11.
[10] 史强强, 党军, 苑祥, 等. 黄绿蜜环菌深层发酵工艺研究[J]. 工业微生物, 2015, 45(4): 35-38. SHI Q Q, DANG J, YUAN X, et al.Studies on submerged fermentation technology ofArmillarialuteorivens[J]. Industrial Microbiology, 2015, 45(4): 35-38.
[11] 孙勇, 蒋继宏. 桦褐孔菌母种培养基的筛选[J]. 食用菌, 2007, 29(1): 30-30. SUN Y, JIANG J H. The mother culture screening ofInonotusobliquus[J]. Edible Fungi, 2007, 29(1): 30-33.
[12] 陈文强, 邓百万, 陈永刚, 等. 用L9(34)正交试验筛选裂褶菌液体培养基[J]. 食品与生物技术学报, 2005, 24(4): 38-41. CHEN W Q, DENG B W, CHEN Y G, et al. Selection of liquid medium forSchinophyllumcommunebyL9(34) orthogonal design[J]. Journal of Food Science and Biotechnology, 2005, 24(4): 38-41.
[13] 杨生兵, 陆震鸣, 耿燕, 等. 灰树花子实体与发酵菌丝体挥发性化合物分析[J]. 菌物学报, 2013, 32(1): 103-113. YANG S B, LU Z M, GENG Y, et al.Analysis of volatile compounds in fruiting bodies and submergedly cultured mycelia ofGrifolafrondosa[J]. Mycosystema, 2013, 32(1): 103-113.
[14] 韩俊杰, 宝丽, 刘宏伟. 药用真菌活性次级代谢产物研究[J]. 菌物学报, 2015, 34(5): 900-913. HAN J J, BAO L, LIU H W.Bioactive secondary metabolites from medicinal fungi[J].Mycosystema, 2015, 34(5): 900-913.
[15] 曾志, 杨东晖, 宋力飞, 等. 高效液相色谱指纹图谱应用于板蓝根的鉴定[J]. 分析化学, 2002, 30(7): 849-852. ZENG Z, YANG D H, SONG L F, et al.The identification ofIsatisIndigoticaFort. by high performance liquid chromatographic fingerprint[J]. Chinese Journal of Analytical Chemistry, 2002, 30(7): 849-852.
[16] 李越峰, 严兴科, 沈菲, 等. 白芍HPLC指纹图谱相似度的分析研究[J]. 中成药, 2008, 30(7): 942-945. LI Y F, YAN X K, SHEN F, et al.HPLC fingerprinting similarity analysis ofRadixpaeoniaealba[J]. Chinese Traditional Patent Medicine, 2008, 30(7): 942-945.
(责任编辑:叶红波)
Study on Fermentation Conditions of Rare Yadong Edible Fungus in Tibetan Plateau
LI Zhaokun1,2, WANG Fenghuan1,*, CHEN Bin2,*, JIANG Siping2, XU Aiguo2
(1.BeijingTechnologyandBusinessUniversity,Beijing100048,China; 2.TibetPlateauInstituteofBiology,Lasa850001,China)
In order to utilize and develop the rare Yadong edible fungus(Exidiasp.) better, the growth and metabolism culture conditions of the mycelium were explored. Effects of the culture mediums and the different conditions on mycelium growth rate, biomass, and secondary metabolites production were investigated. The results showed that glucose was the most suitable carbon source for mycelial growth, and soluble starch was the most suitable carbon source to obtain maximum biomass and metabolic product yield. Yeast extract was the most suitable nitrogen source for growth and metabolism. CaCl2was the optimal inorganic salt while vitamin B1and B2had no significant effects on promoting mycelial growth. HPLC fingerprint results showed that compounds of secondary metabolites were as many as 200 kinds and initial pH and temperature factors had more obvious influences on the secondary metabolic diversity.
edible fungus; Yadong edible fungus; culture conditions; secondary metabolism; HPLC analysis
10.3969/j.issn.2095-6002.2017.02.008
2095-6002(2017)02-0051-07

李兆坤,王凤寰,陈彬,等. 青藏高原珍稀大型真菌亚东木耳菌丝发酵条件研究[J]. 食品科学技术学报,2017,35(2):51-57. LI Zhaokun, WANG Fenghuan, CHEN Bin, et al. Study on fermentation conditions of rare Yadong edible fungus in Tibetan plateau[J]. Journal of Food Science and Technology, 2017,35(2):51-57.
2016-07-05
2014年西藏自治区科技计划应用基础研究项目“高原地区双孢菇栽培技术研究与菌丝发酵及次生代谢活性分析”。
李兆坤,女,硕士研究生,研究方向为食品生物技术;
*王凤寰,男,副教授,博士,主要从事食品生物技术方面的研究,通信作者;
*陈 彬,男,副研究员,博士,主要从事天然产物开发方面的研究,通信作者。
TS255; TS201.3
A

