渗透胁迫对菜用大黄组培苗生长及生理特性的影响
姜立娜+邵珠田+牛延斌+白雪莲+田蕾

摘要:以菜用大黄(Rheum rhaponticum L.)组培苗为材料,比较不同浓度的聚乙二醇PEG6000(分别为0、10、30、50、70 g/L)对其生长和生理特性的影响,主要测定了生长势、形态指标(苗高、鲜重)、生理指标(可溶性蛋白、脯氨酸、丙二醛含量及过氧化氢酶、过氧化物酶活性)的变化。结果表明,随着聚乙二醇浓度增加和培养时间的延长,菜用大黄组培苗出现萎蔫、玻璃化等现象;苗高和鲜重逐渐降低;可溶性蛋白含量先升后降,脯氨酸含量急速增长后缓慢下降,丙二醛含量、过氧化物酶和过氧化氢酶活性不断上升。说明菜用大黄对适度的聚乙二醇渗透胁迫有一定的抗性,但高浓度聚乙二醇胁迫会对其造成严重伤害。
关键词:菜用大黄(Rheum rhaponticum L.);渗透胁迫;聚乙二醇;组培苗;生长;生理特性
中图分类号:S644.9+78 文献标识码:A 文章编号:0439-8114(2017)14-2709-04
DOI:10.14088/j.cnki.issn0439-8114.2017.14.028
Abstract: The effects of different concentration of PEG-6000(0, 10, 30, 50, 70 g/L, respectively) on the growth and physiological and biochemical characteristics of culinary rhubarb(Rheum rhaponticum L.) tissue culture seedling were studied. The changes of morphological index, plant height, fresh weight, soluble protein, proline, MDA content and the activity of catalase(CAT) and peroxidase(POD) were determined. The results showed that with the increase of PEG concentration and prolonging of incubation time, the phenomenon of wilting and vitrification appeared; while seedling height and fresh weight decreased gradually; soluble protein increased first and then decreased; the proline content increased rapidly and decreased slowly afterwards; the content of MDA, activity of POD and CAT increased continuously. It was indicated that culinary rhubarb had some adaptability to moderate osmotic stress; but the PEG osmotic stress with high concentration might lead to severe damage on culinary rhubarb.
Key words: culinary rhubarb(Rheum rhaponticum L.); osmotic stress; PEG; tissue culture seedling; growth; physiological characteristics
干旱脅迫是影响蔬菜作物的主要自然灾害之一,也是农业发展面对的主要生产实际问题之一,是一个世界性的问题[1]。植物遇到干旱胁迫时会发生细胞水势降低、活性氧代谢系统紊乱以及细胞质膜相对透性增大等胁迫反应,进而影响到细胞的渗透调节能力,使得植物体内的渗透调节物质(如可溶性糖、可溶性蛋白、脯氨酸等)含量发生改变,最终影响植物的渗透压。干旱胁迫严重时,会导致植物细胞膨压丧失、失水等对植物生长不利的效应,从而影响植物生长发育甚至导致其死亡[2,3]。目前有关渗透胁迫对植物的影响在甜瓜(Cucumis melo L.)、黄瓜(C. sativus L.)、花生(Arachis hypogaea L.)、水稻(Oryza sativa L.)等作物上已有大量研究[3-6],但在菜用大黄(Rheum rhaponticum L.)上未见报道。菜用大黄为蓼科(Polygonaceae)大黄属(Rheum L.)多年生草本植物,以叶柄为主要食用部位,营养价值高,有极强的保健功能,被誉为“新兴特色蔬菜”,发展前景十分广阔[7,8]。为此,试验采用聚乙二醇(PEG)模拟干旱胁迫,研究菜用大黄组织培养苗在不同干旱程度下的生长情况以及渗透调节物质含量的变化,以期为探讨菜用大黄抗旱机制和培育菜用大黄抗旱品种提供一定的依据。
1 材料与方法
1.1 材料
菜用大黄品种为R19,由河南科技学院菜用大黄引种课题组提供菜用大黄组培苗。聚乙二醇为PEG6000。
1.2 方法
1.2.1 处理 对菜用大黄组培苗进行扩繁,再转接到继代培养基中培养。继代培养基中分别添加10、30、50、70 g/L PEG6000,以不加PEG6000的培养基为对照,继代培养基中琼脂的用量在PEG6000浓度为50、70 g/L时分别为7、8 g,其余浓度为6 g。每个处理设3次重复,每个重复接种30个外植体。培养条件一致,温度为(22±1) ℃,空气相对湿度70%~80%,光照度为2 200 lx,光照时间为12 h/d,培养5周后进行生长势观察和生长、生理指标测定。
1.2.2 测定方法 组培苗鲜重在去除培养基等杂质后直接称量单株重得到,苗高采用游标卡尺测量,可溶性蛋白含量采用考马斯亮蓝比色法[9]测定,脯氨酸含量采用酸性水合茚三酮显色法[10]测定,丙二醛含量采用硫代巴比妥酸显色法[10]测定,过氧化物酶活性采用愈创木酚法[10]测定,过氧化氢酶活性采用紫外分光光度计吸收法[10]测定。
1.3 数据处理
试验所得数据应用Microsoft Office Excel 2007程序处理,并制表、作图,采用SPSS 19.0软件进行统计分析。
2 结果与分析
2.1 PEG模拟干旱胁迫对菜用大黄组培苗生长势的影响
不同浓度PEG模拟干旱胁迫处理对菜用大黄组培苗生长势的影响情况见表1。由表1可见,随着PEG浓度的增加和处理时间的延长,菜用大黄组培苗出现生长缓慢、萎蔫、黄化、褐化、玻璃化等现象。低浓度PEG(≤30 g/L时)处理3周后,组培苗开始出现生长减缓及叶片黄化等现象;50 g/L PEG处理的后期组培苗玻璃化现象明显,而高浓度PEG(70 g/L)处理的第一周生长就缓慢,处理第三周即出现生长停滞,后期玻璃化严重,大部分叶片枯萎。表明较高浓度PEG模拟干旱胁迫对菜用大黄组培苗的生长负面影响非常明显。
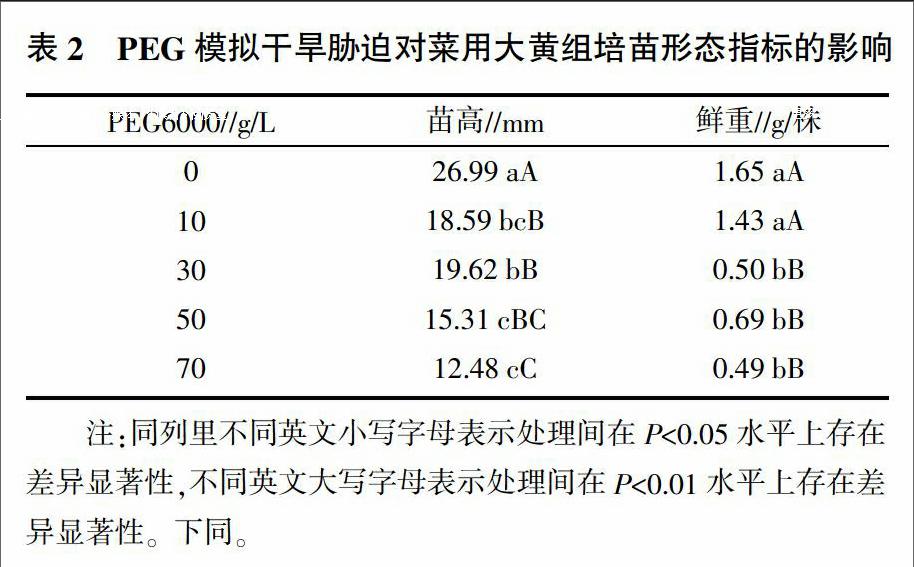
2.2 PEG模拟干旱胁迫对菜用大黄组培苗形态指标的影响
不同浓度PEG模拟干旱胁迫处理对菜用大黄组培苗形态指标的影响情况见表2。由表2可见,随着PEG浓度的增加,菜用大黄组培苗的苗高逐渐下降,且浓度越高下降幅度越大,4个PEG模拟干旱胁迫处理的苗高与对照的差异都极显著(P<0.01)。鲜重是衡量植物生长的重要客观形态指标,鲜重较重表明植物生长良好、根系发达、吸水能力强、营养水平正常[11]。由表2可知,在较低浓度PEG处理(<30 g/L)后,对照与处理间的鲜重差异不显著(P>0.05);但随着PEG浓度的升高(≥30 g/L),菜用大黄组培苗的鲜重迅速下降,并与对照之间差异极显著(P<0.01)。
2.3 PEG模拟干旱胁迫对菜用大黄组培苗生理指标的影响
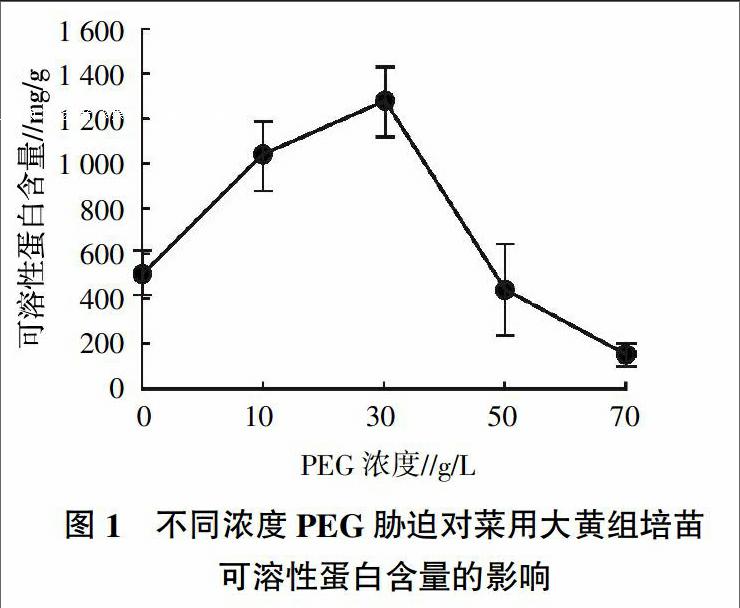
不同浓度PEG模拟干旱胁迫处理对菜用大黄组培苗生理指标的影响情况见图1、表3。
2.3.1 对菜用大黄组培苗可溶性蛋白含量的影响 由图1可见,菜用大黄组培苗可溶性蛋白含量随着PEG浓度的升高呈现先上升后下降的变化,其中在PEG浓度为30 g/L时达到最高值,在PEG浓度为70 g/L时为最低值,并且低于对照。说明在一定浓度的PEG模拟干旱胁迫后,菜用大黄会产生相应的适应,叶片的可溶性蛋白增加,从而增强了细胞的渗透调节能力,以维持代谢平衡;但是随着PEG浓度的持续升高,胁迫压力加大,使代谢平衡被打破,可溶性蛋白含量又迅速下降。
2.3.2 对菜用大黄组培苗脯氨酸含量的影响 从表3可见,随PEG浓度的增加,脯氨酸含量也增加。当PEG浓度为10 g/L时,脯氨酸含量与对照差异不显著(P>0.05);当PEG浓度为30 g/L时,脯氨酸含量达到最高值,与对照差异极显著(P<0.01);然后随着PEG浓度的增加,脯氨酸含量略有下降,但仍高于对照,并且与对照差异显著(P<0.05)。说明脯氨酸是渗透调节物质,其含量在逆境时(如渗透胁迫下)增加可以维持植物叶片的水势,但其含量的增加有一定的限度。
2.3.3 对菜用大黄组培苗丙二醛含量的影响 作为膜脂过氧化的主要产物,丙二醛能够抑制细胞保护酶活性和降低抗氧化物的含量,加剧膜脂的过氧化作用,所以其含量能够反映细胞膜脂过氧化的强度[2]。由表3可见,随着PEG模拟干旱浓度的增加,菜用大黄组培苗的丙二醛含量快速升高,各PEG处理浓度与对照的差异都达极显著水平(P<0.01)。
2.3.4 对菜用大黄组培苗过氧化氢酶活性的影响 过氧化氢酶是植物体内重要的抗氧化酶之一,也是植物体内的清洁剂,可以清除体内的过氧化氢,对植物起保护作用。由表3可见,随着PEG模拟干旱胁迫浓度的增加,菜用大黄组培苗的过氧化氢酶活性呈上升趋势,当PEG浓度为10~30 g/L时,过氧化氢酶活性与对照差异不显著(P>0.05);当PEG浓度 ≥50 g/L时,过氧化氢酶活性与对照的差异达到极显著水平(P<0.01)。
2.3.5 对菜用大黄组培苗过氧化物酶活性的影响 过氧化物酶是植物体内重要的保护酶之一,是一种活性氧自由基的清除剂,能够减轻细胞遭受胁迫引起的伤害。由表3可知,菜用大黄组培苗体内过氧化物酶活性随着PEG模拟干旱胁迫处理浓度的增加而逐步增大,在受到渗透胁迫时植物体内的过氧化物酶活性一直稳定增长,呈现上升趋势,并在高浓度(≥50 g/L)处理下,与对照的差异达到了显著(P<0.05)或极显著水平(P<0.01)。
3 讨论
试验结果表明,在不同浓度的PEG模拟干旱胁迫下,菜用大黄组培苗的生长发育受到了不同程度的影响。随着PEG浓度的增加和培养时间的延长,组培苗陆续出现了生长停滞、黄化、萎蔫、玻璃化等现象,表明渗透胁迫影响了组培苗的正常生长,负面效应非常明显。
植物体内的可溶性蛋白是一种渗透调节物质,在植物遭受到逆境胁迫时,可溶性蛋白含量随之会提高,植物组织的束缚水含量也相应提高,使渗透势降低来维持细胞内的新陈代谢,起到保水、增强植物的抗性等作用[1,2]。而在试验中,随着模拟干旱胁迫程度的增加,出现了可溶性蛋白含量先升后降的现象,这与前人对佛甲草(Sedum lineare Thunb.)[12]、高山离子芥(Chorispora bungeana Fisch. et Mey.)[13]、油菜(Brassica campestris L.)[14]受干旱胁迫時可溶性蛋白的增长趋势研究结果一致。因此,出现先升后降很有可能是由于干旱胁迫下受伤的植物表现出的一种适应性反应,对植物有一定的保护作用。
作为植物体内的渗透调节物质脯氨酸在干旱胁迫下会累积增加,因此可以根据植物体内脯氨酸的含量来判断干旱对植物的危害程度[15]。有报道认为,脯氨酸含量的增加能在一定程度上降低细胞原生质的渗透势,增强保水力,降低细胞酸性以及解除氨毒[16]。在本试验中,随着PEG模拟干旱浓度的增加,脯氨酸含量开始上升,当PEG浓度达到30 g/L时,脯氨酸含量不再增加,开始出现缓慢下降的趋势,这与前人在香蕉(Musa nana Lour.)[17]、紫甘薯[Ipomoea batatas(L.)Poir.][18]上的研究情况基本一致。
丙二醛的含量和过氧化物酶、过氧化氢酶活性可作为鉴定植物抗旱性的重要指标[19]。在本試验中,丙二醛含量和过氧化物酶、过氧化氢酶活性随模拟干旱程度的加重而呈直线上升,这与聂石辉等[20]对大麦(Hordeum vulgare L.)的研究一致,说明在重度胁迫下,丙二醛积累越多,细胞受损越重,保护能力越弱,但大量的过氧化物酶、过氧化氢酶可以清除活性氧自由基,减轻对植物的伤害,增强其抗旱性。
综上所述,菜用大黄组培苗在较低浓度(≤30 g/L)PEG模拟干旱胁迫下,具有一定的适应性,但随着胁迫的加重,质膜相对透性增加,渗透调节物质含量增加,植株生长受到了限制。表明菜用大黄能够耐受一定程度的干旱胁迫,但在较强的干旱胁迫下会受到严重伤害,这在菜用大黄的栽培管理中具有实际指导意义,也为其引种栽培和品种选育提供了一定的理论依据。
参考文献:
[1] 孙存华,李 扬,贺鸿雁,等.藜对干旱胁迫的生理生化反应[J].生态学报,2005,25(10):2556-2561.
[2] 赵文才,李 慧,赵会杰,等.外源腐胺对干旱胁迫下小麦叶片渗透调节的影响[J].中国农学通报,2009,25(9):148-151.
[3] 师进霖,陈恩波,姜悦丽.PEG6000模拟渗透胁迫对甜瓜幼苗叶片渗透调节物质及膜脂过氧化的影响[J].西北农业学报,2010, 19(1):182-185.
[4] 宋唯一.PEG6000模拟干旱胁迫对黄瓜幼苗生长的影响[J].湖北农业科学,2011,50(12):2394-2397.
[5] 毛淑蕊,李墨霞,万勇善,等.渗透胁迫对花生不定根再生及生长特性的影响[J].山东农业大学学报(自然科学版),2009,40(3):329-333.
[6] 杨俊年,胡廷章,刘仁华,等.渗透胁迫对水稻幼苗生理生化的影响[J].广东农业科学,2014(1):1-4,15.
[7] RUBATZKY V E,YAMAGUCHI M. World Vegetable:Principles,Production and Nutritive Values(Second edition)[M].New York:Chapman & Hall,1997.692-695.
[8] 卢 莉,赵一鹏.菜用大黄的研究进展[J].广东农业科学,2008(2):19-21,27.
[9] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.184-185.
[10] 张蜀秋.植物生理学实验技术教程[M].北京:科学出版社,2011.187-201.
[11] 裘丽珍,黄有军,黄坚钦,等.不同耐盐性植物在盐胁迫条件下的生长与生理特性比较研究[J].浙江大学学报(农业与生命科学版),2006,32(4):420-427.
[12] 刘爱荣,张远兵,谭志静,等.模拟干旱对佛甲草生长和渗透调节物质积累的影响[J].草业学报,2012,21(3):56-62.
[13] 杨 宁,王程亮,李宜坤,等.高山离子芥试管苗在PEG6000模拟干旱条件下的生理响应[J].广西植物,2015,35(1):77-83.
[14] 张 弢.PEG6000模拟干旱胁迫对油菜幼苗生理生化指标的影响[J].安徽农业科学,2012,40(20):10363-10364,10379.
[15] 王红梅,包维楷,李芳兰.不同干旱胁迫强度下白刺花幼苗叶片的生理生化反应[J].应用与环境生物学报,2008,14(6):757-762.
[16] 张玉霞,杜晓艳,张玉芹,等.PEG胁迫对苔草渗透调节特性的影响[J].内蒙古民族大学学报(自然科学版),2008,23(3):289-292.
[17] 管利民,吴志祥,张盈盈,等.巴西香蕉幼苗对PEG6000模拟干旱的生理响应[J].广东农业科学,2012(21):66-69.
[18] 龚 秋,王 欣,后 猛,等.PEG6000模拟干旱胁迫对紫甘薯幼苗生理生化指标的影响[J].江西农业学报,2015,27(3):6-10.
[19] 包海柱,徐寿军,张凤英,等.PEG6000胁迫对大麦保护性酶活性的影响[J].内蒙古农业科技,2015,43(1):8-9.
[20] 聂石辉,齐军仓,张海禄,等.PEG6000模拟干旱胁迫对大麦幼苗丙二醛含量及保护酶活性的影响[J].新疆农业科学,2011, 48(1):11-17.

