象山港海水网箱养殖区弧菌群落动态变化
唐 姝, 熊金波, 王 凯, 胡常巨, 郑嘉来, 张德民
(宁波大学 海洋学院, 宁波 315211)
象山港海水网箱养殖区弧菌群落动态变化
唐 姝, 熊金波, 王 凯, 胡常巨, 郑嘉来, 张德民
(宁波大学 海洋学院, 宁波 315211)
象山港养殖区是我国典型海水养殖区,弧菌(Vibrio)是引起鱼类细菌性疾病的重要病原菌之一。研究于2012年8月—11月,采集象山港大黄鱼网箱养殖区内外海水和鱼体样品分析弧菌群落组成及其动态演替。典型对应分析结果表明养殖区和对照区弧菌群落随时间变化显著。温度、总有机碳、总磷和活性磷酸盐是弧菌群落结构变异的最大环境驱动因子。采用16S rRNA和rpoA鉴定海水和鱼体组织中分离出的优势菌株,表明养殖区和对照区的弧菌群落组成不同,且病害暴发时对照区哈维弧菌(Vibrioharveyi)丰度突增。因此,哈维弧菌可作为预测象山港养殖鱼类患病的快速检测指标。病害暴发后由于投加抗生素,养殖区和鱼体组织中纤细发光杆菌(Photobacteriumangustum)丰度突增。
弧菌;群落结构;鱼类病害;环境因子
随着海洋捕捞产量急剧下降,海产品需求的增长更大程度上依靠海水养殖业,其中网箱养殖业占据了重要地位[1]。近年来,随着养殖技术的发展,我国海水网箱养殖业迅速发展;但与此同时,各种病害频繁发生已成为水产养殖产业发展的主要瓶颈[2-3]。弧菌是海水养殖动物最常见且危害最严重的细菌性病原之一,其宿主范围广泛,包括鱼、虾、贝类等几乎所有水产养殖动物,流行面积大、死亡率高,容易造成巨大的经济损失[4-5]。
象山港位于浙江省宁波市东南部,是我国主要海水养殖区之一。随着养殖面积的扩大,科学管理的缺乏,象山港水质环境逐步恶化,养殖病害发生日益频繁,严重制约当地水产养殖业的发展[6-7]。研究表明弧菌群落与环境因子的变化联系密切[8-9],网箱养殖可显著改变海水理化性质进而影响弧菌群落[10]。然而,大多数象山港养殖区生态方面的研究集中在浮游动植物、底栖生物,关于微生物生态特别是弧菌群落结构及其与环境因子间关系的报道较少[11-13]。作者选取象山港大黄鱼网箱养殖区作为供试区,监测了在网箱养殖区和对照区中海水和鱼体弧菌种类与数量变化,研究分析弧菌群落与主要环境因子之间的关系,探究海水弧菌群落与鱼类病害暴发的潜在关联,以期为象山港海域整治及当地大黄鱼病害的控制提供科学依据。
1 材料和方法
1.1 样品采集与分离培养
2012年8月13日至11月20日,以宁波市象山港大黄鱼网箱养殖区(N区,N: 29°31′58.14″, E:121°45′11.71″)和养殖外围航道区(C区,距N区1000 m,N:29°32′21.99″, E:121°45′36.48″)为研究区域,采集海水和大黄鱼样品。采样时间分别为2012年8月13日、8月29日、9月20日、10月9日、10月31日和11月20日,按《海洋环境监测规范》采集水样和大黄鱼样品。水样和大黄鱼样品采集后带回实验室在4 h内处理。监测周期内,8月8日台风“海葵”登陆,8月13日至15日发生了赤潮,9月15日发生了大规模大黄鱼病害。
1.2 环境因子分析方法
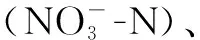
1.3 异养细菌和弧菌计数及分离
采集的海水样品用无菌生理盐水按10倍浓度梯度系列稀释,取100 μL进行涂布。总异养细菌数量采用LB平板涂布法,可培养弧菌数采用TCBS(Thiosulfate citrate bile saccharose)平板涂布法。选取菌落数1~300的TCBS平板,随机挑取30株单菌落(低于30株则全部挑取),用LB(Luria-Bertani)固体培养基连续分离纯化2次,得到纯菌株。同时,对大黄鱼肝、脾、肾组织进行NA(Nutrient agar)平板划线培养,挑取优势菌株于LB固体培养基上连续分离纯化。纯化后的菌株加25%无菌甘油,-80℃保存。PCR扩增纯化菌株的16S rRNA基因及rpoA基因,送上海生工公司进行序列测定。所用引物及PCR扩增条件如表1所示。
1.4 数据分析
将测序结果与NCBI和EzdTaxon[16]数据库中模式菌株的序列比对,通过16S rRNA基因的相似性比较初步判断对应弧菌菌株的种属,再用rpoA序列进行比对验证。运用SPSS17.0软件的Pearson相关性分析,分析可培养弧菌及总异养菌丰度间的相关性。采用典型对应分析(Canonical correspondence analysis, CCA)揭示海水弧菌群落结构及其与环境驱动因子的相关性。
2 结果
2.1 海水环境因子变化动态

表1 所用PCR引物序列及扩增条件

表 2 象山港养殖区和对照区海水样品的环境因子
2.2 海水总异养菌及弧菌丰度动态
我们在最易暴发病害的夏秋季节检测了养殖区和对照区表层海水的总异养菌和弧菌的变化,发现两个区域的总异养菌和弧菌丰度的变化趋势不同(图1)。8月中下旬(13日和29日两个时间点),养殖区和对照区的总异养菌和弧菌丰度都相近;但9月20日,养殖区的总异养菌和弧菌丰度变化不大,而对照区则明显上升,结果,对照区的总异养菌和弧菌丰度明显高于养殖区一到两个数量级;之后的10月9日,情况反转,养殖区总异养菌和弧菌丰度急剧上升,而对照区则明显下降,结果养殖区的总异养菌和弧菌高出对照区一到两个数量级;之后的两个时间点(10月30日和11月20日)都延续了养殖区高于对照区的趋势。
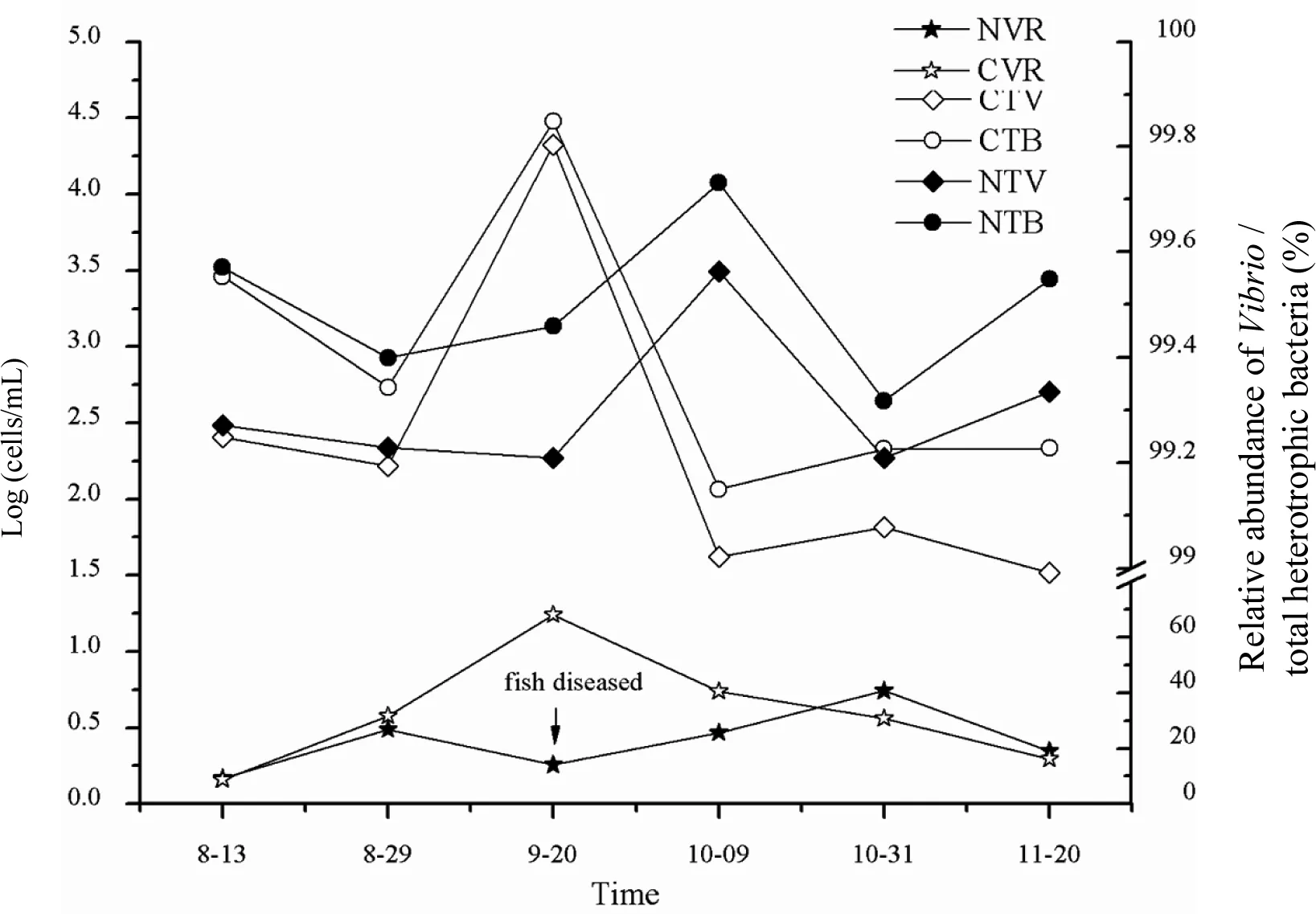
图1 象山港夏秋季节总异养菌及弧菌丰度变化图Fig 1 Abundance of total heterotrophic bacteria and Vibrio during summer and autumn in Xiangshan Bay●、◆:养殖区细菌丰度;○、◇:对照区细菌丰度;●、○:总菌丰度;◆、◇:弧菌相对丰度;★、☆,弧菌占总异养细菌的比例
两个区域的弧菌丰度与总异养菌丰度成正相关(养殖区:R=0.996,P=0.021;对照区:R=0.981,P< 0.001),弧菌是海水细菌的优势菌(占总异养细菌的8.72%~68.07%)。弧菌与异养细菌的比例除养殖区一个时间点(9月20日)外,表现出两头低,中间高的趋势,总体上变化范围在10%~40%之间。但在9月20日,对照区弧菌的数量和丰度都明显增高,与总异养菌的比例接近1∶1,与此形成鲜明对照的是养殖区弧菌的比例却明显降低,只有总异养菌的10%多,其丰度比对照区低两个数量级。
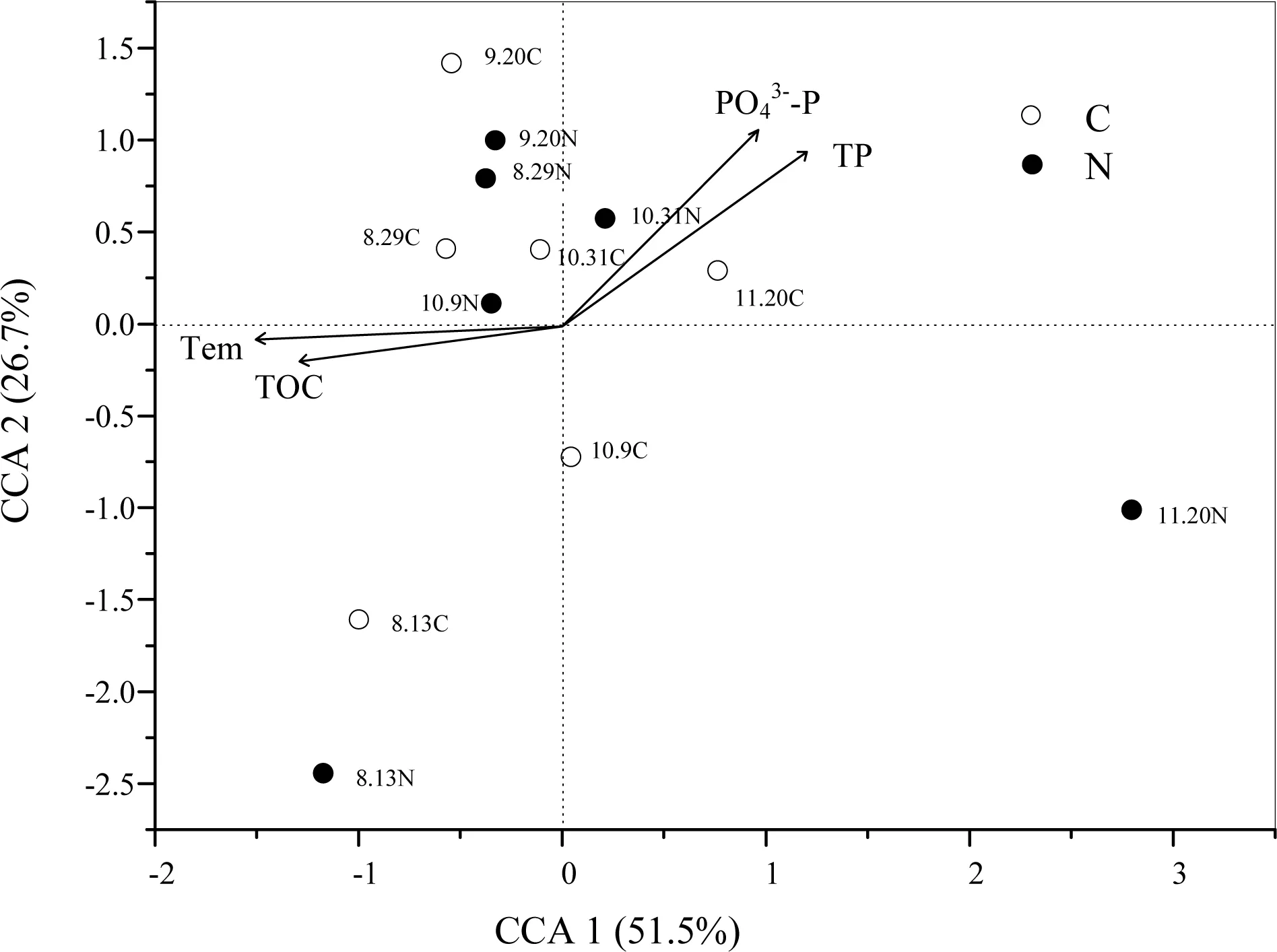
图2 典型对应分析揭示海水弧菌群落结构与环境驱动因子的相关性Fig 2 Canonical correspondence analysis (CCA) illustrates the correlation of the seawater Vibrio community structure with the environmental driving factorsN:养殖区;C:对照区;Tem:温度;TP:总磷;磷酸盐; TOC:总有机碳
2.3 弧菌群落结构及其与环境因子相关性

2.4 海水及鱼体组织优势细菌分离株种类分布
从TCBS平板上共分离出332株海水细菌以及43株鱼体组织细菌。海水细菌包括36种弧菌,其中溶藻弧菌(Vibrio.alginolyticus)、强壮弧菌(Vibrio.fortis)、哈维弧菌(Vibrio.harveyi)、巴西弧菌(Vibrio.brasiliensis)、大菱鲆弧菌(Vibrio.scophthalmi)、轮虫弧菌(Vibrio.rotiferianus)、东方弧菌(Vibrio.orientalis)、副溶血性弧菌(Vibrio.parahaemolyticus)等14种弧菌所占比例较大,为象山港海水主要弧菌种类。其他异养菌中美人鱼发光杆菌杀鱼亚种(Photobacterium.damselaesubsp.Piscicida)、纤细发光杆菌和鳆发光杆菌(Photobacterium.leiognathi)所占比例最高,为象山港海水主要异养菌种类(表3)。43株鱼体组织细菌中哈维弧菌检出率最高,所占比例最大,达20.8%(表4)。8月13日,鱼体组织中未分离到菌株,之后弧菌和哈维弧菌丰度呈现规律性动态变化。8月29日鱼体组织中哈维弧菌丰度上升,于9月20日达到峰值。海水样品中,对照区中哈维弧菌丰度也呈现类似的动态变化, 8月29日,对照区海水中哈维弧菌丰度最高。11月20日,鱼体组织中未分离得弧菌菌株,异养菌纤细发光杆菌所占比例最大,达57.1%(表4)。此时,养殖区海水样品中纤细发光杆菌丰度也达到峰值,显著高于对照区海水样品,占海水纤细发光杆菌总丰度的94.7%(表3)。

表3 海水弧菌类细菌(TCBS平板分离)的种类分布
N:养殖区;C:对照区;V.:Vibrio;S.:Shewanella;P.:Photobacterium
3 讨论
3.1 海水总异养菌和弧菌丰度变化
8月中下旬(8月13日和8月29日),养殖区和对照区间的总异养菌和弧菌丰度相近,但8月13日两者丰度均高于8月29日(图1)。这可能是由于8月13日暴发赤潮(叶绿素浓度激增,见表2),浮游植物生物量升高导致细菌数量激增[9, 17-19]。研究表明细菌数量与盐度负相关[4], 8月8日台风带来的暴雨导致8月13日海水盐度最低(20‰,见表2),且台风引起的雨水流入以及沉积物扰动[20-21],均可导致8月13日总异养菌和弧菌丰度较高。之后的4个时间点(9月20日,10月9日、10月30日和11月20日),两个区域的总异养菌和弧菌丰度变化动态不同。对照区总异养菌和弧菌丰度于9月20日达到峰值后急剧下降,而养殖区总异养菌、弧菌丰度以及弧菌相对丰度出现强势反弹,分别于10月9日和10月31日达到峰值(图2)。这个结果可能跟病害的暴发和其后的干预措施有关。9月15日,养殖区暴发了大规模大黄鱼病害,养殖户在网箱养殖区投加了大量抗生素,抑制了养殖区弧菌的生长,同时也制约了总异养菌的生长,结果出现养殖区总异养菌和弧菌丰度明显低于对照区的结果。9月20日后,养殖区总异养菌和弧菌丰度出现强势反弹。微生物中存在k-r选择,弧菌属于r细菌,适宜的情况下极易大量繁殖[4, 17]。9月20日后随着病害程度降低,养殖区抗生素投加量逐渐减少,对弧菌的抑制作用逐渐减弱,弧菌大量繁殖。此外,由于外源抗生素施用,某些弧菌可能已产生抗药性,这些都导致病害暴发(9月15日)后养殖区弧菌相对丰度明显上升。因此,投加抗生素并不是可持续的防治养殖病害手段,病害消失后仍需密切关注弧菌群落动态并采取相应措施,防止病害再度暴发。

表4 患病鱼体组织中细菌(TCBS平板分离)的种类分布
V.:Vibrio;P.:Photobacterium;Pse.:Pseudomonas;Sta.:Staphylococcus
3.2 海水弧菌群落的主要驱动因子
3.3 弧菌群落与大黄鱼病害间的关系
弧菌是水产养殖动物常见的条件致病菌,其致病性取决于养殖动物生理状态及海水环境因子[4]。本研究中,养殖区和对照区海水弧菌群落α-多样性差异不显著,且未发现与大黄鱼病害暴发存在关系(数据未列出)。之前报道指出弧菌致病性与弧菌数量密切相关,弧菌数量越高,病害暴发概率越大[8, 20, 27]。然而本研究中大黄鱼病害暴发(9月15日)前,对照区海水弧菌丰度未有上升,且病害暴发前后,弧菌群落差异不明显,说明本研究中海水弧菌群落可能主要通过某一种或几种特定弧菌导致大黄鱼病害暴发。8月29日,鱼体组织中哈维弧菌丰度上升,9月15日即暴发了大规模鱼类病害。病害发生后(9月20日),鱼体组织中哈维弧菌丰度最高。病鱼表现为鱼尾溃烂、皮肤破裂,与感染哈维弧菌特征类似[28-29]。此外,对照区哈维弧菌丰度也于病害暴发前达到最大值。因此,哈维弧菌可能是象山港大黄鱼病害的主要致病源,可成为潜在的预测预警象山港大黄鱼病害发生的指示生物因子。这与庞观宏[4]在湛江港网箱养殖区的研究结果一致:夏秋季,海水弧菌主要以哈维氏弧菌出现,对应的水体环境污染相对严重,生态风险较高。此外,大黄鱼病害暴发(9月15日)后,11月20日养殖区和对照区弧菌群落结构差异明显增大,这主要是由纤细发光杆菌所致(图2)。纤细发光杆菌在鱼体组织和养殖区海水中增长迅速,成为11月20日鱼体组织和养殖区海水的主要种群,而在对照区海水中丰度很低。研究表明纤细发光杆菌对青霉素、链霉素、羟氨苄青霉素等抗生素有抗性[30],病害暴发后,大量抗生素被投加至养殖区水体,抑制了多种细菌的生长,可能反而促进了纤细发光杆菌的繁殖。因此,纤细发光杆菌可能可作为病害暴发后的环境指示菌。
[1]陈丹琴, 杨京平, 蔡燕红, 等. 海水网箱养殖区环境质量综合评价[J]. 海洋学研究, 2015, 33(3): 62-69.
[2]THITAMADEE S, PRACHUMWAT A, SRISALA J, et al. Review of current disease threats for cultivated penaeid shrimp in Asia[J]. Aquaculture, 2016, 452: 69-87.
[3]杨少丽, 王印庚, 董树刚. 海水养殖鱼类弧菌病的研究进展[J]. 渔业科学进展, 2005, 26(4): 75-83.
[4]庞观宏. 湛江港网箱养殖海域环境因子与细菌数量调查及弧菌属细菌的分布[D]. 湛江: 广东海洋大学, 2010.
[5]陈 梅. 海养动物中弧菌的种类及其与人类健康、水产病害关系的研究[D]. 青岛: 中国海洋大学, 2000.
[6]章根华, 洪因之, 俞 露. 2011年-2012年宁海县所属象山港和三门湾海域生物性污染状况调查[J]. 中国卫生检验杂志, 2013, 23(9): 2167-2168.
[7]杨林林, 姜亚洲, 袁兴伟, 等. 象山港生态系统结构与功能的 Ecopath 模型评价[J]. 海洋渔业, 2015, 37(5): 399-408.
[8]杨宝丽, 王瑞旋, 时少坤, 等. 鲍养殖环境中弧菌密度变化及其与环境因子的关系[J]. 南方水产科学, 2015, 11(3): 95-102.
[9]ASPLUND M E, REHNSTAM-HOLM A S, ATNUR V, et al. Water column dynamics ofVibrioin relation to phytoplankton community composition and environmental conditions in a tropical coastal area[J]. Environmental Microbiology, 2011, 13(10): 2738-2751.
[10]BANDPEI M A A, NASROLAHZADEH H, RAHMATI R, et al. Examining the effects of fish cage culture on phytoplankton and zooplankton communities in the Southern Coast of the Caspian Sea (Mazandaran Waters Kelarabad)[J]. American Journal of Life Science Researches, 2016, 4(2): 104-117.
[11]陈明明, 王少璞, 韦 梦, 等. 象山港网箱养殖区沉积物的古菌空间分布[J]. 生态学报, 2014, 34(14): 4099-4106.
[12]胡常巨, 熊金波, 陈和平, 等. 象山港网箱养殖区与非养殖区的细菌群落分布[J]. 生态学报, 2015, 35(24): 8053-8061.
[13]江志兵, 朱旭宇, 高 瑜, 等. 象山港春季网采浮游植物的分布特征及其影响因素[J]. 生态学报, 2013, 33(11): 3340-3350.
[14]LANE D J. 16S/23S rRNA sequencing[J]. Nucleic Acid Techniques in Bacterial Systematics, 1991: 125-175.
[15]THOMPSON F L, IIDA T, SWINGS J. Biodiversity ofVibrios[J]. Microbiology and Molecular Biology Reviews, 2004, 68(3): 403-431.
[16]CHUN J, LEE J H, JUNG Y, et al. EzTaxon: a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene Sequences[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(pt10): 2259-2261.
[17]TURNER J W, GOOD B, COLE D, et al. Plankton composition and environmental factors contribute to Vibrio seasonality[J]. ISME Journal, 2009, 3(9): 1082-1092.
[18]ANDERSON D M. Turning back the harmful red tide[J]. Nature, 1997, 388(6642): 513-514.
[19]JOHNSON C N, BOWERS J C, GRIFFITT K J, et al. Ecology ofVibrioparahaemolyticus andVibriovulnificus in the coastal and estuarine waters of Louisiana, Maryland, Mississippi, and Washington (United States)[J]. Applied and Environmental Microbiology, 2012, 78(20): 7249-7257.
[20]王国良, 金 珊, 薛良义, 等. 海水网箱养殖鲈鱼皮肤溃疡病及其病原菌的研究[J]. 黄渤海海洋, 2000, 18(3): 85-89.
[21]WETZ J J, BLACKWOOD A D, FRIES J S, et al. Trends in totalVibriospp. andVibriovulnificus concentrations in the eutrophic Neuse River Estuary, North Carolina, during storm events[J]. Aquatic Microbial Ecology, 2008, 53(1): 141-149.
[22]HSIEH J L, FRIES J S, NOBLE R T. Dynamics and predictive modelling ofVibriospp. in the Neuse River Estuary, North Carolina, USA[J]. Environmental Microbiology, 2008, 10(1): 57-64.
[23]张新中, 谢珍玉, 王世锋, 等. 海南万宁小海近岸表层海水弧菌组成及其变化[J]. 海洋学报, 2011, 33(6): 142-150.
[24]HSIAO H I, JAN M S, CHI H J. Impacts of climatic variability onVibrioparahaemolyticus Outbreaks in Taiwan[J]. International journal of Environmental Research and Public Health, 2016, 13(2): 188.
[25]王 凯,邹 立,高冬梅,等. 黄河口潮滩春季细菌群落的分布特征及其影响因素研究[J]. 中国海洋大学学报,2016,46(1):108-115.
[26]PERALTA R M, AHN C, GILLEVET P M. Characterization of soil bacterial community structure and physicochemical properties in created and natural wetlands[J]. Science of the Total Environment, 2013, 443: 725-732.
[27]SCHETS F M, VANDEN BERG H H, MARCHESE A, et al. Potentially human pathogenic vibrios in marine and fresh bathing waters related to environmental conditions and disease outcome[J]. International Journal of Hygiene and Environmental Health, 2011, 214(5): 399-406.
[28]毛芝娟, 刘国勇, 陈昌福. 大黄鱼溃疡病致病菌的初步分离与鉴定[J]. 安徽农业大学学报, 2002, 29(2): 178-181.
[29]LIU L, GE M, ZHENG X, et al. Investigation ofVibrioalginolyticus,V.harveyi, andV.parahaemolyticusin large yellow croaker, Pseudosciaena crocea (Richardson) reared in Xiangshan Bay, China[J]. Aquaculture Reports, 2016, 3(1): 220-224.
[30]HOLT J G. Bergey′s Manual of Determinative Bacteriology [M]. Williams&Wilkins, 1992: 256-257.
Dynamics of theVibriocommunity in aquaculture area of Xiangshan harbour, Ningbo
TANG Shu, XIONG Jin-bo, WANG Kai, HU Chang-ju, ZHENG Jia-lai, ZHANG De-min
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)

Vibrio; community structure; fish diseases; environmental parameters
2016-06-06;
2016-06-21
国家“863”高技术研究发展计划 (2012AA092001)
唐 姝,硕士研究生,主要从事海洋微生物学研究,E-mail: 272280750@qq.com
张德民,教授,主要从事微生物生态学研究,E-mail: zhangdemin@nbu.edu.cn
Q938.1
A
2095-1736(2017)04-0076-06
doi∶10.3969/j.issn.2095-1736.2017.04.076

