热驯化对大绒鼠的体重和能量代谢的影响
朱万龙, 高文荣
(云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室 云南师范大学 生命科学学院, 昆明 650500)
热驯化对大绒鼠的体重和能量代谢的影响
朱万龙, 高文荣
(云南省高校西南山地生态系统动植物生态适应进化及保护重点实验室 云南师范大学 生命科学学院, 昆明 650500)
为阐明高温胁迫对大绒鼠体重和能量代谢的影响,测定了高温条件下(30℃)大绒鼠的体重、体温、基础代谢率、非颤抖性产热、能量收支和肝脏产热活性。结果表明:热驯化可以使大绒鼠的体重和体温增加,能量摄入和产热能力降低,肝脏线粒体呼吸状态Ⅲ呼吸显著下降,而线粒体状态Ⅳ呼吸差异不显著。以上结果表明大绒鼠在高温条件下增加体重和体温,降低能量摄入和产热能力来适应高温胁迫。
大绒鼠;热驯化;能量代谢
动物的能量代谢水平对其分布、繁殖、生存等具有重要的作用[1-2]。动物体重的维持取决于能量获取和消耗[3]。小型哺乳动物的能量代谢水平受许多环境因子的影响,如温度和光照,这些生态因子对动物的体重调节等有重要作用[3]。很多栖息于温带地区的啮齿类动物的体重和能量摄入等出现季节性变化。很多小型哺乳动物在冬季会降低体重和体脂含量,而体重的降低是对食物资源短缺或者冷胁迫的一种适应方式,即减少绝对能量消耗[4]。也有研究表明低温使得食物摄入量增加,但是低温往往和食物数量和质量较差的环境相对应,因此,在野外的小型哺乳动物的体重变化往往是可变的[5]。
国外关于温度对动物体重调节的研究较多[6-10],如长爪沙鼠[11]、根田鼠[12]、布氏田鼠[13]、高原鼠兔[14]、高山姬鼠[15]和中缅树鼩[16]等。大绒鼠为横断山区的固有种,中国的特有种,大绒鼠栖息的环境特点为年温差小,日温差大,因此每天都要经历高温和低温的胁迫。之前本研究组对大绒鼠低温条件下的适应对策进行了研究[10],但是对高温的适应对策没有报道。本实验通过测定热驯化条件下大绒鼠的能量收支、基础代谢率、非颤抖性产热能力、肝脏线粒体呼吸等特征,以理解该物种对横断山特殊环境的生存适应机理。
1 材料和方法
1.1 动物来源
本实验所用的大绒鼠为实验室饲养繁殖种群,均为成年非繁殖期个体。共选取62只大绒鼠作为研究对象,在实验室条件下适应2周后开始实验。随机分为2组:热驯化组(n=56),驯化条件为30℃,中等光照,驯化49 d,每周测量体重、体温、基础代谢率、非颤抖性产热和能量收支。每周挑选6只动物处死,测定褐色脂肪组织重量和肝脏线粒体的活性。对照组(n=6),驯化条件为25℃,中等光照,驯化49 d,每周测定体重、体温、基础代谢率、非颤抖性产热和能量收支。
1.2 代谢率的测定
每周进行基础代谢率和非颤抖性产热的测定,在呼吸室内静置30 min左右,进入呼吸室后适应30 min,采用开放式呼吸仪进行代谢率的测定,代谢率的具体方法详见文献[17]。
1.3 体重和能量收支的测定
每周测定大绒鼠的体重、体温和能量收支,定时定量给动物喂食,称量动物体重后小心收集剩余食物、粪便及尿液(每次收集时间均在11:00—13:00之间进行)。收集的食物和粪便,在烘箱中干燥至恒重,手工分离剩余食物和粪便;取部分样品称量(重量在1.0 g左右,精确到0.0001 g),用YX-ZR/Q金鹰全自动量热仪测定热值,能量收支的具体方法详见文献[18]。
1.4 线粒体呼吸活性测定
每周测定大绒鼠的线粒体蛋白和呼吸活性测定,采用Hanstech Oxy-Lab Chloroab 2氧电极测定线粒体蛋白含量、呼吸状态Ⅲ和状态Ⅳ,用Lowry法测定蛋白质含量,线粒体蛋白和呼吸活性的具体方法详见文献[18]。
1.5 数据分析
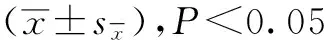
2 结果
2.1 体重和体温
大绒鼠的体重在0~49 d内逐渐增加(F=49.97,P<0.01),28 d后大绒鼠体重差异不显著,28 d平均体重比对照组增加了(7.89±1.44)g,见图1。实验前,大绒鼠的体温差异不显著(F=0.12,P>0.05)。28 d前,大绒鼠的体温随时间的延长而增加,28 d后维持平稳(F=0.08,P>0.05),28 d大绒鼠平均体温比对照组增加了(0.68±0.09)℃,热驯化组与对照组(0 d)比较差异显著(F=2.60,P<0.01,图2)。
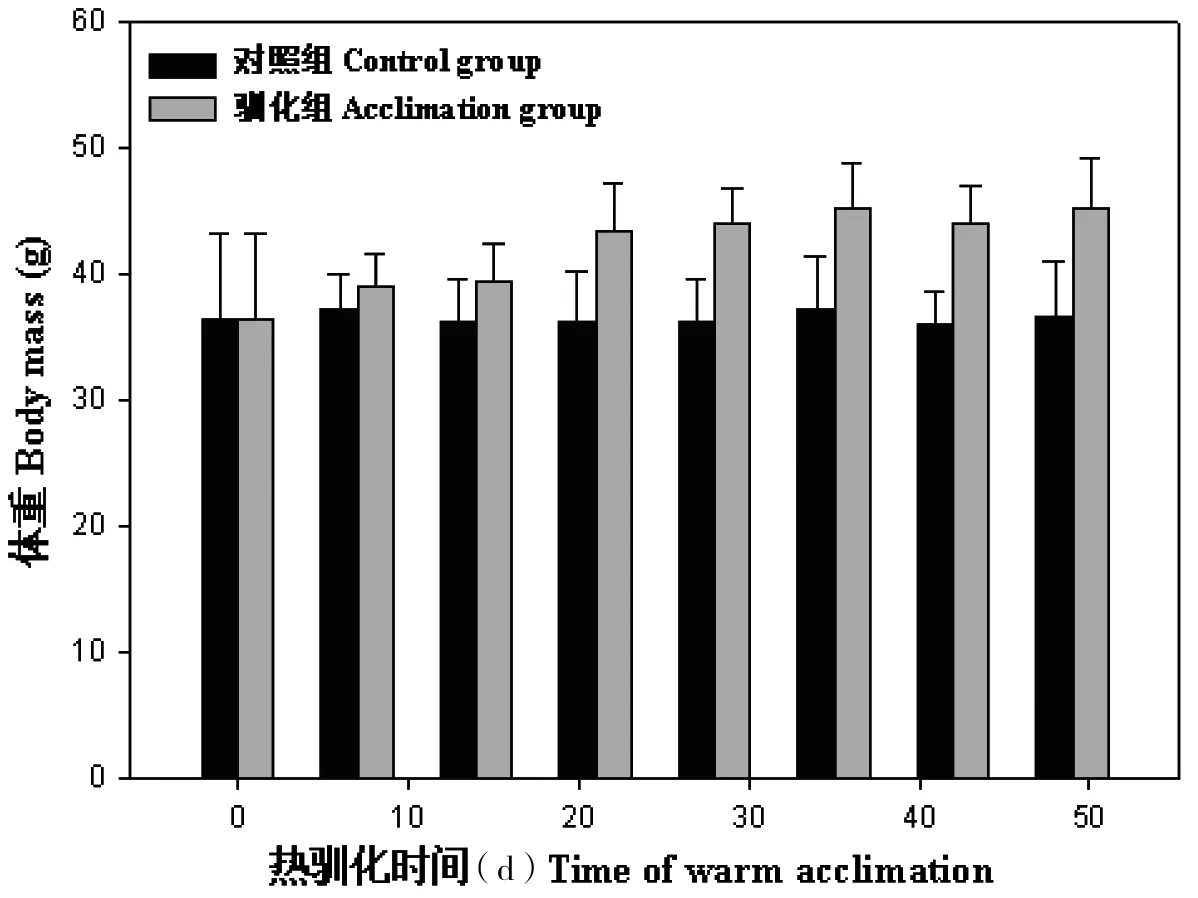
图1 热驯化条件下大绒鼠的体重变化
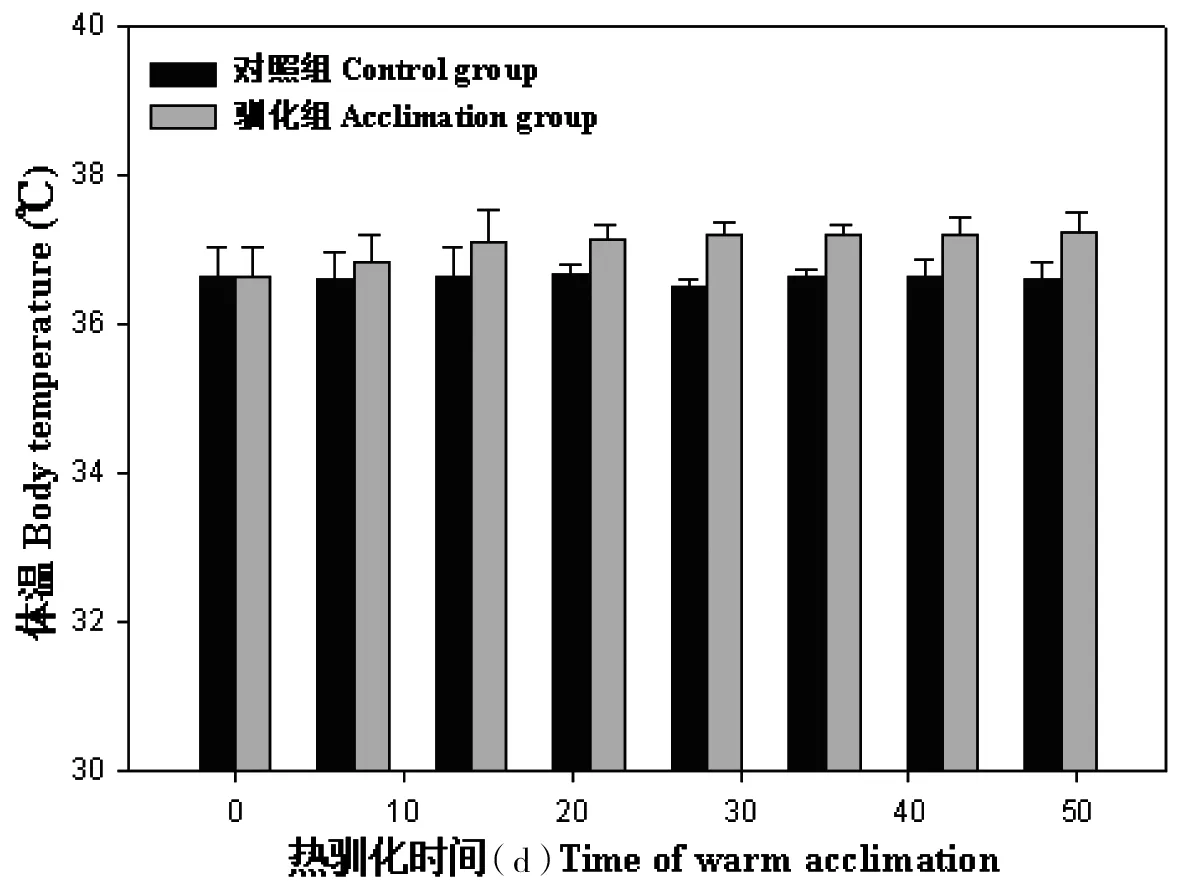
图2 热驯化对大绒鼠体温的影响
2.2 能量收支
大绒鼠摄入能差异极显著(F=14.48,P<0.01),28 d后各实验组差异不显著(F=0.124,P>0.05,图3)。消化能和可代谢能随热驯化时间的延长而降低,28 d后维持在稳定水平(图3)。大绒鼠消化能差异极显著(F=15.86,P<0.01),可代谢能差异极显著(F=16.09,P<0.01)。尿液能和粪便能随热驯化时间的延长差异不显著。大绒鼠消化率差异不显著(F=0.90,P>0.05),可代谢能效率差异不显著(F=1.37,P>0.05)。
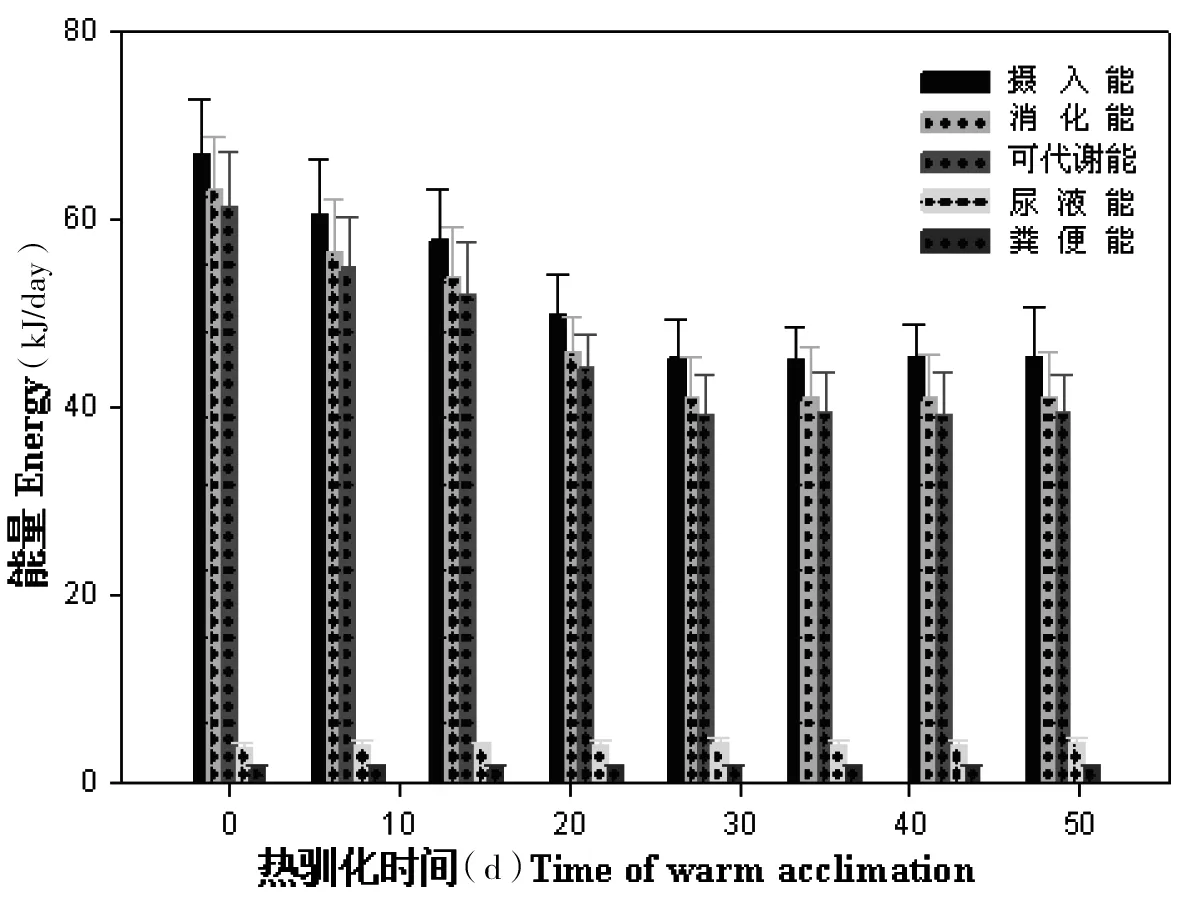
图3 热驯化对大绒鼠的能量收支的影响 (能量单位为kJ,k是小写)
2.3 BMR和NST
驯化前,大绒鼠的BMR差异不显著(F=0.19,P>0.05)。随着驯化时间的延长,大绒鼠的BMR降低(F=11.20,P<0.01),冷驯化28 d后减速变缓(F=0.34,P>0.05,图4),驯化28 d组RMR比对照组平均减少32.3%。驯化前,大绒鼠的NST差异不显著(F=0.13,P>0.05)。对照组和热驯化组NST差异极显著(F=53.81,P<0.01),28 d后各实验组差异不显著(F=0.12,P>0.05,图5)。随着热驯化时间的延长,大绒鼠BAT相对重量稳步减少,对照组和热驯化组BAT相对重量差异极显著(F=8.45,P<0.01,图6)。

图4 热驯化对大绒鼠基础代谢率的影响
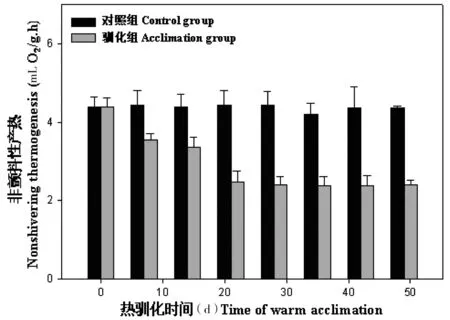
图5 热驯化对大绒鼠非颤抖性产热的影响
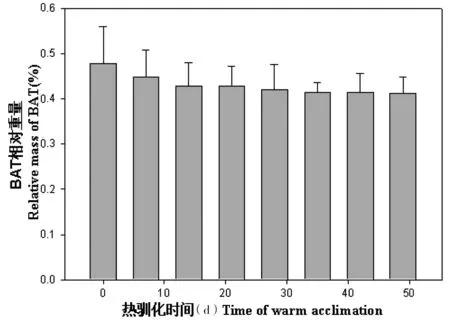
图6 热驯化对大绒鼠BAT相对重量的影响
2.4 肝脏线粒体活性
大绒鼠肝脏总蛋白含量和肝脏线粒体蛋白含量随时间延长逐渐降低(总蛋白含量:F=5.30,P<0.05;肝脏线粒体蛋白含量:F=9.53,P<0.05,图7)。热驯化影响大绒鼠肝脏线粒体状态Ⅲ呼吸(F=3.12,P<0.05,图8),但是大绒鼠肝脏线粒体状态Ⅳ呼吸维持稳定(F7,48=1.39,P>0.05,图8)。

图7 热驯化对大绒鼠肝脏总蛋白和线粒体蛋白含量的影响
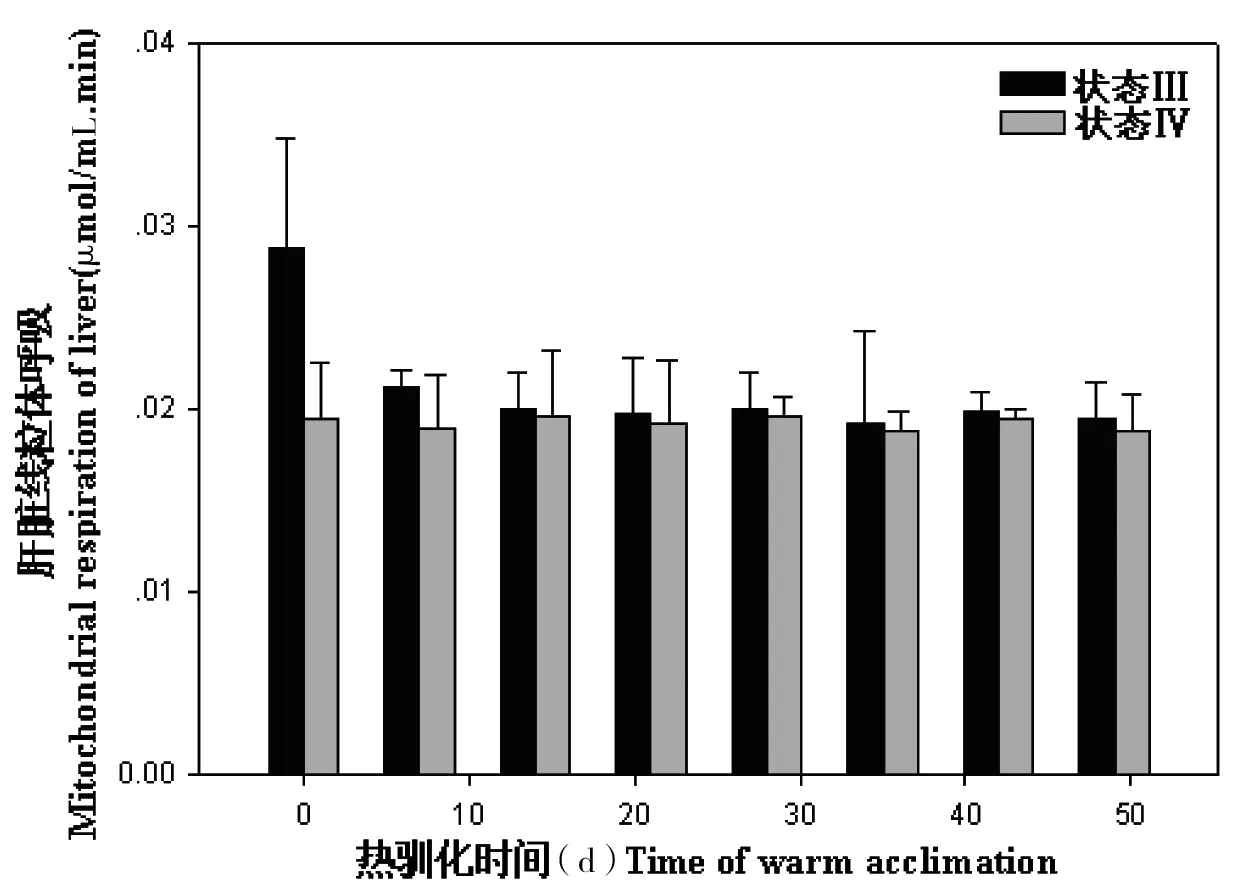
图8 热驯化对大绒鼠肝脏线粒体呼吸的影响
3 讨论
动物体重的季节性变化是对能量的获得与能量支出的一种适应方式[19]。温度对动物的体重和能量代谢也有影响,动物的体重变化与其提高对环境的适应能力有关[2]。目前关于小型哺乳动物体重季节变化的研究较多[20]。动物在适应新环境的过程中,形成一个新的生理稳态的时间非常重要。当外界环境发生变化时,不同物种其生理特征的反应期和形成新稳态的时间也是不一样的[21]。本研究结果表明在热驯化条件下,大绒鼠的体重增加,28 d后维持稳定,表明大绒鼠在通过28 d热驯化后可以形成一个新的生理稳态。此外,小型哺乳动物的体温也具有明显的季节性变化,如灰仓鼠[22]和沙鼠[23]。大绒鼠在热驯化下平均体温增加,在28 d后维持在一个相对平稳的状态。这和之前本研究组在不同温度条件下测定大绒鼠的体温一致,大绒鼠在35℃条件下会出现热死亡的现象[17],因此30℃的长期胁迫会导致大绒鼠的体温调节平衡打破,为了维持生存,只有适当的将体温增加。
动物能量代谢水平对其生存至关重要[1-2]。许多动物的能量收支也表现出明显的季节性变化[20]。热驯化条件下,大绒鼠摄入能、消化能和可代谢能随驯化时间的延长显著降低。而大绒鼠的尿液能和粪便能变化差异不显著,表明大绒鼠在高温条件下维持尿液能和粪便能不变,主要通过降低摄入能、消化能和可代谢能来维持生命活动。此外,动物对食物的利用率与消化道的形态和食物周转时间等有关[24]。本研究表明:大绒鼠在高温条件下消化率、可代谢能效率差异不显著,说明大绒鼠可能不是主要采取加快消化道内食物周转来适应高温胁迫。
基础代谢率可以反映物间或种内个体的能量消耗水平,对于动物而言具有重要的适应意义[2],它受温度等生态因子的影响[20,25-29]。在高温条件下,大绒鼠的BMR显著下降,表明降低BMR是大绒鼠应对热驯化的策略之一。此外,大绒鼠在高温条件下NST也显著降低,这可能与BAT的相对重量的比例下降是分不开的。大绒鼠在高温条件下肝脏总蛋白和线粒体蛋白含量显著下降,这与热驯化条件下BMR的降低是一致的。大绒鼠肝脏状态Ⅲ呼吸在高温条件下显著降低,状态Ⅲ的下降可能与大绒鼠在热胁迫下对能量的需求下降有关。在高温条件下,大绒鼠肝脏线粒体状态Ⅳ呼吸差异不显著,说明在高温条件下,大绒鼠不需要动用更多的能量来维持生存。
综上,在热驯化下,大绒鼠适当增加体重和体温、降低能量摄入和产热能力等,通过这些适应性策略来维持其体重和能量代谢平衡。
[1]SPEAKMAN J R, KRL E. Limits to sustained energy intake IX: a review of hypotheses[J]. Journal of Comparative Physiology, 2005, 175(6): 375-394.
[2]SPEAKMAN J R. The physiological cost of reproduction in small mammals[J]. Philos Trans R Soc Lond B Biol Sci, 2008, 363(1490): 375-398.
[3]ZHU W L, ZHANG H, WANG Z K. Seasonal changes in body mass and thermogenesis in tree shrews (Tupaiabelangeri) the roles of photoperiod and cold[J]. Journal of Thermal Biology, 2012, 37(7): 479-484.
[4]BING C, FRANKISH H M, PICKAVANCE L, et al. Hyperphagia in cold exposed rats is accompanied by decreased plasma leptin but unchanged hypothalamic NPY[J]. Am J Physiol, 1998, 274(1 Pt2): R62-68.
[5]ABELENDA M, LEDESMA A, RIAL E, et al. Leptin administration to cold acclimated rats reduce both food intake and brown adpose tissue thermogenesis[J]. Journal of Thermal Biology, 2003, 28(6-7): 525-530.
[6]ZHAO Z J, CHI Q S, CAO J, et al. Seasonal changes of body mass and energy budget in Striped hamsters: the role of leptin[J]. Physiological and Biochemical Zoology, 2014, 87(2): 245-256.
[7]ZHU W L, JIA T, CAI J H, et al. The effect of cold-acclimation on energy strategies ofApodemusdracoin Hengduan Mountain region[J]. Journal of Thermal Biology, 2012, 37(1): 41-46.
[8]MCDEVITT R M, SPEAKMAN J R. Central limits to sustainable metabolic rate have no role in cold acclimation of the short-tailed field vole (Microtusagrestis)[J]. Physiol Zool, 1994, 67(5): 1117-1139.
[9]TANG G B, CUI J G, WANG D H. Role of hypoleptinemia during cold adaptation in Brandt′s voles (Lasiopodomysbrandtii) [J]. Am J Physiol Regul Integr Comp Physiol, 2009, 297(5):R1293-1301.
[10]ZHU W L, JIA T, LIAN X, et al. Effects of cold acclimation on body mass, serum leptin level, energy metabolism and thermognesis inEothenomysmiletusin Hengduan Mountains region[J]. Journal of Thermal Biology, 2010, 35(1):41-46.
[11]ZHANG Z Q, WANG D H. Seasonal changes in thermogenesis and body mass in wild Mongolian gerbils (Merionesunguiculatus)[J]. Comp Biochem Physiol A Mol Intger Physiol, 2007, 148(2): 346-353.
[12]WANG J M, ZHANG Y M, WANG D H. Photoperiodic regulation in energy intake, thermogenesis and body mass in root voles (Microtusoeconomus)[J]. Comp Biochem Physiol A Mol Integr Physiol, 2006, 145(4): 546-553.
[13]ZHANG X Y, WANG D H. Energy metabolic, thermogenesis and body mass regulation in Brandt′s voles (Lasiopodomysbrandtii) during cold acclimation and rewarming[J]. Horm Behav, 2006, 50(1): 61-69.
[14]齐恒玉, 刘殿辉, 林卓强, 等. 冷暴露过程中高原鼠兔的产热变化[J]. 高师理科学刊, 1999, 19(1): 47-50.
[15]ZHU W L, WANG B, CAI J H, et al. Thermogenesis, energy intake and serum leptin inApodemuschevrieriin Hengduan Mountains region during cold acclimation[J]. Journal of Thermal Biology, 2011, 36(3): 181-186.
[16]ZHU W L, HUANG C M, ZHANG L, et al. Changes of energy metabolism, thermogenesis and body mass in the tree shrew (TupaiabelangerichinensisTupaiidae,Scandebtia) during cold exposure[J]. Italian Journal of Zoology, 2012, 79(2): 175-181.
[17]ZHU W L, JIA T, LIAN X, et al. Evaporative water loss and energy metabolic in two small mammals, voles (Eothenomysmiletus) and mice (Apodemuschevrieri) in Hengduan mountains region[J]. Journal of Thermal Biology, 2008, 33(6): 324-331.
[18]ZHU W L, CAI J H, LIAN X, et al. Adaptive character of metabolism inEothenomysmiletusin Hengduan Mountains region during cold acclimation[J]. J Therm Biol, 2010, 35(8): 417-421.
[19]CHAPPELL M A, HAMMOND K A. Maximal aerobic performance of deer mice in combined cold and exercise chanllenges[J]. J Comp Physiol B, 2004, 174(1): 41-48.
[20]KLINGENSPOR M, NIGEMANN H, HELDMAIER G. Modulation of leptin sensitivity by short photo period acclimation in the Djungarian hamsterPhodopussungorus[J]. J Comp Physiol, 2000, 170(1): 37-43.
[21]REZENDE E L, CHAPPELL M A, HAMMOND K A. Cold-acclimation inPeromyscus: temporal effects and individual variation in maximum metabolism and ventilatory traits[J]. The Journal of Experimental Biology, 2004, 207(Pt2): 295-305.
[22]HAIM A, MARTINEZ J J. Seasonal acclimatization in the migratory hamsterCricetulusmigratorius: the role of photoperiod[J]. J Therm Biol, 1992, 17(6): 347-351.
[23]FEIST D D, MORRISON P R. Seasonal changes in metabolic capacity and norepinephrine thermogenesis in the Alaskan red-backed vole: environmental cues and annual differences[J]. Comp Biochem Physiol, 1981, 69(4): 697-700.
[24]LYNCH G R. Seasonal changes in thermogenesis, organ weights, and body composition in the white-footed mousePeromyscusleucopus[J]. Oecologia, 1973, 13(4): 363-376.
[25]ZHAO Z J, WANG D H. Short photoperiod enhances thermogenic capacity in Brandt′s voles[J]. Physiol Behav, 2005, 85(2): 143-149.
[26]KR L E, REDMAN P, THOMSON P J, et al. Effect of photoperiod on body mass, food intake and body composition in the field vole,Microtusagrestis[J]. J Exp Biol, 2005, 208(Pt3): 571-584.
[27]LI X S, WANG D H. Photoperiod and temperature can regulate body mass, serum leptin concentration, and uncouling protein 1 in Brandt′s voles (Lasiopodomysbrandtii) and Mongolian gerbils (Merionesunguiculatus)[J]. Physiol Biochem Zool, 2007, 80(3): 326-334.
[28]ZHAO Z J. Serum leptin, energy budget and thermogenesis in striped hamsters exposed to consecutive decrease in ambient temperatures[J]. Physiol Biochem Zool, 2011, 84(6): 560-572.
[29]HAMMOND K A, KRISTAN D M. Responses to lactation and cold exposure by deer mice (Peromyscusmaniculatus)[J]. Physiol Biochem Zool, 2000, 73(5): 547-556.
Effect of warm acclimation on body mass and energy metabolism inEothenomysmiletus
ZHU Wan-long, GAO Wen-rong
(Key Laboratory of Ecological Adaptive Evolution and Conservation on Animals-Plants in Southwest Mountain Ecosystem of Yunnan Province Higher Institutes College; School of Life Sciences, Yunnan Normal University, Kunming 650500, China)
In order to investigate the effect of warm acclimation on body mass and energy metabolism, parameters like body mass, body temperature, basal metabolic rate(BMR), non-shivering thermogenesis(NST), energy budgets and thermogenic activity of liver inE.miletuswere measured. The results showed that warm acclimation increased body mass and body temperature, decreased energy intake and thermogenic activity, as well as decreased state Ⅲ of mitochondrial respiration of liver, but it did not affect state Ⅳ of mitochondrial respiration of liver. All of the results indicated thatE.miletusunder warm acclimation increased body mass and body temperature, reduced energy intake and heat production capacity as to adapt to high temperature stress.
E.miletus; warm acclimation; energy metabolism
2016-03-17;
2016-04-05
国家自然科学基金项目(No. 31560126;31260097);云南师范大学博士科研启动项目
朱万龙,副教授,研究方向为动物生理生态,E-mail: zwl_8307@163.com;朱万龙,高文荣并列第一作者
Q955;Q493.8
A
2095-1736(2017)04-0025-04
doi∶10.3969/j.issn.2095-1736.2017.04.025

