红提葡萄光合速率和气孔导度的光响应特征
李虎军,王全九,2,苏李君,石彬彬,周广林,周蓓蓓
(1.西安理工大学西北旱区生态水利工程国家重点实验室培育基地, 陕西 西安 710048;2.中国科学院水利部水土保持研究所侵蚀与旱地农业国家重点实验室, 陕西 杨凌 712100;3.西安理工大学理学院, 陕西 西安 710048)
红提葡萄光合速率和气孔导度的光响应特征
李虎军1,王全九1,2,苏李君3,石彬彬1,周广林1,周蓓蓓1
(1.西安理工大学西北旱区生态水利工程国家重点实验室培育基地, 陕西 西安 710048;2.中国科学院水利部水土保持研究所侵蚀与旱地农业国家重点实验室, 陕西 杨凌 712100;3.西安理工大学理学院, 陕西 西安 710048)
为了比较几种常用的光响应模型和气孔导度模型对红提葡萄的适用性,利用LC pro+便携式光合仪,测定了大田土壤水分状况良好情况下果粒膨大期和浆果成熟期篱架红提葡萄对光强的响应过程。采用常用的光响应模型(非直角双曲线模型、直角双曲线修正模型)和气孔导度模型(Ball-Barry模型、气孔导度机理模型)对光合速率及气孔导度进行拟合,同时将气孔导度Ball-Barry模型与光合速率的光响应非直角双曲线模型进行耦合,并与Jarvis模型进行比较,分析了红提葡萄气孔导度的光响应特征。结果表明:非直角双曲线模型和直角双曲线修正模型均可较好地拟合红提葡萄光合速率光响应过程,但通过非直角双曲线模型获得的初始量子效率(α)、暗呼吸速率(Rd)、光补偿点(LCP)与实测值更接近,拟合效果更佳(R2≥0.987);气孔导度随光合速率的增大而增大,应用Ball-Barry模型拟合该过程得到的决定系数较大(R2≥0.715),均方根误差较小(RMSE≤0.0127),较气孔导度机理模型能更好地拟合红提葡萄气孔导度与光合速率的关系;构建的Ball-Barry模型与非直角双曲线的耦合模型整体上可以描述气孔导度对光强的响应(R2≥0.703),但拟合高光强下气孔导度精度较低,与耦合模型相比,Jarvis模型模拟值与实测值更加接近(R2≥0.839),且均方根误差最小(RMSE≤0.0106),说明Jarvis模型拟合效果优于耦合模型。研究结果可为定量分析葡萄叶片气孔调节行为和计算光合生产力提供理论依据。
红提葡萄;光合速率;气孔导度;模型适用性
光合作用是作物进行物质生产的重要生理过程,光合速率和气孔导度是描述该过程的主要指标[1]。光响应模型和气孔导度模型是评价植物光响应过程光合速率变化和气孔调节的重要工具。目前,具有代表性的光合速率光响应模型有直角双曲线模型、非直角双曲线模型和直角双曲线修正模型,其中以非直角双曲线模型应用较为广泛[2-4]。气孔导度模型主要有唯象模型和基于气孔调节假设的机理模型[5],前者以Jarvis模型为代表,由于该模型能够较好地反映气孔导度对单一因子的响应,所以被广泛使用[6];后者以Ball-Barry模型为典型,它考虑了空气湿度和环境CO2浓度对气孔导度的影响,能够很好地描述稳定条件下气孔导度与光合速率的线性关系。此外,气孔导度机理模型[7](BBY模型)也能用来反映气孔导度与光合速率的关系,还有一些气孔导度模型与光响应模型的耦合模型[8]也被用来描述气孔导度的光响应过程,并取得了不错的效果。对于这些模型适用性方面的研究,许多学者在大量作物上做了比较和讨论,发现不同模型的拟合能力会因研究对象、区域和环境条件的变化而产生不同程度差异[9]。
葡萄是新疆主要的经济作物之一,红提葡萄以其果皮厚实、果肉饱满、口感独特和极耐储存的特点得到了大面积的种植[10]。目前有关葡萄光合特性变化的研究主要集中在光合速率和气孔导度日变化研究[11-12]和部分光响应模型应用方面[13-15],而在气孔导度模型和气孔导度光响应层面研究较少,所以有必要研究光响应模型和气孔导度模型对红提葡萄的适用性。本研究以红提葡萄为试验对象,分析了果粒膨大期和浆果成熟期的光合作用光响应变化特征,采用几种常用的光响应模型(非直角双曲线模型、直角双曲线修正模型)和气孔导度模型(Ball-Barry模型和气孔导度机理模型,Jarvis模型和耦合模型)进行拟合,通过比较各模型之间的差异,旨在获得土壤水分良好状况下红提葡萄最优的光合速率和气孔导度的光响应模型,以期为进一步估算光合生产力提供理论依据。
1 材料与方法
1.1 试验区概况
试验地点位于新疆乌鲁木齐市头屯河农场葡萄园(87°30′E,43°90′N)内,海拔918 m,该地区光照时间长,日较差大,属于典型的温带大陆性干旱气候;年降雨量303 mm,年蒸发量达2 300 mm,年平均日照时长2 775 h,年平均气温7.2℃,≥10℃的有效积温5 300℃以上,无霜期约160 d。土壤质地为壤土,容重1.44 g·cm-3,土层厚度60~80 cm,下层为砂砾。供试材料为15年生红提葡萄,篱架栽培,垄沟南北走向,行株距2.5 m×1.2 m,篱架高2 m;灌水方式为滴灌,田间毛管布置形式为一沟两管;果粒膨大期灌水定额50 m3·667 m-2,灌水次数5次,灌水周期约10 d;浆果成熟期灌水定额40 m3·667 m-2,灌水次数2次,灌水周期约15 d;试验区内施肥、剪枝等其他田间管理措施无差异。
1.2 测定方法
光合作用—光响应曲线测定:分别在红提葡萄果粒膨大期(2015年7月上旬)和浆果成熟期(2015年8月中旬)充分灌水后1~2 d内选择晴朗无云天气于11∶00—13∶00测定。选取中上部长势中庸、无病虫害的3片功能型叶片作为测定对象,采用LC pro+便携式智能光合仪(英国ADC公司)内置红蓝光源提供0~2 000 μmol·m-2·s-1的不同光合有效辐射(PAR),气路开放(大气CO2浓度),于每个光强下最少适应120 s,待各个参数变化稳定后测定其净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)等生理参数。
1.3 光响应模型
1.3.1 非直角双曲线模型 非直角双曲线模型是由Thornley[16]于1976年提出,该模型引入了凸度来反映光响应曲线的弯曲程度,其表达式为:

(1)
式中,Pn为净光合速率(μmol·m-2·s-1);α为初始量子效率,反映了植物对弱光的利用效率;I为光合有效辐射(μmol·m-2·s-1);Pnmax为最大净光合速率(μmol·m-2·s-1),反映了植物对强光的利用能力;θ为反映光响应曲线的弯曲程度的凸度,取值范围0≤θ≤1,θ越大,光响应曲线越弯曲;Rd是暗呼吸速率(μmol·m-2·s-1),用来反映植物消耗光合产物的速率。
1.3.2 直角双曲线修正模型 鉴于传统的光响应模型不能直接给出最大光合速率和光饱和点的特点,为克服这个问题,叶子飘等[17]推导并构建了植物光响应的直角双曲线修正模型:

(2)
式中,γ是初始量子效率与植物最大光合速率的比值,即γ=α/ Pnmax;β为修正系数,当β=0时式(2)退化为直角双曲线方程;其它参数意义同上。
此外,通过分析光响应曲线还可以得到与植物光合特性相关的其它生理参数,如能够反映植物对弱光适应能力的光补偿点(LCP)和反映植物对强光适应能力的光饱和点(LSP)等。
1.4 气孔导度模型
1.4.1 Ball-Barry模型(BB模型) Ball-Barry模型[18]是一种基于气孔导度与环境因素和生理因素关系的半经验气孔导度模型。
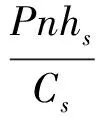
(3)
式中,Gs为气孔导度(mol·m-2·s-1);m和G0是经验系数;hs为叶面上空气的相对湿度(%);Cs为叶片表面处的CO2浓度(μmol·mol-1)。
1.4.2 气孔导度机理模型(BBY模型) 叶子飘和于强[19]从CO2分子在叶片气孔中扩散的机理出发,利用分子扩散和碰撞理论、植物生理学等理论知识,推导并得到气孔导度的机理模型:

(4)
式中,η表示单位时间内参与光合作用的CO2质量与进入气孔内的CO2质量的比例。η应满足的条件为0≤η≤1。当η=0时,表示进入气孔中的CO2没有进行光合作用;当η=1时,表示进入气孔中的CO2全部参与光合作用;当0<η<1时,表示进入气孔的CO2只有部分参与光合作用;C为叶片内外CO2浓度差。
1.4.3 Jarvis模型 Jarvis模型[20]表达了气孔导度与光强、温度等周围环境因素的关系,但认为各因子对气孔导度的影响相互独立。该模型具体形式如下:
Gs=Gs(I)×f1(VPD)×f2(T)×f3(Ca)×f4(Φ)
(5)
式中,Gs(I)、f1(VPD)、f2(T)、f3(Ca)、f4(Φ)分别为光合有效辐射、叶面到大气水汽压差、温度、CO2浓度和叶水势对气孔导度的函数。气孔导度与光合有效辐射和饱和水汽压差的关系用下式表示:
Gs(I)=I/(a1+I)
(6)
f(VPD)=1/(a2+VPD)
(7)
式中,a1、a2为待定系数。本研究由于是短期瞬时测定,叶室温度和CO2浓度基本不变,所以f2(T)=1,f3(Ca)=1。此外,采用钟楚等[7]的方法用叶气温差(ΔT)代替叶水势对气孔导度的影响,分析并得到两者间的关系为:f(Φ)=exp(a3×ΔT),式中a3为待定系数。
1.4.4 Ball-Barry模型+非直角双曲线耦合模型 Ball-Barry模型反映了气孔导度与光合速率的关系,为建立气孔导度与光强之间的关系,用BB模型和非直角双曲线模型进行耦合,即联立式(1)和式(3),具体形式为:

(8)
式中,Pn(I)是通过非直角双曲线拟合得到的与光强有关的净光合速率;其他参数意义同上。
1.5 误差分析
采用SPSS 20.0统计分析软件进行参数拟合,用Microsoft Excel 2007软件绘图。拟合值与实测值的关系用决定系数(R2)和均方根误差(RMSE)比较。

(9)
式中,Pi为预测值,Oi为实测值,n为样本个数。RMSE值越小,表明预测值与实测值越接近。
2 结果与分析
2.1 红提葡萄叶片净光合速率对光强的响应
图1显示了不同生育期红提葡萄净光合速率对光合有效辐射的响应。由图可知,土壤水分充足时,不同生育期(果粒膨大期和浆果成熟期)篱架红提葡萄的光响应曲线具有相似的变化趋势。全过程大致可以分为三个阶段:第一阶段为光强较弱(0 μmol·m-2·s-1 图1 红提葡萄净光合速率对光合有效辐射的响应 Fig.1 The response of net photosynthetic rate of red globe grape to photosynthetic active radiation. 表1 光响应模型拟合红提葡萄光合参数结果与实测数据对比 此外,两种模型拟合的决定系数(R2)均达到0.978 以上,说明各个模型都能较好地拟合红提葡萄光响应过程,但非直角双曲线拟合值与实测值更加接近,决定系数分别为0.997和0.987。所以综合来看,非直角双曲线模型拟合结果优于直角双曲线修正模型,因此非直角双曲线模型更适合用来拟合红提葡萄的光响应过程。 2.2 红提葡萄叶片气孔导度模型适用性分析 图2为不同生育期各模型光响应过程气孔导度与净光合速率的关系。从图2可以看出,篱架红提葡萄在果粒膨大期和浆果成熟期内气孔导度随着光合速率的增加逐渐上升,且两者之间存在一定的线性关系。而在果粒膨大期净光合速率达到15 μmol·m-2·s-1左右和浆果成熟期净光合速率达到13 μmol·m-2·s-1附近后,气孔导度与净光合速率的线性关系并不明显。采用被广泛使用的BB模型和气孔导度机理模型(BBY模型)对该过程进行拟合,结果表明:BB模型整体上可以很好地模拟气孔导度与光合速率之间的关系,拟合值与实测值较为接近(R2≥0.715),但该模型在光合速率逐渐趋于稳定时(气孔导度随净光合速率呈非线性变化阶段)的拟合效果还有待提高。BBY模型拟合值与实测值偏差较大,拟合效果较差(R2≤0.485)。 此外,计算各个模型的均方根误差并进行比较发现(表2),果粒膨大期和浆果成熟期BB模型的均方根误差都很小(RMSE≤0.0127),而通过BBY模型得到的各生育期的均方根误差均大于BB模型。说明与BBY模型相比,BB模型更适合用来拟合红提葡萄气孔导度随光合速率变化过程。 图2 不同生育期气孔导度拟合值与净光合速率的关系 2.3 红提葡萄气孔导度的光响应模型分析 鉴于气孔导度测量的复杂性,为了能够建立气孔导度与光强之间的关系,需要将气孔导度模型与光响应模型结合。BB模型和非直角双曲线可以较好地反映红提葡萄气孔导度对光合速率、光合速率对光强的响应过程,建立BB模型+非直角双曲线的耦合模型来描述气孔导度对单一因子光强的响应。此外Jarvis模型也能反映该过程,因此有必要探讨两种模型对红提葡萄气孔导度的光响应适用性进行探讨。根据不同生育期红提葡萄实测Pn、Gs、Rd、PAR、hs和CO2浓度代入耦合模型和Jarvis模型,分别计算气孔导度,并将气孔导度模拟值和实测值进行比较,结果如图3、表3所示。由图可知,不同生育期(果粒膨大期和浆果成熟期)气孔导度的光响应过程具有相似的变化趋势,均表现为随光合有效辐射的增加,气孔导度逐渐增加。耦合模型和Jarvis模型整体上都能较好地拟合红提葡萄各生育期Gs的光响应过程,两种模型R2均在0.703以上。进一步分析发现,当果粒膨大期和浆果成熟期光强大于1 500 μmol·m-2·s-1,耦合模型的气孔导度模拟值均明显低于实测值,最大达10%左右,说明耦合模型在高光强下的模拟值与实测值偏差较大,精度较低。而Jarvis模型在所设光强范围内模拟值与实测值更加接近(R2≥0.839),且均方根误差更小(RMSE≤0.0106),拟合效果更好。综合各项参数分析,Jarvis模型更适合拟合红提葡萄各生育期气孔导度的光响应过程。 植物光合作用的光响应过程研究和数值模拟在植物生理学方面得到广泛应用[21],而实际使用时,各模型因地域、品种和环境等情况的不同而产生一定差异,因此需要结合实际情况对各模型适用性进行分析。 红提葡萄叶片光合速率对光强的响应过程可以用非直角双曲线模型和直角双曲线修正模型来描述,但非直角双曲线模型的拟合值与实测值更接近,该结果与张保玉[5]在其他品种葡萄得到的结论一致。这是因为非直角双曲线模型虽然是一条没有极值点的渐近线,但考虑了光响应曲线的弯曲程度(凸度),所以能够较好地拟合凸度较大的区域,进而能很好描述光合速率随光强增加幅度逐渐减弱并趋于稳定的阶段;直角双曲线修正模型存在极值,即拟合曲线能够反映光饱和点和光抑制过程,但是本研究试验条件下的实测光响应过程却未出现明显的光饱和点和光抑制现象,所以直角双曲线修正模型对红提葡萄光响应适用性还有待商榷。 图3 红提葡萄气孔导度对光合有效辐射的响应 Fig.3 The response of stomatal conductance of red globe grape to photosynthetic active radiation 表3 耦合模型与Jarvis模型表达式及均方根误差(RMSE)比较 Ball-Barry模型是一个综合考虑大气湿度和CO2浓度对气孔导度影响的半经验模型,其模型简单,对样本数量要求低,拟合情况较好,在不同尺度研究中得到了广泛应用。本文通过BB模型对红提葡萄气孔导度随光合速率的变化过程拟合结果呈线性关系,这虽然整体上能够描述该过程,但在光合速率逐渐趋于稳定时拟合值与实测值之间存在一定差异,这是由于BB模型是线性模型,但各生育期的气孔导度与光合速率变化并非完全线性而造成的,王海珍等[8]对新疆灰胡杨的研究也得到同样结论。BBY模型用叶片内外CO2浓度差替代了BB模型中的Cs,拟合点较为离散,且模拟精度也未得到提高,这可能与植物生理特性或者试验与模型假设条件不完全满足有关。 Jarvis模型和耦合模型都可以很好地拟合红提葡萄气孔导度的光响应过程,但与耦合模型相比,Jarvis模型拟合得到的气孔导度值分布与实测值更加吻合,效果更好,该结果与其他学者在水稻[6]、羊草[22]的研究结果一致。这是因为耦合模型受到光响应模型和气孔导度模型的共同影响,尤其是BB模型的拟合精度;而Jarvis模型虽然考虑了周围环境因素的影响,但认为各因素相互独立,而且本试验中温度和CO2浓度相对恒定,所以未考虑温度和CO2浓度的影响,因此通过Jarvis模型拟合红提葡萄气孔导度光响应过程取得了良好效果。 由于葡萄生长具有一定的变异性,而本文结论是基于一年土壤水分状况良好情况下得到的,其代表期不够长,这些结果是否适用于描述红提葡萄多年的光响应特征变化还有待进一步研究。 1) 直角双曲线修正模型和非直角双曲线模型均可用于红提葡萄光响应过程的拟合,非直角双曲线模型拟合得到的光合参数与实测值更接近,拟合效果更好(R2≥0.987)。 2) BBY模型拟合红提葡萄气孔导度与光合速率的关系效果较差(R2≤0.485),而Ball-Barry模型拟合效果较好(R2≥0.715),能够很好地描述红提葡萄气孔导度与光合速率的关系。 3) 建立的Ball-Barry模型与非直角双曲线模型的耦合模型整体上能够很好地反映气孔导度对光强的响应(R2≥0.703),但在高光强下的拟合值与实测值略有偏差;而Jarvis模型能够很好地反映红提葡萄气孔导度对光强的响应过程(R2≥0.839,RMSE≤0.0106),更适合拟合红提葡萄气孔导度的光响应过程。 [1] 武 阳,王 伟,赵 智,等.调亏灌溉对香梨叶片光合速率及水分利用效率的影响[J].农业机械学报,2012,43(11):80-86. [2] 张保玉.葡萄光合作用光响应曲线的研究[D].杨凌:西北农林科技大学,2009. [3] 张彦群,王建东,龚时宏,等.滴灌条件下冬小麦施氮增产的光合生理响应[J].农业工程学报,2015,31(6):170-177. [4] 陆红飞,郭相平,甄 博,等.旱涝交替胁迫条件下粳稻叶片光合特性[J].农业工程学报,2016,32(8):105-112. [5] 于 强,王天铎.光合作用-蒸腾作用-气孔导度的耦合模型及C3植物叶片对环境因子的生理响应[J].植物学报,1998,40(8):740-754. [6] 彭世彰,庞桂斌,徐俊增,等.节水灌溉条件下水稻气孔导度模型的改进[J].农业工程学报,2009,25(4):19-23. [7] 钟 楚,朱 勇.烟草气孔导度对光强的响应[J].中国生态农业学报,2013,21(8):966-972. [8] 王海珍,韩 路,徐雅丽,等.不同温度下灰胡杨叶片气孔导度对光强响应的模型分析[J].生态环境学报,2015,24(5):741-748. [9] 高冠龙,张小由,常宗强,等.植物气孔导度的环境响应模拟及其尺度扩展[J].生态学报,2016,36(3):1-10. [10] 张 玉.土壤理化性质对红提葡萄品质的影响[J].现代园艺,2013,(20):17-18. [11] 王永杰,王全九,苏李君,等.极端干旱区垂直线源灌方式对葡萄生长及水分利用效率的影响[J].干旱地区农业研究,2012,30(3):63-69. [12] 李小红,周 凯,谢 周,等.不同葡萄砧木对矢富罗莎葡萄嫁接苗光合作用的影响[J].果树学报,2009,26(1):90-93. [13] 李雅善,李 华,王 华,等.赤霞珠葡萄光合-光响应曲线拟合模型的比较分析[J].西北林学院学报,2013,28(2):20-25. [14] 郑 睿,康绍忠,胡笑涛,等.水氮处理对荒漠绿洲区酿酒葡萄光合特性与产量的影响[J].农业工程学报,2013,29(4):133-141. [15] 杨艳芬,王全九,白云岗,等.极端干旱地区滴灌条件下葡萄生长发育特征[J].农业工程学报,2009,25(12):45-50. [16] Thornley J H M. Mathematical Models in Plant Physiology[M]. London: Academic Press(Inc.), 1976. [17] 叶子飘,于 强.光合作用光响应模型的比较[J].植物生态学报,2008,32(6):1356-1361. [18] Ball J T, Woodrow I E, Berry J A. A model predicting stomatal conductance and its contribution to the control of photosynthesis under different environmental conditions[C]//Progress in photosynthesis research. Netherlands: Springer, 1987:221-224. [19] 叶子飘,于 强.植物气孔导度的机理模型[J].植物生态学报,2009,33(4):772-782. [20] Jarvis P G. The interpretation of the variations in leaf water potential and stomatal conductance found in canopies in the field[J]. Philosophical Transactions of the Royal Society of London B: Biological Sciences, 1976,273(927):593-610. [21] 王荣荣,夏江宝,杨吉华,等.贝壳砂生境干旱胁迫下杠柳叶片光合光响应模型比较[J].植物生态学报,2013,37(2):111-121. [22] 王玉辉,周广胜.羊草叶片气孔导度对环境因子的响应模拟[J].植物生态学报,2000,24(6):739-743. Light response characteristic of photosynthetic rate and stomatal conductance in red globe grape LI Hu-jun1, WANG Quan-jiu1,2, SU Li-jun3, SHI Bin-bin1, ZHOU Guang-lin1, ZHOU Bei-bei1 (1.StateKeyLaboratoryBaseofEco-hydraulicEngineeringinAridArea,Xi'anUniversityofTechnology,Xi'an,Shaanxi710048,China; 2.StateKeyLaboratoryofSoilErosionandDry-LandFarmingonLoessPlateau,InstituteofSoilandWaterConservation,ChineseAcademyofSciencesandMinistryofWaterResources,Yangling,Shaanxi712100,China;3.CollegelofSciences,Xi'anUniversityofTechnology,Xi'an,Shaanxi710048,China) In order to access the applicability of light response model and stomatal conductance model for Red Globe Grape, the light response processes of red globe grape were measured at fruit swelling stage and berry ripening stage in the field. The optical light response model (non rectangular hyperbola model, modified rectangular hyperbola model) and stomatal conductance model (Ball-Barry model, stomatal conduction mechanism model) were adopted to fit photosynthetic rate and stomatal conductance. Meanwhile, Ball-Barry model was coupled with non rectangular hyperbola model and compared with Jarvis model, and then the stomatal conductance of the light response characteristics was analyzed. Results indicated that the non rectangular hyperbolic model and the modified rectangular hyperbola model could predict the light response process of photosynthetic rate of red globe grape well. The initial quantum efficiency (α), dark respiration rate (Rd) and light compensation point (LCP) obtained by non rectangular hyperbolic model were more close to the measured values, the determination coefficient was larger than 0.9 (R2≥0.987). Furthermore, the stomatal conductance increased with the increase of photosynthetic rate, the determination coefficient fitted by Ball-Barry model was bigger(R2≥0.715), and theRMSEwas smaller(RMSE≤0.0127), which indicated that Ball-Barry model could better predict the relationship between the stomatal conductance and photosynthetic rate of red globe grape. Coupling model could describe the light response of stomatal conductance (R2≥0.703) as a whole, but the accuracy of stomatal conductance under the high light intensity was low. Different from the coupling model, the simulated results from the Jarvis model were more close to the measured data (R2≥0.839), and the value ofRMSEwas small (RMSE≤0.0106), which suggested that the Jarvis model was more superior than the coupled model in describing the light response of stomatal conductance of red globe grape. Results obtained above could provide theoretical basis for the quantitative analysis of the stomatal regulation behavior of grape leaves and the calculation of photosynthetic productivity. red globe grape; photosynthetic rate; stomatal conductance; models applicability 1000-7601(2017)04-0230-06 10.7606/j.issn.1000-7601.2017.04.35 2016-05-18 新疆“十二五”科技重大专项(2011BAD29B05);国家自然科学基金(51409212) 李虎军(1992—),男,陕西榆林人,硕士研究生,主要从事农业水土资源与生态环境研究。E-mail:hujun2964@163.com。 王全九(1964—),男,内蒙古丰镇人,教授,博士生导师,主要从事土壤物理与溶质迁移研究。E-mail:wquanjiu@163.com。 S663.1 A



3 讨 论


4 结 论

