玻璃体注射抗VEGF药物联合黄斑区格栅样光凝治疗糖尿病黄斑水肿
郑晖 杨秀霞 刘苹苹 李勤 赵晓静
玻璃体注射抗VEGF药物联合黄斑区格栅样光凝治疗糖尿病黄斑水肿
郑晖 杨秀霞 刘苹苹 李勤 赵晓静
目的 对比玻璃体注射抗血管内皮生长因子(VEGF)药物联合黄斑区格栅样光凝治疗糖尿病黄斑水肿(DME)的效果, 进一步探讨联合治疗的适应证。方法 55例(97眼)糖尿病黄斑水肿患者,按照随机数字表法分为对照组(50眼)与研究组(47眼)。对照组患者予以单纯黄斑区格栅样光凝治疗,研究组患者予以玻璃体注射抗VEGF药物联合黄斑区格栅样光凝治疗。比较两组治疗效果。结果 治疗6个月后, 研究组视力有效率为87.2%, 高于对照组的66.0%, 差异有统计学意义(χ2=6.039, P<0.05)。术前, 两组患者的黄斑中心凹视网膜厚度比较, 差异无统计学意义(P>0.05);术后1、3、6个月, 两组患者的黄斑中心凹视网膜厚度均较本组术前下降, 且研究组下降程度优于对照组, 差异均具有统计学意义 (P<0.05)。两组患者均未出现眼内感染、白内障加重、心脑血管意外等并发症。结论 糖尿病黄斑水肿患者应用玻璃体注射抗VEGF药物联合黄斑区格栅样光凝治疗的效果良好, 应用价值高, 可作为首选治疗方法在临床中应用与推广。
糖尿病视网膜病变;黄斑水肿;激光;抗血管内皮生长因子
糖尿病视网膜病变(DR)是糖尿病(DM)的常见并发症,是导致糖尿病患者眼盲的直接因素, 对患者视功能与生活质量产生了巨大的影响[1]。美国的流行病学调查显示, 糖尿病成年患者中糖尿病视网膜病变发病率为28.5%, 致盲率为4.4%[2]。我国徐亮“The Beijing Eye Study 2006”表明我国糖尿病视网膜病变在成年糖尿病者中的发病率为27.9%[3],致盲率为7.7%[4]。糖尿病视网膜病变的患病率和严重程度随着年龄和糖尿病病程的增长而增加[5]。糖尿病黄斑水肿患者传统的标准治疗方案是黄斑部格栅样光凝, 近年抗VEGF药物的研发和应用也为黄斑水肿的治疗带来了希望。本研究对比玻璃体注射抗VEGF药物联合黄斑区格栅样光凝治疗糖尿病黄斑水肿的效果, 进一步探讨联合治疗的适应证。
1 资料与方法
1. 1 一般资料 连续性收集2015年1月~2016年10月中山大学附属第五医院眼科门诊及住院糖尿病视网膜病变患者, 纳入标准:①内科确诊的糖尿病患者, 空腹血糖控制在5.0~6.0 mmol/L;②眼底彩照、眼底血管荧光造影提示重度非增生性糖尿病视网膜病变或早期增殖期糖尿病视网膜病变, 光学相干断层扫描技术 (OCT)提示弥漫性黄斑水肿;③患者知情并同意治疗;④观察期间屈光介质无明显变化。55例(97眼)患者符合入选标准, 其中男28例(47眼), 女27例(50眼), 年龄36~74岁。按照随机数字表法分为对照组(50眼)与研究组(47眼)。两组治疗前视力分布情况比较, 差异无统计学意义(P>0.05), 具有可比性。见表1。

表1 两组治疗前视力分布情况(n)
1. 2 治疗方法 对照组患者予以单纯黄斑区格栅样光凝治疗, 黄斑区格栅样光凝治疗: 采用蔡司532激光机进行治疗,所有患者治疗前血糖、血压控制良好, 黄斑格栅样光凝用100 μm光斑, 能量在100~150 mW之间, 光凝时间为0.1 s。由同一名医生进行治疗操作。研究组患者予以玻璃体注射抗VEGF药物联合黄斑区格栅样光凝治疗。玻璃体注射抗VEGF药物治疗: 治疗前3 d用可乐必妥眼液滴眼(4 次/d)。术前予以常规准备, 即对患者结膜囊予以充分冲洗, 给予表面麻醉、后眼部消毒, 之后经由睫状体扁平部进针, 向玻璃体腔注射抗VEGF药物(康柏西普/雷珠单抗0.05 ml)。用无菌棉签压迫注射点防止药物返流, 术毕可乐必妥眼液滴眼, 6次/d, 共5 d。研究组患者在接受注射抗VEGF药物治疗7~10 d后, 给予黄斑区格栅样光凝治疗。由同一名医生进行治疗操作。
1. 3 观察指标及评定标准 ①视力评价标准, 即视力提高:视力提高至少2行;视力不变;视力下降:视力下降至少2行;有效率=视力提高率+视力不变率。②黄斑中心凹视网膜厚度(central macular thickness, CMT):采用OCT黄斑容积分析, ETDRS环中心l mm圈内平均厚度代表黄斑中心凹视网膜厚度。③对两组患者是否出现眼内感染、白内障加重、心脑血管意外等并发症予以观察。
1. 4 统计学方法 采用SPSS20.0统计学软件进行统计分析。计量资料以均数±标准差()表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2. 1 两组治疗6个月后视力结果比较 治疗6个月后, 研究组视力有效率为87.2%, 高于对照组的66.0%, 差异有统计学意义(χ2=6.039, P<0.05)。见表2。
2. 2 两组术前、术后黄斑中心凹视网膜厚度比较 术前,两组患者的黄斑中心凹视网膜厚度比较, 差异无统计学意义(P>0.05);术后1、3、6个月, 两组患者的黄斑中心凹视网膜厚度均较本组术前下降, 且研究组下降程度优于对照组, 差异均具有统计学意义 (P<0.05)。见表3。
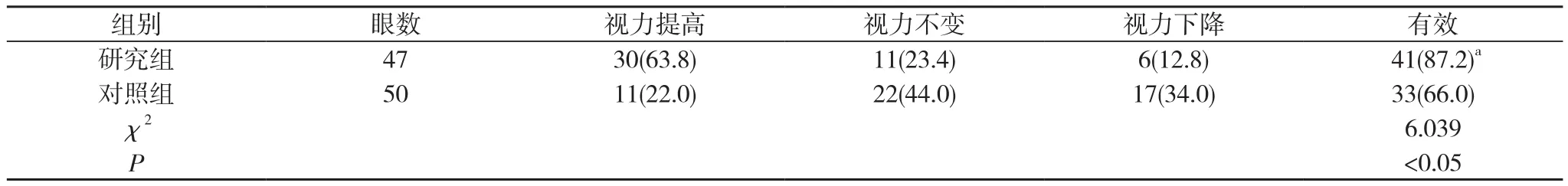
表2 两组治疗6个月后视力结果比较 [n(%)]
表3 两组术前、术后黄斑中心凹视网膜厚度比较 (, μm)

表3 两组术前、术后黄斑中心凹视网膜厚度比较 (, μm)
注:与对照组比较,aP<0.05,bP>0.05
组别眼数术前术后1个月术后3个月术后6个月研究组47 401.00±30.05b248.00±29.20a277.00±21.20a289.00±19.70a对照组50389.00±32.54345.00±31.14331.00±21.19320.00±32.20 t 1.88415.80112.5405.676 P>0.05<0.05<0.05<0.05
2. 3 两组并发症情况 比较两组患者均未出现眼内感染、白内障加重、心脑血管意外等并发症。
3 讨论
高血糖导致糖尿病患者视网膜内屏障破坏, 视网膜毛细血管渗透性增加, 局部视网膜增厚并发生水肿, 累及黄斑部,即发生糖尿病黄斑水肿。黄斑区格栅样光凝产生的热效应能够对部分耗氧量大的色素上皮层与光感受器产生破坏作用,进而形成瘢痕组织, 调节黄斑区血氧分配, 增大内层视网膜血氧, 收缩视网膜血管, 以此减小黄斑区毛细血管灌注压,预防渗漏;同时, 在瘢痕组织作用下, 可促进黄斑水肿吸收激光可封闭黄斑区及近黄斑区微血管瘤与扩张的毛细血管,降低了血管渗出率, 且构建了良好的屏障作用, 预防了中心凹外扩张毛细血管渗漏到中心凹。
有关文献报道表明, 血管内皮生长因子-A(VEGF-A)在糖尿病视网膜病变治疗中发挥了十分重要的作用, VEGF能直接对血管内皮细胞产生作用, 增大血管通透性, 加快血管内皮细胞增殖, 以此促进视网膜内屏障破坏, 致使血管渗漏,致使形成黄斑水肿[6]。
抗VEGF 药物的作用机制为:通过对VEGF和其特异性受体结合跨膜级联反应的阻断, 减少新生血管的生成, 预防血管渗漏, 实现治疗黄斑水肿的目次。针对糖尿病黄斑水肿抗VEGF药物的使用指征为:①累积中心凹伴视力受损糖尿病黄斑水肿;②其他治疗后水肿存在或复发;③弥漫性水肿,中央视网膜厚度>300 μm。视力<0.5。
Do等[7]研究显示, 51眼经局部光凝无效的弥漫性黄斑水肿糖尿病视网膜病变患者可于玻璃体注射抗VEGF药物治疗, 12周后, 视网膜厚度均由(501±163)μm降低为(377±117)μm,在治疗6周时, 患者视力提高至少3行者15眼, 12周随访中, 23例患者中视力提高至少3行者6眼, 在12周后, 视力提高比例明显降低, 说明, 部分患者还需要予以第2次玻璃体腔注射贝伐单抗(IVB), 16例患者实施了至少2次。国内有关学者研究表明, 在增生期糖尿病视网膜病变(PDR)引起的黄斑水肿治疗中, 雷珠单抗联合黄斑区格栅样光凝应用越来越普遍, 治疗效果明显由于单纯应用黄斑区格栅样光凝治疗[8,9]。
本次研究中, 研究组在最终随访6个月时视力较治疗前明显提高, 对照组虽视力亦有提高, 但较研究组有显著差异,研究组明显优于对照组(P<0.05)。黄斑中心凹视网膜厚度的变化较视力更为明显。在本次研究中, 术前, 两组患者的黄斑中心凹视网膜厚度比较, 差异无统计学意义(P>0.05);术后1、3、6个月, 两组患者的黄斑中心凹视网膜厚度均较本组术前下降, 且研究组下降程度优于对照组, 差异均具有统计学意义 (P<0.05)。
虽然抗VEGF药物治疗糖尿病黄斑水肿疗效明确, 但药物价格偏高, 反复注药增加了患者的经济负担及医疗风险,且长期反复使用VEGF 抑制剂, 不仅导致病理性新生血管减少, 还会影响正常血管。目前国际上对糖尿病黄斑水肿暂无玻璃体注射抗VEGF药物的规范用药方案, 用最少的注射次数取得最佳的治疗效果也是研究的焦点。
对于糖尿病黄斑水肿, OCT表现为早期病变者(弥漫性水肿无视网膜下液)比更晚期病变者有更好的治疗效果[10]。对视力较好, 全视网膜激光光凝(PRP)术前中心凹旁视网膜厚度>300 μm的糖尿病视网膜病变患者, PRP术后发现持续性视力减退的发生率更高[10]。研究发现OCT检查黄斑水肿较眼底检查、荧光素眼底血管造影术(FFA) 敏感, 在治疗后的随访中, 患者的视力变化与OCT检测的黄斑中心凹厚度呈正相关。
综上所述, 先玻璃体内注射抗VEGF药物再行黄斑区格栅样光凝, 可缓解视网膜黄斑水肿症状, 稳定视网膜血管,在一定程度上提高了激光治疗效果, 对保护患者视力有着十分积极的作用。用OCT定量视网膜黄斑区, 了解黄斑形态的改变、黄斑的渗漏程度及黄斑视网膜厚度对患者再次行玻璃体注药具有一定的指导意义。
[1] 邹海东, 张晰, 许迅, 等. 糖尿病视网膜病变对生存质量的影响. 中华医学会全国眼科学术大会, 2007:1.
[2] Kempen JH, Friedman DS, Congdon NG. The Prevalence of Diabetic Retinopathy in the United States. Ajr American Journal of Roentgenology, 2002, 192(6):1608-1617.
[3] Xie XW, Xu L, Wang YX, et al. Prevalence and associated factors of diabetic retinopathy. The Beijing Eye Study 2006. Graefes Archive for Clinical & Experimental Ophthalmology, 2008, 246(11):1519-1526.
[4] Xu L, Wang Y, Li Y, et al. Causes of blindness and visual impairment in urban and rural areas in Beijing: the Beijing Eye Study. Ophthalmology, 2006, 113(7):1-11.
[5] Negi A, Vernon SA. An overview of the eye in diabetes. Journal of the Royal Society of Medicine, 2003, 96(6):266-272.
[6] Stefanini FR, Badaró E, Falabella P, et al. Anti-VEGF for the management of diabetic macular edema. Journal of Immunology Research, 2014, 2014(3):632307.
[7] Do DV, Heier JS, Shah SM, et al. Two-Year Results of the READ 2 Study: Ranibizumab for Edema of the Macula in Diabetes. Ophthalmology, 2010, 117(11): 2146-2151.
[8] 王海山, 张海军, 李玉军, 等. 雷珠单抗玻璃体腔注射并激光光凝治疗糖尿病性黄斑水肿疗效观察. 中国实用眼科杂志, 2015, 33(1):25-29.
[9] 邹红, 黎蕾, 任建萍, 等. 激光联合雷珠单抗治疗增殖型糖尿病视网膜病变. 国际眼科杂志, 2016(1):107-110.
[10] Shimura M, Yasuda K, Nakazawa T, et al. Visual Dysfunction After Panretinal Photocoagulation in Patients With Severe Diabetic Retinopathy and Good Vision. American Journal of Ophthalmology, 2005, 140(1):8-15.
Intravitreal injection of anti VEGF drugs combined with macular grid laser photocoagulation in the treatment of diabetic macular edema
ZHENG Hui, YANG Xiu-xia, LIU Ping-ping, et al. Department of
Ophthalmology, Fifth Affiliated Hospital of Sun Yat-sen University, Zhuhai 519000, China
Objective To compare the effect of intravitreal injection of anti-vascular endothelial growth factor (VEGF) and macular grid laser photocoagulation in the treatment of diabetic macular edema (DME), for further investigating indications of combination therapy. Methods A total of 55 diabetic macular edema patients (97 eyes) were divided by random number table method into control group (50 eyes) and research group (47 eyes). The control group was treated with macular grid laser photocoagulation only, and the research group was treated with intravitreal injection of anti VEGF drugs and macular grid laser photocoagulation. The treatment effect was compared in two groups. Results After 6 months of treatment, the research group had higher visual effective rate as 87.2% than 66.0% in the control group, and the difference had statistical significance (χ2=6.039, P<0.05). Before operation, both groups had no statistically significant difference in macular foveal retinal thickness (P>0.05). In postoperative 1, 3 and 6 months, both groups had lower macular foveal retinal thickness than before treatment, and the research group had better decline degree than the control group. Their difference had statistical significance (P<0.05). The research group had no complications of intraocular infection, increased cataract and cardiovascular accidents in 47 intravitreal injection eyes. Conclusion Application of intravitreal injection of anti VEGF drugs and macular grid laser photocoagulation shows good effect in treating diabetic macular edema with high application value, and it can be used as the preferred treatment method for application and promotion in clinic.
Diabetic macular edema; Macular edema; Laser; Anti-vascular endothelial growth factor
10.14164/j.cnki.cn11-5581/r.2017.15.001
2017-05-08]
珠海市医学科研基金项目
519000 中山大学附属第五医院眼科
赵晓静

