干化葡萄酒酿造中不同干化处理对白藜芦醇的影响
刘建花,齐晓琴,李金鹏,张惠玲
(宁夏大学农学院,宁夏银川750021)
干化葡萄酒酿造中不同干化处理对白藜芦醇的影响
刘建花,齐晓琴,李金鹏,张惠玲*
(宁夏大学农学院,宁夏银川750021)
研究以宁夏贺兰山东麓赤霞珠葡萄为原料酿制干化葡萄酒时3种不同干化处理方法(日光下晒制、日光下隔离紫外线晒制、阴制)对葡萄及葡萄酒中白藜芦醇含量的影响,以及干化处理时天气的温度、紫外线强度及葡萄水分损失对白藜芦醇含量的影响。采用高相液相色谱法(HPLC)测定葡萄及葡萄酒中白藜芦醇的含量。结果表明:以未处理的鲜葡萄做对照,3种干化方法都可以提高葡萄以及用它们酿制的葡萄酒中白藜芦醇的含量。相比未处理的鲜葡萄,3种干化方法使葡萄中的白藜芦醇含量分别提高了206.17%、187.65%、138.27%,所酿制的干化葡萄酒中白藜芦醇含量分别提高了139.46%、116.22%、75.30%,干化过程中温度对白藜芦醇含量影响较大,日光下紫外线及葡萄水分含量对白藜芦醇含量影响较小。
晒制;阴制;干化酒;白藜芦醇
近年来,葡萄酒中白藜芦醇有益于人体健康方面的研究一直是研究者们的热点,特别是在软化血管方面具有很好的功效,长期适量饮用红葡萄酒能够降低出现心血管疾病的危险[1]。研究发现,白藜芦醇具有多种生物学作用[2],可抑制血小板聚集和低密度脂蛋白氧化,调节脂蛋白代谢从而降低人体血脂,防止血栓形成。但是,自然条件下的葡萄以及葡萄酒中白藜芦醇含量很低,只有在遭受病虫害、机械伤害的情况下,葡萄才能大量合成白藜芦醇。近年来的研究发现,采收后的某些植物在紫外照射、霉变等情况下也可诱导组织继续产生白藜芦醇[3],干化葡萄酒在酿酒前需要对葡萄进行晒制或阴制,使水分降低糖度达到30%~35%再进行酿制,在此期间葡萄会受到温度、日光紫外线以及水分脱失的外界影响,这些因素可能会刺激白藜芦醇合成,目前在此方面还少见报道。
本文研究干化葡萄酒酿造中3种不同干化方法对采后的葡萄及酿制的葡萄酒中白藜芦醇含量的影响,目的获得有利于提高白藜芦醇含量的处理工艺,为酿造富含白藜芦醇的优质干红葡萄酒提供理论依据。
1 材料与方法
1.1 材料
赤霞珠葡萄:采自宁夏蒲尚酒庄2015年份新鲜葡萄;有机玻璃:上海美佳塑料制品有限公司。
1.2 主要仪器
SCL-10AVP高效液相色谱:岛津仪器公司;RE52-99型旋转蒸发仪:上海亚荣生化仪器厂;DirectQ3 UV超纯水机:MILLIPORE公司;KQ5200DE型数控超声波清洗器:昆山市超声仪器有限公司;ZQJ-254型紫外线强度检测仪(测量波长范围200 nm~320 nm):上海宝山电光仪器厂;101B-2型电热恒温鼓风干燥箱:上海一恒科技有限公司;梅特勒电子天平:托利多仪器(上海)有限公司;DP-1007DG冷冻干燥机:无锡德谱仪器制造有限公司;LTI-700恒温培养箱:北京中仪友信科技有限公司。
1.3 主要试剂
乙酸乙酯(分析纯)、甲醇(色谱纯)、色谱纯(乙腈)、白藜芦醇标样(纯度为99.95%):宁夏盛泰尔生物有限公司。
1.4 干化葡萄的晾制试验过程
1.4.1 晒制
1.4.1.1 日光下晒制
将采摘的新鲜赤霞珠葡萄每筐平铺一层放置,采摘与放置过程中尽量防止葡萄碰破,之后在日光下照射,保证日出到日落期间都能够照射到阳光。试验过程中选取温差较大和紫外线强度最强时取样,共取7次样、样品编号1~7,每天检测环境温度与紫外线强度、葡萄水分含量及含糖量,记录天气状况,当葡萄糖度达到30%~35%时,停止晒制。
1.4.1.2 日光下隔离紫外线晒制
将采摘的新鲜赤霞珠葡萄每筐平铺一层放置,筐的上部搭置两层有机玻璃用来隔离紫外线,与日光下晒制的葡萄在同一场地,相同的时间段以及相同的天气状况下晒制,取样方法及样品编号同日光下晒制相同,每天检测环境温度、葡萄的水分含量以及含糖量,记录天气状况,当葡萄糖度达到30%~35%时,停止晒制。
1.4.2 阴制
将采摘的新鲜赤霞珠葡萄每筐平铺一层(或者将葡萄悬挂起来)放置在较偏凉避光的房间内,避免太阳光的照射,摆放尽量稀疏,防止长霉。取样方法及样品编号同日光下晒制相同,每天检测环境温度、葡萄的水分含量以及含糖量,记录天气状况,当葡萄糖度达到30%~35%时,停止阴制。
1.4.3 模拟试验
为了更好的分析外界环境对白藜芦醇的影响,进行以下模拟试验:
1)温度:以一天的早晨、中午、下午、晚上4个阶段的温度为参数,分别设置温度为16、22、17、10℃,每个温度条件下放置5 h之后取样、测定白藜芦醇含量。
2)紫外线:取晒制过程中的紫外线强度5.11、6.16、7.43 μW/cm2,作为模拟参数,分别在该强度紫外线下照射5 h之后,取样、测定白藜芦醇含量。
3)水分:将新鲜葡萄放置在冷冻干燥箱内,使葡萄的水分含量分别减少到晾制时所取样品对应的不同阶段的水分,即83.23%、74.19%、63.26%,取样、测定白藜芦醇含量。
1.5 干化葡萄酒的酿造
用3种不同干化方法处理获得的干化赤霞珠葡萄分别进行葡萄酒酿制,并以同批新鲜赤霞珠葡萄进行酿造作对比,在酿造过程中定时取样,测定样品中白藜芦醇的含量。
1.6 检测方法
1.6.1 水分含量的测定
将各葡萄样品分别置于烘干并已知质量m的称量瓶中,称鲜重m1。提前将干燥箱温度升至105℃,将称过鲜重的样品连同称量瓶放入干燥箱中,将称量瓶开盖放置,烘至恒重。取出称量瓶,放干燥器中冷却至室温,称重m2。通过称量葡萄干重和鲜重计算葡萄中的水分含量,每个样品重复3次[4]。计算公式:
葡萄组织含水量/%=[(m1-m2)/(m1-m)]×100
式中:m1为鲜重,g;m2为干重,g;m为称量瓶的重量,g。
1.6.2 紫外线的测定
使用ZQJ-254型紫外线强度检测仪(测量波长范围200 nm~320 nm)进行检测。
1.6.3 白藜芦醇的测定
使用高效液相色谱法(HPLC)进行测量。
1.6.3.1 样品中白藜芦醇的提取
准确称取20 g样品置于匀浆机内捣碎,加乙酸乙酯定容至50 mL,超声波辅助提取30 min后,置于4℃冰箱中,浸提48 h后,用砂心漏斗过滤,滤液在40℃条件下减压浓缩,将粗提物加入甲醇定容至5 mL,将上述样品经0.45 μm脂溶性微孔滤膜过滤,在高效液相色谱仪中进行检测。
1.6.3.2 色谱条件
结合参考文献与实验室现有工作基础,稍加改进,确定色谱条件:色谱柱为反相色谱柱Eclipse XDB C-18柱(4.6 mm×250 mm,5 μm);流动相为体积分数40%的乙腈水溶液,流速为1.0 mL/min;检测波长306 nm;柱温为30℃;进样量为20 μL。
1.6.3.3 标准曲线的绘制
准确称取一定量的白藜芦醇标样,分别用流动相配制成40、20、10、2.5 mg/L 4个不同浓度的溶液,摇匀,经0.45 μm滤膜过滤上机测定。以浓度为X轴,峰面积为Y轴,建立线性回归方程。
2 结果与讨论
2.1 试验过程中的天气状况
试验过程中每隔5天取样,共取7次样,样品编号1~7,对应的天气状况见表1,葡萄阴制过程中室内温度状况见表2。
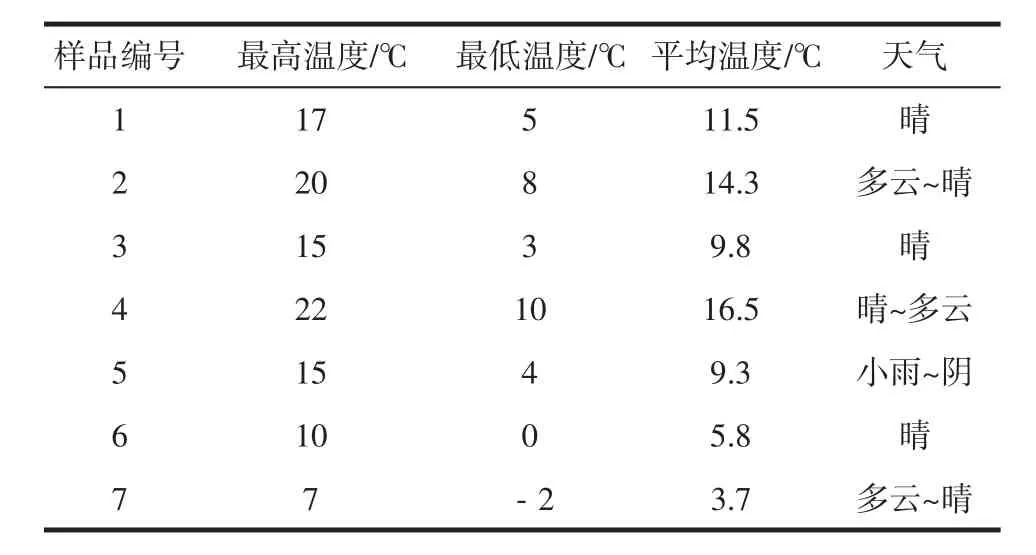
表1 葡萄晒制过程中的天气状况Table 1 Grapes Weather proofing process
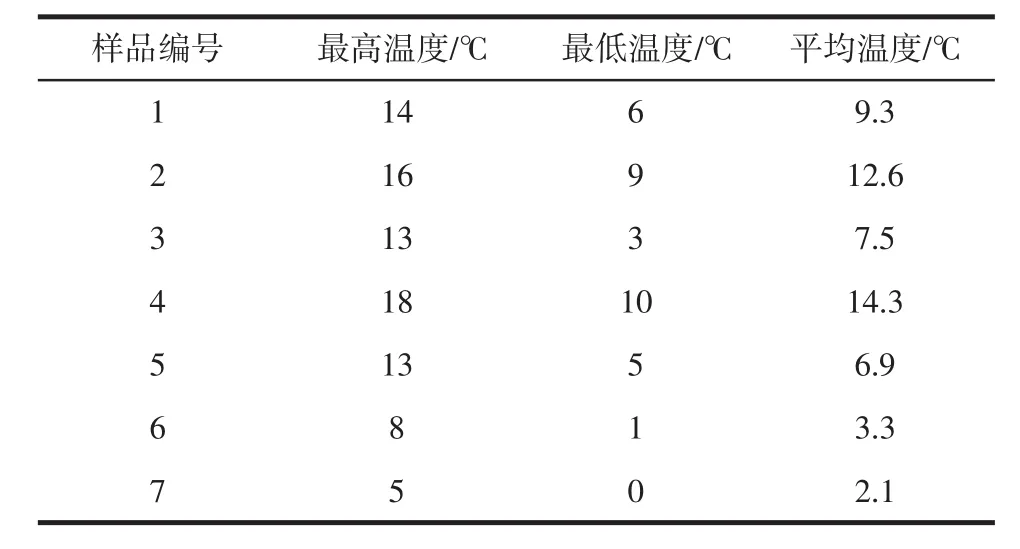
表2 葡萄阴制过程中室内温度状况Table 2 Grape room temperature refining process condition

图1 白藜芦醇标准曲线Fig.1 Resveratrol standard curve
2.2 白藜芦醇标准曲线的绘制
准确称取一定量的白藜芦醇标样,分别用流动相配制成40、20、10、2.5 mg/L 4个不同浓度的溶液,每次进样20 μL,以白藜芦醇含量为横坐标,峰面积为纵坐标绘制白藜芦醇标准曲线(见图1)。
2.3 3种干化过程中各参数与葡萄中白藜芦醇含量
干化过程中各参数与葡萄中白藜芦醇含量见表3。由表3可以看出,在3种干化方法下,随着晾制时间的增加,葡萄中的水分不断下降,糖度不断增大,白藜芦醇的含量也随之增加,但温度、紫外线强度、葡萄水分下降哪一个对白藜芦醇含量影响较大,需要下面的模拟试验进一步确定。
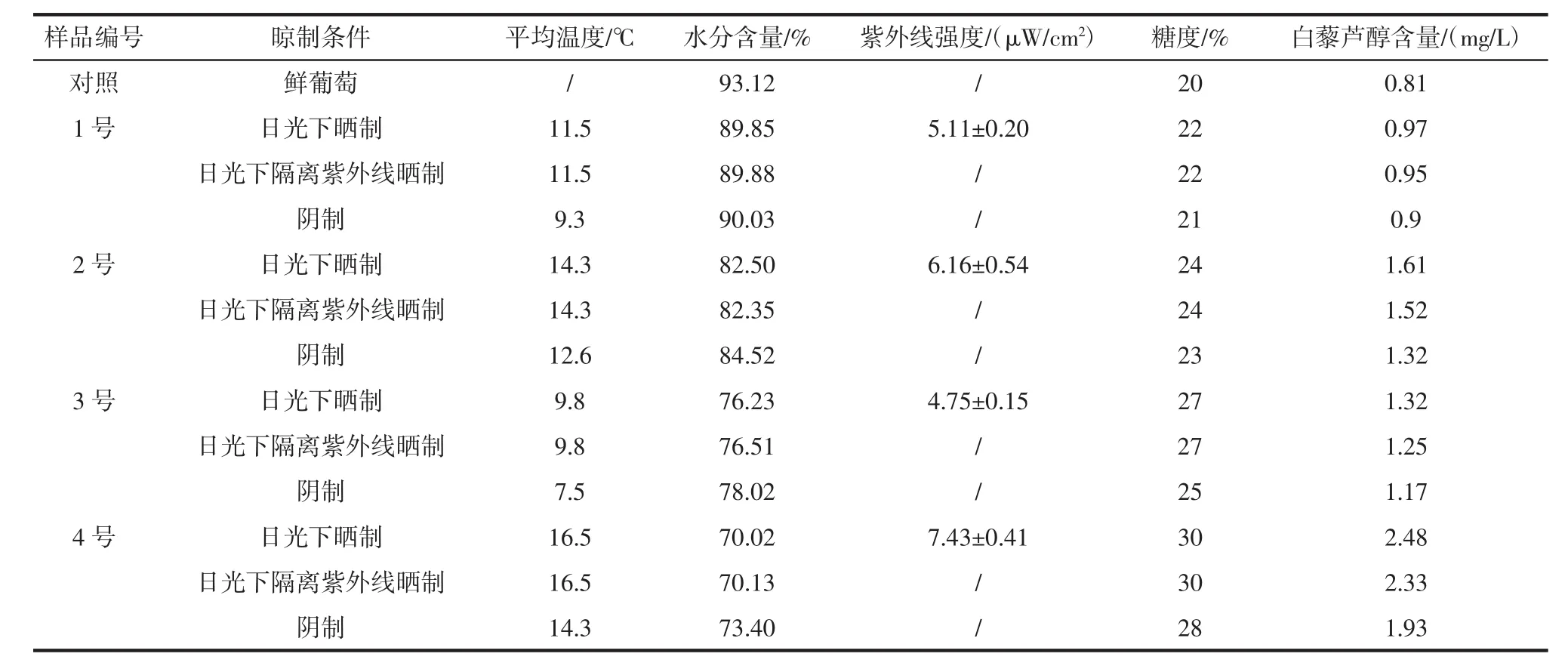
表3 干化过程中各参数与葡萄中白藜芦醇含量Table 3 Drying process parameters and resveratrol content in grapes
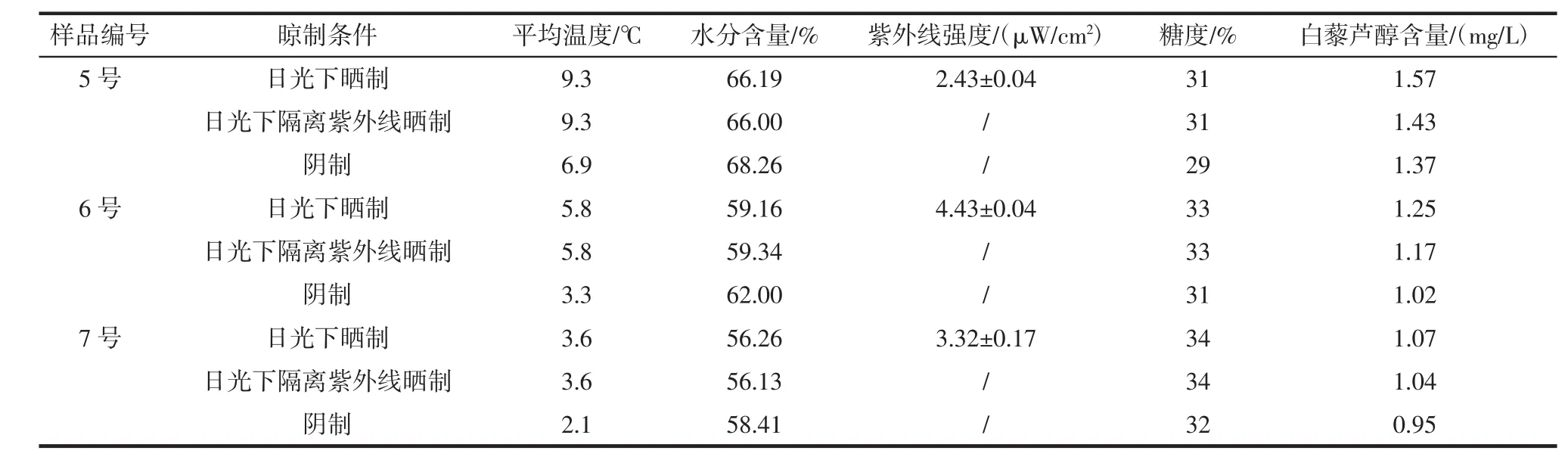
续表3 干化过程中各参数与葡萄中白藜芦醇含量Continue table 3 Drying process parameters and resveratrol content in grapes
2.4 模拟试验结果
2.4.1 温度对白藜芦醇含量的影响
温度对白藜芦醇含量的影响见图2。

图2 温度对白藜芦醇含量的影响Fig.2 Effect of temperature on the content of resveratrol
由图2可以看出,温度对葡萄中白藜芦醇含量影响较大,处理后葡萄中白藜芦醇含量分别为22℃>17℃>16℃>10℃,最高可以达到1.45 mg/L,相比鲜葡萄中白藜芦醇含量(0.81 mg/L)提高了80%。这是因为启动白藜芦醇合成的二苯乙烯合酶(Stilbene Synthase,简称STS)的合成受诱导型基因表达调控[5],在正常情况下STS合成途径是关闭的,只有当受到逆境胁迫诱导后,STS酶激活,才启动白藜芦醇的合成[6-7],当温度升高时,STS酶活性增强,加快了白藜芦醇的合成。另一方面,可能是因为葡萄中含有一系列以白藜芦醇为基本单位在植物体内脱氢聚合生成的白藜芦醇衍生物,这些衍生物具有与白藜芦醇相似的生物活性,其中有些化合物的活性、选择性和稳定性甚至强于白藜芦醇,这些多聚体通过调整温度可以转化为白藜芦醇[8]。
2.4.2 紫外线对白藜芦醇含量的影响
紫外线对白藜芦醇含量的影响见图3。

图3 紫外线对白藜芦醇含量的影响Fig.3 Effect of UV on the content of resveratrol
由图3可以看出,模拟试验中,葡萄中白藜芦醇的含量受紫外线的影响较小,鲜葡萄在紫外线强度为(7.43±0.41)μW/cm2下照射5 h后葡萄中白藜芦醇含量最高达到0.92 mg/L,相比鲜葡萄中白藜芦醇含量(0.81 mg/L)提高了13%。这是因为启动白藜芦醇合成所需的STS酶对紫外线的感受区在260 nm~270 nm[9],在300 nm以上时,只有少量甚至无白藜芦醇产生,而正常的日光中恰恰缺乏300 nm以下的紫外线[10],葡萄虽然暴露在日光中,但是缺少启动诱导型基因表达的“外力”而无法大量合成白藜芦醇。2.4.3 水分对白藜芦醇含量的影响
水分对白藜芦醇含量的影响见图4。
由图4可以看出,水分变化对葡萄中白藜芦醇含量影响较小,鲜葡萄水分减少到56.26%时,葡萄中白藜芦醇含量增加到0.87 mg/L,相比鲜葡萄中白藜芦醇含量(0.81 mg/L)提高了7%。这可能是因为启动白藜芦醇合成的STS酶对水分不敏感,葡萄水分含量下降不能激活STS酶的活性,仅仅是因为葡萄水分降低白藜芦醇因为干物质的浓缩含量随之稍有增加,还有待进一步研究。
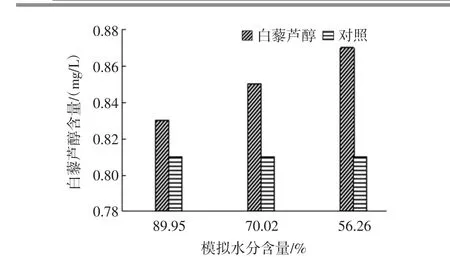
图4 水分对白藜芦醇含量的影响Fig.4 Effect of moisture on the content of resveratrol
2.5 不同酿制方法葡萄酒中白藜芦醇含量比较
不同酿制方法葡萄酒中白藜芦醇含量比较见图5。
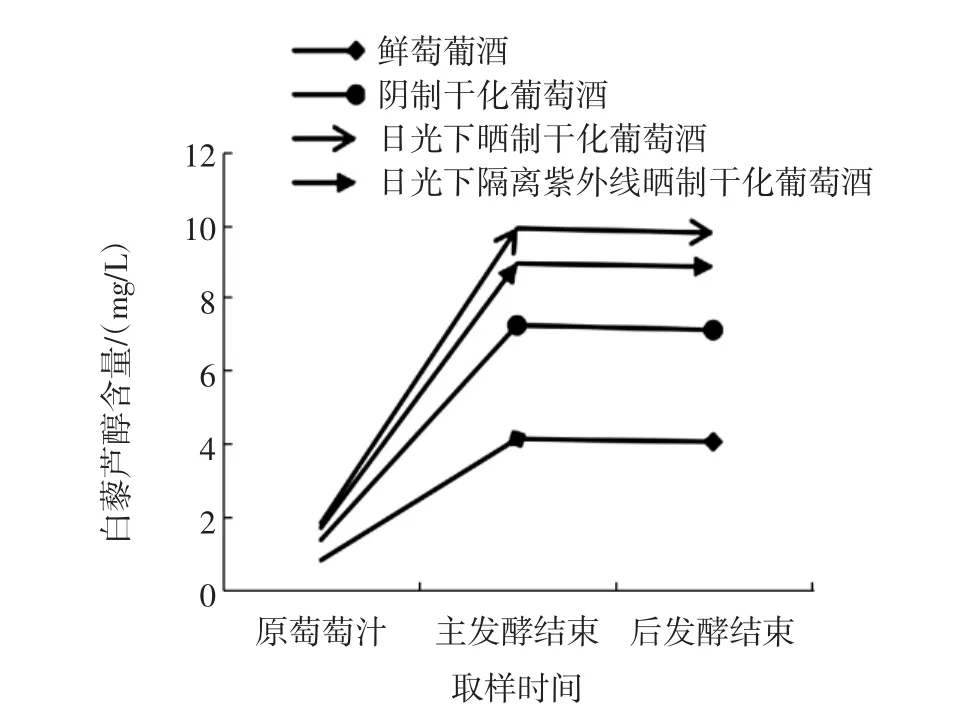
图5 不同酿制方法葡萄酒中白藜芦醇含量比较Fig.5 Comparison of the content of resveratrol in different wine-growing methods
由图5可知,鲜葡萄、日光下晒制、日光下隔离紫外线晒制、阴制葡萄原料的初期白藜芦醇含量是鲜葡萄<阴制葡萄<日光下隔离紫外线晒制葡萄<日光下晒制葡萄,在主发酵结束时都有所增加,其中,鲜葡萄酒、阴制干化酒、日光下隔离紫外线晒制干化酒、日光下晒制干化酒的白藜芦醇含量分别达到4.13、7.24、8.93、9.89 mg/L,后发酵阶段白藜芦醇含量稍有减少并趋于平稳。这是因为当添加果胶酶和酵母进行发酵时,在酶解作用下,使白藜芦醇及其衍生物的单体释放出来,进而被发酵所生成的酒精反复萃取进入葡萄酒中,随着酒精生成量的增加,它们的含量也增加;当主发酵完成除去皮渣后进入苹果酸-乳酸发酵,由于轻度氧化的作用,使得白藜芦醇及其衍生物的含量略有下降[11]。
3 结论
1)日光下晒制、日光下隔离紫外线晒制、阴制处理3种干化处理后的葡萄中白藜芦醇含量都有所提高,最高可提高206.17%。
2)通过模拟试验,分析了单因素温度、紫外线强度、葡萄水分下降对葡萄中白藜芦醇影响,结果得出,鲜葡萄在紫外线强度为(7.43±0.41)μW/cm2下照射5 h后葡萄中白藜芦醇含量提高了13%,鲜葡萄水分减少到56.26%时,葡萄中白藜芦醇的含量提高了7%。鲜葡萄在22℃下放置5 h葡萄中白藜芦醇含量可以提高80%,说明了温度对白藜芦醇含量影响较大,紫外线及葡萄水分下降对白藜芦醇含量影响相比而言小一些,这是由于温度可以促进提高合成白藜芦醇所需的STS酶的活性;紫外线和水分是间接环境刺激胁迫所导致白藜芦醇合成。
3)用干化处理后的葡萄所酿造的葡萄酒,明显比鲜葡萄酿制的葡萄酒白藜芦醇含量高,由于干化处理后的葡萄中的白藜芦醇较高,并在发酵过程中由于葡萄的破碎与酶的水解释放使发酵过程中白藜芦醇含量持续升高,到发酵结束时白藜芦醇含量比鲜葡萄酒中白藜芦醇含量提高了75.30%~139.46%。
[1]Renaud S,Logeril M D.Wine,alcohol,platelets,and french paradox for coronary heart disease[J].Lancet,1992,339:1523-1526
[2]Jeandet P,Bessis R,Sbaghi M,et al.Production of the phytoalexin resveratrol by grape as response to Botrytis attack under natural conditions[J].Journal of Phytopathology-phytopathologische Zeitschrift, 1995,143:135-139
[3]李华.现代葡萄酒工艺学[M].西安:陕西人民出版社,2000:56-61 [4]曹健康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:113-118
[5]Lanz T,Tropf S,Marner F J,et al.The role of cysteines in polyketide synthases[J].J Biological Chemistry 1991,15:9971-9976
[8]李景明.葡萄采后白蔡芦醇的诱导与葡萄酒中白葵芦醇的调控研究[D].北京:中国农业大学,2003:19-24
[9]Langcake P,Pryce R J.The production of resveratrol and the viiferins by grapevines in response toultraviolet irradiaion[J].Phytochemistry,1977,16:1193-1196
[10]Gates D M.Spectral distribution of solar radiation at the earth's surface[J].Science,1966,151:523-529
[11]高年发,陈志頔,姜丽,等.葡萄酒发酵过程中白藜芦醇含量变化的研究[J].酿酒科技,2006(12):13-15
The Effects of Different Desiccated Method on Resveratrol Content during the Process of Desiccation
LIU Jian-hua,QI Xiao-qin,LI Jin-peng,ZHANG Hui-ling*
(College of Agriculture,Ningxia University,Yinchuan 750021,Ningxia,China)
This experiment had studied the impact of three different methods of desiccating on grapes and wine resveratrol content as well as the influence temperature,ultraviolet ray and grape moisture have on resveratrol content during the process of desiccation.It had adopted HPLC to test the resveratrol content in grape and wine made from grapes.However,it turned out that all three desiccation methods could help to improve the resveratrol content in grape and wine made from grapes.Compared with unprocessed fresh grapes,all three desiccation methodshadrespectivelyhelpedtheresveratrolcontentingrapetoincreaseby206.17%,187.65%and138.27%,and that in wine made from grapes to respectively rise by 139.46%,116.22%and 75.30%.During the process,temperature had a great influence on the resveratrol content while ultraviolet ray and grape moisture have little impact on the resveratrol content.
basking under sunshine;shady production conditions;desiccated wine;resveratrol
2016-09-05
宁夏回族自治区科技支撑计划项目
刘建花(1990—),女(汉),硕士研究生,研究方向:微生物发酵。
*通信作者
10.3969/j.issn.1005-6521.2017.16.022
——清徐老陈醋酿制技艺

