Zometa对骨肉瘤细胞中MMP-9、TIMP-1及COX-2表达的影响
冷华平 段永壮 李宽宽 钱华兵
Zometa对骨肉瘤细胞中MMP-9、TIMP-1及COX-2表达的影响
冷华平 段永壮 李宽宽 钱华兵
目的 探讨唑来膦酸(Zometa)对骨肉瘤细胞中MMP-9、TIMP-1及COX-2表达情况的影响。方法 应用细胞增殖实验、细胞凋亡实验、细胞迁移和侵袭实验,研究Zometa对骨肉瘤细胞U2OS的影响;应用WB和qRT-PCR,研究Zometa对骨肉瘤细胞内COX-2、MMP-9和TIMP1蛋白和mRNA表达的影响。结果 Zometa抑制骨肉瘤细胞的增殖、迁移和侵袭,促进骨肉瘤细胞凋亡,且这些影响都存在剂量依赖性;经不同浓度Zometa处理后,骨肉瘤细胞内COX-2、MMP-9 蛋白和mRNA表达水平随浓度的增加而逐渐降低,TIMP-1 蛋白mRNA表达水平随浓度的增加而逐渐升高,且都存在剂量依赖性。结论 Zometa通过调节COX-2、MMP-9和TIMP1在细胞内的表达来影响骨肉瘤细胞的增殖、迁移和侵袭能力,可作为治疗恶性骨肿瘤的药物,且对患者预后情况的改善有一定的价值。
Zometa;骨肉瘤细胞;MMP-9;TIMP-1;COX-2
(ThePracticalJournalofCancer,2017,32:1224~1228)
骨肿瘤1种是临床上常见的恶性骨性肿瘤,其中骨肉瘤的发病率和死亡率居原发性恶性骨肿瘤之首。肿瘤的转移性扩散是人类癌症死亡率高的主要原因之一,并且对癌症的治疗产生严重阻碍。仅使用具有诱导细胞凋亡能力的治疗剂可能对骨肿瘤无效,因此,抑制癌细胞的转移能力已经成为评估抗癌药物的重要标准。MMP-9和COX-2表达的诱导作用与骨肿瘤血管生成、侵袭和转移密切相关,能促进肿瘤侵袭和增殖,因此MMP-9和COX-2表达的抑制作用在癌症治疗中起关键作用。Zometa(唑来膦酸)是第三代二膦酸盐,它是二膦酸盐家族成员之一,可以降低骨骼并发症(骨骼相关事件,SREs)的发生率和严重程度[1-2]。本实验通过研究Zometa对骨肉瘤细胞中MMP-9、TIMP-1及COX-2表达情况的影响,分析Zometa对骨肿瘤疾病的治疗及预后意义。
1 材料与方法
1.1 细胞系
人骨肉瘤细胞U2OS购于上海复祥生物科技有限公司,冻存在本实验室,以进行后续的复苏,作为靶细胞使用。将细胞维持在含有10%胎牛血清(FBS,Life Technologies),100 U/ml青霉素和100 mg/ml链霉素的DMEM培养基中,置于37 ℃ 5%CO2的潮湿培养箱中培养。
1.2 细胞活力测定
应用MTT测定来评估Zometa对U2O细胞活力的影响。将U2OS和Saos2细胞以5×104个细胞/ml的细胞密度接种在96孔培养板中,并用Zometa(sigma Aldrich,USA)(0、20、40、60和80 μmol/L)处理或保持未处理(Ctrl组)72 h,在含有5%CO2的潮湿环境中于37 ℃下孵育。 随后,使用MTT测定(5 mg/ml MTT)评估细胞活力。使用Tecan Sunrise Elisa-Reader(Tecan Group,Ltd,Mannedorf,Switzerland)在490 nm的测试波长下测量吸光度。
1.3 细胞凋亡实验
U2OS细胞在96孔板中以5×104个细胞/ml的密度培养,并用Zometa(0、20、40、60和80 μmol/L)处理或保持未处理(对照)24 h。将细胞进行胰蛋白酶消化,并用磷酸盐缓冲盐水(PBS)洗涤3次,加入75%乙醇于4 ℃下过夜。用PBS洗涤固定的细胞3次,用10 μl RNA酶在37 ℃下孵育30 min,用10 μl PI进行染色,然后在黑暗中4 ℃孵育30 min。应用FACScan流式细胞仪(BD Biosciences,Franklin Lakes,NJ,USA)进行数据采集和分析。应用ModFit LT软件(Verity Software House,USA)进行凋亡细胞的百分比。
1.4 细胞侵袭实验
使用BioCoatTMMatrigelTM侵袭室进行细胞侵袭测定。Matrigel涂层在实验前于DMEM培养基中水化30 min。将悬浮在0.5 ml无血清培养基中的细胞(5×104)加入到Matrigel上腔中。用不同浓度Zometa(0、20、40、60和80 μmol/L)处理1 h后,将含有50nM TPA 0.5 ml的无血清培养基加入到底部孔。然后将腔室孵育24 h。孵育后,用棉签将上室细胞移出,迁移的细胞用含有0.2%结晶紫色粉末的2%乙醇染色。在光学显微镜下统计侵袭的细胞。
1.5 细胞划痕修复试验
细胞划痕修复试验进行细胞迁移测定。将细胞(5×104)接种在24孔培养皿中直至达到90%整合。细胞保持在无血清培养基中12 h。使用移液管尖小心地划伤单层细胞。PBS洗涤除去细胞碎片,将细胞置于无血清培养基中培养。然后将迁移的细胞用冷的75%甲醇吹动30 min,并用PBS洗涤3次。在0和24 h拍摄培养物,以监测细胞迁移到受伤区域的数量。
1.6 蛋白免疫印迹分析
应用WB分析检测Zometa对MMP-9、COX-2、TIMP-1蛋白的表达水平的影响。在37 ℃ 5%CO2的潮湿环境中,Zometa(0、20、40、60和80 μmol/L)处理U2OS细胞24 h,之后使用RIPA蛋白提取试剂(Beyotime)裂解细胞,从细胞中提取蛋白质。在4 ℃下12 000×g离心10 min后,通过10%SDS-PAGE分离上清液,将分离的蛋白质转移到硝酸纤维素膜(Sigma)上。将膜在PBS和5%脱脂乳中封闭1 h,并用针对MMP-9、COX-2、TIMP-1的一抗(Cell Signaling Technology)将膜在4 ℃孵育过夜。将膜用HRP缀合的二抗(Cell Signaling Technology)在室温下孵育1 h。β-tubulin蛋白表达作为内参。应用Quantity One软件(Life Technologies)评估相对蛋白表达水平。
1.7 荧光定量实时PCR(Quantitative realtime-PCR,qRT-PCR)
采用qRT-PCR检测Zometa对MMP-9、COX-2、TIMP-1 mRNA的表达水平的影响。在37 ℃ 5%CO2的潮湿环境中,Zometa(0、20、40、60和80 μmol/L)处理U2OS细胞24 h,应用TRIzol试剂(Invitrogen)从细胞提取总RNA。使用Reverse Transcription Kit(Takara)将RNA逆转录为cDNA。使用SYBR Green(Takara)进行实时PCR分析。以β-Actin作为内参。应用ABI7500系统(Applied Biosystems)进行qRT-PCR反应。用熔解曲线分析来确定PCR产物的特异性。用2-ΔΔCt法计算mRNA相对表达的倍数变化。qRT-PCR反应条件:95 ℃ 10 min,95 ℃15 s,72 ℃ 15 s,共40个循环。
1.8 统计学分析
实验中所有数据均应用SPSS 20.00进行数据处理。统计数据表示方式为平均数±标准差表示,行t检验。
2 结果
2.1 Zometa 对U2OS细胞增殖的影响
如图1所示,与对照组(0 μmol/L)相比,细胞培养72 h后,Zometa组在20、40、60、80 μmol/L Zometa处理后,细胞增殖能力显著降低(*P<0.05)。提示,Zometa抑制骨肉瘤细胞U2OS的增殖,且存在剂量依赖性。
2.2 Zometa 对U2OS细胞凋亡的影响
与对照组(0 μmol/L)相比,用不同剂量Zometa(20~80 μmol/L)处理后,Zometa组细胞凋亡显著增强(*P<0.05)(图2)。
2.3 Zometa 对U2OS细胞迁移和侵袭的影响
如图3所示,与对照组(0 μmol/L)相比,Zometa组中细胞迁移(图3A)和侵袭(图3B)能力均显著降低(P<0.05),且这种降低随Zometa浓度增加而改变。

图1 Zometa 对U2OS细胞增殖的影响

图2 Zometa 对U2OS细胞凋亡的影响
2.4 Zometa 对U2OS细胞中COX-2、MMP-9、TIMP-1蛋白表达的影响
如图4所示,不同浓度Zometa(0、20、40、60和80 μmol/L)处理U2OS细胞24 h后,COX-2(4A)、MMP-9(4B)蛋白表达水平随浓度的增加而逐渐降低。当浓度为40、60和80 μmol/L时,与对照组比较有显著差异性(*P<0.05)。而在用不同浓度Zometa处理后,TIMP-1蛋白表达水平随浓度的增加而逐渐升高,且存在剂量依赖性(图4C)。
2.5 Zometa 对U2OS细胞中COX-2、MMP-9、TIMP-1mRNA表达的影响
如图5所示,不同浓度Zometa(0、20、40、60和80 μmol/L)处理U2OS细胞24 h后,COX-2(图5A)、MMP-9(图5B) mRNA表达水平随浓度的增加而逐渐降低,TIMP-1 mRNA(图5C)表达水平随浓度的增加而逐渐升高,且都存在剂量依赖性。
3 讨论
恶性肿瘤通常归因于其侵袭性和转移能力,仅使用具有诱导细胞凋亡能力的治疗剂可能对骨肿瘤无效。临床上,癌症患者出现肿瘤骨转移,则意味着死亡率的增加。
Zometa(唑来膦酸)是第三代二膦酸盐,属于二膦酸盐家族成员之一,可以降低骨骼并发症(骨骼相关事件,SREs)的发生率和严重程度[3]。与其它二膦酸盐相比,它更方便使用,且更有效,能进一步减少SREs的发生[4-5]。越来越多的证据表明,Zometa具有直接的抗肿瘤活性[6]。已研究227名女性患有乳腺癌骨转移(主要是溶骨性病变)使Zometa(注射输入15 min,每4周一次,持续1年)的作用,发现与安慰剂组相比,Zometa治疗组患者SREs显著降低[7]。本实验中,但使用不同浓度Zometa培养骨肉瘤细胞,观察m肉瘤细胞的增殖、凋亡、迁移和侵袭。结果发现,Zometa抑制骨肉瘤细胞的增殖、迁移和侵袭,促进骨肉瘤细胞凋亡,且这些影响都存在剂量依赖性。
肿瘤的转移性是1个多步骤的过程,涉及癌细胞与原发性肿瘤的分离,以及它们迁移、粘附和入侵到淋巴管或血液中。血管外渗是由细胞外蛋白酶作用所介导,其中基质金属蛋白酶(matrix metalloproteinases,MMPs )在这一过程中发挥着急作用。基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)是降解细胞外基质蛋白的锌依赖性内肽酶。实验研究表明,MPP-2涉及与各种生理和病理状况相关的骨重建过程,包括骨转移形成[8]。肿瘤细胞可以分泌和/或诱导破骨细胞释放蛋白消解酶MMP-2和MMP-9到骨微环境中,降解骨基质蛋白,从而破坏骨质,使其释放相关生长因子,如转化生长因子(transforming growth factor-β,TGF-β)等,促进肿瘤细胞生长[9]。反过来,这些因素可能刺激肿瘤细胞释放其它可溶性生长因子、细胞因子、激素和蛋白消解酶,进一步促进肿瘤细胞增殖、宿主组织迁移和侵袭,形成恶性循环[10]。研究表明,抑制MMP2和MMP9破坏了肿瘤转移骨质降解的能力。MMP2主要由成纤维细胞和成骨细胞分泌,并参与MMP13的活化和基底膜的降解。MMP9主要由破骨细胞和免疫系统的细胞(包括巨噬细胞和嗜中性粒细胞)产生,据报道其对肿瘤生长至关重要。MMP2和MMP9能够切割Ⅰ型,Ⅳ型和Ⅴ型胶原,并且在骨基质降解中是有重要作用[11]。TIMP-1是MMP-9的特异性内源抑制剂,二者的生理活性高度相关。TIMP-1能够降低MMP-9的活性,使细胞外基质保持稳定,抑制肿瘤细胞的侵袭和转移[12]。环氧合酶-2(Cyclo-oxygenase-2,COX-2)是1种炎症相关酶,在慢性炎症组织的肿瘤起始中起关键作用[13]。它是骨肿瘤组织中最主要的血管生长因子,其过表达是包括乳腺癌在内的多种上皮癌肿瘤发生和转移的标志性特征,且COX-2抑制剂具有化学预防和治疗作用。对小鼠和人类乳腺癌模型的研究表明,乳腺癌细胞中高表达的COX-2通过多种机制促进肿瘤发生,如宿主抗肿瘤免疫细胞失活、增强癌细胞迁移和侵袭能力、促进肿瘤相关血管发生等。MMP-9和COX-2表达的诱导作用与肿瘤血管生成、侵袭和转移密切相关。MMPs催化细胞外ECM的降解,并促进肿瘤侵袭和增殖,因此MMP-9和COX-2表达的抑制作用在癌症治疗中起关键作用。

图3 Zometa 对U2OS细胞迁移和侵袭的影响
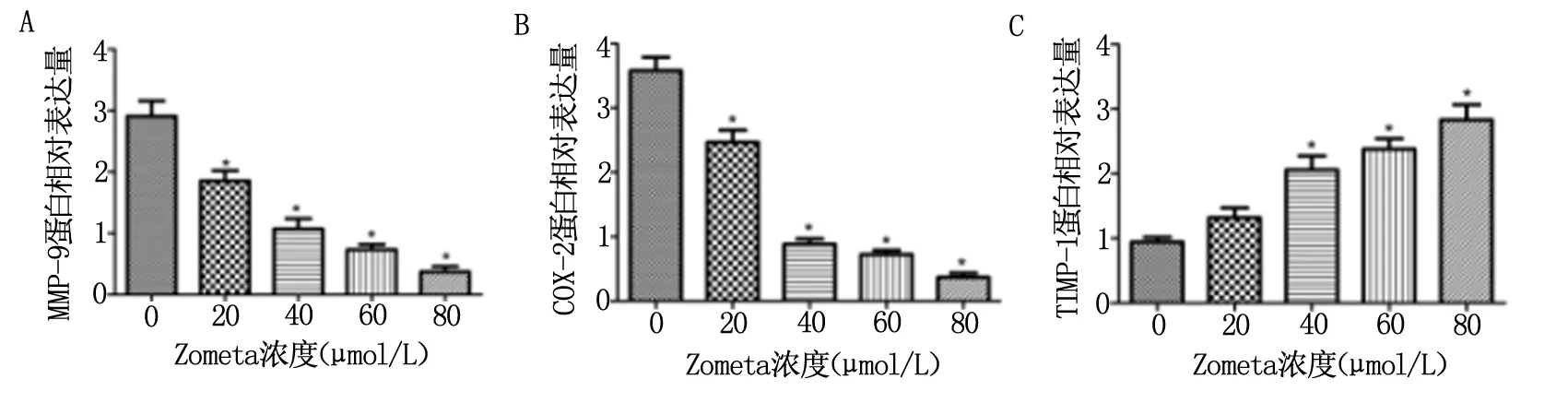
图4 Zometa 对U2OS细胞中COX-2、MMP-9、TIMP-1蛋白表达的影响

图5 Zometa 对U2OS细胞中COX-2、MMP-9、TIMP-1mRNA表达的影响
研究发现,MMP-9和COX-2在侵袭性乳腺癌中过表达,与乳腺癌患者癌细胞转移、预后差、死亡率高密切相关,当它们的表达被抑制时,可降低乳腺癌细胞的增殖、侵袭能力[14-15]。本实验中WB和qRT-PCR结果显示,经不同浓度Zometa处理后,骨肉瘤细胞内COX-2、MMP-9 蛋白和mRNA表达水平随浓度的增加而逐渐降低,TIMP-1蛋白mRNA表达水平随浓度的增加而逐渐升高,且都存在剂量依赖性。提示,Zometa可能通过抑制COX-2、MMP-9的表达来抑制骨肉瘤细胞的迁移和侵袭。
综上所述,Zometa通过调节COX-2、MMP-9和TIMP1在细胞内的表达情况,来影响骨肉瘤细胞的增殖、迁移和侵袭能力。提示Zometa可作为治疗恶性骨肿瘤的药物,且对患者预后情况的改善有一定的价值。然而,COX-2、MMP-9和TIMP1在细胞中的变化情况涉及到多种信号通路,对恶性骨肿瘤的影响还需要进一步深入探究。
[1] Hurst M,Noble S.Clodronate:a review of its use in breast cancer〔J〕.Drugs Aging,1999,15(2):143-167.
[2] Theriault RL,Lipton A,Hortobagyi GN,et al.Pamidronate reduces skeletal morbidity in women with advanced breast cancer and lytic bone lesions:a randomized,placebo-controlled trial.Protocol 18 Aredia Breast Cancer Study Group〔J〕.J Clin Oncol,1999,17(3):846-854.
[3] 崔 巍,彭六保.唑来膦酸的临床应用研究进展〔J〕.中国新药与临床杂志,2007,4(3):467-469.
[4] Nagy Z.Zoledronic acid(ZOMETA):a significant improvement in the treatment of Bone metastases〔J〕.Pathol Oncol Res,2005,11(3):186-187.
[5] Perry CM,Figgitt DP.Zoledronic acid:a review of its use in patients with advanced cancer〔J〕.Drugs,2004,64(11):1197-1211.
[6] Senaratne SG,Colston KW.The role of bisphosphonates in breast cancer:Direct effects of bisphosphonates on breast cancer cells〔J〕.Breast Cancer Res,2001,4(1):18-23.
[7] Kohno N,Aogi K,Minami H,et al.Zoledronic acid significantly reduces skeletal complications compared with placebo in Japanese women with bone metastases from breast cancer:a randomized,placebo-controlled trial〔J〕.J Clin Oncol,2005,23(15):3314-3321.
[8] Gillard JA,Reed MW,Buttle D,et al.Matrix metalloproteinase activity and immunohistochemical profile of matrix metalloproteinase-2 and-9 and tissue inhibitor of metalloproteinase-1 during human dermal wound healing〔J〕.Wound Repair Regen,2004,12(3):295-304.
[9] Jinga DC,Blidaru A,Condrea I,et al.MMP-9 and MMP-2 gelatinases and TIMP-1 and TIMP-2 inhibitors in breast cancer:correlations with prognostic factors〔J〕.J Cell Mol Med,2006,10(2):499-510.
[10] Fili S,Karalaki M,Schaller B.Mechanism of bone metastasis:the role of osteoprotegerin and of the host-tissue microenvironment-related survival factors〔J〕.Cancer Lett,2009,283(1):10-19.
[11] Liu B,Cui J,Sun J,et al.Immunolocalization of MMP9 and MMP2 in osteolytic metastasis originating from MDA-MB-231 human breast cancer cells〔J〕.Mol Med Rep,2016,14(2):1099-1116.
[12] 戴 磊,冼 磊,陈铭伍,等.TIMP-1在非小细胞肺癌组织中的表达及意义〔J〕.广西医科大学学报,2011,28(2):234-236.
[13] Rakesh N,Iyengar A,Majumdar K,et al.Quantitative Evaluation of Tumour -Associated Tissue Eosinophilia and Cyclo-oxegenase-2 Gene in Oral Cancer Patients with Assessment of Long Term Outcomes〔J〕.Pathol Oncol Res,2016,22(2):1-8.
[14] Kim S,Kim SH,Hur SM,et al.Silibinin prevents TPA-induced MMP-9 expression by down-regulation of COX-2 in human breast cancer cells〔J〕.J Ethnopharmacol,2009,126(2):252-257.
[15] Simeone AM,Nieves-Alicea R,Mcmurtry VC,et al.Cyclooxygenase-2 uses the protein kinase C/interleukin-8/urokinase-type plasminogen activator pathway to increase the invasiveness of breast cancer cells〔J〕.Int J Oncol,2007,30(4):785-792.
(编辑:吴小红)
Effects of Zometa on MMP-9,TIMP-1 and COX-2 in Osteosarcoma Cells
LENG Huaping,DUAN Yongzhuang,LI Kuankuan,et al.
Zhengzhou Yihe Hospital Affiliated to He'nan University,Zhengzhou,450000
Objective To investigate the effect of Zometa on the expression of MMP-9,TIMP-1 and COX-2 in osteosarcoma cells.Methods Using cell proliferation assay,apoptosis assay,cell migration and invasion assay to investigate the effects of Zometa on COX-2,MMP-9 and TIMP1 in osteosarcoma cells.Using WB and qRT-PCR to investigate the effects of Zometa on COX-2,MMP-9 and TIMP-1 in osteosarcoma cells.Results Zometa inhibited the proliferation,migration and invasion,and promoted the apoptosis of osteosarcoma cells.The mRNA and protein expression of COX-2 and MMP-9 in osteosarcoma cells were markedly decreased,whereas the mRNA and protein expression of TIMP-1 was significantly increased following exposure to different concentrations of Zometa.Those effects were dose-dependent.Conclusion Zometa suppress the proliferation,migration and invasion of osteosarcoma cells and induce apotosis by regulating the expression of COX-2,MMP-9 and TIMP-1.Zometa can be used as a drug for the treatment of malignant bone tumors,and improve the prognosis of patients with a certain value.
Zometa;Osteosarcoma cells;MMP-9;TIMP-1;COX-2
450000 河南大学附属郑州颐和医院(冷华平,李宽宽,钱华兵);450000 郑州大学第一附属医院(段永壮)
段永壮
10.3969/j.issn.1001-5930.2017.08.002
R738.1
A
1001-5930(2017)08-1224-05
2017-04-06
2017-05-23)

