线辣椒SSR-PCR反应体系优化及多态性标记筛选
李全辉,李 江,邵登魁,王亚艺,侯全刚,钟启文
(青海大学 农林科学院,西宁 810016)
线辣椒SSR-PCR反应体系优化及多态性标记筛选
李全辉,李 江,邵登魁,王亚艺,侯全刚,钟启文
(青海大学 农林科学院,西宁 810016)
以循化线辣椒果实黄色突变体H0809和高代自交系0599-1为试材,采用L9(34)正交试验设计,研究线辣椒SSR-PCR 反应体系的主要成分对扩增结果的影响,并对420对SSR分子标记进行筛选。结果表明,最优的反应体系为:总体积20 μL,基因组DNA 20 ng,dNTP 100 μmol·L-1,引物0.6 μmol·L-1, Mg2+2.5 mmol·L-1,TaqDNA聚合酶1.5 μmol;通过筛选,获得72对具有多态性的SSR标记,多态性率为17.1%,平均每个标记扩增出2. 67个等位基因。本试验建立的SSR-PCR反应体系和筛选的多态性标记可用于线辣椒种质资源分析、分子标记辅助育种、分子遗传图谱构建及基因克隆等研究。
线辣椒;SSR;体系优化;引物筛选
简单重复序列(Simple Sequence Repeats, SSR)又称微卫星(Microsatellites),是一类有1~5个核苷酸可变次数的串联重复序列。SSR由于具有数量丰富、多态性高、呈共显性遗传、实验操作简单以及对DNA数量和质量要求不高等优点, 目前已广泛应用于种质资源的遗传多样性分析[1-2],杂交种纯度鉴定[3-5]、遗传连锁图谱构建及性状定位[6-9]等各个领域。在辣椒全基因组测序基础上,利用辣椒基因组富集文库和公共数据库的cDNA序列,开发了很多的SSR标记[10-11],为相关应用奠定基础。
辣椒属茄科(Solanaceae)辣椒属(Capsicum),是一种重要的蔬菜作物,适应性很强,广泛栽培于世界各地。中国作为世界上最大的辣椒生产国家之一,目前年播种面积可以达130 多万hm2,且种植面积还在不断加大,已成为农民致富的主要经济作物之一[12]。对辣椒重要性状进行连锁标记筛选及遗传定位研究,不仅可以加快育种时间,同时节省成本,对辣椒育种实践具有重要的意义。本试验以线辣椒为材料,建立稳定的、适合线辣椒的SSR分析体系,以期为利用SSR分子标记进行线辣椒分子标记辅助育种,并为后续品质、产量等相关数量性状的QTL定位研究奠定基础。
1 材料与方法
1.1 试验材料
采用青海省地方品种循化线辣椒果实黄色突变体H0809(黄色)和高代自交系 0599-1为试材。
1.2 试剂和仪器
辣椒基因组DNA用天根公司的植物基因组DNA提取试剂盒(DP305)提取, SSR引物由上海生工生物工程公司合成(由中国农业科学院蔬菜花卉研究所辣椒课题组提供),TaqDNA聚合酶、 dNTPs为天根公司产品,PCR 仪为Eppendorf Mastercycler pro 梯度 PCR 仪,电泳仪为BIO- RAD 公司生产的Power Pac3000型。成像仪为BIO- RAD公司的GelDoc XR System凝胶成像系统。
1.3 PCR 扩增反应和电泳检测
PCR反应体系为20 μL;PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火60 s,72 min延伸90 s,35个循环;72 ℃延伸5 min。PCR产物用20 g/L琼脂糖凝胶电泳分离检测。
1.4 PCR反应体系优化
采用L9(34)正交试验设计,各因素和水平在参照辣椒[13],黄瓜[14]等的SSR体系的基础上进行优化,试验方案见表1及表2。基因组DNA来自H0809,引物为HpmsE004。此外,体系中应含有1×PCRbuffer和50 ng基因组DNA,加ddH2O补足20 μL。设3次重复。
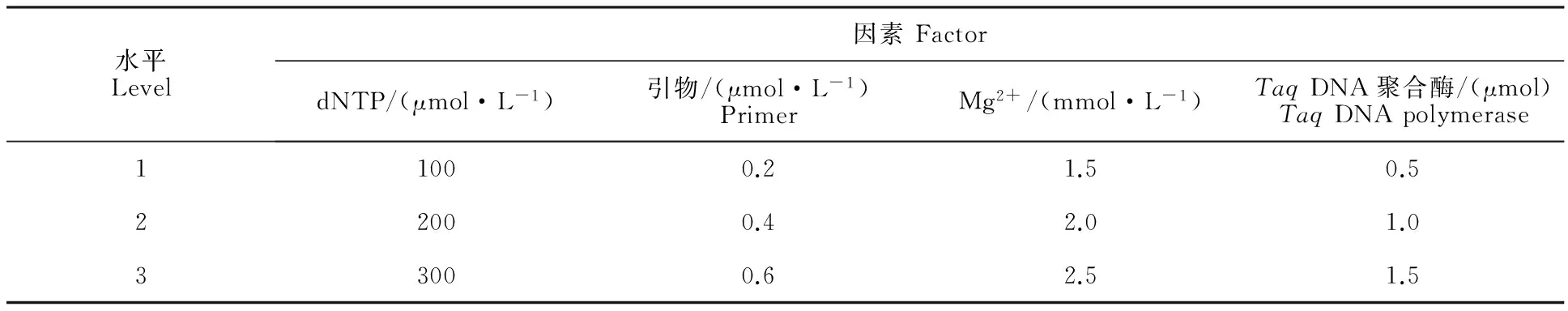
表1 线辣椒SSR- PCR反应体系正交设计因素水平表Table 1 Factors and levels of SSR-PCR system of pepper with orthogonal design

表2 SSR- PCR正交试验设计方案Table 2 SSR-PCR orthogonal design
1.5 DNA底物质量筛选
在体系优化的基础上,进行DNA底物质量筛选试验,共设100 ng、80 ng、60 ng、40 ng、20 ng、10 ng 6个处理。选用黄色线辣椒H0809的基因组DNA,引物为HpmsE004。
1.6 体系稳定性检测和多态性SSR引物的筛选
选择8对SSR引物同时对H0809和0599-1的基因组DNA进行PCR 扩增, 对优化后的辣椒反应体系及反应参数的可靠性和稳定性进行检测。在此基础上,采用420对 SSR引物进行多态性筛选,扩增结果用6%的聚丙烯酰胺凝胶电泳检测。
2 结果与分析
2.1 DNA质量检测
利用天根植物基因组提取试剂盒提取线辣椒H0809和0599-1的基因组DNA , 用Bio-Photometer核酸检测仪检测DNA 溶液浓度和纯度, 其检测结果OD260/OD280值为1.80~1.89, 说明DNA 纯度较高。用琼脂糖检测DNA检测结果表明条带整齐, 没有拖尾现象, 说明提取的DNA完整而且没有降解, 可以用于SSR标记分析(图1)。
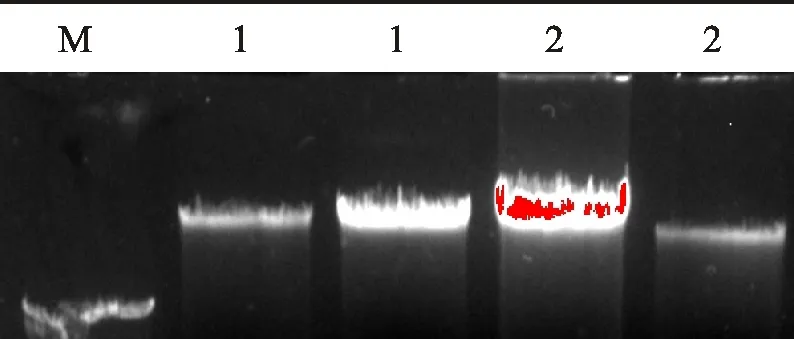
M. Maker; 1. H0809基因组DNA H0809 genomic DNA; 2. 0599-1基因组DNA 0599-1 genomic DNA
图1 线辣椒基因组DNA
Fig.1 Pepper genomic DNA
2.2 SSR- PCR反应体系的正交试验优化
SSR-PCR体系的Mg2+、dNTPs 、引物、TaqDNA聚合酶、基因组DNA用量和扩增循环次数等因素都会影响扩增效果,本研究选用黄色线辣椒H0809的DNA 为模板, 利用引物组合HpmsE004来进行各个因素梯度正交试验。由图2可以看出,不同处理组合扩增效果存在明显的差异。1、4、6、7、8组合扩增结果经琼脂糖凝胶电泳检测,条带较弱,组合9没有检测到扩增产物,组合2、5扩增的条带较为清晰完整,组合3除主要条带外,在500 bp出,还扩增出另一条带,而且重复性较好。综合考虑,本试验选择第3组合为最佳组合,即dNTP 100 μmol·L-1,引物0.6 μmol·L-1, Mg2+2.5 mmol·L-1,TaqDNA聚合酶1.5 μmol。
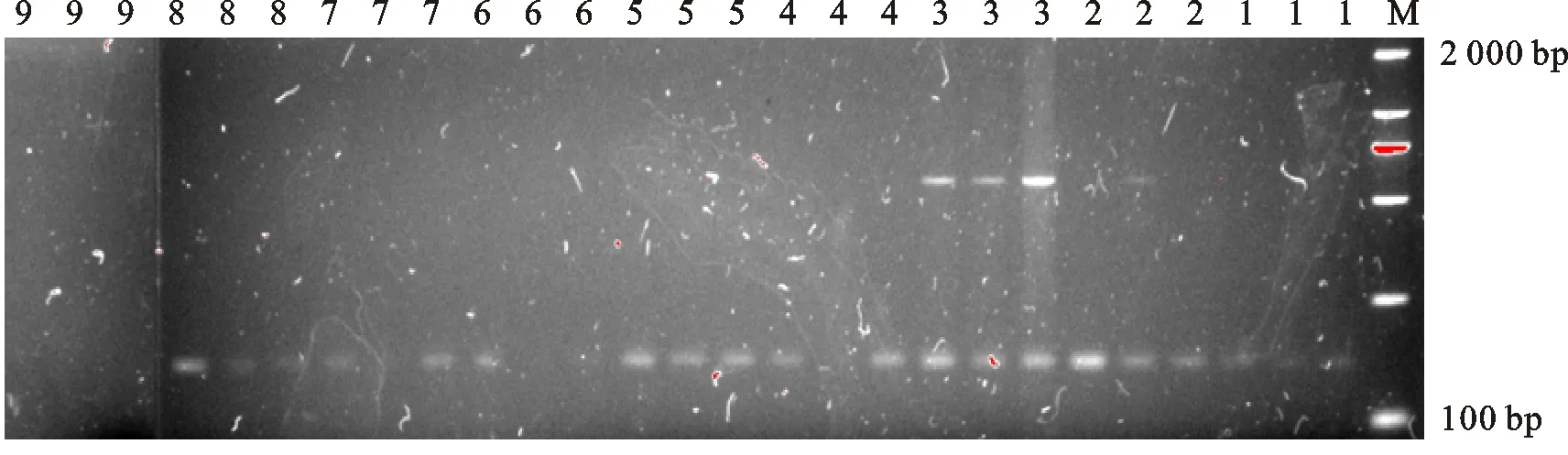
M. Maker;1~9. 正交试验各处理组合号,3次重复 Treatment 1-9 denoted in table 2,repeat three times
图2 正交试验SSR-PCR反应扩增结果
Fig.2 The amplified results of each treatment according to the orthogonal design
2.3 基因组DNA用量筛选
用模版100 ng、80 ng、60 ng、40 ng、20 ng 、10 ng 6个处理进行梯度试验,结果见图3,可以看出,不同的质量都能扩增到完整的条带,扩增效果在20~100 ng差异不明显,模版用量在10 ng时,扩增条带较弱。因此,从试验可靠性及经济性出发,选用体系模版用量为20 ng。

M. Maker; 1~6. 模版DNA用量分别是100 ng、80 ng、60 ng、40 ng、20 ng 、10 ng The amount of template DNA was 100 ng,80 ng,60 ng,40 ng,20 ng ,10 ng
图3 不同模版用量的PCR扩增
Fig.3 Result of PCR with different amount of DNA template
2.4 SSR-PCR反应体系稳定性检测和多态性标记筛选
2.4.1 SSR-PCR反应体系稳定性检测 随机选取8对SSR引物,分别为HpmsE008、HpmsE036、HpmsE056、HpmsE106、GP20095、GPMS 203、ES64、ES137, 以H0809和0599-1为模版,用最佳组合进行体系稳定性检测。结果如图4所示,选择的8 对引物均能扩增出清晰谱带,表明优化的辣椒SSR-PCR反应体系是稳定可靠的。
2.4.2 多态性标记筛选 以黄色线辣椒H0809及高代自交系0599-1为为材料,用筛选出的最佳SSR-PCR体系进行引物筛选(图5)。结果从420个SSR标记中,筛选出72对具有多态性、扩增质量好的标记。部分SSR标记的的多态性信息见表3。72对SSR标记在2份辣椒种质材料中共扩增出192个等位基因,平均每对引物能检测到2.67 个等位基因。
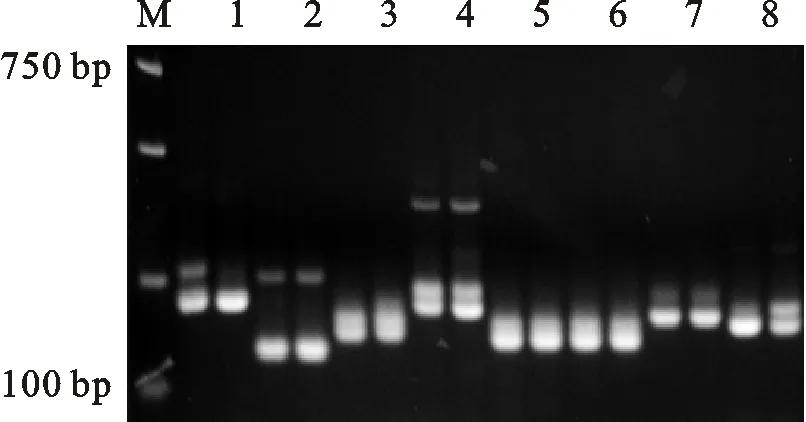
M. Maker;1~8.HpmsE008,HpmsE036,HpmsE056,HpmsE106,GP20095,GPMS 203,ES64,ES137
图4 最佳组合对8对SSR引物的扩增结果
Fig.4 Amplification effects of using 8 pairs of SSR primers with optimized SSR system
3 结论与讨论
随着辣椒基因组测序以及高通量测序技术的发展,基于全基因组开发的SSR标记及EST-SSR标记数量日益丰富。刘峰等[11]基于公共数据库开发出大量的SSR标记,并在品种鉴定及改良、资源分析、遗传图谱构建、功能基因发掘等方面得到广泛应用[15-17]。因此,建立稳定的SSR-PCR体系,是SSR标记技术在线辣椒开展相关研究的基础。

本研究对影响辣椒SSR反应的dNTPs、Mg2+、引物、TaqDNA聚合酶及模板DNA浓度等因素进行分析,确定出线辣椒SSR-PCR的最佳体系为:总体积20 μL,dNTP 100 μmol·L-1,引物0.6 μmol·L-1, Mg2+2.5 mmol·L-1,TaqDNA聚合酶1.5μmol以及基因组DNA 20 ng。 目前多数研究认为Mg2+浓度决定TaqDNA聚合酶的活性, 浓度过低时, 酶活力显著降低, 浓度过高则催化非特异片段的扩增[13-14]。本研究结果显示的Mg2+浓度对SSR- PCR 扩增的影响与上述结论一致。同时可以看出dNTP浓度在100~300 μmol·L-1时对反应体系影响不大。引物浓度是影响PCR 扩增的一个重要因素,引物浓度过高,容易产生非特异性扩增和高含量引物二聚体,还易引起碱基错配;引物浓度过低,则易产生拖尾现象和导致扩增产量下降[18],佟海申等[19]的研究发现引物浓度对扩增结果的影响最大,本试验结果未能反映出上述结论,可能与设计的引物浓度梯度差异不大有关,第9组合可能由于TaqDNA聚合酶浓度过低,没有扩增出条带。
本研究利用黄色线辣椒H0809和高代自交系0599-1对420对SSR标记进行筛选,结果显示,72对SSR标记具有多态性,扩增质量较好,多态性率为17.1%。相比较刘峰等[11]在辣椒中筛选的36.84%、苏辉等[20]在豆中筛选的37%的SSR标记多态性率,本试验相对偏低,推测可能与亲本材料的遗传距离相对较近有关系;同时平均每个标记扩增出2.67个等位基因,这跟罗玉娣等[21]平均每对SSR引物检测到2.6个,周晶等[22]平均每对引物可扩增出2. 66个等位基因变异的结果基本一致。但低于刘峰等[11]平均每对引物4.42个、何建文等[4]平均每对引物可检测3.8个等位基因。
本试验建立的辣椒的SSR-PCR体系,通过对部分SSR标记进行扩增,得到较为清晰、完整、可靠条带,说明该体系可以用于线辣椒SSR-PCR分析;通过筛选,得到的72对多态性标记为今后线辣椒种质资源分析、分子标记辅助选择、分子遗传图谱构建及相关基因克隆等奠定了基础。
Reference:
[1] NISHA J,PRASANTH V P,SONIYA E V,etal.Microsatellite based analysis of genetic diversity of popular black pepper genotypes in South India[J].Genetica,2011,139(8):1033-1043.
[2] RAI V P,KUMAR R,SINGH M,etal.Genetic diversity in capsicum germplasm based on microsatellite and random amplified microsatellite polymorphism markers[J].Physiology&MolecularBiologyofPlants,2013,19(4):575-586.
[3] 刘子记,李静婷,杨 衍,等.辣椒杂交种SSR 分子标记鉴定及表型比较分析[J].华北农学报,2014,29(1):69-72.
LIU Z J,LI J T,YANG Y,etal.SSR molecular markers identification of pepper hybrid and comparative analysis with phenotypes[J].ActaAgriculturaeBoreali-Sinica,2014,29(1):69-72(in Chinese with English abstract).
[4] 何建文,杨文鹏,姜 虹,等.贵州12个辣椒杂交种SSR标记指纹图谱的构建与分析[J].云南农业大学学报,2010,25(6):769-774.
HE J W,YANG W P,JIANG H,etal.Establishment and analyses of SSR marker fingerprints on 12Capsicumhybrids in Guizhou province[J].JournalofYunnanAgriculturalUniversity,2010,25(6):769-774(in Chinese with English abstract).
[5] 管俊娇, 黄清梅,张 鹏,等. 辣椒杂交种纯度鉴定的SSR核心引物筛选[J].农业科学与技术,2015,16(10):2155-2158,2230.
GUAN J J,HUANG Q M,ZHANG P,etal.Screening of SSR core primers for purity identification of pepper(Capsicum) hybrids[J].AgriculturalScience&Technology,2015,16(10):2155-2158,2230(in Chinese with English abstract).
[6] BARCHI L,LEFEBVRE V,SAGE-PALLOIX A M,etal.QTL analysis of plant development and fruit traits in pepper and performance of selective phenotyping[J].Theoretical&AppliedGeneticsTag,2009,118(6):1157-1171.
[7] MIMURA Y,INOUE T,MINAMIYAMA Y,etal.An SSR-based genetic map of pepper (CapsicumannuumL.) serves as an anchor for the alignment of major pepper maps[J].BreedingScience,2012,62(1):93-98.
[8] MINAMIYAMA Y,TSUR M,HIRAI M,etal.An SSR-based linkage map ofCapsicumannuumL.[J].MolecularBreeding,2006,18(2):157-169.
[9] 张 宇,张晓芬,陈 斌,等.与辣椒抗根结线虫基因Me1紧密连锁的EST-SSR标记开发[J].核农学报,2011,25(5):933-938.
ZHANG Y,ZHANG X F,CHEN B,etal.Development of EST-SSR makers linked to Me1,a nematodes resistance gene in pepper[J].JournalofNuclearAgriculturalSciences,2011,25(5):933-938(in Chinese with English abstract).
[10] SHIRASAWA K,ISHII K,KIM C,etal.Development of capsicum est-ssr markers for species identification and in silico mapping onto the tomato genome sequence[J].MolecularBreedingNewStrategiesinPlantImprovement,2013,31(1):101-110.
[11] 刘 峰,王运生,田雪亮,等.辣椒转录组SSR挖掘及其多态性分析[J].园艺学报,2012,39(1):168-174.
LIU F,WANG Y SH,TIAN X L,etal.SSR mining in pepper(CapsicumannuumL.)transcriptome and the polymorphism analysis[J].ActaHorticulturaeSinica,2012,39(1):168-174(in Chinese with English abstract).
[12] 徐小万,李 颖,王恒明.中国辣椒工业现状、发展趋势及对策[J].中国农学通报,2008,24(11):332-338.
XU X W,LI Y,WANG H M.Present situation,development trend and countermeasures of pepper industry in China[J].ChineseAgriculturalScienceBulletin,2008,24(11):332-338(in Chinese with English abstract).
[13] 胡勇胜,毛胜利,王立浩,等.辣椒SSR反应体系的优化[J].辣椒杂志,2007,5(2):36-40.
HU Y SH,MAO SH L,WANG L H,etal.Optimization of SSR system in pepper[J].JournalofChinaCapsicum,2007,5(2):36-40(in Chinese with English abstract).
[14] 杨迪菲,秦智伟,王桂玲.黄瓜SSR-PCR反应体系的优化[J].东北农业大学学报,2006,37(5):619-623.
YANG D F,QING ZH W,WANG G L.Optimization of SSR-PCR reaction system in cucumber[J].JournalofNortheastAgriculturalUniversity,2006,37(5):619-623(in Chinese with English abstract).
[15] YI G,LEE J M,LEE S,etal.Exploitation of pepper EST-SSRs and an SSR-based linkage map[J].TAGTheoreticalandAppliedGenetics,2006,114(1):113-130.
[16] PORTIS E,NAGY I,SASVARI Z,STAGEL A,etal.The design ofCapsicumspp.SSR assays via analysis of in silico DNA sequence,and their potential utility for genetic mapping[J].PlantScience,2007,172(3):640-648.
[17] YANG H B,LIU W Y,KANG W H,etal.Development of SNP markers linked to the L locus inCapsicumspp.by a comparative genetic analysis[J].MolecularBreeding,2009,24(4):433-446.
[18] SOBRAL B W S,HONEYCUTT R J.High output genetic mapping of polyploids using pcr-generated markers[J].Theoretical&AppliedGenetics,1993,86(1):105-112.
[19] 佟海申,宋 琳,张志刚,等.大白菜EST-SSR反应体系优化及引物筛选.科技导报,2010,28(3):76-81.
TONG H SH,SONG L,ZHANG ZH G,etal.Optimization of EST-SSR system on heading chinese cabbage and primer screening[J].Science&TechnologyReview,2010,28(3):76-81(in Chinese with English abstract).
[20] 苏 辉,李志刚,宋书宏.正交设计优化大豆SSRr-PCR反应体系及引物筛选[J].华北农学报,2009,24(2):99-102.
SU H,LI ZH G,SONG SH H.Optimization of SSR-PCR system on soybean by orthogonal design and SSR primer selection[J].ActaAgriculturalBoreali-Sinica,2009,24(2):99-102(in Chinese with English abstract).
[21] 罗玉娣,李建国,李明芳.用SSR标记分析辣椒属种质资源的遗传多样性[J].生物技术通报,2006(S1):337-341.
LUO Y D,LI J G,LI M F.Analysis of genetic diversity ofCapsicumgermplasmresources by using SSR markers[J].BiotechnologyBulletin,2006(S1):337-341(in Chinese with English abstract).
[22] 周 晶,沈火林,杨文才,等.辣椒遗传多样性的SSR分析[J].华北农学报,2009,24(8):62-67.
ZHOU J,SHEN H L,YANG W C,etal.Analysis of genetic diversity ofCapsicumgermplasmby using SSR markers[J].ActaAgriculturalBoreali-Sinica,2009,24(8):62-67(in Chinese with English abstract).
(责任编辑:成 敏 Responsible editor:CHENG Min)
Optimization of SSR-PCR Reaction System and Selection for Polymorphic Primers in Chili Pepper(Capsicumannuumvar.longunt).
LI Quanhui, LI Jiang, SHAO Dengkui, WANG Yayi, HOU Quangang and ZHONG Qiwen.
(Academy of Agriculture and Forestry,Qinghai University,Xining 810016,China)
In the study, the factors affecting the SSR-PCR results of pepper were studied with L9(34) orthogonal design, and the polymorphism of 420 primer pairs were screened by yellow pepper fruit mutant HJ2002 and high generation inbred 0599-1. The results showed that optimal reaction system was the total 20 μL reaction system containing 20 ng of DNA template, 100 μmol·L-1dNTP, 0.6 μmol·L-1primer, 2.5 mmol·L-1Mg2+and 1.5 μmol ofTaqDNA polymerase enzyme. All the 420 primer pairs were selected at random for yielding amplification products, of which 72 primer pairs showed polymorphism between two different pepper varieties. The polymorphism rate was 17.1% while the average alleles per locus was 2.67.This optimized SSR-PCR system and polymorphism primer could be applied for further research on germplasm analysis, molecular marker-assisted breeding, construction of molecular genetic linkage maps and gene cloning in chili pepper.
Capsicumannuumvar.longunt; SSR; System optimization; Primer screening
2016-10-23 Returned 2016-11-21
Middle Youth Foundation of the Academy of Agriculture and Forestry, Qinghai Province(No.2014-NKY-04); Genetics and Physiology Key Laboratory Project of Qinghai Province.
LI Quanhui,research assistant,doctoral student.Research area:genetic breeding and molecular biology in vegetable crop.E-mail:liquanhui_2008@163.com
日期:2017-06-29
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170629.1108.026.html
2016-10-23
2016-11-21
青海省农林科学院中青年基金(2014-NKY-04);青海省遗传与生理重点实验室项目。
李全辉,男,助理研究员,在职博士,研究方向为蔬菜作物遗传育种与分子生物学。E-mail:liquanhui_2008@163.com
S641.3
A
1004-1389(2017)07-1047-07

