梨树CDPK基因家族进化和表达分析
韩艳丽,李 静,操庆国,徐 银,颜志明,2
(1.江苏农林职业技术学院,江苏镇江 212400;2.江苏现代园艺技术中心,江苏镇江 212400)
梨树CDPK基因家族进化和表达分析
韩艳丽1,李 静1,操庆国1,徐 银1,颜志明1,2
(1.江苏农林职业技术学院,江苏镇江 212400;2.江苏现代园艺技术中心,江苏镇江 212400)
钙依赖蛋白激酶(CDPK或CPK)在植物生长和发育、逆境信号刺激及其对病原物的防御反应过程中发挥着非常重要的作用。本研究利用梨树全基因组数据,采用生物信息学的方法,在全基因组水平上对梨树CDPK基因家族进行系谱进化关系、基因结构、共线性关系及表达情况等分析。结果表明,梨树基因组中共存在31个CDPK基因,命名为 PbCDPK1 ~ PbCDPK31。系谱分析结果表明,这些CDPK基因归属于4个亚家族。共线性分析检测到12对CDKP基因间存在显著的共线性关系,其中10对由最近一次发生的全基因组复制事件形成。非同义/同义置换率的比率(dN/dS)说明CDPK基因在功能上进化得非常保守。荧光定量PCR结果发现,5个梨树CDPK基因对干旱逆境有响应。试验结果可为进一步开展梨树CDPK基因家族的功能鉴定和分子进化机制的研究提供参考。
梨树;CDPK基因;生物信息学;进化;干旱
植物的生长发育和作物产量往往受到外部逆境的影响,这些因素包括干旱、低温、高盐、病原体感染,微生物诱导等。植物体自身形成了一套复杂的信号网络途径来适应多变的外界环境[1]。钙离子(Ca2+)作为第二信使,在细胞信号转导途径中发挥重要作用[2]。在植物中,各种不同的内源和外部信号,如光照、激素、生物胁迫及非生物胁迫都会触发胞浆Ca2+浓度的变化。这些钙信号被不同Ca2+传感器分子传导到下游的信号级联反应,如目标蛋白磷酸化等。钙依赖蛋白激酶(CDPK或CPK)是植物中研究最为深入和广泛的Ca2+传感器之一。到目前为止,已经在植物界(从绿藻到显花植物)以及原生生物中都发现了CDPK。CDPK蛋白包含一个N-端可变区域、有催化活性的蛋白激酶区、自抑制区以及包含EF-hand模块(结合Ca2+)的CaM区[3]。CDPK独特的结构使它同时具备Ca2+感应器和效应器的功能。CDPK通过解除其自抑制的机制使其具有活性。
大量研究表明,CDPK在植物的生长和发育、环境信号刺激及其对病原物的防御反应过程中发挥着非常重要的作用。拟南芥AtCPK1的过量表达显著提高了NADPH氧化酶活性[4],激活苯丙氨酸氨基水解酶PAL(Phenylalanine ammonialyase),导致水杨酸(SA)的积累[5]。AtCPK5能激活呼吸氧化酶同系物D(RBOHD)[6],从而诱导活性氧(ROS)爆发。 AtCPK4/11/23通过调控K+通道提高植物的抗盐性[7]。CDPKs也在激素(如ABA、MeJA和乙烯等)信号传导中起着重要作用[8-9]。此外,一些CDPK基因还参与植物根部发育和花粉管生长[10-11]。编码CDPK的基因以多基因家族的形式存在,目前,在拟南芥基因组中共发现32个CDPK基因成员[12],水稻中检测到31个CDPK基因成员[13]。
梨树在世界果树生产中占有重要的位置,具有很高的经济价值。梨树全基因组序列虽已公布,但梨树CDPK基因家族的系统分析还未见报道,CDPK响应非生物胁迫的研究处于起步阶段。本研究在全基因组水平上识别和分析梨树CDPK基因家族,对其进行系谱发生、共线性和表达特性等方面的分析,以期为进一步开展梨树CDPK基因家族的基因功能和分子进化机制的研究奠定理论基础。
1 材料与方法
1.1 植物材料
供试材料为‘砀山酥梨’幼苗,由江苏农林职业技术学院保存,挑选长势一致的无菌植株移至霍格兰培养液培养7 d进行缓苗。将幼苗置于滤纸上,对植物材料进行干旱处理,分别在0、2、4和8 h后收集叶片于液氮速冻,用于RNA提取和基因表达分析。每个时间点设3个生物学重复。
1.2 数据收集和搜索
从Pear Genome Project(http://peargenome.njau.edu.cn)下载梨(Pyrusbretschneideri)全基因组的注释序列。从Pfam数据库(http://www.sanger.ac.uk/Software/Pfam/)中下载kinase(PF00069)和EF-hand(PF13499)结构域的隐马可夫模型(HMM)。用HMMER3(http://hmmer.janelia.org/)软件包以隐马可夫模型对梨树基因组进行搜索,所用选项为“cut_ga”。得到的基因提交到InterProScan(http://www.ebi.ac.uk/interpro/search/sequence-search)搜索结构域进行验证。
1.3 系谱发生分析
以CDPK基因的全长氨基酸序列作多序列联配,所用软件为MUSCLE[14],参数使用默认值。根据多序列比对的结果,使用MEGA6构建系统发生树,所用算法为邻近法(neighbor joining,NJ),对构建的树进行自举检验,重复设为1 000。
1.4 共线性检测和dN/dS估算
对CDPK各成员间进行共线性检测,所用软件为MicroSyn[15]。采用该软件检测各基因所在基因组区段之间同源基因在数量和顺序上的保守程度。使用PAML软件包的codeml程序[16]进行计算。同义置换率 dS(synonymous)和非同义置换率 dN(nonsynonymous)
1.5 荧光定量PCR
利用CTAB法提取梨叶片的总RNA,利用PrimeScript○RRT reagent Kit反转录cDNA。运用软件Beacon Designer 7.0对全长CDPK基因特异的区域设计引物(表1)。常用的看家基因(actin,GenBank登录号 GU830958)作为荧光定量PCR(qPCR)的内参基因。反应程序为:预变性4 min,95 ℃;变性40 s,95 ℃;退火20 s,60 ℃;延伸30 s,72 ℃;38个循环;熔解曲线温度为65~95 ℃,反应程序为15 s,94 ℃,1 min,60 ℃,15 s,95 ℃。所有的反应重复3次。以0 h收集的叶片作为对照,根据2-ΔΔCt的方法分别计算干旱处理2 h、4 h、8 h样品中各基因的相对表达量。

表1 实时荧光PCR引物序列Table 1 Primer sequence for real-time PCR analysis
2 结果与分析
2.1 梨树中CDPK基因的鉴定
本研究以Ser/Thr蛋白激酶区和EF-hand模块的HMM在梨全基因组蛋白序列中进行搜索,并用InterProScan对蛋白的结构进行验证,共获得31个梨树CDPK基因。根据基因与HMM相似性的大小,将这些CDPK基因命名为 PbCDPK1 ~ PbCDPK31(表2)。
2.2 系谱发生分析
为了考察CDPK基因家族在梨树中的系谱发生关系,在多序列联配的基础上,以NJ法构建CDPK基因家族的系谱发生树。为了更好地对梨树CDPK基因家族进行分类,以31个梨树CDPK基因和32个拟南芥CDPK基因作联合系谱发生树(图1)。根据自举值的大小(一般>50%)和拟南芥CDPK基因的分类信息,将梨树CDPK基因分为4个亚家族,分别命名为Ⅰ、Ⅱ、Ⅲ和Ⅳ。亚家族Ⅰ中含有12个CDPK基因,亚家族Ⅱ具有5个成员,亚家族Ⅲ存在12个CDPK基因,而亚家族Ⅳ中只存在2个基因。

表2 梨树CDPK基因家族成员基本信息Table 2 Characteristics of CDPK genes in pear
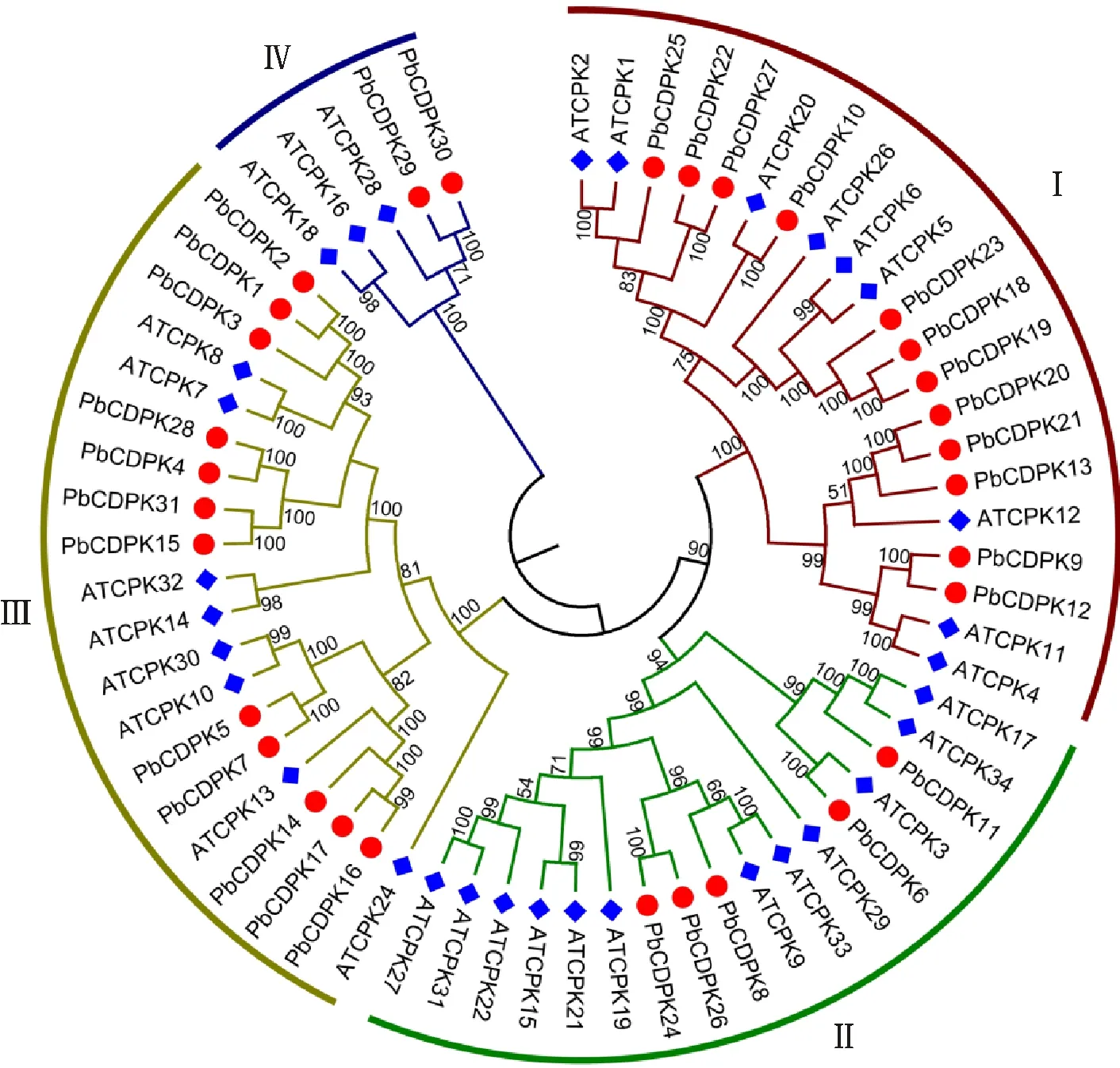
图1 梨树和拟南芥中CDPK蛋白的联合系谱发生树Fig.1 Joined phylogenetic tree of CDPK proteins in pear and Arabidopsis
2.3CDPK基因外显子/内含子结构
梨树CDPK基因内含子数目为6、7、9和11个。在进化树中,亲缘关系靠近的成员具有相同的内含子数目和相位(图2)。亚家族Ⅰ包括12个梨树基因,其中9个基因具有6个内含子,并且内含子的相位相同。值得注意的是,亚家族Ⅰ中有3个基因无含子插入,这种无内含子的CDPK只在蔷薇科植物中发现,可能蔷薇科植物中CDPK基因发生了内含子的丢失事件。所有亚家族Ⅱ中的梨树CDPK基因均由7个内含子组成,并且内含子相位相同。亚家族Ⅲ中除了3个基因外,均具有7个内含子。亚家族Ⅳ中2个梨树CDPK基因的内含子数目最多,为11个。各个亚家族成员内含子数目和插入相位的保守性说明基因结构在各亚家族内的保守性。

梨树和拟南芥CDPK基因按图1进化树中的顺序排列CDPKgenes on the left was arranged in Fig. 1;外显子以方形表示,连接外显子的线则表示内含子 Exon is represented by box and line connecting two exons represents an intron;黑色方形表示蛋白激酶结构域 Protein kinase domain was marked by black color
图2 梨树CDPK基因内含子-外显子
Fig.2 Schematic representations of exon-intron compositions ofCDPKgenes in pear andArabidopsis
2.4 共线性分析
由基因组或基因组片段复制导致的同源基因,不仅表现为基因序列具有相似性,而且其染色体上相邻基因的排列序列具有很高的一致性。这种基因排列的保守性称为共线性。本研究利用MircoSyn软件对31个CDPK基因的基因组区段之间进行共线性分析。结果表明,在梨树基因组内,12对CDKP基因间存在显著的共线性关系(表3)。为了估算CDPK基因间复制事件发生的大致时间,笔者考查了CDPK基因间共线性区段内同源基因的平均同义置换率。结果发现,10对CDPK基因共线性区段间的dS在0.06~0.38 的范围内(表3),而有2对基因间的dS值大于0.57。非同义/同义置换率的比率(dN/dS)可在蛋白水平上度量选择压力。12对存在共线性关系的CDKP基因对的dN/dS均远小于1,说明CDPK基因在进化上非常保守,氨基酸在纯化选择(负选择)压力下保守地突变。
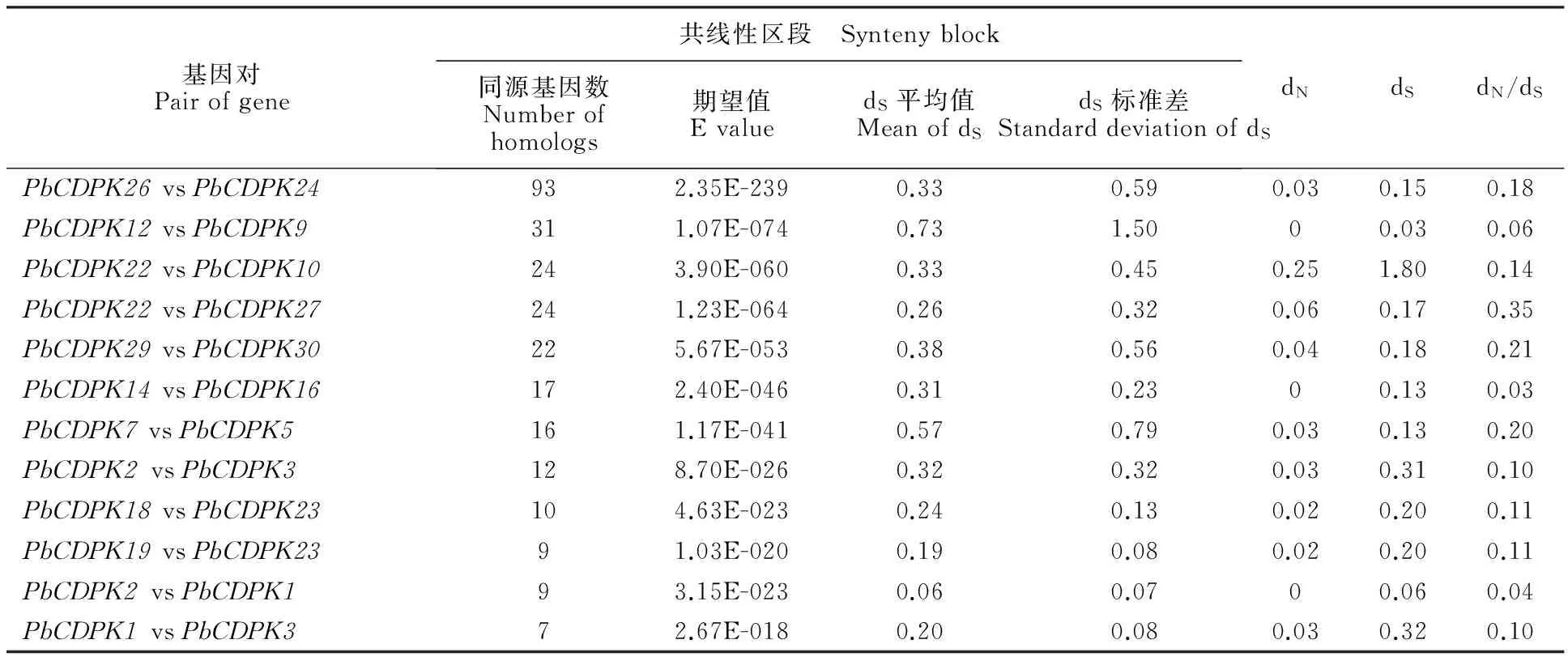
表3 梨树各CDPK基因之间的共线性关系及非同义置换率(dN)和同义置换率(dS)Table 3 Synteny related to genes in CDPK gene family in pear
2.5 表达分析
通过对拟南芥中同源基因的功能以及梨树CDPK基因的进化分析后发现, PbCDPK10、 PbCDPK22、 PbCDPK27、 PbCDPK5和 PbCDPK7很可能与梨树逆境信号转导有关(见讨论)。选取这5个CDPK基因,通过qPCR技术考查它们在表达水平上是否响应干旱逆境。结果发现,干旱处理能显著影响这5个基因的表达,并具有类似的表达模式(图3)。干旱处理2~4 h,每个基因的表达开始上升,但没有显著的变化,在处理8 h后表达水平显著高于对照,最高为处理的8.7倍。
3 讨 论
CDPK蛋白由多基因家族编码,广泛存在于植物中。本研究在梨基因组中共发现31个CDPK基因。在目前已测序的蔷薇科植物中,草莓、桃和苹果中分别存在15、15和26个CDPK基因。梨树和苹果中的CDPK基因数目接近,是草莓和桃的2倍左右。据报道,在显花植物中,物种特异性的全基因组复制事件通常导致基因家族成员数目在不同物种间的差异[17]。在蔷薇科植物中,梨树和苹果树的基因组比草莓和桃多发生了一次全基因组复制[18]。这个复制事件很可能是导致梨树和苹果树中CDPK基因家族数目增加的主要原因。
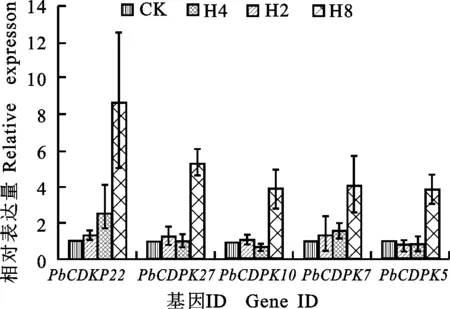
H2、H4和H8分别表示脱水处理2、4和8 h H2, H4, and H8, dehydrated for 2, 4, 8 h;对照(CK)的表达量标准化为1 Expression of control (CK) was normalized to 1
图3 定量 RT-PCR 表达分析5个梨树CDPK基因在转录水平上对干旱处理的响应
Fig.3 Quantitative RT-PCR analysis of 5PbCDPKgenes expression response to drought stress
为了初步推测梨树CDPK基因的功能,把梨树31个CDPK基因和拟南芥的32个CDPK基因作联合系谱发生树分析。通过进化树的构建,可以分析分子之间的起源关系,预测分子的功能。同一亚家族或小的分枝往往具有相似的功能。另外,据报道,在梨树基因组序列中保留了发生2次全基因组复制的证据,一次为“古代六倍体化”事件(大约140百万年前)和最近一次发生的全基因组复制事件(30~45百万年前)。通过分析CDPK基因所在染色体区段内的共线性,可以推测这些基因的起源及复制时间等特性。在梨树基因组内,在10对存在显著的共线性关系的CDKP基因间,其共线性区段间同义置换率较小(0.06~0.38),很可能由最近一次发生的全基因组复制事件形成,而另外2对CDPK基因共线性区段间的dS较大,说明它可能起源于较古老的“古代六倍体化”基因组复制事件。
据报道,在拟南芥32个CDPK成员和31个水稻CDPK成员中,多数CDPK与逆境信号转导有关[19]。Sheen[20]发现,在干旱和盐诱导条件下,拟南芥AtCPK1和AtCPK2的表达量显著增加,而拟南芥 AtCPK10和 AtCPK30参与了对ABA和非生物胁迫的信号转导。本研究中发现,在梨树和拟南芥CDPK的进化树中,AtCPK1和AtCPK2为1对直系同源基因,和AtCPK1和AtCPK2最同源的梨树基因为 PbCDPK10、 PbCDPK22和 PbCDPK27。而这3个梨树CDPK基因由最近发生的一次全基因组形成,基因间的dN/dS均远小于1,说明它们在纯化选择压力下进化得非常保守。 AtCPK10和 AtCPK30也为1对直系同源基因,而 PbCDPK5和 PbCDPK7跟 AtCPK10和 AtCPK30的亲缘关系最近,它们也是由最近发生的一次全基因组复制形成,并且基因间的dN/dS均远小于1。这些证据表明 PbCDPK10、 PbCDPK22和 PbCDPK27以及 PbCDPK5和 PbCDPK7很可能与梨树逆境信号转导有关。qPCR试验结果发现,在干旱处理8 h后,这5个基因的表达量显著提高,说明通过系谱发生树、共线性和选择压等分析推测的CDPK基因的功能和试验结果较为一致。
4 结 论
在梨树基因组中共存在31个CDPK基因,归属于4个亚家族。在梨树基因组内,12对CDKP基因间存在显著的共线性关系,其中10对由最近一次发生的全基因组复制事件形成,而另外2对CDPK基因可能起源于较古老的“古代六倍体化”基因组复制事件。梨树CDPK基因在功能上进化得非常保守。通过系谱发生树、共线性和选择压等分析推测 PbCDPK10、 PbCDPK22、 PbCDPK27、 PbCDPK5和 PbCDPK7可能与梨树逆境信号转导有关。qPCR试验在表达水平上表明这5个梨树CDPK基因对干旱逆境有响应。本试验结果可为进一步开展梨树CDPK基因家族的功能鉴定和分子进化机制的研究提供参考。
Reference:
[1] XIONG L,SCHUMAKER K S,ZHU J K.Cell signaling during cold,drought,and salt stress[J].PlantCell,2002,14(Suppl):165-183.
[2] SANDER S D,BROWNL E E,CHARPER J F.Communicating with calcium[J].PlantCell,1999,11(4):691-706.
[3] KLIMECK A M,MUSZYNSK A G.Structure and functions of plant calcium-dependent protein kinases [J].ActaBiochimicaPolonica,2007,54(2):219-233.
[4] XING T,WANG X J,MALIK K,etal.Ectopic expression of anArabidopsiscalmodulin-like domain protein kinase-enhanced NADPH oxidase activity and oxidative burst in tomato protoplasts[J].MolecularPlant-MicrobeInteractions,2001,14(10):1261-1264.
[5] COCA M,SAN SEGUNDO B.AtCPK1 calcium-dependent protein kinase mediates pathogen resistance inArabidopsis[J].PlantJournal,2010,63(3):526-540.
[6] DUBIELLA U,SEYBOLD H,DURIAN G,etal.Calcium-dependent protein kinase/NADPH oxidase activation circuit is required for rapid defense signal propagation[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2013,110(21):8744-8749.
[7] MA S Y,WU W H.AtCPK23 functions inArabidopsisresponses to drought and salt stresses [J].PlantMolecularBiology,2007,65(4):511-518.
[8] ZHAO R,SUN H L,MEI C,etal.TheArabidopsisCa2+-dependent protein kinase CPK12 negatively regulates abscisic acid signaling in seed germination and post-germination growth[J].NewPhytologist,2011,192(1):61-73.
[9] MUNEMASA S,HOSSAIN M A,NAKAMURA Y,etal.TheArabidopsiscalcium-dependent protein kinase,CPK6,functions as a positive regulator of methyl jasmonate signaling in guard cells[J].PlantPhysiology,2011,155(1):553-561.
[10] ESTRUCH J J,KADWELL S,MERLIN E,etal.Cloning and characterization of a maize pollen-specific calcium-dependent calmodulin-independent protein kinase [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1994,91(19):8837-8841.
[11] IVASHUTA S,LIU J,LOHAR D P,etal.RNA interference identifies a calcium-dependent protein kinase involved inMedicagotruncatularoot development[J].PlantCell,2005,17(11):2911-2921.
[12] HRABAK E M,CHAN C W,GRIBSKOV M,etal.TheArabidopsisCDPK-SnRK superfamily of protein kinases[J].PlantPhysiology,2003,132(2):666-680.
[13] RAY S,AGARWAL P,ARORA R,etal.Expression analysis of calcium-dependent protein kinase gene family during reproductive development and abiotic stress conditions in rice (OryzasativaL.spp.indica) [J].MolecularGeneticsandGenomics,2007,278(5):493-505.
[14] EDGAR R C.MUSCLE:a multiple sequence alignment method with reduced time and space complexity[J].BMCBioinformatics,2004,19(5):113.
[15] CAI B,YANG X,TUSKAN G A,etal.MicroSyn:a user friendly tool for detection of microsynteny in a gene family[J].BMCBioinformatics,2011,12(1):79.
[16] YANG Z.PAML:a program package for phylogenetic analysis by maximum likelihood [J].ComputerApplicationsintheBiosciences,1997,13(5):555-556.
[17] CANNON S B,MITRA A,BAUMGARTEN A,etal.The roles of segmental and tandem gene duplication in the evolution of large gene families inArabidopsisthaliana[J].BMCPlantBiology,2004,20(3):116-124.
[18] WU J,WANG Z,SHI Z,etal.The genome of the pear (PyrusbretschneideriRehd.) [J].GenomeResearch,2013,23(2):396-408.
[19] HARPER J F,BRETON G A.Decoding Ca2+signals through plant protein kinases [J].AnnualReviewofPlantBiology,2004,55(1):263-288.
[20] SHEEN J.Ca2+-dependent protein kinases and stress signal transduction in plants[J].Science,1996,274(5294):1900-1902.
(责任编辑:潘学燕 Responsible editor:PAN Xueyan)
Evolution and Expression Analysis ofCDPKGene Family in Pear (Pyrusspp.).
HAN Yanli1,LI Jing1,CAO Qingguo1,XU Yin1and YAN Zhiming1,2.
(1.Jiangsu Polytechnical College of Agriculture and Forestry,Zhenjiang Jiangsu 212400, China; 2.Jiangsu Engineering and Technology Center for Modern Horticulture,Zhenjiang Jiangsu 212400,China)
Calcium-dependent protein kinase (CDPK or CPK) plays important roles in plant growth and development, stress response, and immune and defense signaling, etc. This study aims to provide valuable foundation for further study of biological function and evolutionary relationship in this family. Bioinformatic method was used to comprehensively analyze phylogenetic relationship, synteny relationship and expression pattern ofCDPKgene family in pear (Pyrusspp.).A total of 31CDPKgenes were identified in pear, namely PbCDPK1- PbCDPK31, and they were phylogenetically clustered into 4 subfamilies. The synteny relationship showed that significant synteny relationship were detected within 12CDPKgene pairs, of which 10 were evolved form the recent whole genome duplication event. Purifying selection also played a critical role in the function evolution ofCDPKfamily genes through nosynonymous/synonymous substitution analysis. FiveCDPKgenes responded to drought stress based on the quantitative real-time RT-PCR (qPCR). The results of this study might lay a significant foundation for further studies on the gene functions and molecular evolutionary mechanism ofCDPKgene family in pear.
Pear (Pyrusspp.);CDPKgene; Bioinformatics; Evolution; Drought
2016-03-30 Returned 2016-05-20
Jiangsu Natural Science Foundation(No.BK20131243); Jiangsu Sanxin(Three New)Agricultural Project(No.SXGC[2015]311); Qinglan Project of Jiangsu Province.
HAN Yanli, female, master. Research area:fruit molecular biology.E-mail:45600134@qq.com
日期:2017-06-29
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170629.1108.020.html
2016-03-30
2016-05-20
江苏省自然科学基金(BK20131243);江苏省农业三新工程(SXGC[2015]311);江苏省青蓝工程。
韩艳丽,女,硕士研究生,研究方向为果树分子生物学。E-mail: 45600134@qq.com
S661.2
A
1004-1389(2017)07-1026-07
——以多重共线性内容为例

