山楂叶原花青素对肿瘤坏死因子—α诱导人脐静脉内皮细胞细胞间黏附分子—1和E—选择素过表达的影响
李澎 王建农 许勇刚 付建华 刘建勋
摘要:目的 观察山楂叶原花青素对肿瘤坏死因子-α(TNF-α)诱导的人脐静脉内皮细胞细胞间黏附分子-1(ICAM-1)和E-选择素过表达的影响,探讨其抗炎作用的机制。方法 体外培养人脐静脉内皮细胞。MTT法检测细胞活力,流式细胞术检测ICAM-1和E-选择素的表达。结果 山楂叶原花青素浓度≤200 mg/L时,对细胞活力无明显影响;模型组人脐静脉内皮细胞ICAM-1和E-选择素表达较正常组显著升高,10、20、30、40、50 mg/L山楂叶原花青素浓度依赖地抑制ICAM-1和E-选择素的表达升高,其中40、50 mg/L组较模型组差异有统计学意义。结论 山楂叶原花青素能够抑制TNF-α诱导的血管内皮细胞ICAM-1和E-选择素的过表达,这可能与其抗炎作用相关。
关键词:山楂叶;原花青素;血管内皮细胞;肿瘤坏死因子-α;细胞间黏附分子-1;E-选择素
DOI:10.3969/j.issn.1005-5304.2017.08.012
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2017)08-0050-04
Effects of Hawthorn Leaf Procyanidins on Over Expressions of ICAM-1 and E-selectin in Human Umbilical Vein Endothelial Cells Induced by TNF-α LI Peng, WANG Jian-nong, XU Yong-gang, FU Jian-hua, LIU Jian-xun (Xiyuan Hospital, China Academy of Chinese Medical Sciences, Beijing 100091, China)
Abstract: Objective To observe the effects of hawthorn leaf procyanidins (HLP) on over expressions of ICAM-1 and E-selectin in human umbilical vein endothelial cells (HUVEC) induced by TNF-α,and clarify the mechanism of HLPs anti-inflammation effect. Methods HUVEC were cultured in vitro. MTT assay was used to detect cell viabilities. The expressions of ICAM-1 and E-selectin in HUVEC were detected by flowcytometry. Results Up to 200 mg/L, HLP showed no significant decrease in cell viabilities; the expression levels of ICAM-1 and E-selectin in the model group significantly increased, compared with that in the normal group; 10, 20, 30, 40, 50 mg/L HLP inhibited the expression elevations of ICAM-1 and E-selectin in concentration-dependent manner; and there were statistical significances in 40, 50 mg/L HLP groups, compared with the model group. Conclusion HLP can inhibit the over expressions of ICAM-1 and E-selectin of vascular endothelial cells induced by TNF-α, which possibly underlies HLPs anti-inflammation effect.
Key words: hawthorn leaf; procyanidins; vascular endothelial cell; TNF-α; ICAM-1; E-selectin
過度的炎症反应是动脉粥样硬化、缺血性心脏病、中风、感染性休克等疾病发展、恶化乃至造成死亡的关键病理环节。因此,抑制炎症发生、阻断炎症反应过程,对于这些重大难治疾病的治疗具有重要意义。山楂叶具有活血化瘀、降脂消浊的功效。原花青素是山楂叶的重要活性成分,约占山楂叶黄酮类物质
基金项目:国家自然科学基金(81274196);北京市自然科学基金(7092089)
通讯作者:付建华,E-mail:jianhuaffcn@263.net
总量的20%。有研究显示,原花青素可抑制炎症细胞的激活、降低炎症因子的释放,还可以直接对抗氧自由基、氮过氧化物等炎症毒素对细胞的杀伤[1-2]。我们前期研究显示,富含原花青素的山楂叶提取物能抑制缺氧复氧诱导的白细胞与内皮细胞的黏附,降低白细胞黏附分子的表达[3]。但是,山楂叶原花青素对炎性反应中血管内皮细胞黏附分子表达的影响尚缺乏研究。本实验以肿瘤坏死因子-α(TNF-α)刺激人脐静脉内皮细胞,观察山楂叶原花青素对内皮细胞2种经典黏附分子,即细胞间黏附分子-1(ICAM-1)和E-选择素过表达的影响,探讨其抗炎作用的机制。
1 实验材料
1.1 脐带
剖腹产健康婴儿无菌脐带,购自北京市海淀区妇幼保健院。
1.2 药物及制备
山楂叶原花青素,本院实验中心参照文献[4]方法制备。6倍体积60%乙醇加热山楂叶1 h,过滤,取滤液,回收至无醇味。经AB8树脂吸附,水洗至清。70%乙醇洗脱树脂至无色,收集洗出液,回收至无醇味。加氯仿萃取2次,去除叶绿素,聚酰胺吸附,烘干。
1.3 試剂
原花青素标准品(纯度>95%,沃玛特公司,4852-22-6),Ⅰ型胶原酶(Gibco公司,17100-017),胰酶(Amesco公司,0458),内皮细胞培养基(M200-500)及其添加物(S003-10),Cascade公司。重组人TNF-α(CytoLab公司,300-01A),藻红蛋白(PE)标记小鼠单克隆抗人ICAM-1荧光抗体(BD公司,347977),异硫氰酸荧光素(FITC)标记小鼠单克隆抗人E-选择素荧光抗体(R&D;公司,BBA21),PE标记小鼠IgG2a(BD公司,349053),FITC标记小鼠IgG1(R&D;公司,IC002F)。
1.4 仪器
Synergy 4多功能酶标仪,Biotek公司;Navios流式细胞检测仪,Beckman Coulter公司。
2 实验方法
2.1 山楂叶原花青素纯度测定
采用香草醛法,参照文献[5]方法进行。
2.2 人脐静脉内皮细胞的培养与鉴定
将内皮细胞培养添加物按1∶50的比例加入内皮细胞培养基,并加入青霉素和链霉素(终浓度分别为100 U/L和100 μg/L),配制成完全内皮细胞培养基。取婴儿脐带,长约20 cm。PBS洗净血迹,从脐静脉上端插入剪去针尖的12号针头,以止血钳固定。通过针头向脐静脉内注入PBS,冲洗3遍,洗净残血。以另一止血钳夹闭脐静脉下端,向脐静脉内注入以DMEM培养基配制的0.1%Ⅰ型胶原酶,取出针头,夹闭脐静脉上端。37 ℃消化15 min。收集脐静脉内的消化液,PBS冲洗2~3遍,将流出液体与消化液合并,1500 r/min离心10 min,取沉淀。加入完全内皮细胞培养基,每条脐带所得细胞约加5 mL。将细胞吹打均匀,加入培养瓶内,37 ℃、5%CO2培养。当细胞生长至80%融合时,进行传代。PBS冲洗3遍,0.25%胰酶37 ℃消化5 min,收集细胞,1∶3传代。实验使用第3代细胞。免疫荧光检测血小板Ⅷ因子表达。
2.3 人脐静脉内皮细胞活力检测
细胞完全融合生长后,弃去培养基,PBS洗3遍。加入含有药物的完全内皮细胞培养基,继续培养。药物以DMSO溶解,按1∶1000比例加入培养基内。正常组给予含0.1 mL/L DMSO的培养基。24 h后弃去培养基,PBS洗3遍,培养板内加入1 g/L PBS配制的MTT溶液,继续培养4 h;弃去MTT液,培养板内加入DMSO,室温放置15 min,于波长490 nm处测定吸光度(OD)。
2.4 造模和给药
待细胞长满培养皿后,弃去培养基,PBS冲洗3遍。加入含有药物的完全内皮细胞培养基,继续培养1 h。药物以DMSO溶解,按1∶1000比例加入培养基内。正常组和模型组给予含1 mL/L DMSO的培养基。之后,模型组和给药组按1∶1000比例向培养基内加入PBS配制的重组人TNF-α(终浓度10 μg/L),正常组给予等量PBS。继续培养4 h。
2.5 细胞间黏附分子-1和E-选择素检测
弃去培养基,PBS洗3遍,0.01%胰酶-0.02%EDTA消化10 min。胎牛血清终止消化,收集细胞,PBS洗3次。4 ℃、1500 r/min离心10 min,弃去上清液,加入10 μL PBS,吹打均匀,平均分作2份。一份加入5 μL抗ICAM-1抗体和5 μL抗E-选择素抗体,另一份加入5 μL PE标记小鼠IgG2a和10 μL FITC标记小鼠IgG1,作为同型对照。4 ℃、避光孵育30 min。4 ℃、1500 r/min离心10 min,弃去上清液,PBS洗1次。收集细胞,每份细胞加入25 μL多聚甲醛固定15 min,加入250 μL PBS,4 ℃避光保存,24 h内测定。流式细胞术测定PE和FITC荧光强度,以同型对照调定检测范围。各样本荧光强度=测定管荧光强度-同型对照管荧光强度。每次实验每组只作1个样本,以对模型的表达抑制率(1-给药组样本荧光强度÷同次实验模型样本荧光强度)衡量药效。
3 统计学方法
采用SPSS16.0统计软件进行分析。实验数据以—x±s表示,组间比较用方差分析或Kolmogorov-Smirnov Test检验。P<0.05表示差异有统计学意义。
4 结果
4.1 山楂叶原花青素的纯度测定
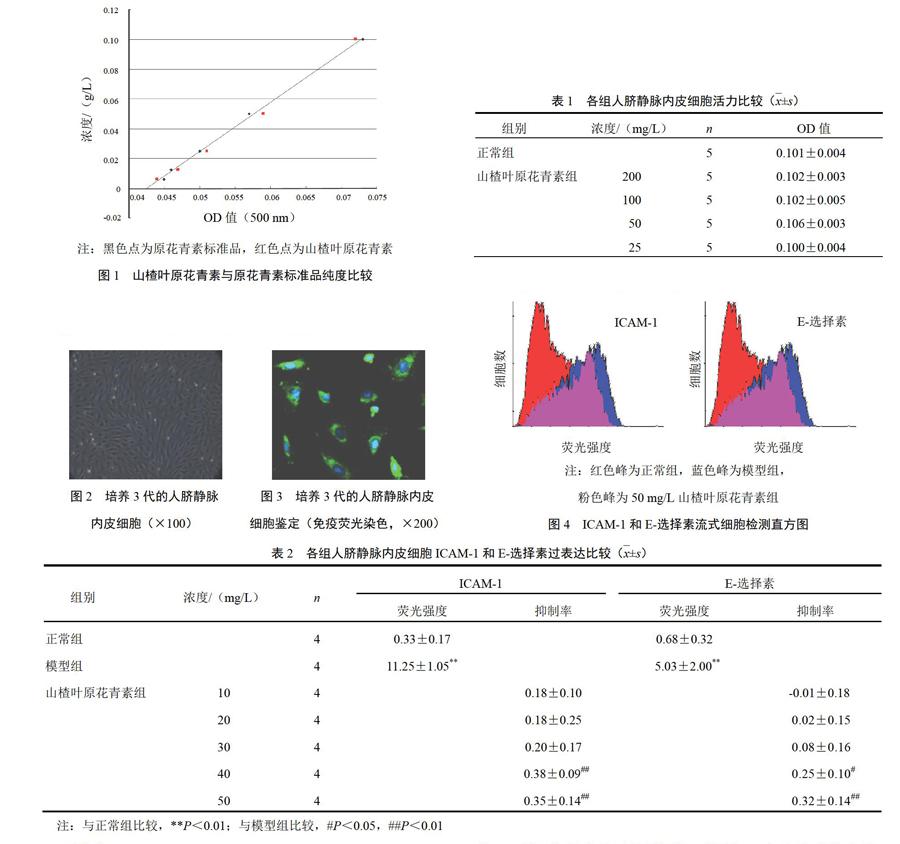
0.006 25~0.1 g/L浓度范围内,标准品浓度与OD值呈良好的线性相关。回归方程为原花青素浓度(g/L)=3.306 3×OD值-0.140 6,r2=0.998 3;山楂叶原花青素样品的测定点分布在标准品曲线的附近,表明其纯度与标准品相近或稍高。见图1。
注:黑色点为原花青素标准品,红色点为山楂叶原花青素
图1 山楂叶原花青素与原花青素标准品纯度比较
4.2 人脐静脉内皮细胞的培养与鉴定结果
培养的内皮细胞成梭形、卵圆形或多角形,融合生长时呈青石子铺路状,见图2。抗血小板Ⅷ因子免疫荧光染色均为阳性,阳性表达部位在胞浆,呈绿色;细胞核以DAPI染色呈蓝色,见图3。
4.3 山楂叶原花青素对人脐静脉内皮细胞活力的影响
与正常组比较,山楂叶原花青素25、50、100、200 mg/L组人脐静脉内皮细胞活力无明显差异,见表1。
4.4 山楂叶原花青素对肿瘤坏死因子-α诱导的人脐静脉内皮细胞细胞间黏附分子-1和E-选择素过表达的影响
与正常组比较,模型组ICAM-1、E-选择素荧光强度明显升高(P<0.01);与模型组比较,山楂叶原花青素各浓度均可抑制ICAM-1、E-选择素的表达升高,其中40、50 mg/L原花青素差异有统计学意义(P<0.05,P<0.01),見图4、表2。
5 讨论
炎症是一种极其重要的病理过程。它是有血管生物体对损伤因素做出的一种非特异性的反应,其主要表现为实质器官细胞的变性和死亡、血液成分和血细胞的渗出及炎性、组织间质细胞的增生。一方面,炎症反应有助于清除感染病原体以及损伤、死亡的细胞,对机体具有有利的影响;但是,过于强烈的炎症反应会波及那些原本正常的组织,使其出现严重的水肿、缺血缺氧和代谢障碍,并大量杀伤那些原本未出现损伤的细胞,从而导致严重的附加伤害[6]。
白细胞等炎症细胞黏附于血管内皮是炎症反应中最为关键的一环,它是炎症诱发一系列严重损伤的必要前提。白细胞黏附会阻塞微血管,阻碍乃至终断血流供应,还会影响血液回流,造成组织水肿;黏附的白细胞渗入组织深处,释放氧自由基、毒性细胞因子、水解酶等,直接导致细胞的变性与死亡及组织基质的崩解。白细胞黏附于血管内皮细胞依赖于它们各自表面的黏附分子,这些黏附分子通过受体配基样作用相互结合,介导白细胞的黏附。
ICAM-1和E-选择素是血管内皮细胞表达2个最重要的黏附分子。前者属于免疫球蛋白超家族,通过与白细胞上整合素分子(包括CD11、CD18等)相作用,使白细胞与血管内皮细胞产生牢固的结合。而后者属于选择素家族,与白细胞的E-选择素配基相作用,介导黏附的早期过程,如白细胞与内皮细胞的接触及白细胞在内皮细胞上的滚动等。它们的表达主要受到炎性细胞因子的调控,TNF-α、白细胞介素-1等均具有很强的诱生作用。
山楂叶的主要活性成分是黄酮和原花青素。黄酮含量较高,约占提取物总量的80%,余下部分为原花青素。WS?1442为德国开发的一种山楂叶制剂,在当今临床上得到广泛的应用。对其抗心肌缺血作用的研究表明,山楂叶提取物的药理作用主要依赖于原花青素而非含量更高的黄酮,增加提取物中原花青素的含量可以显著改进疗效[7]。
本研究结果显示,在10~50 mg/L浓度范围内,山楂叶原花青素能剂量依赖地抑制TNF-α诱导的人脐静脉内皮细胞ICAM-1和E-选择素的过表达,且抑制作用对药物浓度有一定的依赖性,并在40、50 mg/L达到高峰。这一药物有效浓度范围与量效关系,与我们对山楂叶原花青素抗心肌细胞缺氧损伤的研究结果是一致的,这也提示40~50 mg/L可能就是山楂叶原花青素干预不同疾病的共同最佳范围[8]。结合山楂叶原花青素对人脐静脉内皮细胞的毒性实验结果,浓度高至200 mg/L的山楂叶原花青素也未显示出明显的细胞毒性,其有效作用的浓度范围是安全的。
至于山楂叶原花青素是如何抑制炎症介质诱导的血管内皮细胞ICAM-1过表达的,我们推测可能与其抗氧化的性质有关。有研究表明,包括上调ICAM-1在内的绝大多数TNF-α的生物学效应,均是氧自由基依赖的[9]。其具体机制还需进一步实验验证。
综上所述,本研究结果提示,山楂叶原花青素能抑制炎症反应中血管内皮细胞ICAM-1的表达上调,这可能是其抗炎机制之一。
参考文献:
[1] TERRA X, PALOZZA P, FERNANDEZLARREA J, et al. Procyanidin dimer B1 and trimer C1 impair inflammatory response signaling in human monocytes[J]. Free Radical Res,2011,45(5):611-619.
[2] ALDINI G, CARINI M, PICCLI A, et al. Procyanidins from grape seeds protect endothelial cells from peroxynitrite damage and enhance endothelium-dependent relaxation in human artery:new evidences for cardio-protection[J]. Life Sci,2003,73:2883-2898.
[3] 李澎,付建华,李欣志,等.山楂叶提取物及其制剂对人脐静脉内皮细胞缺氧复氧损伤中性粒细胞黏附的影响[J].中国中西医结合杂志, 2008,28(8):716-720.
[4] SVEDSTR?M U, VUORELA H, KOSTIAINEN R, et al. Fractionation of polyphenols in hawthorn into polymeric procyanidins, phenolic acids and flavonoids prior to high-performance liquid chromatographic analysis[J]. J Chromatogr A,2006,1112(1/2):103- 111.
[5] 董瑞霞,李立祥,王茜,等.植物中原花青素含量测定[J].茶业通报, 2008,30(2):67-69.
[6] 董郡.病理学[M].北京:人民卫生出版社,1996:117-119.
[7] VEVERIS M, KOCH E, CHATTERJEE S S. Crataegus special extract WS? 1442 improves cardiac function and reduces infarct size in a rat model of prolonged coronary ischemia and reperfusion[J]. Life Sci,2004,74:1945-1955.
[8] 李澎,王建农,卢树杰,等.山楂叶原花青素对乳鼠心肌细胞缺血再灌注损伤的保护作用[J].中国中药杂志,2009,34(1):96-99.
[9] SHEN H M,PERVAIZ S. TNF receptor superfamily-induced cell death:redox dependent execution[J]. FASEB J,2006,20(10):1589- 1598.
(收稿日期:2016-11-29)
(修回日期:2016-12-13;编辑:华强)

