浙江楠组培繁育丛芽技术*
黄碧华
(福建省林业科技试验中心,福建南靖363600)
浙江楠组培繁育丛芽技术*
黄碧华
(福建省林业科技试验中心,福建南靖363600)
通过不同培养基和不同激素及不同浓度对浙江楠组培各阶段的影响研究,筛选出浙江楠组培诱导和增殖阶段的最佳组培配方。试验研究结果表明:浙江楠初代诱导培养的最佳培养基为B5+6-BA0.5mg·L-1+NAA0.2mg·L-1,继代增殖丛芽最佳培养基B5+6-BA0.8mg·L-1+KT1.0mg·L-1+NAA0.6mg·L-1。
浙江楠;组织培养;增殖培养
1 材料与方法
1.1 试验材料
2013年底在开展浙江楠优树筛选的基础上,采集优树的种子,2014年在福建省林业科技试验中心无板桥基地苗圃进行优树家系育苗测试,在苗圃筛选出一株优树子代超级苗,采集其嫩梢和侧芽作为组培诱导的材料。
1.2 试验方法
1.2.1 外植体采集和消毒处理
从优选出的浙江楠1a生超级苗上剪取嫩梢及其苗木中上部腋芽饱满、节间较短的枝条作为外植体,去除叶片,保留叶柄,长度约10cm,用毛刷轻刷洗净附于茎枝上的细绒毛和其它粘着物,放在自来水流动冲洗1~2h,然后放至接种室超净工作台上,用70~75%酒精消毒20s,用无菌水清洗1遍,再转入0.15%升汞溶液中消毒时间设置为4个梯度:3min、5min、8min和10min,消毒完后用无菌水冲洗外植体4~5遍,并置于经过高温消毒的滤纸上沥干,然后将枝条切割成1.0~1.5cm不等的茎段,每茎段带1个腋芽,14d后统计外植体的污染率和存活率[7]。
1.2.2 诱导培养基筛选
采用L9(34)正交试验设计,对浙江楠的诱导培养基进行配制,各基础培养基、激素以及激素浓度的设置如表1所示(为控制随机误差,将其中一因素设计为空白)。然后依据正交设计表对所设计的9个处理对浙江楠进行初代培养试验,每处理50瓶,每瓶1个,3个重复。一段时间后调查统计萌芽率不定芽数,并通过方差分析和显著性检验,筛选出最优诱导培养基配方。
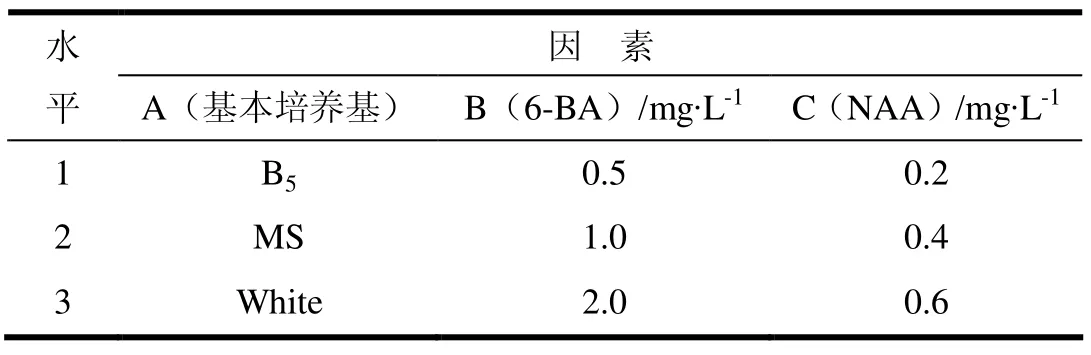
表1 浙江楠诱导培养正交试验因素及水平表
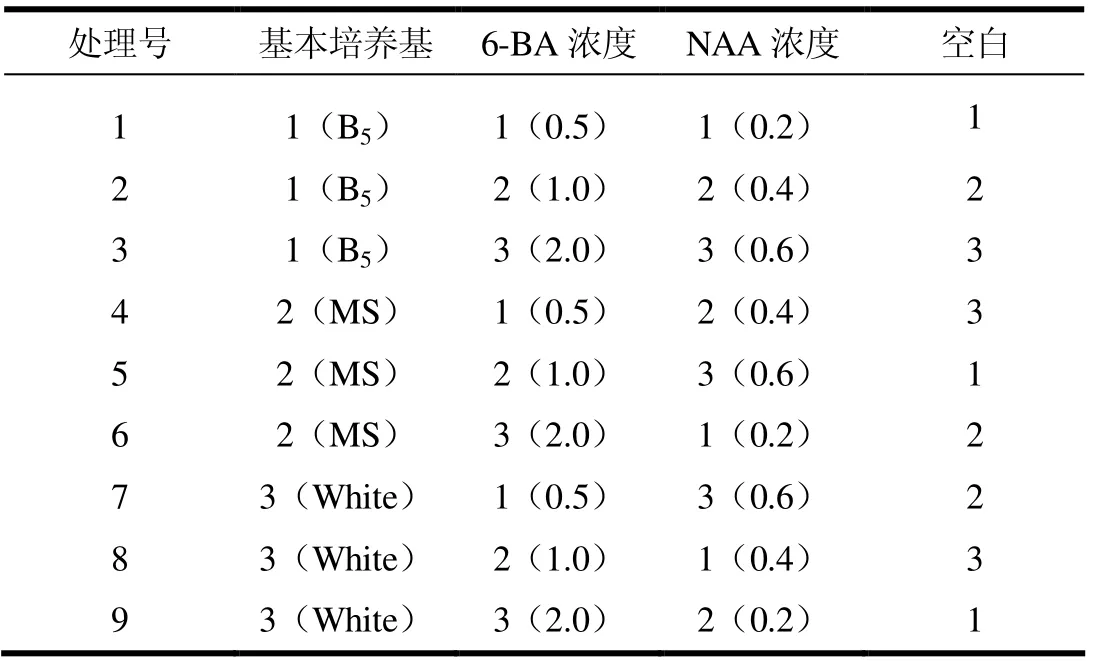
表2 浙江楠初代培养正交试验设计表
1.2.3 继代增殖培养基筛选
以B5、1/2MS、MS为基本培养基,分别添加不同激素(6-BA、KT、NAA),形成4因素3水平、9个处理的正交设计(见表3、4)。每个处理50瓶,每瓶1个茎段,每个径段带1个腋芽,试验重复3次。一段时间后调查统计其平均增殖倍数,并进行方差分析和显著性检验。

表3 继代增殖培养正交试验因素及水平表
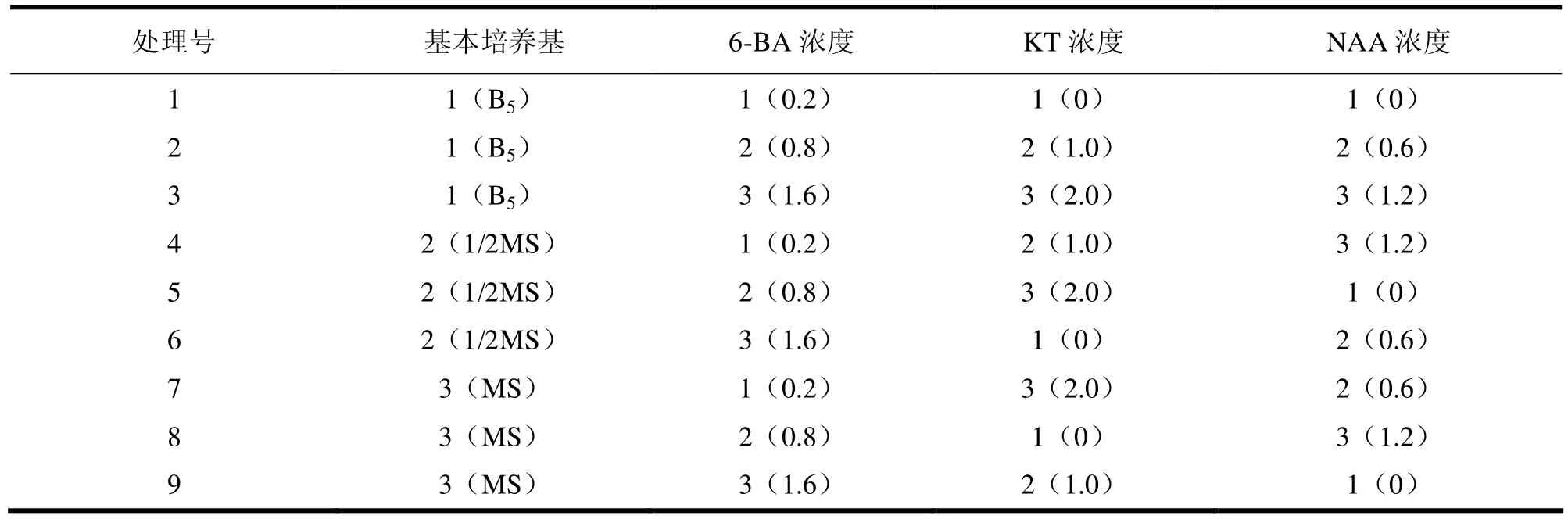
表4 浙江楠继代增殖正交试验设计表
1.3 培养条件
在浙江楠诱导阶段、继代增殖培养试验时,外植体接种后,因为是木本植物,切口容易产生褐化,为防止此种现象的发生,在接种后需进行7~10d的暗光培养处理。光照培养阶段,光照时间设为12h·d-1、温度为(25±2)℃、光照强度1500~3000Lux。诱导(初代)培养蔗糖用量为15g·L-1,、继代培养蔗糖用量增为30g·L-1,抗坏血酸5mg,半胱氨酸5mg·L-1,琼脂粉7g·L-1,酸碱度PH为5.8。诱导培养和继代增殖培养试验,观察统计时间为培养30d一周期[8-9]。
2 结果与分析
2.2.1 浙江楠无菌体系的建立
从表5可以看出,采用HgCl2进行消毒,随着时间的增长,外植体的污染率不断降低,存活率先上升而后下降。当消毒时间为5 min时,污染率为26%,存活率最高,可达42%。
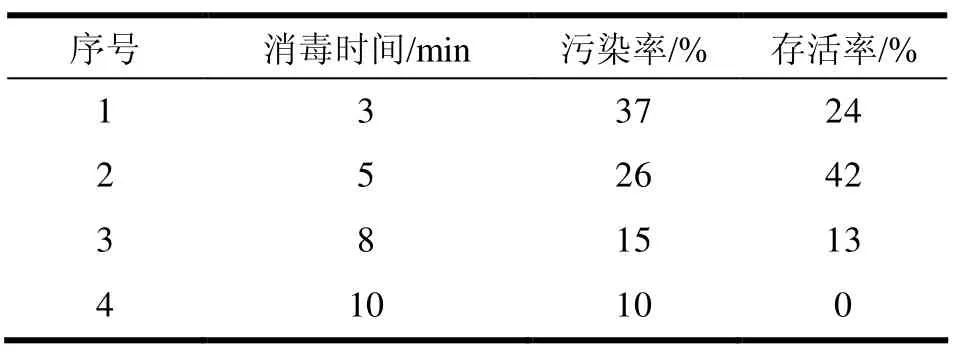
表5 HgCl2消毒时间对外植体污染率和存活率的影响
2.2.2 诱导培养基对浙江楠初代培养的影响
从正交试验结果(表6)分析可以得出,3个因素对浙江楠诱导萌芽的影响力的大小顺序为:基本培养基>6-BA>NAA,即基本培养基对其不定芽数的萌芽的影响力(A)>6-BA对其不定芽数的萌芽的影响力(B)>NAA对其不定芽数的萌芽的影响力(C)。由表6的分析结果还可发现,不同因素组合的培养基,其诱导出的不定芽数不同,高浓度6-BA和NAA的培养基上的不定芽数差异显著。不定芽数量最大的处理为1,平均倍数为3.6个;其次是处理2,增殖倍数为3.1个。处理8和处理9诱导的不定芽数均较少,这是因为处理8和处理9的基本培养基为White,该培养基对木本植物的生长有抑制作用,并在较高6-BA浓度均为1.0mg·L-1和2.0mg·L-1的环境下萌芽效果不好。综合以上分析,诱导不定芽诱导数以处理1为最佳。因此,浙江楠诱导的最佳培养基为B5+6-BA(0.5mg·L-1)+NAA(0.2mg·L-1),能获得分化能力较强且健康的不定芽。
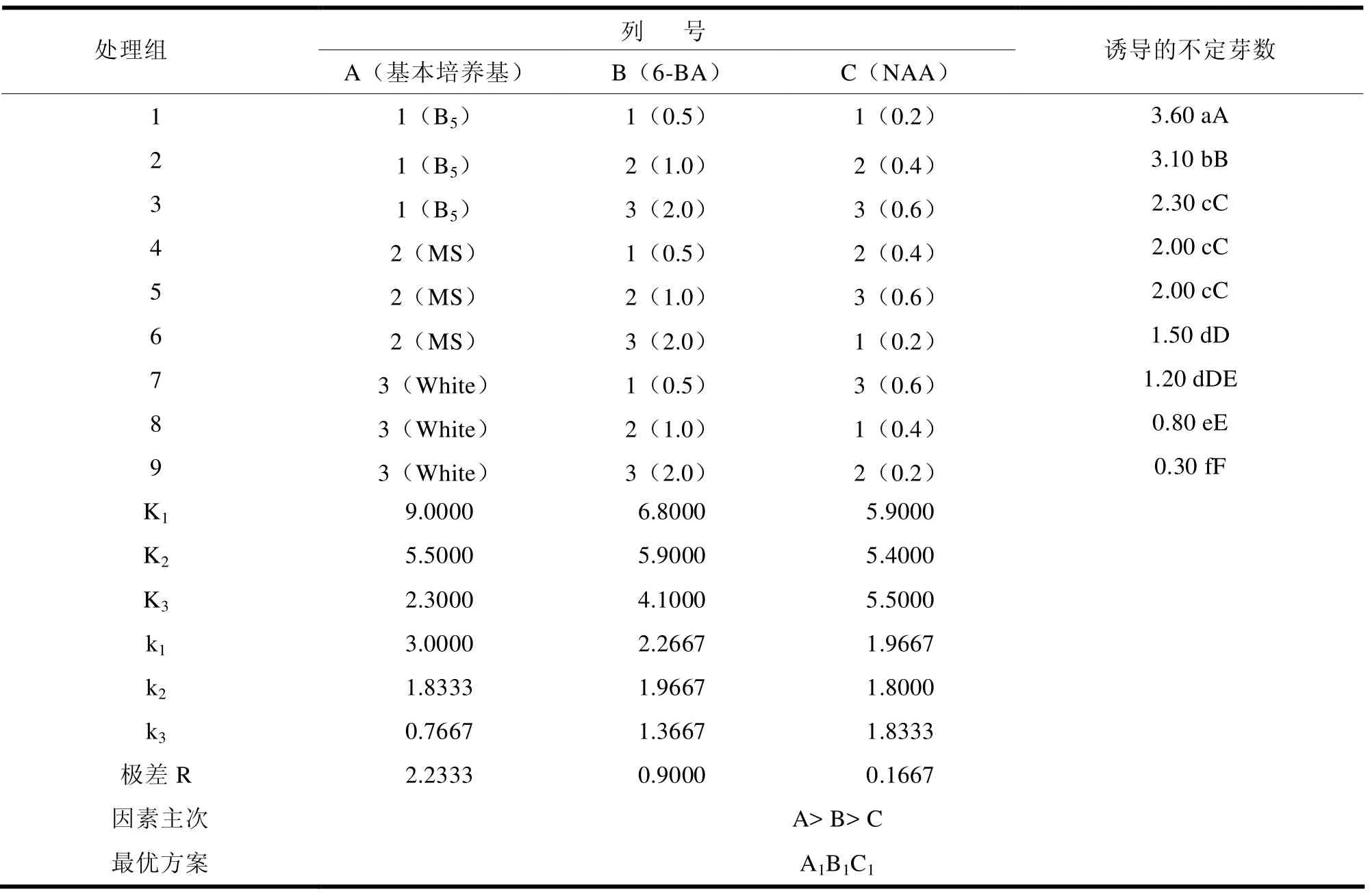
表6 浙江楠初代培养诱导萌芽正交试验结果
2.2.3 继代培养基对浙江楠增殖的影响
继代增殖培养,是植物组织培养能否顺利并投入扩繁生产推广的关键,也是植物离体快繁的主要阶段。本试验研究中,将长度约1.5cm左右的单芽切下转接到增殖培养基上进行培养。由表7结果分析可看出,4个因素对其增殖倍数影响的主次关系为:B>C>D>A,即6-BA对浙江楠继代增殖倍数影响力(A)>KT对其继代增殖倍数的影响力(B)>NAA对其继代增殖倍数的影响力(D)>基本培养基其继代对增殖倍数的影响力(C)。不同水平的6-BA、KT、NAA对增殖倍数的影响显著差异。理论上浙江楠最佳的增殖培养基应为B5+6-BA0.8mg·L-1+KT1. 0mg·L-1,但由于这一方案并未出现在已做的试验中,而且在本试验中,增殖倍数最高的处理为2,平均倍数为4.80;其次是处理5,增殖倍数为4.60,但处理2和处理5两组增殖倍数差异不显著。浙江楠最佳的增殖培养基为B5+6-BA0.8mg·L-1+KT1.0mg·L-1+NAA0.6mg·L-1或者1/2MS+6-BA0.8mg·L-1+NAA0.6。
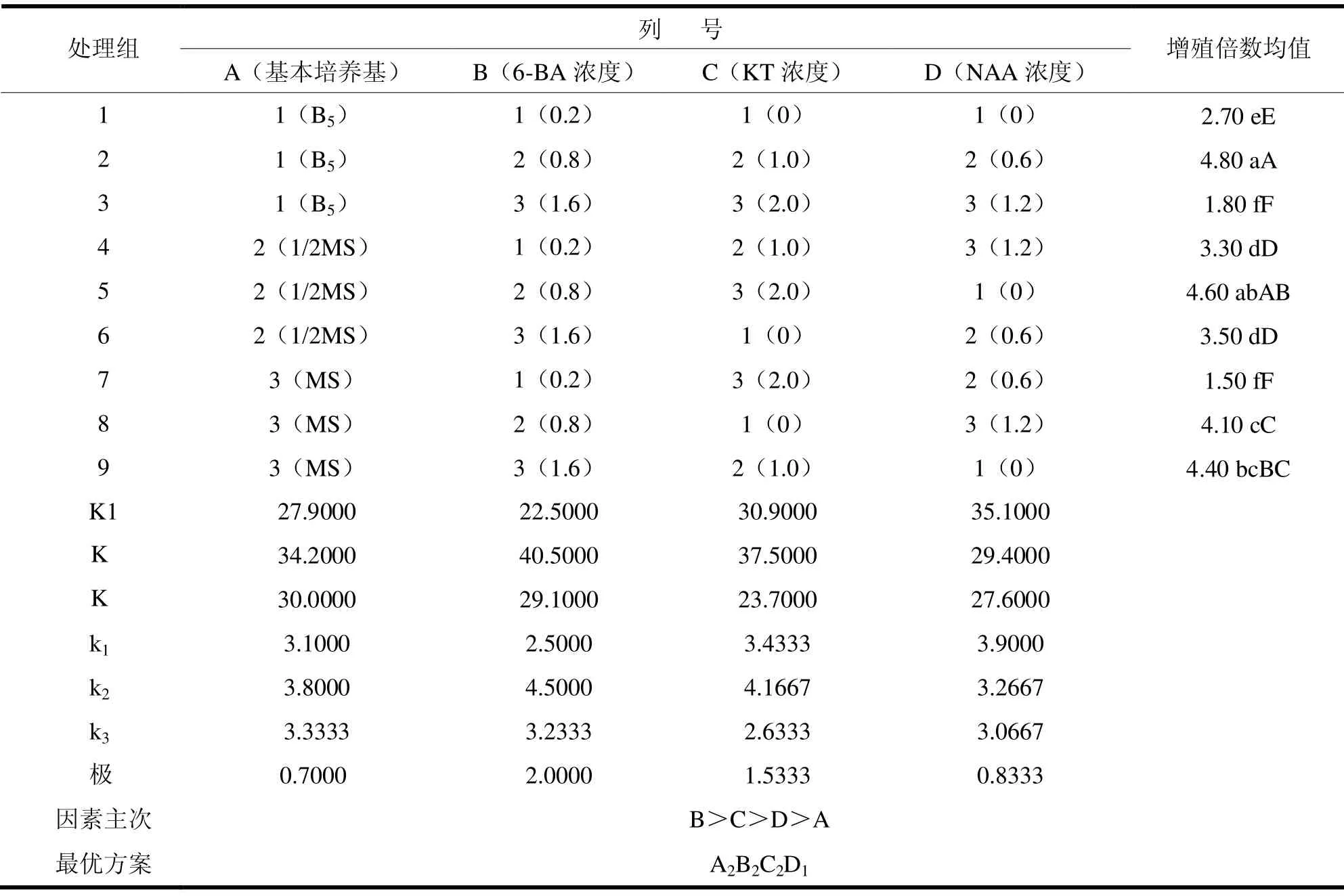
表7 浙江楠继代培养正交试验结果
3 结论
采用茎段为外植体培养浙江楠组培苗,初代培养中诱导不定芽分化的最佳培养基是B5+6-BA0.5mg· L-1+NAA0.2mg·L-1,诱导存活率可达42%,采用此配方能获得分化能力较强的不定芽。浙江楠继代增殖培养基以B5+6-BA0.8mg·L-1+KT1.0mg·L-1+NAA0.6mg·L-1、1/2MS+6-BA0.8mg·L-1+NAA0.6为最佳的增殖培养基配方,增殖倍数可达4倍以上。
由于组织培养中所选择的激素种类比较多,并且激素的种类、浓度不同,浙江楠组培效果各异。筛选最为经济、稳定、高效的培养基配方,降低经济成本,提高工厂化育苗效益还有需要进一步探索。
[1]许智宏.植物生物技术[M].上海科学出版社,1998:245.
[2]朱建华,彭士勇编.植物组织培养实用技术[M].中国计量出版社,2002:67-72.
[3]陈正华.木本植物组织培养及其应用[M].北京:高等教育出版社,1994.
[4]谭文澄.观赏植物试管组培的研究[J].甘肃林业科学,1991,(4):11-14.
[5]吴中伦编.中国主要外来树种引种[M].北京:中国林业出版社,1994
[6]曹孜仪.刘国民实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,1966:98-102.
[7]陈春,陈孝丑.黄枝润楠组培快繁技术研究[J],林业科技开发,2015,29(6):82-84.
[8]祈述雄.中国按树:第二版[M].北京:中国林业出版社,2002.
[9]中国植物志编辑委员会.中国植物志(第十九卷)[M].北京:科学出版社,1999.
责任编辑/罗美娟
The Technique of Bud Propagation in Tissue Culture of
Huang Bihua
(Fujian Forestry Science and Technology Test Center,Nanjing Fujian 363600,China.)
S792.24
A
1003-4382(2017)02-0045-04
2017-01-05
2017-02-09
黄碧华(1973-),女,本科,工程师,主要从事植物组织培养工作。

