珠江口表层水体颗粒物中古菌四醚类脂物的分布特征
郭威,叶丰,贾国东,3*
(1. 东华理工大学 江西省大气污染成因与控制重点实验室,江西 南昌 330013;2. 中国科学院广州地球化学研究所 边缘海地质重点实验室,广东 广州 510640; 3. 同济大学 海洋地质国家重点实验室,上海 200092)
珠江口表层水体颗粒物中古菌四醚类脂物的分布特征
郭威1,2,叶丰2,贾国东2,3*
(1. 东华理工大学 江西省大气污染成因与控制重点实验室,江西 南昌 330013;2. 中国科学院广州地球化学研究所 边缘海地质重点实验室,广东 广州 510640; 3. 同济大学 海洋地质国家重点实验室,上海 200092)
类异戊二烯甘油二烷基甘油四醚类化合物(isoGDGTs)是古菌微生物的特征脂类标志物,由这组化合物构造出的TEX86温标在海水古温度重建中得到了广泛应用。本文调查了珠江口及近岸海域(水深小于30 m)4个季节水体悬浮颗粒物(SPM)的isoGDGTs分布情况。结果显示:虎门上游河流水体中的isoGDGTs主要来自原地生产的甲烷古菌输入,进入河口水体后,主要来自原地奇古菌和广古菌的输入。陆源古菌的输入在5月份和8月份,对河流水体产生一定的影响,但对河口水体的影响相对较小。珠江口水体isoGDGTs中的GDGT-2与GDGT-3比值(GDGT-[2]/[3])和GDGT-Cren′的丰度百分比(Cren′%)分别小于4和4%,与南海深水沉积物明显不同,表明珠江口与南海深水沉积物中isoGDGTs的古菌来源存在差异,这也可能是引起珠江口水体TEX86温度(基于全球标定公式)偏离水体实际温度的原因。珠江口表层水体isoGDGTs中的GDGT-2和GDGT-3的丰度百分比与南海表层水体存在差异,这可能与Group Ⅰ 奇古菌和Group Ⅱ 广古菌相对比例空间变化有关。珠江口表层水体isoGDGTs的TEX86温度在2月份明显高于原地表层水体温,而其他月份都低于原地表层水体温度,可能与Group Ⅰ 奇古菌和Group Ⅱ 广古菌相对比例的季节变化有关。几个月份中11月份isoGDGTs绝对含量最高,8月份较低,表明11月份和8月份分别是原地古菌生产量较大和较小时期。统计分析的结果显示,水体铵根离子含量、水体温度,以及溶解氧水平可能是控制珠江口水体isoGDGTs分布的主要环境因素。
珠江口;isoGDGTs;TEX86;悬浮颗粒物;季节变化
1 引言
甘油二烷基甘油四醚类化合物(GDGTs)是微生物细胞膜的主要成分,主要包括类异戊二烯GDGTs(isoGDGTs)和支链GDGTs(brGDGTs)[1—2]。isoGDGTs是一种由古菌合成的细胞膜脂,分子中含有0~3个环戊烷结构(GDGT-0~GDGT-3)以及一类特殊的isoGDGTs(GDGT-Cren, Crenarchaeol)及其重构异构体(GDGT-Cren′)。后二者分子中含有4个环戊烷结构和一个环已烷结构[3—4]。培养实验表明,古菌细胞膜对温度有一种适应机制,表现为isoGDGTs平均5元环数与生长温度有关[5]。Schouten等[6]通过对大洋表层沉积物中的isoGDGTs的研究发现,isoGDGTs的分布与年均海水表层温度(SST)具有显著的线性相关性(GDGT-0和GDGT-1与SST负相关,GDGT-2、GDGT-3以及GDGT-Cren′与SST正相关),并根据这种相关性提出了一个古温度指标TEX86,以及海洋表层水体温度重建的TEX86公式。Kim等[7—8]基于更加广泛的海洋表层沉积物数据,对TEX86温度公式进行了校正,并提出了适应温暖海区和低温海区的校准公式TEX86H和TEX86L。TEX86指标已经在海洋古温重建的研究中发挥了重要作用。

南海是西太平洋热带海区的重要边缘海,其沉积物中蕴含着大量古海洋的环境信息。当前,很多学者开展了针对南海水体和沉积物中isoGDGTs的研究。一些研究结果显示,南海深海区表层沉积物的TEX86指标能准确地记录南海年均SST (水深大于1 000 m)[18—19]或次表层(30~125 m,水深大于300 m)[9]水体温度,但是南海北部的陆架浅水区(水深小于200 m)表层沉积物TEX86指标记录的温度普遍低于年平均SST[18]。Ge等[19]、Zhang等[12]以及Zhou等[20]对南海北部浅水区(水深小于100 m)表层沉积物的TEX86进行了调查,发现TEX86指标计算的温度接近冬季表层水体温度,据此认为此区域表层沉积物的TEX86指标可能有季节偏向,主要记录了冬季SST。最近,Wang等[21]发现珠江口及邻近陆架浅水区(水深小于20 m)表层沉积物中的TEX86温度也低于年平均表层水体温度。通过与前人表层沉积物的TEX86数据进行对比,认为浅水区偏低TEX86温度可能并不是受季节性因素的影响,而是由这一区域古菌类型与深海区存在差异所造成。
最近,我们对珠江口表层水体悬浮颗粒物(SPM)的isoGDGTs分布进行了不同季节的调查和分析。本文将珠江口isoGDGTs组成与南海陆架浅水区和开放海区表层水体SPM和沉积物中isoGDGTs组成进行了比较,讨论了珠江河流与河口水体isoGDGTs的古菌来源,评估了温度及有关的非温度因素对珠江口isoGDGTs分布的影响,以期对TEX86温度指标在珠江口及其邻近陆架浅水区的应用提供一些启示。
2 材料和方法
2.1 研究区域概况
珠江是中国径流量第二大河流(330×109m3/a),也是珠江口最重要的淡水补给,并最终输送到南海。珠江口地处热带与亚热带。受东南季风和西南季风的影响,珠江流域水汽主要来源于南海、西太平洋和孟加拉湾。珠江流域降雨量丰富,全年降水主要集中于4-9月份,其降水量约占全年降水量的80%。枯水期一般为10月至次年3月,年平均降雨量为1 200~2 200 mm[22]。
珠江河口至伶仃洋外水域位于21°~23°30′N,112°40′~114°50′E(图1),主要由3个次级河口组成,即磨刀门(Modaomen)、黄茅海(Huangmaohai) 和伶仃洋(Lingdingyang Bay)。伶仃洋是最大的次级河口,我们的研究点主要设在伶仃洋(图1)。伶仃洋水域长48 km,宽4~48 km,平均水深4.8 m,从西北向东南,水深逐渐增加[23]。
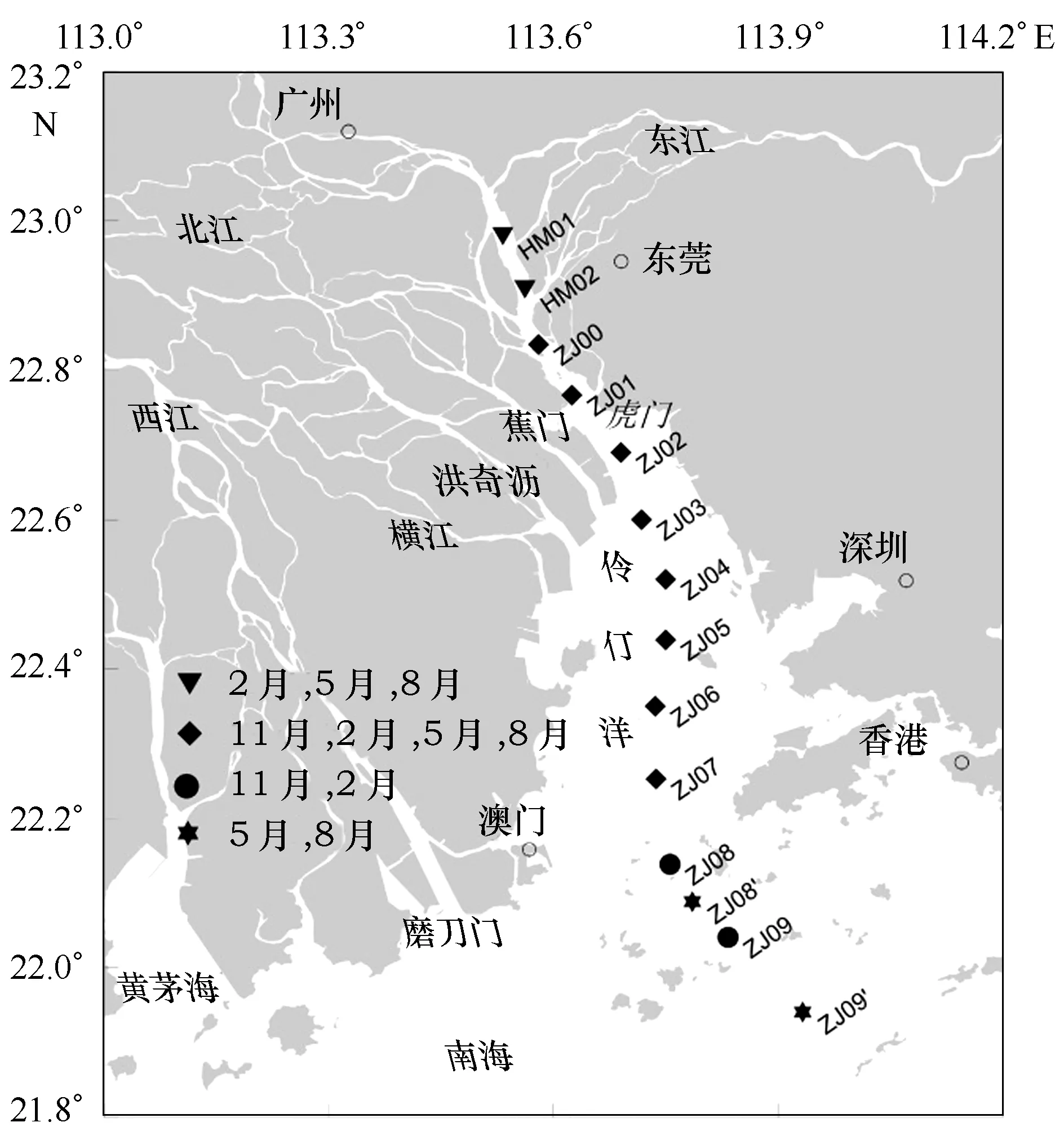
图1 珠江口采样点分布Fig.1 Distribution of sampling sites in the Pearl River Estuary
2.2 采样
对珠江口及其邻近水域SPM进行了不同季节的采样,采样点分布如图1,采样时间分别是2013年11月、2014年2月、2014年5月、2014年8月。SPM样品采自表层水体(水深约1 m),使用大体积有机玻璃过滤器过滤大约50 L体积的水,用预先灼烧(450℃)和称质量的玻璃纤维滤膜(Whatman GF/F, 0.7 μm, 142 mm直径)收集颗粒物。水温、盐度用CTD仪现场测定。所有样品现场采集后放入-20℃冰箱保存,带回实验室进行下一步的分析。
2.3 脂类萃取和分离
SPM样品在实验室冷冻干燥。然后,附着SPM的滤膜用剪刀剪碎,装入Teflon离心管内。依次用甲醇(2次)、1∶1体积比的二氯甲烷/甲醇(2次)和二氯甲烷(2次)进行超声萃取,离心分离后进行合并。萃取溶液在真空条件下进行旋转干燥,用正己烷洗脱后进行组分分离,分离柱采用活化的氧化铝柱,分别用99∶1的正己烷/二氯甲烷和1∶1的二氯甲烷/甲醇分离非极性组分和极性组分,GDGTs在极性组分中。含GDGTs的溶液用N2吹干后用正己烷/异丙醇(99∶1,V∶V)进行超声溶解,并用直径为4 mm,孔径为0.45 μm的有机相滤膜过滤后进行仪器分析。
GDGTs的分析采用的仪器是Agilent 1200HPLC6410 TripleQuad MS。使用的程序参考了Hopmans等[24]和Schouten等[25]介绍的方法,色谱柱采用氰基柱(2.1×150 mm,3 μm,流速0.2 mL/min),温度保持在30℃。依据样品浓度,进样量在5~20 μL之间进行调节。流动相采用梯度洗脱,初始流动相为99%的正己烷和1%的异丙醇,之后在45 min内异丙醇的浓度增加至1.8%,流速0.2 mL/min。以质谱扫描单离子的峰面积作为比较化合物含量的标准。
2.4 卫星温度
卫星温度数据来自于美国国家海洋和大气局高分辨率探测器(version 5.0 and 5.1; http://pathfinder.nodc.noaa.gov)。因为水体SPM主要反映的是采样时期水体的环境信息,因此我们提取了采样期间(2013年11月至2014年8月)每个采样点当日的平均表层水体温度。
2.5 统计分析
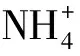
2.6 GDGTs相关指标的计算
BIT指标采用Hopmans等[26]提出的公式,TEX86温度计算采用Kim等[7—8]年提出的公式,具体计算公式如下:
BIT = (Ⅰ+Ⅱ+Ⅲ) / (Ⅰ+Ⅱ+Ⅲ + Cren),
TEX86= (GDGT-2+GDGT-3+Cren′) / (GDGT-1+GDGT-2+GDGT-3+Cren′),
TEX86H= log (TEX86),
SST =68.4·TEX86H+38.6,
式中,Ⅰ、Ⅱ和Ⅲ属于支链GDGTs;GDGT-1、GDGT-2、GDGT-3、Cren和Cren′属于isoGDGTs。
3 结果
3.1 SPM的isoGDGTs绝对含量
珠江河流及河口水体不同季节SPM总isoGDGTs含量范围为0.75~57.34 ng/L。isoGDGT含量在珠江下游河流水体中相对较高(1.65~57.34 ng/L),河口水体则相对较低(0.75~52.12 ng/L)(图2)。本工作中SPM的isoGDGTs含量与Wang等[21]报道的珠江口(采样时间为2010年7月)SPM中的含量(7.4~71.0 ng/L)接近,并且高于Wei等[18]报道的南海表层水体(采样时间为2010年4—5月)SPM中的含量(0.001~0.894 ng/L)。从季节变化来看,2013年11月份总isoGDGT含量(平均为36.12 ng/L)明显高于其他月份(2014年2月平均为6.40 ng/L,2014年5月为14.70 ng/L,2014年8月为6.16 ng/L)。
3.2 SPM的isoGDGTs相对含量
SPM样品中isoGDGTs主要以GDGT-0(9.13%~92.16%)和GDGT-Cren(5.39%~72.62%)为主要组成部分(图3)。其中,2013年11月,GDGT-0和GDGT-Cren在不同地点(随着盐度升高)的相对含量较为稳定。而其他月份GDGT-0的相对含量随着盐度增加而逐渐减小,GDGT-Cren则正好相反,随着盐度增加逐渐变大。其他isoGDGTs组分相对含量(GDGT-2、GDGT-3和GDGT-Cren′)空间和季节变化不明显。

图2 不同季节isoGDGTs绝对含量Fig.2 The abundance of total isoGDGTs in surface water SPM of PRE in different months

图3 不同季节isoGDGTs相对含量Fig.3 Relative abundance of isoGDGTs from surface water SPM of PRE in different months
3.3 IsoGDGTs相关指标的时空变化
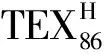

表1 IsoGDGTs各组分与表层水体温度(SST)和GDGT-Cren之间的相关关系

图4 不同季节盐度对应SPM的BIT值(a), GDGT-[0]/[Cren]与MI值(b), 原地水体温度与温度(c)Fig.4 Distribution of SPM in different months in the diagram of salinity vs. BIT (a), MI vs. GDGT-[0]/[Cren] (b), and in situ surface water temperatures vs. TEX86 derived temperatures (c)
3.4 PCA、RDA分析结果
PCA分析的目的是评估GDGTs各组分之间,以及环境参数(如温度、盐度、水体中离子含量等)与GDGTs相关指标(BIT、MI、GDGT-[2]/[3]等)之间的相互关系。在isoGDGTs各组分的PCA分析结果中(图5a和表2),两个坐标轴共解释了87.7%的isoGDGTs组分变化,其中第一个轴(PC1)解释了78.3%,第二轴(PC2)解释了9.4%。在PC1轴中,GDGT-1、GDGT-2、GDGT-3和GDGT-Cren′在左侧轴,具有较高的负向载荷(r分别为-0.79,-0.94, -0.70 和-0.97)。而GDGT-0则在右侧轴,并具有较高的正向载荷(r=0.92)。
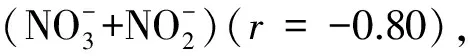
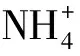

图5 isoGDGTs各组分PCA结果图(a), isoGDGTs不同指标与环境参数PCA结果图(b), isoGDGTs各组分与环境参数RDA结果图(c)(TSM是总悬浮物,Chl a为叶绿素a,DO为溶解氧)Fig.5 Principal component analysis (PCA) biplot of isoGDGTs components (a). Principal component analysis (PCA) biplot showing relationships among environmental variables and isoGDGTs correlation indices (b). Redundancy analysis (RDA) triplot showing relationships between environmental variables and isoGDGTs com-ponents (c)

变量PCA载荷PC1PC2变量PCA载荷PC1PC2变量RDA相关性Axis1Axis2GDGT0092-033TEX86-027049深度004-005GDGT⁃1-079-059MI-062-038盐度-024039GDGT⁃2-094-004GDGT-[0]/[Cren]-053-044温度-045-044GDGT⁃3-07009BIT-074-022溶解氧-041059Cren-097007GDGT-[2]/[3]010-002Chla005002Cren′-054040深度004002TSM014025
续表2
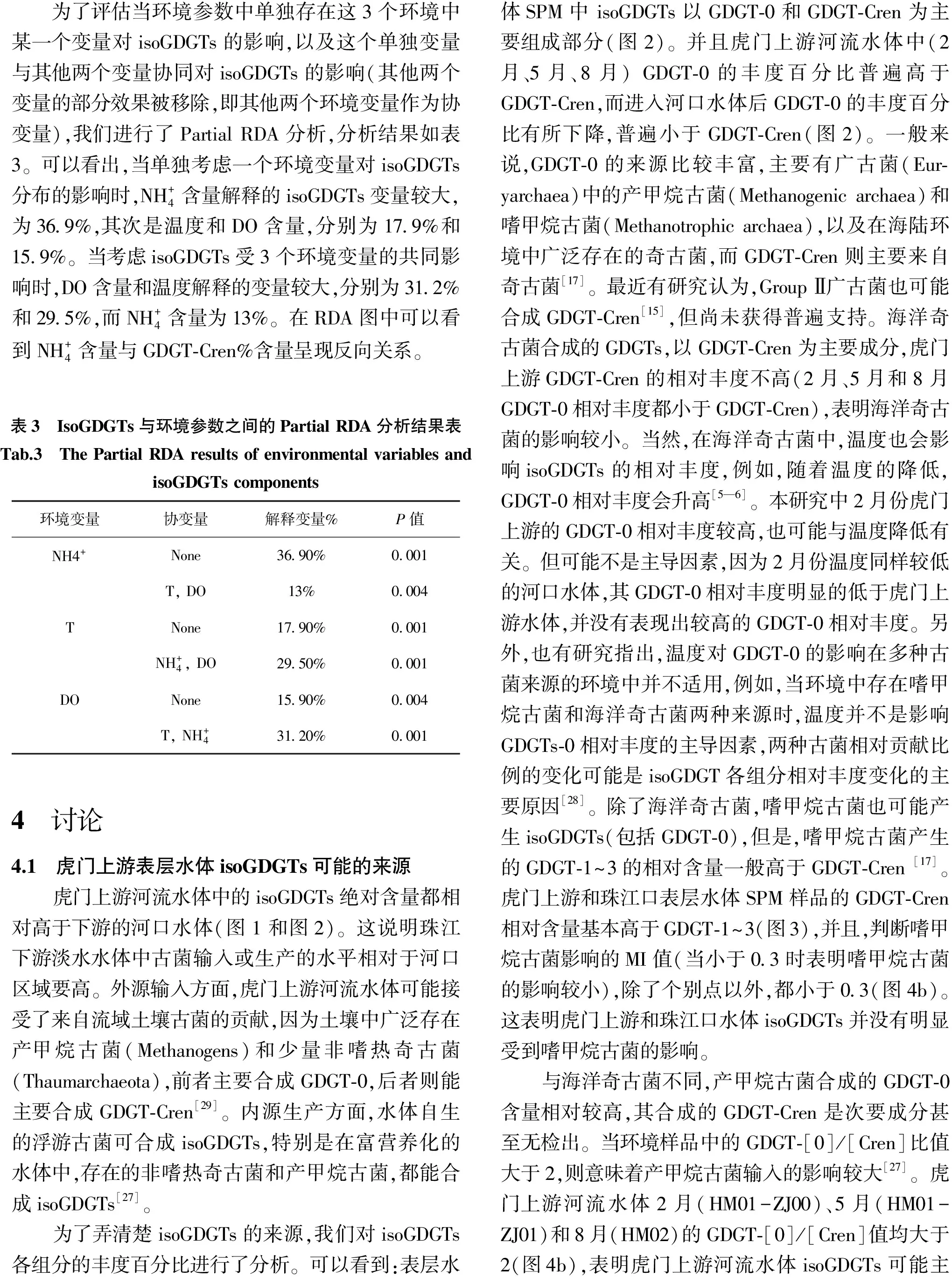
为了评估当环境参数中单独存在这3个环境中某一个变量对isoGDGTs的影响,以及这个单独变量与其他两个变量协同对isoGDGTs的影响(其他两个变量的部分效果被移除,即其他两个环境变量作为协变量),我们进行了PartialRDA分析,分析结果如表3。可以看出,当单独考虑一个环境变量对isoGDGTs分布的影响时,NH+4含量解释的isoGDGTs变量较大,为369%,其次是温度和DO含量,分别为179%和159%。当考虑isoGDGTs受3个环境变量的共同影响时,DO含量和温度解释的变量较大,分别为312%和295%,而NH+4含量为13%。在RDA图中可以看到NH+4含量与GDGT⁃Cren%含量呈现反向关系。表3 IsoGDGTs与环境参数之间的PartialRDA分析结果表Tab.3 ThePartialRDAresultsofenvironmentalvariablesandisoGDGTscomponents环境变量协变量解释变量%P值NH4+None3690%0001T,DO13%0004TNone1790%0001NH+4,DO2950%0001DONone1590%0004T,NH+43120%00014 讨论4.1 虎门上游表层水体isoGDGTs可能的来源虎门上游河流水体中的isoGDGTs绝对含量都相对高于下游的河口水体(图1和图2)。这说明珠江下游淡水水体中古菌输入或生产的水平相对于河口区域要高。外源输入方面,虎门上游河流水体可能接受了来自流域土壤古菌的贡献,因为土壤中广泛存在产甲烷古菌(Methanogens)和少量非嗜热奇古菌(Thaumarchaeota),前者主要合成GDGT⁃0,后者则能主要合成GDGT⁃Cren[29]。内源生产方面,水体自生的浮游古菌可合成isoGDGTs,特别是在富营养化的水体中,存在的非嗜热奇古菌和产甲烷古菌,都能合成isoGDGTs[27]。为了弄清楚isoGDGTs的来源,我们对isoGDGTs各组分的丰度百分比进行了分析。可以看到:表层水体SPM中isoGDGTs以GDGT⁃0和GDGT⁃Cren为主要组成部分(图2)。并且虎门上游河流水体中(2月、5月、8月)GDGT⁃0的丰度百分比普遍高于GDGT⁃Cren,而进入河口水体后GDGT⁃0的丰度百分比有所下降,普遍小于GDGT⁃Cren(图2)。一般来说,GDGT⁃0的来源比较丰富,主要有广古菌(Eur⁃yarchaea)中的产甲烷古菌(Methanogenicarchaea)和嗜甲烷古菌(Methanotrophicarchaea),以及在海陆环境中广泛存在的奇古菌,而GDGT⁃Cren则主要来自奇古菌[17]。最近有研究认为,GroupⅡ广古菌也可能合成GDGT⁃Cren[15],但尚未获得普遍支持。海洋奇古菌合成的GDGTs,以GDGT⁃Cren为主要成分,虎门上游GDGT⁃Cren的相对丰度不高(2月、5月和8月GDGT⁃0相对丰度都小于GDGT⁃Cren),表明海洋奇古菌的影响较小。当然,在海洋奇古菌中,温度也会影响isoGDGTs的相对丰度,例如,随着温度的降低,GDGT⁃0相对丰度会升高[5—6]。本研究中2月份虎门上游的GDGT⁃0相对丰度较高,也可能与温度降低有关。但可能不是主导因素,因为2月份温度同样较低的河口水体,其GDGT⁃0相对丰度明显的低于虎门上游水体,并没有表现出较高的GDGT⁃0相对丰度。另外,也有研究指出,温度对GDGT⁃0的影响在多种古菌来源的环境中并不适用,例如,当环境中存在嗜甲烷古菌和海洋奇古菌两种来源时,温度并不是影响GDGTs⁃0相对丰度的主导因素,两种古菌相对贡献比例的变化可能是isoGDGT各组分相对丰度变化的主要原因[28]。除了海洋奇古菌,嗜甲烷古菌也可能产生isoGDGTs(包括GDGT⁃0),但是,嗜甲烷古菌产生的GDGT⁃1~3的相对含量一般高于GDGT⁃Cren[17]。虎门上游和珠江口表层水体SPM样品的GDGT⁃Cren相对含量基本高于GDGT⁃1~3(图3),并且,判断嗜甲烷古菌影响的MI值(当小于03时表明嗜甲烷古菌的影响较小),除了个别点以外,都小于03(图4b)。这表明虎门上游和珠江口水体isoGDGTs并没有明显受到嗜甲烷古菌的影响。与海洋奇古菌不同,产甲烷古菌合成的GDGT⁃0含量相对较高,其合成的GDGT⁃Cren是次要成分甚至无检出。当环境样品中的GDGT⁃[0]/[Cren]比值大于2,则意味着产甲烷古菌输入的影响较大[27]。虎门上游河流水体2月(HM01-ZJ00)、5月(HM01-ZJ01)和8月(HM02)的GDGT⁃[0]/[Cren]值均大于2(图4b),表明虎门上游河流水体isoGDGTs可能主

图6 不同区域表层水体SPM和表层沉积物isoGDGT-[2]/[3]与GDGT-Cren′丰度百分比分布
Fig.6 isoGDGT-[2]/[3] vs. GDGT-Cren′% of SPM and surface sediments in the South China Seac
a. 南海; b. 南海海岸区;c. 虎门上游和珠江口;d. 虎门上游和珠江口表层水体SPM的GDGT-2和GDGT-3的丰度百分比; e. 珠江口-南海表层水体SPM的GDGT-2和GDGT-3的丰度百分比比较。南海海岸区表层水体SPM数据来自郭威(未发表数据,样品采于2015年6月);南海开阔海洋表层水体SPM数据来自Wei等[18](样品采于2010年4月23至5月26);珠江口表层沉积物数据来自郭威(未发表数据,样品采于2014年
12月);南海海岸区和南海表层沉积物数据来自Wei等[18],Jia等[19],Ge等[9],Zhou等[20]
a. South China Sea(SCS); b. Coastal South China Sea; c. Upper Humen and Pearl River Estuary(PRE); d. fractional abundance of GDGT-[2] vs. GDGT-[3] of SPM in Upper Humen and RRE; e. fractional abundance of GDGT-2 vs. GDGT-3 of SPM in Coastal SCS and open SCS. The dates of SPM in Coastal SCS from Guowei (unpublished date, sampling in June of 2015); the dates of SPM in SCS from Wei et al[18](sampling in May of 2010); the dates of surface sediments in PRE from Guowei (unpublished date, sampling in December of 2014); the dates of surface sediments in Coast-al SCS and SCS from Wei et al.[18], Jia et al.[19], Ge et al.[9], Zhou et al.[20]
在2月、5月和8月这3个月份中, 5月份的BIT值随盐度的变化与2月、8月并不相同(图4a)。5月份,正处在珠江流域前汛期,降雨较大,河流水体较高的BIT值可能是因为土壤有机质的输入。珠江口SPM有机碳的同位素值在5月份更接近于土壤有机碳碳同位素值,可以支持这一推断[30]。但是2月,珠江流域降雨量小,陆源有机质输入较少。河流水体包括低盐度河口水体中的较高的BIT值可能与原地brGDGTs的生产有关。虽然8月份珠江流域降雨也较大,但是陆源土壤有机质的输入并不多[30,42],表明原位brGDGT的生产也可能是8月份河流水体BIT值较高的原因。
4.4 环境因素对isoGDGTs分布的影响
在isoGDGTs的PCA分析中,可以看到,PC1轴上GDGT-1、GDGT-2、GDGT-3、GDGT-Cren和GDGT-Cren′表现出很明显的同向性(图5a),暗示它们具有相同的来源,即主要是浮游奇古菌或广古菌。但GDGT-0与其他isoGDGTs组分有着方向相反的载荷,则暗示GDGT-0与其他isoGDGTs组分在来源上存在差异。正如前文所述,GDGT-0来自甲烷古菌的输入,特别是在虎门上游。

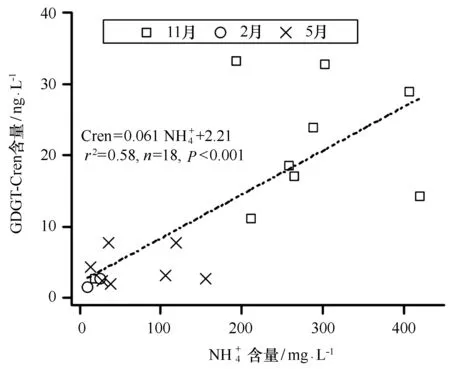
图与GDGT-Cren含量之间的关系(BIT<0.4的样品)Fig.7 The concentration of N vs. GDGT-Cren (BIT <0.4)
5 结论
(1)虎门上游河流段产甲烷古菌的输入对isoGDGTs有重要影响,进入河口水体后,以奇古菌和广古菌的输入为主。5月份和8月份陆源古菌的输入对河流水体产生一定的影响,对河口水体的影响相对较小。
(2)珠江口水体存在广古菌与奇古菌相混合的浅水古菌类型。这可能是珠江口水体TEX86温度偏离实测温度的原因。表层水体isoGDGTs组分(GDGT-2、GDGT-3的丰度百分比)从珠江口到南海开阔海洋发生了变化,这可能与奇古菌和广古菌相对贡献量空间变化有关。

(4)水体铵根离子含量、水体温度,以及溶解氧水平可能是控制珠江口水体isoGDGTs分布的主要环境因素。
[1] Damsté J S S, Rijpstra W I C, Hopmans E C, et al. Distribution of membrane lipids ofPlanktonicCrenarchaeotain the Arabian Sea[J]. Applied and Environmental Microbiology, 2002, 68(6): 2997-3002.
[2] Damsté J S S, Ossebaar J, Abbas B, et al. Fluxes and distribution of tetraether lipids in an equatorial African lake: Constraints on the application of the TEX86palaeothermometer and BIT index in lacustrine settings[J]. Geochimica et Cosmochimica Acta, 2009, 73(14): 4232-4249.
[3] Leininger S, Urich T, Schloter M, et al. Archaea predominate among ammonia-oxidizing prokaryotes in soils[J]. Nature, 2006, 442(7104): 806-809.
[4] Schouten S, Hopmans E C, Baas M, et al. Intact membrane lipids of “CandidatusNitrosopumilus maritimus,” a cultivated representative of the cosmopolitan Mesophilic Group I crenarchaeota[J]. Applied and Environmental Microbiology, 2008, 74(8): 2433-2440.
[5] Schouten S, Hopmans E C, Pancost R D, et al. Widespread occurrence of structurally diverse tetraether membrane lipids: Evidence for the ubiquitous presence of low-temperature relatives of hyperthermophiles[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(26): 14421-14426.
[6] Schouten S, Hopmans E C, Schefuß E, et al. Distributional variations in marine crenarchaeotal membrane lipids: a new tool for reconstructing ancient sea water temperatures[J]. Earth and Planetary Science Letters, 2002, 204(1/2): 265-274.
[7] Kim J H, Schouten S, Hopmans E C, et al. Global sediment core-top calibration of the TEX86paleothermometer in the ocean[J]. Geochimica et Cosmochimica Acta, 2008, 72(4): 1154-1173.
[8] Kim J H, Van Der Meer J, Schouten S, et al. New indices and calibrations derived from the distribution of crenarchaeal isoprenoid tetraether lipids: implications for past sea surface temperature reconstructions[J]. Geochimica et Cosmochimica Acta, 2010, 74(16): 4639-4654.
[9] Jia Guodong, Zhang Jie, Chen Jianfang, et al. Archaeal tetraether lipids record subsurface water temperature in the South China Sea[J]. Organic Geochemistry, 2012, 50: 68-77.
[10] Kim J H, Schouten S, Rodrigo-Gmiz M, et al. Influence of deep-water derived isoprenoid tetraether lipids on the TEpaleothermometer in the Mediterranean Sea[J]. Geochimica et Cosmochimica Acta, 2015, 150: 125-141.
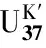
[12] Zhang Jie, Bai Yang, Xu Shendong, et al. Alkenone and tetraether lipids reflect different seasonal seawater temperatures in the coastal northern South China Sea[J]. Organic Geochemistry, 2013, 58: 115-120.
[13] Weijers J W H, Schouten S, Spaargaren O C, et al. Occurrence and distribution of tetraether membrane lipids in soils: implications for the use of the TEX86proxy and the BIT index[J]. Organic Geochemistry, 2006, 37(12): 1680-1693.
[14] Zhu Chun, Weijers J W H, Wagner T, et al. Sources and distributions of tetraether lipids in surface sediments across a large river-dominated continental margin[J]. Organic Geochemistry, 2011, 42(4): 376-386.
[15] Lincoln S A, Wai B, Eppley J M, et al. Planktonic euryarchaeota are a significant source of archaeal tetraether lipids in the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(27): 9858-9863.
[16] Zhu Chun, Wakeham S G, Elling F J, et al. Stratification of archaeal membrane lipids in the ocean and implications for adaptation and chemotaxonomy of planktonic archaea[J]. Environmental Microbiology, 2016, 18: 4324-4336.
[17] Schouten S, Hopmans E C, Damsté J S S. The organic geochemistry of glycerol dialkyl glycerol tetraether lipids: a review[J]. Organic Geochemistry, 2013, 54: 19-61.
[18] Wei Yuli, Wang Jinxiang, Liu Jie, et al. Spatial variations in archaeal lipids of surface water and core-top sediments in the South China Sea and their implications for paleoclimate studies[J]. Applied and Environmental Microbiology, 2011, 77(21): 7479-7489.
[19] Ge Huangmin, Zhang Chuanlun, Dang Hongyue, et al. Distribution of tetraether lipids in surface sediments of the northern South China Sea: implications for TEX86proxies[J]. Geoscience Frontiers, 2013, 4(2): 223-229.
[20] Zhou Haoda, Hu Jianfang, Spiro B, et al. Glycerol dialkyl glycerol tetraethers in surficial coastal and open marine sediments around China: indicators of sea surface temperature and effects of their sources[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2014, 395: 114-121.
[21] Wang Jinxiang, Wei Yuli, Wang Peng, et al. Unusually low TEX86values in the transitional zone between Pearl River estuary and coastal South China Sea: impact of changing archaeal community composition[J]. Chemical Geology, 2015, 402: 18-29.
[22] Zhang Shurong, Lu Xixi, Higgitt D L, et al. Recent changes of water discharge and sediment load in the Zhujiang (Pearl River) Basin, China[J]. Global and Planetary Change, 2008, 60(3/4): 365-380.
[23] Hu Jianfang, Peng Ping′an, Chivas A R. Molecular biomarker evidence of origins and transport of organic matter in sediments of the Pearl River estuary and adjacent South China Sea[J]. Applied Geochemistry, 2009, 24(9): 1666-1676.
[24] Hopmans E C, Schouten S, Pancost R D, et al. Analysis of intact tetraether lipids in archaeal cell material and sediments by high performance liquid chromatography/atmospheric pressure chemical ionization mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2000, 14(7): 585-589.
[25] Schouten S, Forster A, Panato F E, et al. Towards the calibration of the TEX86palaeothermometer for tropical sea surface temperatures in ancient greenhouse worlds[J]. Organic Geochemistry, 2007, 38(9): 1537-1546.
[26] Hopmans E C, Weijers J W H, Schefuß E, et al. A novel proxy for terrestrial organic matter in sediments based on branched and isoprenoid tetraether lipids[J]. Earth and Planetary Science Letters, 2004, 224(1/2): 107-116.
[27] Blaga C I, Reichart G J, Heiri O, et al. Tetraether membrane lipid distributions in water-column particulate matter and sediments: a study of 47 European lakes along a north-south transect[J]. Journal of Paleolimnology, 2009, 41(3): 523-540.
[28] Zhang Yige, Zhang Chuanlun, Liu Xiaolei, et al. Methane Index: a tetraether archaeal lipid biomarker indicator for detecting the instability of marine gas hydrates[J]. Earth and Planetary Science Letters, 2011, 307(3/4): 525-534.
[29] Weijers J W H, Panoto E, Van Bleijswijk J, et al. Constraints on the biological source(s) of the orphan branched tetraether membrane lipids[J]. Geomicrobiology Journal, 2009, 26(6): 402-414.
[30] Guo Wei, Ye Feng, Xu Shendong, et al. Seasonal variation in sources and processing of particulate organic carbon in the Pearl River estuary, South China[J]. Estuarine, Coastal and Shelf Science, 2015, 167: 540-548.
[31] Huang X P, Huang L M, Yue W Z. The characteristics of nutrients and eutrophication in the Pearl River estuary, South China[J]. Marine Pollution Bulletin, 2003, 47(1/6): 30-36.
[32] Chen C T A, Wang Shulun, Lu Xixi, et al. Hydrogeochemistry and greenhouse gases of the Pearl River, its estuary and beyond[J]. Quaternary International, 2008, 186(1): 79-90.
[33] He Biyan, Dai Minhan, Zhai Weidong, et al. Hypoxia in the upper reaches of the Pearl River Estuary and its maintenance mechanisms: a synthesis based on multiple year observations during 2000-2008[J]. Marine Chemistry, 2014, 167: 13-24.
[35] Taylor K W R, Huber M, Hollis C J, et al. Re-evaluating modern and palaeogene GDGT distributions: implications for SST reconstructions[J]. Global and Planetary Change, 2013, 108: 158-174.
[36] Kim J H, Villanueva L, Zell C, et al. Biological source and provenance of deep-water derived isoprenoid tetraether lipids along the Portuguese continental margin[J]. Geochimica et Cosmochimica Acta, 2016, 172: 177-204.
[37] Turich C, Freeman K H, Bruns M A, et al. Lipids of marine Archaea: Patterns and provenance in the water-column and sediments[J]. Geochimica et Cosmochimica Acta, 2007, 71(13): 3272-3291.
[38] Xia Xiaomin, Guo Wang, Liu Hongbin. Dynamics of the bacterial and archaeal communities in the Northern South China Sea revealed by 454 pyrosequencing of the 16S rRNA gene[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2015, 117: 97-107.
[39] Wuchter C, Schouten S, Wakeham St G, et al. Temporal and spatial variation in tetraether membrane lipids of marine Crenarchaeota in particulate organic matter: implications for TEX86paleothermometry[J]. Paleoceanography, 2005, 20(3): PA3013.
[41] Wuchter C, Abbas B, Coolen M J L, et al. Archaeal nitrification in the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(33): 12317-12322.
[42] Chen Fajin, Jia Guodong. Spatial and seasonal variations in δ13C and δ15N of particulate organic matter in a dam-controlled subtropical river[J]. River Research and Applications, 2008, 25(9): 1169-1176.
[43] Pitcher A, Rychlik N, Hopmans E C, et al. Crenarchaeol dominates the membrane lipids ofCandidatusNitrososphaera gargensis, a thermophilic Group I. 1b Crenarchaeote[J]. The ISME Journal, 2010, 4(4): 542-552.
[44] Wu Weichao, Ruan Jiaping, Ding Su, et al. Source and distribution of glycerol dialkyl glycerol tetraethers along lower Yellow River-estuary-coast transect[J]. Marine Chemistry, 2014,158(1): 17-26.
Distribution of archaeal lipids in surface water suspened particulate matter of Pearl River Estuary
Guo Wei1,2, Ye Feng2, Jia Guodong2,3
(1.JiangxiProvinceKeyLaboratoryoftheCausesandControlofAtmosphericPohllution,EastChinaUniversityofTechnology,Nanchang330013,China; 2.KeyLaboratoryofMarginalSeaGeology,GuangzhouInstituteofGeochemistry,ChineseAcademyofSciences,Guangzhou510640,China; 3.StateKeyLaboratoryofMarineGeology,TongjiUniversity,Shanghai200092,China)
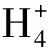
Pearl River Estuary; isoGDGTs; TEX86; surface water SPM; seasonal variation
10.3969/j.issn.0253-4193.2017.08.001
2016-11-09;
2017-02-16。
国家自然科学基金(41276072,41306102)。
郭威(1988—),男, 湖北省洪湖市人,讲师,从事河口水体不同形态碳的地球化学特征研究。E-mail:guowei@ieecas.cn
*通信作者:贾国东,男,教授,主要从事海洋有机地球化学研究。E-mail:jiagd@tongji.edu.cn
P736.21
A
0253-4193(2017)08-0001-15
郭威,叶丰,贾国东. 珠江口表层水体颗粒物中古菌四醚类脂物的分布特征[J].海洋学报,2017,39(8):1—15,
Guo Wei, Ye Feng, Jia Guodong. Distribution of archaeal lipids in surface water suspend particulate matter of Pearl River Estuary[J]. Haiyang Xuebao,2017,39(8):1—15, doi:10.3969/j.issn.0253-4193.2017.08.001

