MiR-150在大鼠垂体瘤细胞中的表达及其对细胞增殖的影响
王义彪,赵建农,王鹏程,刘小丘,彭浩
(海南省人民医院神经外科,海南海口570311)
MiR-150在大鼠垂体瘤细胞中的表达及其对细胞增殖的影响
王义彪,赵建农,王鹏程,刘小丘,彭浩
(海南省人民医院神经外科,海南海口570311)
目的探讨微小核糖核酸-150(miR-150)在大鼠垂体瘤细胞中的表达及其对垂体细胞增殖的影响。方法选用5周龄Fischer344雌性大鼠20只,按实验要求分为对照组(n=10)与观察组(垂体瘤组,n=10)。观察组大鼠皮下埋置10 mg雌激素缓释泵诱导垂体瘤模型,对照组小鼠皮下埋置生理盐水缓释泵作为对照。造模成功后,观察组及对照组分别取垂体瘤组织及正常垂体组织,采用实时荧光定量PCR(qPCR)检测miR-150的表达。培养正常的大鼠垂体细胞,用miR-150 mimics和miR-150 mimics control分别转染正常的垂体细胞,并观察其对细胞增殖功能的影响。结果结果显示观察组组织中miR-150的表达量为(0.39±0.10),明显低于对照组的(1.47±0.37),差异有统计学意义(P<0.05);转染miR-150 mimics的正常垂体细胞增殖(1.16±0.11),相对于转染miR-150 mimics control的(1.82±0.13)显著减少,差异有统计学意义(P<0.05)。结论miR-150在垂体瘤中表达下调,其可能调控垂体细胞的增殖从而抑制垂体瘤的发生。
微小核糖核酸-150;垂体瘤;垂体瘤细胞;增殖
目前垂体瘤的发病机制尚未明确,小分子RNA的出现为临床研究垂体瘤致病基因提供了新的途径,microRNA(微RNA,miRNA)作为小RNA的一种,是一种非编码调控RNA家族。研究表明miRNA参与了肿瘤形成的调节过程[1]。miR-150在胃癌、胰腺癌等肿瘤的发生发展中起到重要作用[2]。研究发现Let-7a、miR-15a、miR-16、miR-21、miR-141、miR-143、miR-145和miR-150参与了ACTH型垂体瘤的发病,且与肿瘤的大小和复发率相关性比较高[3]。本研究探讨微小核糖核酸-150(miR-150)在垂体瘤细胞中的表达及垂体瘤细胞增殖的影响。
1 材料与方法
1.1 试剂与仪器总RNA提取试剂Trizol(Invitrogen,USA),反转录试剂盒miRNA Reverse Transcription Kit(Invitrogen,USA),SYBR Green PCR Kit (BIO-RAD,USA),普通PCR仪(BIO-RAD,USA),NanoDrop 2000c紫外分光光度计(ThermoScientific,USA),荧光定量PCR仪(BIO-RAD,USA)。PCR扩增引物由生工生物公司合成,miR-150 mimics购自锐博公司。细胞培养DMEM培养基及胎牛血清购自Hyclone公司。蛋白提取试剂及BCA定量试剂盒购自碧云天公司。双荧光素酶报告基因系统(Dual-Luciferase Reporter Assay System)试剂盒购自美国Promega公司。MTT增殖检测试剂盒购自碧云天公司。
1.2 动物模型建立观察组10只Fischer344雌性大鼠;对照组10只相同体质量范围及相同周龄的Fischer344雌性大鼠。实验用大鼠均购自海南大学实验动物中心,在海南大学医学中心的SPF级动物房饲养。观察组大鼠皮下埋置10 mg雌激素缓释泵诱导垂体瘤模型,对照组小鼠皮下埋置生理盐水缓释泵作为对照。饲养室温保持18℃~20℃环境,相对湿度40%~70%。造模8周后,彩超观察垂体瘤形成情况,如无明显垂体瘤形成,继续放置缓释泵或更换新的缓释泵继续造模。观察组及对照组分别取垂体瘤组织及正常垂体组织,用于下一步实验。
1.3 细胞培养垂体细胞取自Fischer344雌性大鼠的正常垂体组织。在超净台中将用干冰保存的细胞悬液转入含有5 mL配制好的1640培养基的小号无菌细胞培养瓶中,在37℃,5%CO2细胞培养箱中进行培养。体外实验均分为两组,其中观察组转染miR-150 mimics(模拟生物体内源的miRNA),对照组转染miR-150 mimics control(miR-150 mimics的阴性对照)。按照Lipo2000转染试剂说明转染miR-150 mimics和miR-150 mimics control,之后按照相应实验需要孵育后收集细胞进行实时荧光定量PCR(qPCR)实验[4]。
1.4 RNA提取每100 mg垂体瘤组织和正常垂体组织标本中加入1 mL Trizol试剂,冰上充分裂解。将混匀后的组织标本加入Eppendorf管中,剧烈震荡15 s,静置5 min。加入氯仿0.2 mL,充分混匀后室温静置5 min。在4℃下,以12 000 r/min离心10 min。吸去上清后转入新的Eppendorf管中,加入异丙醇0.2 mL,混匀后放置于冰上10 min。再次在4℃,12 000 r/min条件下离心10 min。去上清后留取沉淀。加入l mL 75%已经预冷的乙醇,洗涤沉淀RNA。7 000 r/min离心5 min。吸去乙醇后空气干燥3 min。加入4℃DEPC水以充分溶解。
1.5 qPCR将培养好的正常垂体细胞分别通过转染miRNA-150 mimics和miR-150 mimics control提取RNA,并按照SYBR Green PCR试剂盒说明书,以合成的cDNA作为模版在荧光定量PCR仪上进行qPCR反应。PCR反应体系为:模版cDNA 0.2 μL,miR-150引物0.6 μL,SYBR Green PCR Mix 5 μL,microRNA-150上游引物为5'-CGGAATGTGAAGTACTAAGTAT-3',下游引物为Qiagen公司试剂盒提供的通用引物;以U6为作为内参,U6上游引物为5'-CTCGCTTCGGCAGCACA-3',下游引物为5'-ACGCTTC ACGAATTTGCGT-3',加DEPC水至反应总体积为10 μL。PCR反应条件为:95℃2 min,随后95℃5 s,60℃30 s,72℃30 s,共40个循环。经qRT-PCR扩增得到各目的基因的循环阈值(Ct)值,以2-ΔΔCT相对定量的方法分析miR-150与U6拷贝数的比值。
1.6 增殖实验96孔板内每孔培养7 000个正常垂体细胞,实验分为miR-150 mimics组和miR-150 mimics control组。细胞转染后使用MTT增殖检测试剂盒检测转染细胞48 h后的增殖率,酶标仪490波长下检测细胞的增殖情况。以上所有的实验至少独立重复3次[5]。
1.7 统计学方法应用SPSS22.0软件进行统计分析,计量资料以均数±标准差(x-±s)表示,两组间比较和组内比较分别采用成组t检验和配对t检验;以P<0.05表示差异有统计学意义。
2 结果
2.1 miR-150在大鼠垂体瘤组织和正常垂体组织中的表达特征观察组组织中miRNA-150的表达量为(0.39±0.10),对照组织miRNA-150的表达量为(1.47±0.37),观察组miRNA-150表达量明显低于对照组,差异有显著统计学意义(t=0.376,P<0.01)。
2.2 miR-150对正常垂体细胞增殖的影响为了验证miR-150对正常垂体细胞增殖的影响,使用miR-150 mimics和miR-150 mimics control分别转染正常垂体细胞,使用MTT法检测细胞增殖。结果显示,转染miR-150 mimics的正常垂体细胞增殖(1.16± 0.11),相对于转染miR-150 mimics control的(1.82± 0.13)显著减少,差异有统计学意义(t=1.795,P<0.05) (图1、图2)。
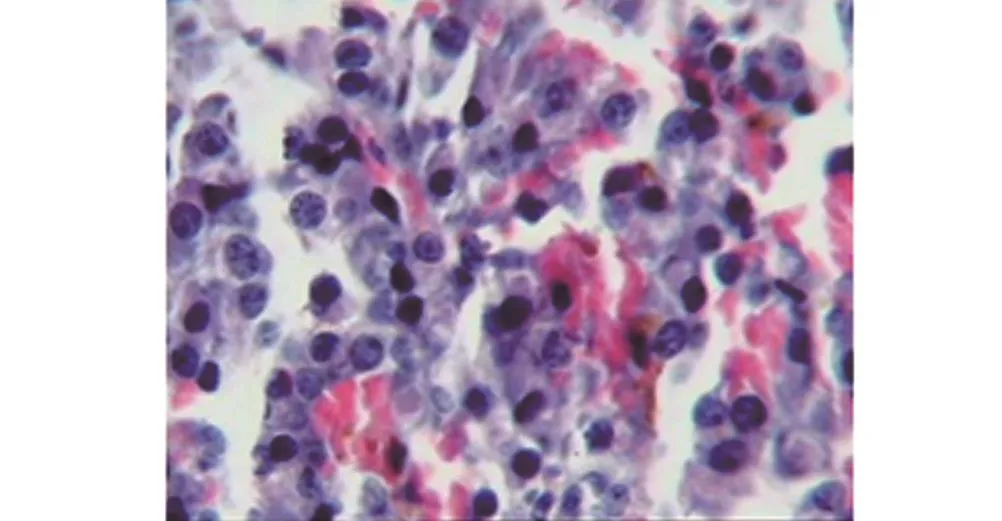
图1 转染miR-150 mimics control的正常垂体细胞明显增多(HE×400)

图2 转染miR-150 mimics的正常垂体细胞数量较少(HE×400)
3 讨论
近年来,miRNAs作为细胞生命活动的重要调控因子,越来越多地被用于研究肿瘤细胞的生命活动改变[6]。miRNAs是一类非编码小型RNA分子,几乎参与人体的每一项生理活动过程[7]。miRNAs主要在转录后水平调节细胞的生理功能,它们特异性地结合到其靶基因mRNA的3'非编码区段,调节靶基因mRNA的转录,使其降解或抑制其转录,进而抑制相应蛋白质的合成,最终发挥调节细胞的生命活动功能,如细胞的生长、增殖、分化、迁移和凋亡等[8-10]。目前,miR-150在垂体瘤中研究尚未见文献报道。本研究通过构建垂体瘤模型对miR-150在垂体瘤中的作用做了一些相关研究[11]。本研究发现miR-150在大鼠垂体瘤中的表达相对于正常垂体中明显下调,提示miR-150在垂体瘤的形成和发展中起到了一定的作用,但miR-150在垂体瘤的形成和发展中发挥什么作用,以及通过什么机制调控垂体瘤的进展目前尚不清楚[14]。垂体瘤细胞的增殖活力从某种程度上可以反映肿瘤的恶性程度[12]。通过本研究我们发现当增加miR-150的表达时可抑制正常垂体细胞的增殖,提示miR-150在垂体细胞转变为垂体瘤细胞的发展过程中,通过对垂体细胞的增殖和凋亡两个过程起到调节作用。
综上所述,miR-150在垂体瘤中的表达下调,并通过细胞学方法在模拟环境中运用miR-150 mimics干预正常的垂体细胞,降低垂体细胞增殖能力,提示miR-150参与垂体细胞向垂体瘤细胞的转变的发生和发展过程。
[1]Wm G,Berezikov E.Controlling miRNA regulation in disease[J]. Methods Mol Biol,2012,822:1-18.
[2]Palumbo T,Faucz FR,Azevedo M,et al.Functional screen analysis reveals miR-26b and miR-128 as central regulators of pituitary somatomammotrophic tumor growth through activation of the PTEN-AKT pathway[J].Oncogene,2013,32(13):1651-1659.
[3]王东.神经肽Y和miRNA在垂体瘤细胞中的作用及相关性[D].天津:天津医科大学,2011.
[4]李东.miRNA对垂体瘤细胞株中增生细胞核抗原、垂体瘤转化基因、血管内皮细胞生长因子表达的影响[J].中国老年学杂志,2015, 35(24):7033-7035.
[5]段家峰,张秋娟,施扬,等.miRNA与垂体瘤发病机制关系的研究进展[J].齐鲁医学杂志,2016,31(2):240-241.
[6]Amaral FC,Torres N,Saggioro F,et al.MicroRNAs differentially expressed in ACTH-secreting pituitary tumors[J].J Clin Endocrinol Metab,2009,94(1):320-323.
[7]Hayashi H,Sakai K,Baba H,et al.Thrombospondin-1 is a novel negative regulator of liver regeneration after partial hepatectomy through transforming growth factor-betal activation in mice[J].Hepatology, 2012,55(5):1562-1573.
[8]徐川,张怀璧,康继辉,等.miRNA在PRL型垂体瘤患者血清中的表达[J].中华中医药学刊,2016,34(7):1602-1605.
[9]许橙.miRNA-141-3P和miRNA-346在大鼠腺垂体中靶基因的识别与验证[D].长春:吉林大学,2015.
[10]RecouvreuxMV,Camilletti MA,Rifkin DB,et al.Thrombospondin-1 (TSP-1)analogs ABT-510 and ABT-898 inhibit prolactinomagrowth and recover active pituitary transforming growth factor-betal (TGF-betal)[J].Endocrinology,153(8):3861-3871.
[11]Jiang M,Mou CZ,Han T,et al.Thrombospondin-1 andtransforming growth factor-betal levels in prolactinoma and their clinical significance[J].J Int Med Res,40(4):1284-1294.
[12]Dayer C,Stamenkovic I.Recruitment of matrix metalloproteinase-9 (MMP-9)to the fibroblast cell surface by lysyl hydroxylase 3(LH3) triggers transforming growth factor-β(TGF-β)activation and fibroblast differentiation[J].J Bio Chem,2015,290(22):13763-13778.
Expression of microRNA-150 and its effect on cell proliferation of microRNA-150 in pituitary tumor cells of rats.
WANG Yi-biao,ZHAO Jian-nong,WANG Peng-cheng,LIU Xiao-qiu,PENG Hao.Department of Neurosurgery, Hainan Provincial People's Hospital,Haikou 570311,Hainan,CHINA
ObjectiveTo investigate the expression of microRNA-150(miR-150)and its effect on cell proliferation in pituitary tumor cells of rats.MethodsTwenty Fischer344 female rats of five weeks old were selected.They were divided into control group(n=10)and observation group(pituitary adenoma group,n=10)according to experiment requirements.The observation group was treated by embedding estrogen slow-release pumps subcutaneously to induce model of pituitary adenoma,and the control group were treated with saline sustained-release pump subcutaneously as control.After successful modeling,pituitary adenoma and normal pituitary tissue were respectively extracted in the observation group and the control group.The expressions of miR-150 was detected by real-time quantitative PCR(qPCR).Human pituitary adenoma cells were cultured in vitro.MiR-150 mimics and miR-150 mimics control were respectively transfected into normal pituitary cells,and their effect on cell proliferation function was observed.ResultsMiRNA-150expression in observation group was(0.39±0.10),which was significantly lower than(1.47±0.37)in control group(P<0.05).The cell proliferation of normal pituitary cells transfected with miRNA-150 mimics was(1.16±0.11),which was significantly lower than(1.82±0.13)of those transfection with miR-150 mimics control(P<0.05).ConclusionExpression of miRNA-150 is decreased in pituitary adenoma,which may regulate the proliferation of pituitary cells,thereby inhibiting the occurrence of pituitary adenomas.
miRNA-150(miR-150);Pituitary adenoma;Pituitary tumor cell;Proliferation
R-332
A
1003—6350(2017)14—2243—03
10.3969/j.issn.1003-6350.2017.14.002
2017-03-15)
海南省自然科学基金(编号:20158354)
彭浩。E-mail:haozigogo@163.com

