1,3,3,3-四氟丙烯与异三十烷汽液相平衡实验测量
孙艳军,王晓坡,刘志刚,金立文
1,3,3,3-四氟丙烯与异三十烷汽液相平衡实验测量
孙艳军1,2,王晓坡1,刘志刚1,金立文2
(1西安交通大学热流科学与工程教育部重点实验室,陕西西安 710049;2西安交通大学人居环境与建筑工程学院建筑环境与能源应用工程系,陕西西安 710049)
在原有等体积饱和法相平衡实验台的基础上,改进了可视窗口的平衡釜、调整了控温及搅拌系统。为了验证装置的可靠性,测量了温度为303.15 K时二氧化碳与季戊四醇四己酸酯的相平衡,测量结果与文献值的绝对平均偏差为0.95%,最大偏差为2.01%。在此基础上,采用改进的实验装置,测量了制冷剂1,3,3,3-四氟丙烯与异三十烷在温度为283.15~348.15 K范围内的汽液相平衡性质。利用PR状态方程及双参数的van der Waals混合规则对实验结果进行了关联,计算的平衡压力和实验压力的绝对平均偏差为0.88%,最大偏差为3.80%。此外,在温度范围为283.15~333.15 K内发现了1,3,3,3-四氟丙烯与异三十烷的不互溶现象。
相平衡;测量;二元混合物;1,3,3,3-四氟丙烯;异三十烷
引 言
在节能和环保的双重压力下,开发高效环保的制冷工质已成为制冷行业可持续发展的关键问题之一[1-5]。在替代制冷工质的研究中,霍尼韦尔和杜邦公司联合研发的新型氢氟烯烃类制冷剂1,3,3,3-四氟丙烯[HFO1234ze(E)],具有极短的大气寿命,超低的GWP值以及零ODP值,被认为是可用于替代R134a的新一代制冷剂[6-10]。
新型制冷剂应用于实际制冷系统中有许多关键技术问题亟待解决[11-17],其中寻求与制冷剂相匹配的润滑油是首要解决的问题之一。制冷剂与润滑油的相平衡性质是开展其他研究的基础,已有学者开展了HFO1234ze(E)与PECs型润滑油相平衡的研究,分析了不同PECs油的结构对其溶解度的影响[18-20]。但HFO1234ze(E)与其他类型润滑油的相平衡研究则比较少。目前在制冷系统中使用的商业润滑油如矿物油、POE(脂类)、PAG(聚二醇类)等都是复杂的混合物。因此,研究制冷剂与商业润滑油的热物理性质不具有普遍意义。异三十烷是许多矿物型润滑油的主要成分,具有明确的化学分子式及分子结构。鉴于此,本文在原有的等体积饱和法相平衡实验台的基础上,改进了相关的实验系统,并对HFO1234ze(E)与异三十烷的相平衡性质进行了实验测量,为其选取相匹配的润滑油提供了依据和支持。
1 实验系统
1.1 实验装置
在原有相平衡实验台的基础上[19,21],改进了实验本体、控温及搅拌系统。实验系统如图1所示,主要由恒温系统、可视窗口的平衡釜、磁力搅拌系统、温度压力测量系统、真空系统和样品充注系统等组成。
恒温系统由主恒温装置和低温恒温装置组成,主恒温装置由本课题组自制的恒温槽和Lauda ECO控制器组成,温度控制范围从室温到473.15 K。低温恒温装置由Lauda DLK45恒温槽和外循环系统组成,温度控制范围233.15~373.15 K。实验本体包含两个不同体积的不锈钢腔体,一个用于放置制冷剂气体,另一个是可视窗口的平衡釜。磁力搅拌系统由磁力搅拌器和转子组成,加速测量制冷剂在润滑油中的溶解速率,达到缩短测量时间的目的。实验过程中,利用Fluke公司生产的100 Ω铂电阻温度计进行温度测量。对于压力的测量,采用瑞士keller压力传感器,其最大量程为3.0 MPa。实验系统的温度、压力和组分不确定度分别为0.03 K、2.0 kPa、3.0%。
1—gas bottle; 2—thermostatic bath; 3—low-temperature thermostatic bath; 4—magnetic stirrer; 5—gas cell; 6—equilibrium cell; 7—thermometer; 8—controller; 9—pressure transducer; 10—vacuum pump; 11—standard resistance; 12—direct current; 13—multimeter; 14—computer
1.2 实验步骤
实验之前,采用称重法对气体腔体和平衡釜的容积进行了标定[22]。标定工质采用高纯二氧化碳气体(纯度为99.999%)。标定时,将已知量的二氧化碳通过小钢瓶充入腔体和平衡釜,通过电子天平(梅特勒ME204)称量小钢瓶充气前后的质量,充入气体的密度采用Refprop9.1计算得到。经过标定,改进后的实验系统中制冷剂气体腔体和平衡釜的容积分别为(73.26±0.02)cm3和(33.30±0.02)cm3。
实验测量时,首先将已知量的润滑油注入到平衡釜内,并将其连接到实验系统中,打开真空泵,对整个系统进行抽真空,抽至低于0.1 Pa。然后,关闭阀门V2和V4,开启阀门V1和V3,对气体腔体进行充气。达到实验所需压力后,关闭阀门V1和V3,记录此时的压力和温度。随后打开阀门V4,气体进入平衡釜,打开搅拌器,直至压力达到一个恒定值,记录该点的压力和温度,完成了一个相平衡实验点的测量。改变恒温槽的温度,重复上述步骤,测量下一个实验点。
1.3 相平衡的计算
由于异三十烷在实验温度范围内的饱和蒸气压很低[23],实验系统达到平衡时,平衡釜中气相组分可以认为只有制冷剂气体。HFO1234ze(E)(组分1)溶解到异三十烷(组分2)的摩尔分数为
1=1/(1+2) (1)
式中,2为异三十烷的物质的量,可以通过注入异三十烷的质量和其摩尔质量求得;1为溶解到异三十烷的制冷剂的物质的量,可以通过式(2)计算得到[18,20]

式中,ini和ini分别为制冷剂气体腔体初始的温度和压力;equilib和equilib分别为实验系统达到溶解平衡时的温度和压力;sys和cell分别为制冷剂气体腔体的体积和平衡釜的体积;2,cell为注入异三十烷的体积,通过注入润滑油的质量和密度数据计算得到[24];abs,gas为制冷剂气体的气相摩尔比体积,可由Refprop9.1获得。
1.4 装置可靠性的验证
为了验证改进后实验装置的可靠性,首先测量了温度为303.15 K时二氧化碳与季戊四醇四己酸酯(PEC6)的相平衡性质,并与文献值进行了对比。采用CO2在PEC6中的溶解度进行验证的原因就是PEC6(分子式:C29H52O8;CAS: 7445-47-8)是POE型润滑油中的一种纯组分,其测量结果具有代表性。图2给出了本文测量结果与Bobbo等[25]的实验数据对比,从图中可以看出本文的测量值与文献值吻合较好。两者的平均绝对偏差为0.95%,最大偏差为2.01%。
2 实验结果与讨论
HFO1234ze(E)(CAS No:29118-24-9)由霍尼韦尔公司提供,纯度高于99.9%(质量),异三十烷(CAS No:111-01-3)由阿拉丁化学试剂有限公司提供,纯度高于99.99%(质量)。表1给出了283.15~348.15 K内HFO1234ze(E)与异三十烷的相平衡实验数据。从表1可以看出,在相同温度下,HFO1234ze(E)在异三十烷中的溶解度随着压力的升高而增大。在相同压力时,随着温度的升高而减小。
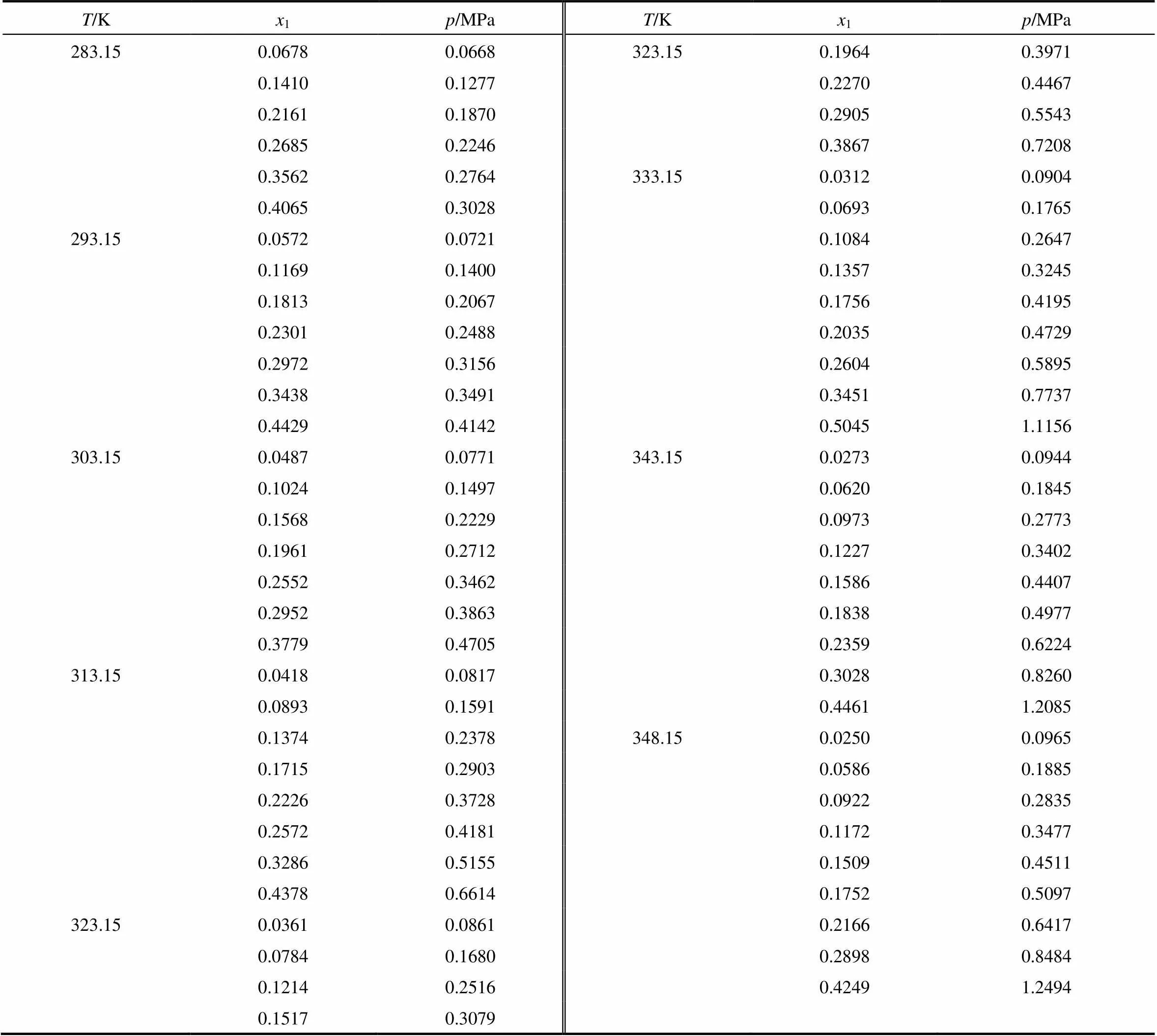
表1 HFO1234ze(E)与异三十烷的相平衡实验数据
值得注意的是,在温度为283.15~333.15 K范围内,在HFO1234ze(E)相应温度的饱和压力附近出现不互溶的现象,如图3所示。由于实验条件的限制,无法定量获得每条等温线上不互溶的临界点。但可以从实验测量的趋势上定性分析得到每条等温线上的临界值,温度为283.15 K时出现不互溶现象在溶解度为0.47左右,温度为293.15 K时为0.46左右,温度为303.15 K时为0.45左右,温度为313.15 K时为0.44左右,温度为323.15 K时为0.43左右,温度为333.15 K时为0.42左右。
本文采用PR状态方程[26]结合双参数van der Waals混合规则[27]对所测量得到的实验数据进行关联,建立相关模型。HFO1234ze(E)的临界性质及偏心因子等参数由Refprop9.1获得,异三十烷的临界参数及偏心因子由文献[28-29]提供。van der Waals混合规则表达式如下

k=Kx+Kx(4)
(5)
式中,K和K为相互作用系数。通过实验值和模型计算值绝对平均偏差的最小值[式(6)]来求出每个温度下K和K的最优值
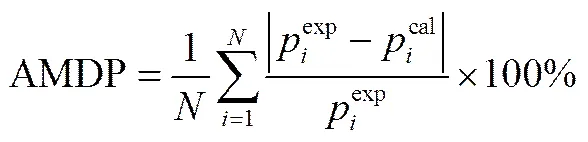
式中,为实验数据点的个数;exp和cal分别为实验压力和计算压力。图4给出了不同温度下HFO1234ze(E)在异三十烷中的溶解度变化情况,表2列出了不同温度的K和K关联值及计算压力的绝对平均偏差(AARD)。图5给出了不同温度下实验值与模型计算值的相对偏差,计算的平衡压力和实验压力的绝对平均偏差为0.88%,最大偏差为3.80%。从图和表中可以看出,PR状态方程结合双参数van der Waals混合规则能很好地关联HFO1234ze(E)与异三十烷的相平衡性质。
图4 不同温度下HFO1234ze(E)与异三十烷的相平衡
Fig. 4 Phase equilibrium of HFO1234ze(E) with squalaneat at different temperatures
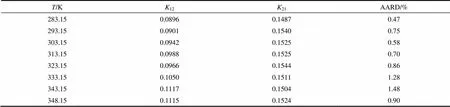
表2 Kij参数值和压力平均偏差
3 结 论
对原有的汽液相平衡实验台进行了改进,测量不确定度为3.0%。利用改进后的实验装置测量了HFO1234ze(E)与异三十烷的相平衡性质,实验结果表明,溶解度随着温度的升高和压力的降低而减小,且温度低于333.15 K时发现了不互溶现象。采用PR状态方程和双参数van der Waals混合规则对实验结果进行关联,结果表明该模型能够很好地计算HFO1234ze(E)与异三十烷的相平衡性质。
符 号 说 明

a——状态方程中分子间的引力对压力的校正项 b——状态方程中考虑分子本身的体积校正项 K——交互作用系数 n——物质的量,mol p——压力,MPa T——温度,K V——体积,m3 v——摩尔比体积,m3·mol-1 x——摩尔分数,%
References
[1] 马一太, 田华. 制冷空调关键节能减排技术的现状及进展[J]. 机械工程学报, 2009, 45(3): 49-56. MA Y T, TIAN H. Actuality and development of pivotal energy-saving and emission reduction technology on refrigeration and air-condition[J]. Journal of Mechanical Engineering, 2009, 45(3): 49-56.
[2] 刘志刚, 吴江涛, 陈圣坤. 冰箱空调替代制冷剂的研究进展(上)[J]. 西安交通大学学报, 2005, 39(7): 661-665. LIU Z G, WU J T, CHEN S K. Recent progress on alternatives to CFC12 and HCFC22 (Ⅰ)[J]. Journal of Xi’an Jiaotong University, 2005, 39(7): 661-665.
[3] 刘志刚, 吴江涛, 陈圣坤. 冰箱空调替代制冷剂的研究进展(下)[J]. 西安交通大学学报, 2005, 39(7): 666-669. LIU Z G, WU J T, CHEN S K. Recent progress on alternatives to CFC12 and HCFC22 (Ⅱ)[J]. Journal of Xi’an Jiaotong University, 2005, 39(7): 666-669.
[4] Directive 2006/40/EC of the European parliament and of the council of 17 May 2006 relating to emissions from air-conditioning systems in motor vehicles and amending council directive 70/156/EEC[R]. Union OJE, 2006.
[5] Regulation(EU) No. 517/2014 of the European parliament and of the council of 16 April 2014 on fluorinated greenhousegases and repealing regulation (EC) No 842/2006[R]. Union OJE, 2014.
[6] Calm J M. The next generation of refrigerants historical review consideration and outlook[J]. International Journal of Refrigeration, 2008, 31: 1123-1133.
[7] MclindenM O, Kazakov A F, Brown J S,. A thermodynamic analysis of refrigerants: possibilities and tradeoffs for low-GWP refrigerants[J]. International Journal of Refrigeration, 2014, 38: 80-92.
[8] SANCHEZ D, CABELLO R, LIOPIS R,. Energy performance evaluation of R1234yf, R1234ze(E), R600a, R290 and R152a as low-GWP R134a alternatives[J]. International Journal of Refrigeration, 2016, 74: 269-282.
[9] MOTA-BABILONI A, NAVARRO-ESBRI J, MOLES F,. A review of refrigerant R1234ze(E) recent investigations[J]. Applied Thermal Engineering, 2016, 95: 211-222.
[10] YATAGANBABA A, KILICARSLAN A, KURTBAS I. Exergy analysis of R1234yf and R1234ze as R134a replacements in a two evaporator vapour compression refrigeration system[J]. International Journal of Refrigeration, 2015, 60: 26-37.
[11] 邱金友, 张华, 余晓明, 等. 新型制冷剂R1234ze(E)水平圆管内流动沸腾换热特性[J]. 化工学报, 2016, 67(6): 2255-2262. QIU J Y, ZHANG H, YU X M,. Flow boiling heat transfer characteristic of refrigerant R1234ze(E) in horizontal circular tube[J]. CIESC Journal, 2016, 67(6): 2255-2262.
[12] 杨富方, 段远源, 杨震. R1234yf + CO2和R1234ze(E) + CO2二元混合物的比容平移Soave-Redlich-Kwong方程[J]. 化工学报, 2016, 67(S2): 14-19. YANG F F, DUAN Y Y, YANG Z. Volume translation Soave-Redlich-Kwong equation of state for binary mixtures of R1234yf + CO2and R1234ze(E) + CO2[J]. CIESC Journal, 2016, 67(S2): 14-19.
[13] Marsh K N, Kandil M E. Review of thermodynamic properties of refrigerants + lubricant oils[J]. Fluid Phase Equilibria, 2002, 199: 319-334.
[14] 田田, 杨昭, 吴曦, 等. RE170、RE170/R227ea与矿物油的互溶性评价[J]. 化工学报, 2015, 66(6): 2005-2010. TIAN T, YANG Z, WU X,. Miscibility evaluation of RE170 and RE170/R227ea with a mineral oil[J]. CIESC Journal, 2015, 66(6): 2005-2010.
[15] Wang X P, Sun Y J, Gong N. Experimental investigations for the phase equilibrium of R1234yf and R1234ze(E) with two linear chained pentaerythritol esters[J]. Journal of Chemical Thermodynamics. 2016, 92: 66-71.
[16] Bobbo S, Zilio C, Scattolini M,. R1234yf as a substitute of R134a in automotive air conditioning. Solubility measurements in two commercial PAG oils[J]. International Journal of Refrigeration, 2014, 40: 302-308.
[17] Marcelino Neto M A, Franca R M, Barbosa J R. Convection-driven absorption of R-1234yf in lubricating oil[J]. International Journal of Refrigeration, 2014, 44: 151-160.
[18] Sun Y J, Wang X P, Gong N,. Solubility of-1,3,3,3-tetrafluoropropene (R1234ze(E)) in pentaerythritol ester heptanoic aid (PEC7) and in pentaerythritoltetranonanoate (PEC9) between 283.15 K and 353.15 K[J]. Fluid Phase Equilibria, 2015, 387: 154-159.
[19] Sun Y J, Wang X P, Gong N,. Solubility of-1,3,3,3-tetrafluoroprop-1-ene in pentaerythritol- tetrapentanoate (PEC5) in the temperature from 283.15 to 353.15 K[J]. International Journal of Refrigeration, 2014, 48: 114-120.
[20] Wang X P, Sun Y J, Kang K. Experimental investigation for the solubility of R1234ze(E) in pentaerythritoltetrahexanoate and pentaerythritol- tetraoctanoate[J]. Fluid Phase Equilibria, 2015, 400: 38-42.
[21] 王晓坡, 孙艳军, 龚娜, 等. DME与POE基础油溶解度的实验与理论研究[J]. 工程热物理学报, 2015, 36(5): 937-940. WANG X P, SUN Y J, GONG N,. Measurement and theoretical research of solubility of DME in POE oil[J]. Journal of Engineering Thermophysics, 2015, 36(5): 937-940.
[22] SUN Y, WANG X, GONG N,. Solubility of dimethyl ether in pentaerythritol tetrahexanoate (PEC6) and in pentaerythritol tetraoctanoate (PEC8) between (283.15 and 353.15) K[J]. Journal of Chemical and Engineering Data, 2014, 59: 3791-3797.
[23] Hong H, Gong M Q, Wu J F. Solubility measurements of 1,1,1,2-tetrafluoroethane (R134a) and of propane in squalane at temperatures from (325 to 400) K and pressures from (0.1 to 1) MPa[J]. Journal of Chemical and Engineering Data, 2006, 51: 2270-2273.
[24] Fandino O, Pensado A S, Lugo L,. Compressed liquid densities of squalane and pentaerythritol tetra-(2-ethylhexanoate)[J]. Journal of Chemical Engineering Data, 2005, 50: 939-946.
[25] Bobbo S, Pernechele F, Fedele L,. Solubility measurements and data correlation of carbon dioxide in pentaerythritoltetrahexanoate (PEC6)[J]. Journal of Chemical Engineering Data, 2008, 53: 2581-2585.
[26] Peng D Y, Robinson D B. A new two-constant equation of state[J]. Industrial and Engineering Chemistry Fundamentals, 1976, 15: 59-64.
[27] VAN DER WAALS J. Molekulartheorie eines körpers, der aus zwei verschiedenen stoffen besteht[J]. Zeitschrift für Physikalische Chemie, 1890, 5: 133-173.
[28] VonNiederhausern D M, Wilson G M, Giles N F. Critical point and vapor pressure measurements at high temperatures by means of a new apparatus with ultralow residence times[J]. Journal of Chemical Engineering Data, 2000, 45: 157-160.
[29] Nikitin E D, Popov A P. Vapor-liquid critical properties of squalane measured by the pulse-heating technique[J]. Fluid Phase Equilibria, 2005, 237: 16-20.
Measurement of gas-liquid phase equilibrium for-1,3,3,3-tetrafluoropropene and squalane
SUN Yanjun1,2, WANG Xiaopo1, LIU Zhigang1, JIN Liwen2
(1Key Laboratory of Thermo-Fluid Science and Engineering, Ministry of Education, Xi’an Jiaotong University, Xi’an 710049, Shaanxi, China;2Department of Building Environment and Energy Engineering, School of Human Settlements and Civil Engineering, Xi’an Jiaotong University, Xi’an 710049, Shaanxi, China)
The gas-liquid phase equilibrium experimental system based on the isochoric saturation method in the laboratory was improved. The visual equilibrium cell, thermostatic system and magnetic stirring system were modified. In order to check the reliability and accuracy of the new system, the phase equilibrium of carbon dioxide and pentaerythritol tetrahexanoate was measured at 303.15 K, the absolute average deviation was 0.95% and the maximum deviation was 2.01% compared with the reference data. The expanded uncertainties of temperature, pressure and mole fraction are 0.03 K, 2.0 kPa, and 3.0%, respectively. Phase equilibria behavior of-1,3,3,3-tetrafluoropropene and squalane was determined at temperature range from 283.15 K to 348.15 K. The experimental data were correlated with Peng-Robinson equation of state and van der Waals mixing rule using two interaction parameters. The absolute average deviation between experimental data and calculated values for pressure was 0.88%, and the maximum deviation was 3.80%. In addition, the immiscibility phenomenon for-1,3,3,3-tetrafluoropropene and squalane mixtures was found in the temperature range from 283.15 K to 333.15 K.
phase equilibria; measurement; binary mixture;-1,3,3,3-tetrafluoropropene; squalane
10.11949/j.issn.0438-1157.20170284
TK 121
A
0438—1157(2017)08—2979—06
王晓坡。第一作者:孙艳军(1984—),男,博士,讲师。
国家自然科学基金项目(51606148)。
2017-03-23收到初稿,2017-04-28收到修改稿。
2017-03-23.
Prof.WANG Xiaopo, wangxp@xjtu.edu.cn
supported by the National Natural Science Foundation of China (51606148).

