两种化学平衡体系中各参数的对比分析
江苏 李宗来
两种化学平衡体系中各参数的对比分析
江苏 李宗来
在化学平衡特别是判断两平衡体系是否是等效平衡时一重要标准是:在平衡状态时相同组分的百分含量(体积百分含量、物质的量百分含量、质量百分含量等)是否一致,可见厘清平衡体系中的百分含量等参数的变化举足轻重。本文对比分析两种平衡体系中各参数的变化以期能抛砖引玉。
一、反应前后气体分子总数减小的平衡体系的比较(自身反应所引发的体积变化)
在下列a(恒温恒容)、b(恒温恒压)的容器中各投入2mol的NO2,发生反应,比较两体系达到平衡状态时各参数对比分析如下表:

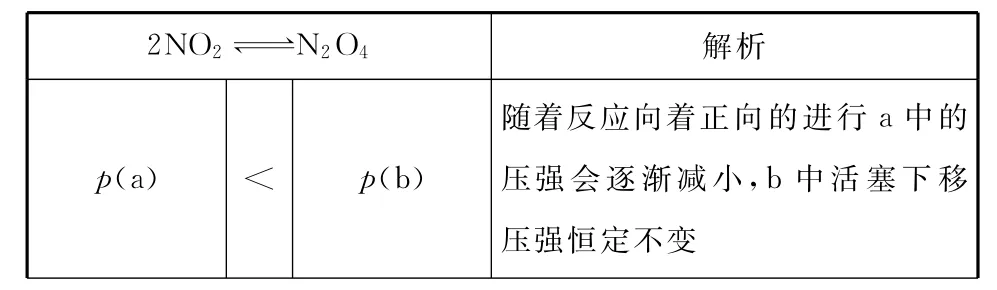
2NO2N2O4解析p(a)<p(b)随着反应向着正向的进行a中的压强会逐渐减小,b中活塞下移压强恒定不变
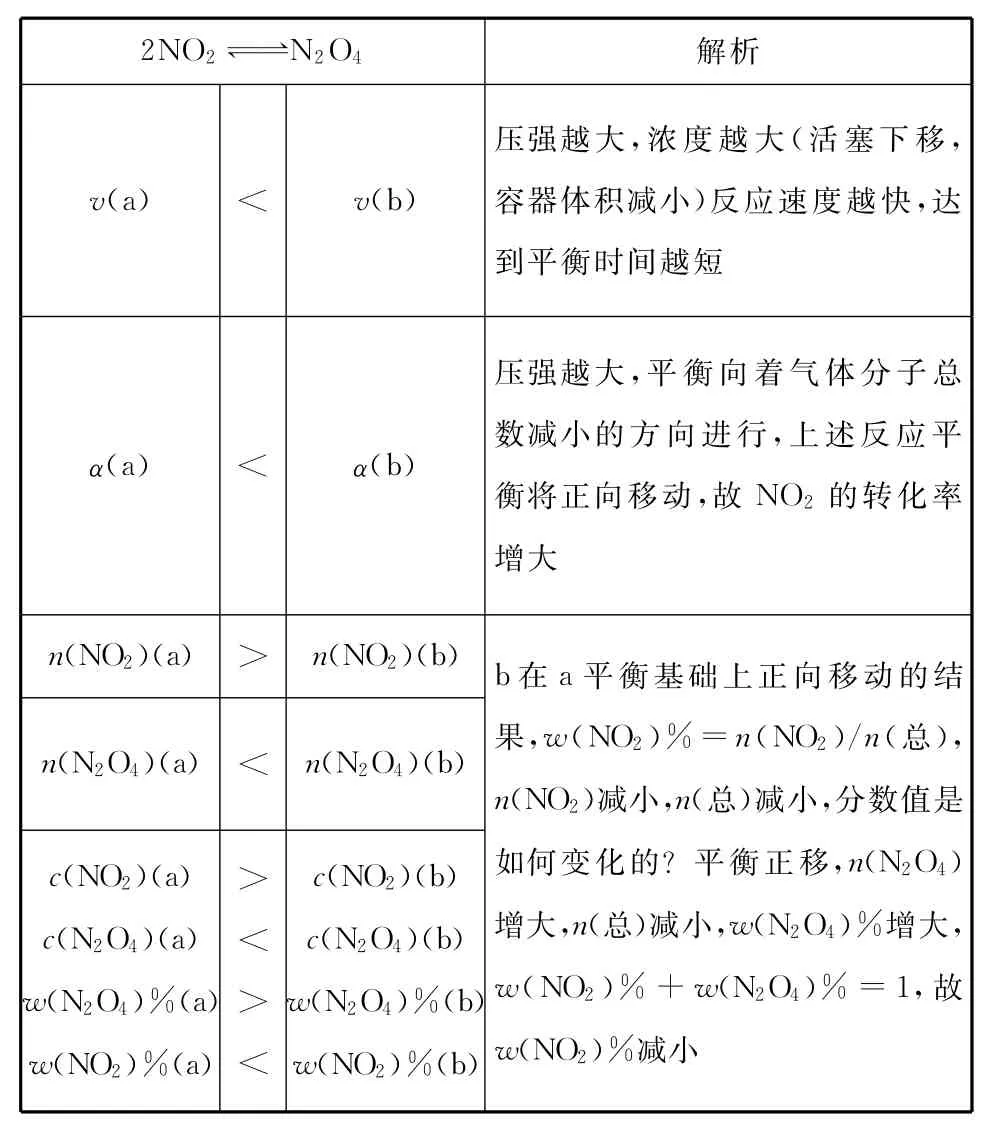
续表
例1 体积相同的甲乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为α%,则乙容器的转化率( )
A.等于α%B.大于α%
C.小于α%D.无法判断
解析:2SO2+O22SO3为正反应方向体积总数减小的反应,当甲容器保持体积不变,平衡时甲容器中SO2的转化率为α%,而对于乙来说,由于该反应的正反应方向为气体体积减小的方向,所以,为了保持体系内压强不变,相当于在甲的基础上增大压强,所以平衡继续向正反应方向移动,即乙容器中SO2的转化率大于α%,答案选B。
变式练习 两个体积相同的密闭容器A、B,在A中充入SO2和O2各1mol,在B中充入SO2和O2各2mol,加热到相同温度,有如下反应对此反应,下述不正确的是( )
A.反应速率:B>A
B.SO2的转化率:B>A
C.平衡时SO2的百分含量:B>A
D.平衡时容器的压强:B>A
解析:根据题意知,B与A相比相当于增大压强,A项,根据题意知,B中反应物浓度大于A,反应物浓度越大反应速率越大,所以反应速率B>A,故A正确;B项,B中反应物物质的量是A的两倍,将B容器体积增大到A的两倍,该反应达到平衡状态时,再将B体积缩小的原来体积,与A相比相当于增大压强,增大压强平衡向正反应方向移动,所以B中SO2的转化率大于A,故B正确;C项,根据B知,B中SO2的转化率大于A,所以平衡时SO2的百分含量B<A,故C错误;D项,平衡时B中混合物的物质的量大于A,所以气体压强B>A,故D正确;故答案选C。
二、反应前后气体分子总数增大的平衡体系的比较(充入无关气体所引发的体积变化)
在下列a(恒温恒容)、b(恒温恒压)的容器中各投入N2O4,发生反应,达到平衡时体积都为V,比较两体系中都充入氦气,重新达到平衡状态时各参数的变化分析如下表:

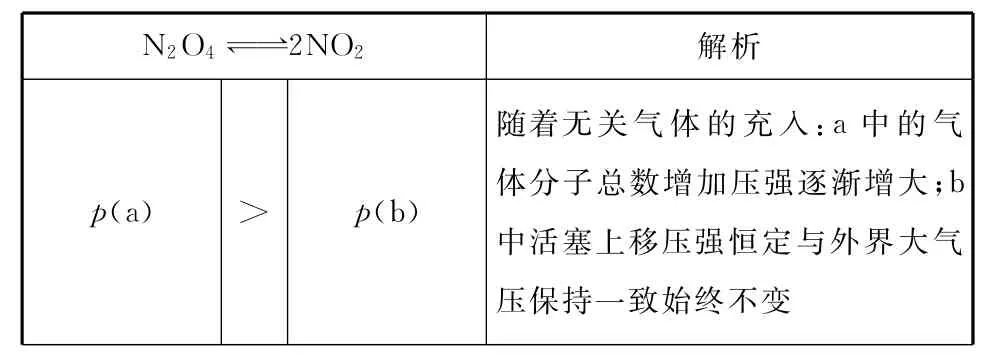
_______N2O42NO2解析p(a)>p(b)随着无关气体的充入:a中的气体分子总数增加压强逐渐增大;b中活塞上移压强恒定与外界大气压保持一致始终不变
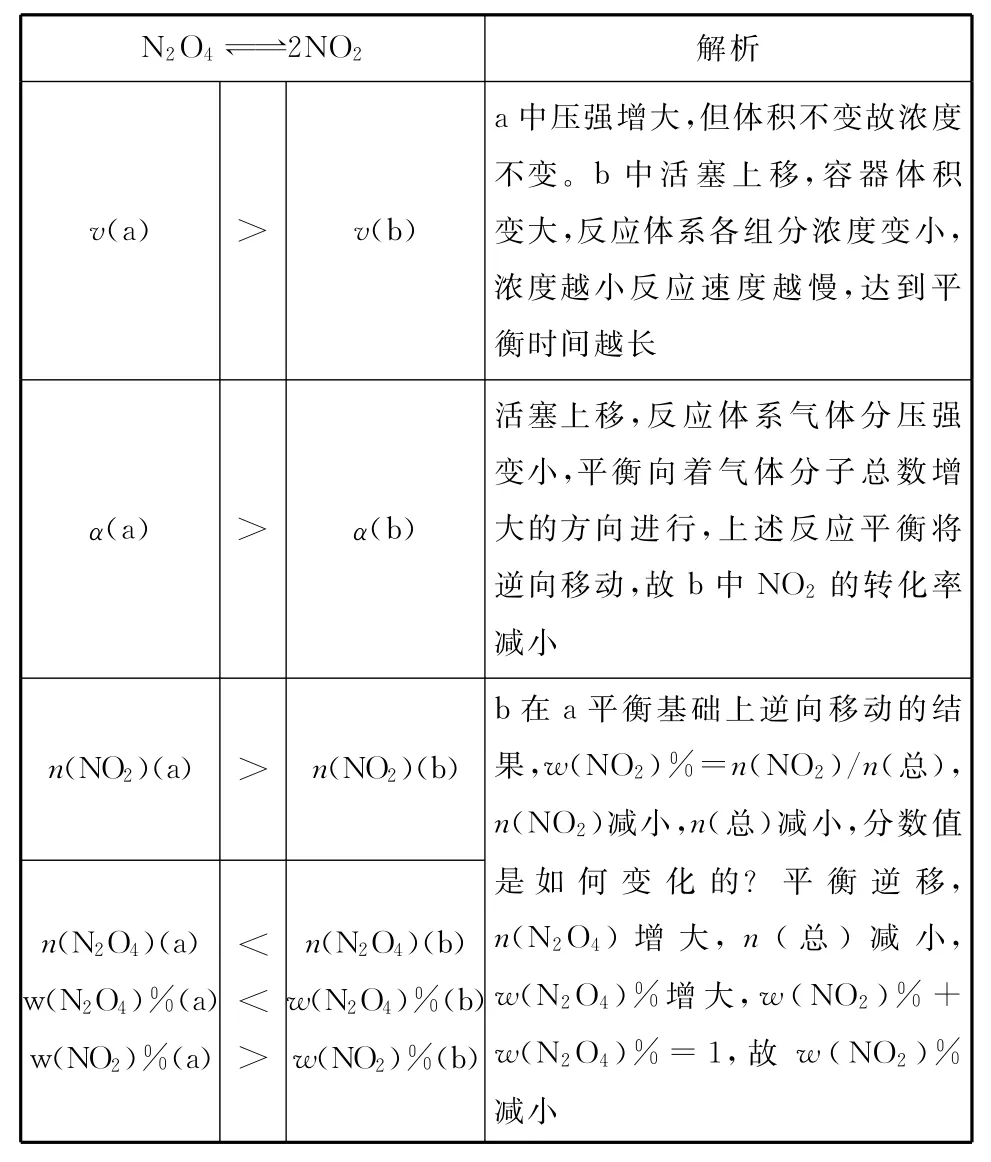
续表
例2 有两只密闭容器A和B,A能保持恒压,B能保持恒容。起始时向容积相等的A、B中加等量的SO3,使之发生反应,并达到平衡。则:(填“>”“=”或“<”;“左”或“右”;“增大”“减小”或“不变”)
(1)达到平衡时所需要的时间:t(A)________t(B),SO3的转化率:α(A)________α(B)。
(2)起始时两容器中的反应速率:v(A)________v(B),反应过程中的反应速率:v(A)________v(B)。
(3)达到平衡时,在两容器中分别通入等量的氩气。A中的化学平衡向_________移动,B中的化学反应速率________。
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中SO3的百分含量________,B容器中SO2的百分含量__________。
解析:(1)由于A可保持恒压,B可保持恒容,A中压强高于B中,因此A中的SO2转化率比B容器中高。
(2)起始反应物浓度相等,故反应速率相等;反应过程中,随着反应的进行,A的压强不变,体积会变小,反应物浓度相对B要大,故A反应速率大于B。
(3)如果加入等量氩气,则A中的反应物及生成物所占有的分压减小,因此A容器中平衡左移,B中反应物与生成物所占分压不变,因此反应平衡不变。
(4)因为恒压,A容器中SO3的含量不变;因为恒容B压强增大,平衡右移,B中SO2的物质的量的分数减小,百分含量减小。
答案:(1)< > (2)= > (3)左 不变 (4)不变 减小
(作者单位:江苏省响水中学)

