铁及其化合物知识剖析及高考考查趋势
安徽 尉言勋 李怀远
铁及其化合物知识剖析及高考考查趋势
安徽 尉言勋 李怀远
铁及其化合物是元素及其化合物知识的高频考点,由于铁是可变价元素,相关化学反应较多,可以与氧化还原反应、物质的量、原电池等相关知识结合,在高考中占有重要地位,考试题型灵活多变,要想在此类试题的解答中拿高分,必须储备铁及其化合物的相关基础知识和一定的解题技巧,下面就铁及其化合物的主要内容结合近年高考真题做以下归纳总结,希望对同学们的复习备考有所帮助。
一、铁及其化合物知识脉络

二、铁三角及铁盐(Fe3+)和亚铁盐(Fe2+)的检验
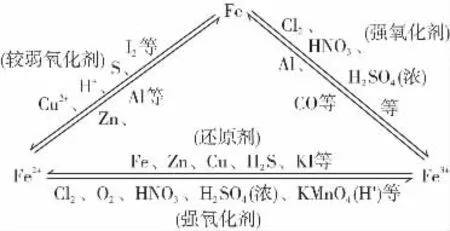
1.铁三角
提示:
(1)价态观:从铁元素三种价态的相互转化(铁三角关系)去认识铁及其化合物间的氧化还原反应规律。
(2)类别观:如铁是一种比较活泼的过渡金属,氧化亚铁、氧化铁为碱性氧化物,氢氧化亚铁、氢氧化铁为不溶性弱碱,氯化铁为强酸弱碱盐,由此去分析理解它们各自所具有的性质。
(3)铁元素的原子在化学反应中,当遇弱氧化剂(如S、H+、Cu2+、I2等)时,生成+2价铁的化合物,当遇到强氧化剂(如Cl2、Br2、HNO3等)时,生成+3价铁的化合物。
(4)Fe2+具有氧化性和还原性,但主要表现还原性;Fe3+具有氧化性,与S2-、I-、S等能发生氧化还原反应。
(5)Fe3+是典型的弱碱阳离子,与C、[Al(OH)4]-等在溶液中发生双水解,不能够共存。
(6)亚铁盐、铁盐的存放方法:亚铁盐溶液——加入少量铁屑以防止Fe2+被氧化;铁盐溶液——加入少量相应的酸溶液以防止Fe3+水解。
2.Fe2+和Fe3+的检验

__检验方法_______亚铁盐(Fe2+)铁盐(Fe3+)直接观察颜色______________________________________________________浅绿色棕黄色氢氧化物沉淀的颜色滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最后变为红褐色滴加NaOH溶液,出现红褐色沉淀KSCN溶液滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色滴加KSCN溶液或NH4SCN溶液,溶液立即变为血红色苯酚溶液____溶液不呈紫色___________溶液呈紫色溴水或高锰酸钾褪色不褪色淀粉-碘化钾试纸不变蓝变蓝
三、铁及其化合物在高考中的考查形式
1.铁及其化合物与原电池结合的考查
【例1】(2016北京,节选)用零价铁(Fe)去除水体中的硝酸盐(N)已成为环境修复研究的热点之一。

①作负极的物质是________。
②正极的电极反应式是___________________________。
2.铁及其化学在离子方程式中的考查
【例2】(2014安徽)下列有关Fe2(SO4)3溶液的叙述正确的是( )
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
C.和Ba(OH)2溶液反应的离子方程式:Fe3++
D.1L0.1mol/L该溶液和足量的Zn充分反应,生成11.2g Fe
【解析】Fe3+与C6H5OH发生显紫色,A项错误;离子方程式电荷不守恒,B项错误;离子方程式中离子不符合化学式的配比,正确的离子方程式为,C项错误;1L 0.1mol/L的该溶液中含有n(Fe3+)=1L×0.2mol/L=0.2mol,利用原子守恒可知,加入足量锌可置换出铁的质量为0.2mol×56g/mol=11.2g,D项正确。
【答案】D
3.铁及其化合物在化学计算中的考查
【例3】(2016上海)某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mL Cl2,恰好将Fe2+完全氧化。x值为( )
A.0.80 B.0.85
C.0.90 D.0.93
【解析】由题意,消耗标准状况下氯气112mL,即0.005mol,根据电子守恒可知原氧化物中二价铁元素为0.01mol,则根据正负化合价代数和相等,可得x=0.8,所以A正确。
【答案】A
4.铁及其化合物在无机推断中的考查
【例4】(2015浙江)某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
【解析】工业流程除杂类题目,流程设计意图把Fe2O3、Al2O3转化为硫酸盐,除去不溶物SiO2,硫酸不引入杂质,加入铁粉的目的是和足量的酸及生成的Fe3+反应,A正确;SiO2不溶于硫酸,所以固体1中有SiO2,控制pH是为了除去Al3+,B正确;Fe2+容易被氧化,所以得到产品的过程中,要防止其氧化和分解,C正确;由于溶液1中铁以Fe3+形式存在,加NaOH至过量,生成Fe(OH)3,最终只能够得到Fe2(SO4)3,所以D错误。
【答案】D
5.铁及其化合物与热化学方程式结合的考查
【例5】(2015四川,节选)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。

2Fe(s)+2C(s)+3O2(g)2FeCO3(s) ΔH=-1 480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是_____________________。
【解析】三个热化学方程式依次编号为①②③式,可由①+4×②-2×③得到目标方程式(g),根据盖斯定律ΔH=-1 648kJ/mol+4×(-393kJ/mol)-2×(-1 480kJ/mol)=-260 kJ/mol。
【答案】4FeCO3(s)+O2(g)2Fe2O3(s)+4CO2(g)ΔH=-260kJ/mol
6.铁及其化合物在水解平衡中的考查
【例6】(2015天津,节选)FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(3)FeCl3在溶液中分三步水解:Fe3++H2OFe(OH)2++H+K1

以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_______________。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为欲使平衡正向移动可采用的方法是________(填序号)。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是_________________。
【解析】Fe3+的水解分为三步,且水解程度逐渐减弱,所以水解平衡常数逐渐减小,所以K1>K2>K3;欲使平衡正向移动,因为水解是吸热反应,降温平衡逆向移动,a错误;加水稀释,平衡正向移动,b正确;加入NH4Cl,增加了H+浓度,平衡逆向移动;加入NaHCO3降低H+浓度,平衡正向移动,d正确,答案选bd。从离子方程式可知,H+离子浓度影响高浓度聚合氯化铁的生成,所以关键步骤是调节溶液的pH。
【答案】(3)K1>K2>K3bd 调节溶液的pH
7.铁及其化合物在方程式缺项配平中的考查
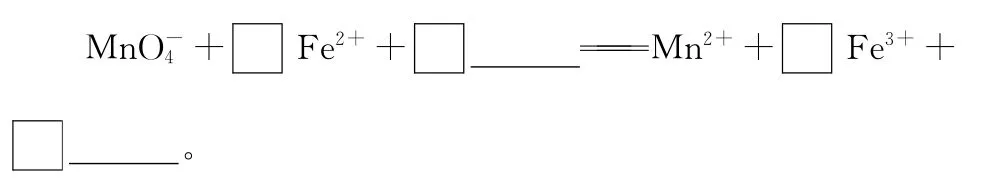
【答案】5 8H+5 4H2O
8.铁及其化合物在化学实验中的考查
【例8】(2015北京)在通风橱中进行下列实验:

步骤现象Fe表面产生大量无色气泡,液面上方变为红棕色Fe表面产生少量红棕色气泡后,迅速停止Fe、Cu接触后,其表面产生红棕色气泡
下列说法中不正确的是( )
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【解析】Ⅰ是铁与稀硝酸反应生成无色气体NO,NO被空气中氧气氧化成红棕色的NO2气体,A正确;Ⅱ的现象是因为铁发生了钝化,铁表面生成了致密的氧化物薄膜,阻止铁进一步反应,B正确;由于Ⅱ中发生了钝化,不能用来比较稀硝酸、浓硝酸氧化性强弱,物质氧化性强弱可以通过得失电子能力大小来分析,C错误;Ⅲ中铁、铜都能与硝酸发生反应,二者接触,符合原电池构成条件,可以通过在Fe、Cu之间连接电流计,判断Fe是否被氧化,D正确。
【答案】C
(作者单位:安徽省砀山四中)

