滴定实验的类型归纳与解题技巧
广东 周曼文
滴定实验的类型归纳与解题技巧
广东 周曼文
酸碱中和滴定是高中化学中的一个重要定量实验,既是学习的重点和难点,又是高考化学的热点。由“酸碱中和滴定”拓展、延伸和演变的滴定有:氧化还原滴定、配位(络合)滴定、沉淀滴定和电势滴定,还有返滴定法和双指示剂滴定法(该法常用于测定混合碱的含量,教材中有介绍,但目前高考题中较少出现),等等。
这些滴定实验试题的解答技巧,我也归纳为“三步法”:①确定滴定反应。②构建各物质关系式。③运用相关概念、原理解答问题(实验操作、仪器使用、指示剂选择、滴定终点判断、误差分析、定量计算等知识),本文主要谈谈计算技巧,仅供参考。
1.酸碱中和滴定
例1 (2015北京,27节选)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用x mol/L HCl溶液滴定,消耗y mL HCl溶液,海水中溶解无机碳的浓度=________mol/L。
【解题三步法】
第一步:根据题中信息,确定滴定反应
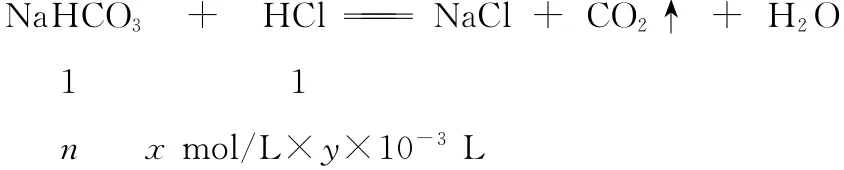
第二步:抓关键元素守恒,构建各物质关系式
碳元素守恒:NaHCO3的碳原子源自CO2,确认n(CO2)=n(HCO-3)
该滴定过程物质转化的关系式为CO2~HCO-3~HCl
解得n(CO2)=n(HCl)=xy×10-3mol
第三步:运用相关概念、原理解答问题
由n(CO2)=xy×10-3mol 得c(CO2)=xy/z mol/L
2.氧化还原滴定
例2 (2016天津,9节选)水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。

Ⅰ.测定原理
碱性体积下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++↓;酸性条件下,MnO(OH)2将I-氧化为I2:②MnO(OH)2+H2O(未配平);用Na2S2O3标准溶液滴定生成的I2:
Ⅱ.测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mL MnSO4无氧溶液(过量)2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d.搅拌并向烧瓶中加入2mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.010 00mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。
回答下列问题:
(6)步骤e中达到滴定终点的标志为_____________。若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:________(填“是”或“否”)。
【答案】(6)溶液蓝色褪去(半分钟内不变色) 9.0 是
【解题三步法】
第一步:确定滴定反应

第二步:由反应①②③各物质的配比,构建各物质关系式

第三步:运用相关概念、原理解答问题
3.电势滴定
例3 (2015浙江,29节选)某学习小组按如下实验流程探究海带中碘含量的测定。
实验(一) 碘含量的测定

取0.010 0mol·L-1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:

V(AgNO3)/mL 15.00 19.00 19.80 19.98 20.00 20.02 21.00 23.00 25.00____E/mV____-225-200-150-100 50.0 175 275 300 325
请回答:
(2)①根据表中数据绘制滴定曲线:

②该次滴定终点时用去AgNO3溶液的体积为________mL,计算得海带中碘的百分含量为________%。
【答案】(2)①

②20.00mL 0.635%
【解题三步法】
第一步:确定滴定反应

第二步:构建关系式
该滴定过程转化的关系式为Ag+~I-
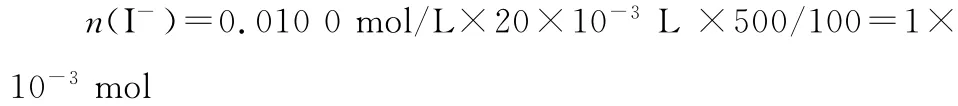
第三步:运用相关概念、原理解答问题

4.配位(络合)滴定
例4 (2016浙江,29节选)无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2。(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式
②测定时,先称取0.250 0g无水MgBr2产品,溶解后,用0.050 0mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是________(以质量分数表示)。
【答案】②97.5%
【解题三步法】
第一步:确定滴定反应

第二步:构建关系式
该滴定过程转化的关系式为MgBr2~Mg2+~Y4-
n(MgBr2)=0.050 0mol/L×26.5×10-3L=1.325×10-3mol
第三步:运用相关概念、原理解答问题

5.沉淀滴定
例5 已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10-10和1.12×10-12。分析化学中,测定含氯的中性溶液中Cl-的含量,以K2CrO4作指示剂,用AgNO3溶液滴定。滴定过程中首先析出沉淀________,达到滴定终点的实验现象为___________________,滴定终点时,溶液中的CrO2-4浓度为________mol·L-1时合适。
【答案】AgCl 滴最后一滴AgNO3溶液时,有砖红色沉淀现象出现则达到终点 2.8×10-3
【解题三步法】
第一步:依题意Ag+与Cl-、CrO2-4都生成沉淀,利用溶度积计算比较两者所需Ag+,Ksp(AgCl)=c(Ag+)·c(Cl-)=2×10-10,因c(Ag+)=c(Cl-)解得c(Ag+)=1.4×10-5mol/L;Ksp(Ag2CrO4)=c2(Ag+)·c(CrO2-4)=c2(Ag+)·[c(Ag+)/2]=1.12×10-12解得c(Ag+)=1.3×10-4mol/L。

第二步:构建关系式
因沉淀顺序,遵循溶解度最小原则,Ag+与Cl-、CrO2-4都能生成沉淀时,生成AgCl沉淀所需c(Ag+)小,先沉淀。达到终点,滴定反应完全,指示剂反应刚开始。
计算指示剂c(CrO2-4),采用逆向思维,求c(CrO2-4)需c(Ag+),要求c(Ag+)又需知c(Cl-),滴定终点,c(Cl-)小于1×10-5mol/L才叫完全沉淀。
第三步:运用相关概念、原理解答问题
6.返滴定

【解题三步法】
第一步:确定滴定反应
与样品(絮凝剂)反应后余盐酸与NaOH溶液的反应。
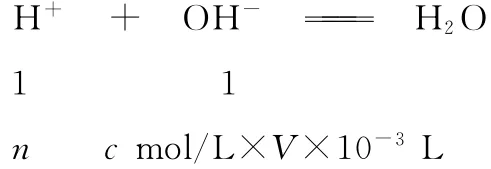
第二步:构建关系式
盐酸的总量(空白实验)=c mol/L×V0×10-3L
盐酸量(滴定)=c mol/L×V×10-3L
盐酸的总量(空白实验)=与样品(絮凝剂)中OH-反应+盐酸量(滴定)
第三步:运用相关概念、原理解答问题

启示:滴定型试题是高考考查学生能力的一种综合性题目,集实验、原理、计算于一体,有一定难度。及时了解该考点的考查内容、题型及解题技巧,对提高化学成绩有非常重要的意义。本文介绍的“三步法”,关键还在第二步“关系式的构建”,简洁、清晰的关系式,既是你对试题的整体把握,也将直接导致答案的正误。
(作者单位:广东省佛山市三水中学)

