人参皂苷Rg1通过调控骨骼肌TRB3/AKT信号通路改善大鼠胰岛素抵抗的分子机制研究
郑永仁 王 礴 刘传凤 杨晓密*
1.云南中医学院科研实验中心,云南 昆明 650500;2 云南白药集团股份有限公司,云南 昆明 650500
实验研究
人参皂苷Rg1通过调控骨骼肌TRB3/AKT信号通路改善大鼠胰岛素抵抗的分子机制研究
郑永仁1王 礴1刘传凤2杨晓密1*
1.云南中医学院科研实验中心,云南 昆明 650500;2 云南白药集团股份有限公司,云南 昆明 650500
目的:探讨人参皂苷Rg1对大鼠骨骼肌的保护作用,并讨论其通过调控骨骼肌TRB3/AKT信号通路缓解大鼠IR的分子机制。方法:50只雄性SD大鼠随机分为5组,正常对照组给予普通饲料喂养,胰岛素抵抗(IR)组以及人参皂苷Rg1低剂量治疗组、中剂量治疗组以及高剂量治疗组给予高脂饲料喂养,4周后,分别对 Rg1低剂量、中剂量和高剂量治疗组大鼠予以Rg1 25 mg/kg·d、50 mg/kg·d和100 mg/kg·d灌胃治疗,同时IR组大鼠予以相同体积生理盐水灌胃,4周后处死大鼠,收集血清和骨骼肌组织。分别采用ELISA、RT-qPCR和Western blot等方法进行相关因子检测。结果:与对照组比较,IR组大鼠血清中TG、TC、LDL-C、HOMA-IR、MDA、TNF-α、IL-6和IL-1β含量升高(P<0.05),人参皂苷Rg1治疗后,上述指标下降(P<0.05)且具有剂量依赖性;SOD和GSH的含量降低,人参皂苷Rg1 治疗4周后升高(P<0.05);且骨骼肌组织中TRB3的mRNA和蛋白表达水平,经人参皂苷Rg1治疗后下降明显(P<0.05),AKT(Ser473位点)的磷酸化水平升高(P<0.05),且都具有剂量依赖性。 结论:人参皂苷Rg1可以降低机体HOMA-IR、减轻炎症和氧化应激反应、改善血脂,并通过调控骨骼肌TRB3/AKT信号通路保护大鼠骨骼肌代谢,缓解IR。
人参皂苷Rg1;胰岛素抵抗;骨骼肌;TRB3;AKT
胰岛素由生物体胰岛β细胞分泌,并且通过与胰岛素受体结合并激活胰岛素信号来实现其生物效应的一种小分子蛋白质,当胰岛素传导信号发生障碍时,就会导致胰岛素抵抗(Insulin Resistance, IR)[1-2]。IR的发生由遗传和环境因素共同作用,是胰岛素促进葡萄糖摄取作用受损,导致正常剂量的胰岛素分泌低于正常生物学效应的一种状态,主要表现为机体本身对胰岛素生理作用的反应能力降低,即外周组织对胰岛素敏感性下降, 以及对葡萄糖的利用障碍,高胰岛素血症是IR的重要标志,其发生的主要器官是脂肪、肝脏和骨骼肌[3-4]。文献报道,IR诱发的脂质代谢紊乱与二型糖尿病、非酒精性脂肪肝以及非酒精性脂肪肝炎等代谢性疾病的发生、发展密切相关, 因此,对IR的治疗是目前临床研究的热点[5-6]。
有研究报道[7-9],Akt /PKB 分子信号通路在胰岛素信号传导过程中发挥重要作用,它的磷酸化水平改变可直接影响 IR的发生,而Tribbles 同源蛋白3 (Tribbles Homolog Protein 3,TRB3)是一种具有广泛调节作用的生物小分子, TRB3可作为调节蛋白调控Akt信号通路, 并且可以和Akt /PKB 结合, 抑制胰岛素信号通路, 在IR的发生、发展中起到了至关重要的作用。人参皂苷Rg1是从三七中分离出的一种皂苷类物质, 具有抗炎,抗氧化,抗血栓,抗肿瘤,并且能有效降低IR患者的体重和血糖血脂水平的活性[10-11]。另外,人参在治疗IR方面有一定疗效, 但其药效物质基础和作用机制尚不明确。本实验旨在研究人参皂苷Rg1对高脂饮食诱导的IR大鼠模型中TRB3/AKT信号通路的调控作用,并对其作用机制进行初步评价,为今后的临床和基础研究提供一定的理论基础。
1 材料
1.1 动物 50只雄性SD大鼠,体重180~200g,基础饲料及高脂饲料, 由昆明医科大学实验动物中心提供生产许可证:SCXK(滇)K2015-0002。
1.2 供试品 人参皂苷Rg1购自上海研生公司,纯度99.6%。
1.3 试剂 葡萄糖(Glucose)(生产批号:20090626)、甘油三酯(TG)(生产批号:201207342)、总胆固醇(TC)(生产批号:2400512)和低密度脂蛋白胆固醇(LDL-c)(生产批号:2401095)等测定试剂盒均购自南京建成生物工程研究所;胰岛素(Insulin)(生产批号:CSB-E05071m)、丙二醛(MDA)(生产批号:201302671)、超氧化物歧化酶(SOD)(生产批号:201308802)、谷胱甘肽(GSH)(生产批号:20130731)、白介素-6(IL-6)(生产批号:20131491)、白介素-1β(IL-1β)(生产批号:2012527)和肿瘤坏死因子α(TNF-α)(生产批号:2014727)测定试剂盒均购自武汉欣博盛公司;组织RNA提取试剂盒(生产批号:52304)均购自德国Qiagen公司);mRNA Random逆转录试剂盒(生产批号:2013527)均购自美国Thermo Fisher公司。引物基因合成(上海生工公司);荧光QPCRmix染料(生产批号:K5053200)(瑞士Roche公司);兔抗Anti-TRB3(生产批号:CST-4764S)、Anti-p-AKT(473)(生产批号:CST-5877S)和Anti-AKT单克隆抗体(生产批号:CST-1311S)(美国Cell Signaling Technology公司);羊抗兔辣根酶标记过氧化物酶二抗(生产批号:501101)(北京中杉金桥公司);ECL化学发光试剂(生产批号:2009071)(美国Millipore公司)。
2 方法
2.1 分组 大鼠分笼喂养,饲养条件为SPF清洁级,给予通风、安静的饲养环境,温度 (23±2)℃,相对湿度为(55±2)%,监测血糖均正常,所有大鼠均自由饮水及进食,进行适应性喂养2周。随机分为正常对照组(Control,n=10)、胰岛素抵抗组(IR,n=10)以及人参皂苷Rg1低剂量治疗组(LD Rg1,n=10)、中剂量治疗组(MD Rg1,n=10)以及高剂量治疗组(HD Rg1,n=10)。Control组给予普通饲料喂养,IR组和Rg1治疗组给予高脂饲料喂养,4周后,分别对LD Rg1、MD Rg1和HD Rg1治疗组大鼠予以Rg1 25 mg/kg·d、 50 mg/kg·d和100 mg/kg·d灌胃治疗,同时IR组大鼠予以相同体积生理盐水灌胃,4周后处死大鼠,收集样本。
2.2 取材 大鼠用10%水合氯醛腹腔注射麻醉(0.4mL/100g体重),心脏快速取血,静置约1h后,4℃ 3500 r/min离心15 min,收集血清。处死大鼠,收集骨骼肌组织存于-80℃冰箱。
2.3 血清相关指标检测 Glucose、TG、TC和LDL-c的含量采用比色法检测; Insulin、MDA、SOD、GSH、IL-6、IL-1β 以及TNF-α的含量采用酶联免疫(ELISA)法检测,Thermo Multiskan GO 1510全波段酶标仪读数,具体步骤参照试剂盒详细说明书。
2.4 RT-qPCR检测 取18~20mg骨骼肌组织,研磨后提取组织总RNA,定量后每个样本各取2μg反转录随机cDNA,加入荧光PCR mix进行目的片段扩增,引物设计为TRB3 Forward primer:5′-CTCTTGGGGTGATGCTCCTT-3′, Reverse primer:5′-TCATCCTCCCCCAGTTCAAC-3′,Product length:145bps;AKTFoward primer:5′-CCGCCTGATCAAGTTCTCCT-3′,Reverse primer:5′-TTCAGATGATCCATGCGGGG-3′,Product length:118bps;β-actinFoward primer:5′-TGAGCTGCGTTTTACACCCT-3′,Reverse primer:5′-GCCTTCACCGTTCCAGTTTT-3′,Product length: 198bps。PCR扩增反应条件如下:95 ℃预变性2 min;95 ℃变性10s、退火:60 ℃ 30s、72 ℃延伸35s,循环次数40次,72 ℃最后再延伸5 min。采用荧光定量PCR相对定量分析法 2-ΔΔCT法进行统计分析。
2.5 Western blot检测 取骨骼肌组织约100 mg加入组织裂解液匀浆,BCA法测定总蛋白含量,取40 μg蛋白质样本进行SDS-PAGE电泳,采用半干转膜法转移至PVDF膜,5%的脱脂牛奶封闭2h后加入一抗,4℃过夜,洗膜后加入HRP标记的二抗孵育,洗涤后与ECL发光试剂反应,曝光洗片,扫描图像后用Image J软件计算各条带的吸光度值,以β-actin作为内参进行标准对照。每组实验重复3次。

3 结果
3.1 胰岛素抵抗指数 血清Glucose和Insulin的含量检测发现,与Control组比较,IR组大鼠血清中Glucose含量、Insulin含量以及HOMA-IR都明显升高(P<0.05),经人参皂苷Rg1治疗后,各项指标均下降明显(P<0.05),且随人参皂苷Rg1剂量的增加,改善效果更加明显。见表1。

表1 人参皂苷Rg1治疗后大鼠HOMA-IR比较
注:与Control组比较,#P<0.05;与IR组比较,*P<0.05。
3.2 炎症指标 与Control组相比,IR组大鼠血清中IL-6、IL-1β和TNF-α的含量增加明显(P<0.05);经人参皂苷Rg1治疗后,各项指标均下降明显(P<0.05),且随人参皂苷Rg1剂量的增加,改善效果更加明显。见表2。

表2 人参皂苷Rg1治疗后大鼠炎症因子
注:与Control组比较,#P<0.05;与IR组比较,*P<0.05。
3.3 血脂 与Control组相比,IR组血清中的TC、TG和LDL-C升高(P<0.05),人参皂苷Rg1治疗后,大鼠血清中的TC、TG和LDL-C降低(P<0.05),且随Rg1剂量的增加,上述血脂指标的含量逐渐降低。见表3。

表3 人参皂苷Rg1治疗后大鼠血清血脂指标比较
注:与Control组比较,#P<0.05;与IR组比较,*P<0.05。
3.4 氧化和抗氧化指标 与Control组比较,IR组大鼠血清中氧化指标MDA的含量升高明显(P<0.05),经人参皂苷Rg1治疗后MDA的含量降低(P<0.05),且随Rg1剂量的增加,MDA的含量逐渐降低;与Control组比较,IR组大鼠血清中抗氧化指标SOD和GSH的含量下降(P<0.05),经人参皂苷Rg1治疗后SOD和GSH的含量增多(P<0.05),且随Rg1剂量的增加,SOD和GSH的含量升高更加明显。见表4。
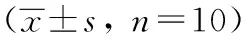
表4 人参皂苷Rg1后大鼠氧化和抗氧化指标比较
注:与Control组比较,#P<0.05;与IR组比较,*P<0.05。
3.5 TRB3和AKT的mRNA表达 各组大鼠骨骼肌组织经RT-qPCR检测发现:与Control组比较,IR组大鼠骨骼肌TRB3的mRNA表达水平明显升高(P<0.05),经人参皂苷Rg1治疗后,TRB3的mRNA表达水平下降(P<0.05),且随Rg1剂量的增加,下降更加明显;而AKT的mRNA水平在各组大鼠骨骼肌组织中的表达变化不明显,差异无统计学意义(P>0.05)。见图1。

3.6 TRB3和AKT的蛋白表达以及磷酸化程度 与Control组比较,IR组大鼠骨骼肌TRB3的蛋白表达水平明显升高(P<0.05),经人参皂苷Rg1治疗后,TRB3的表达水平下降(P<0.05),且随Rg1剂量的增加,下降更加明显,与RT-qRCR结果一致;AKT的总蛋白水平在各组大鼠骨骼肌组织中的表达变化不明显,差异无统计学意义(P>0.05);而与Control组相比,IR组大鼠骨骼肌组织中p-AKT(473位点)的表达水平显著降低(P<0.05),Rg1治疗后,大鼠骨骼肌组织中AKT的磷酸化水平升高(P<0.05),且具有剂量依赖性(图2)。
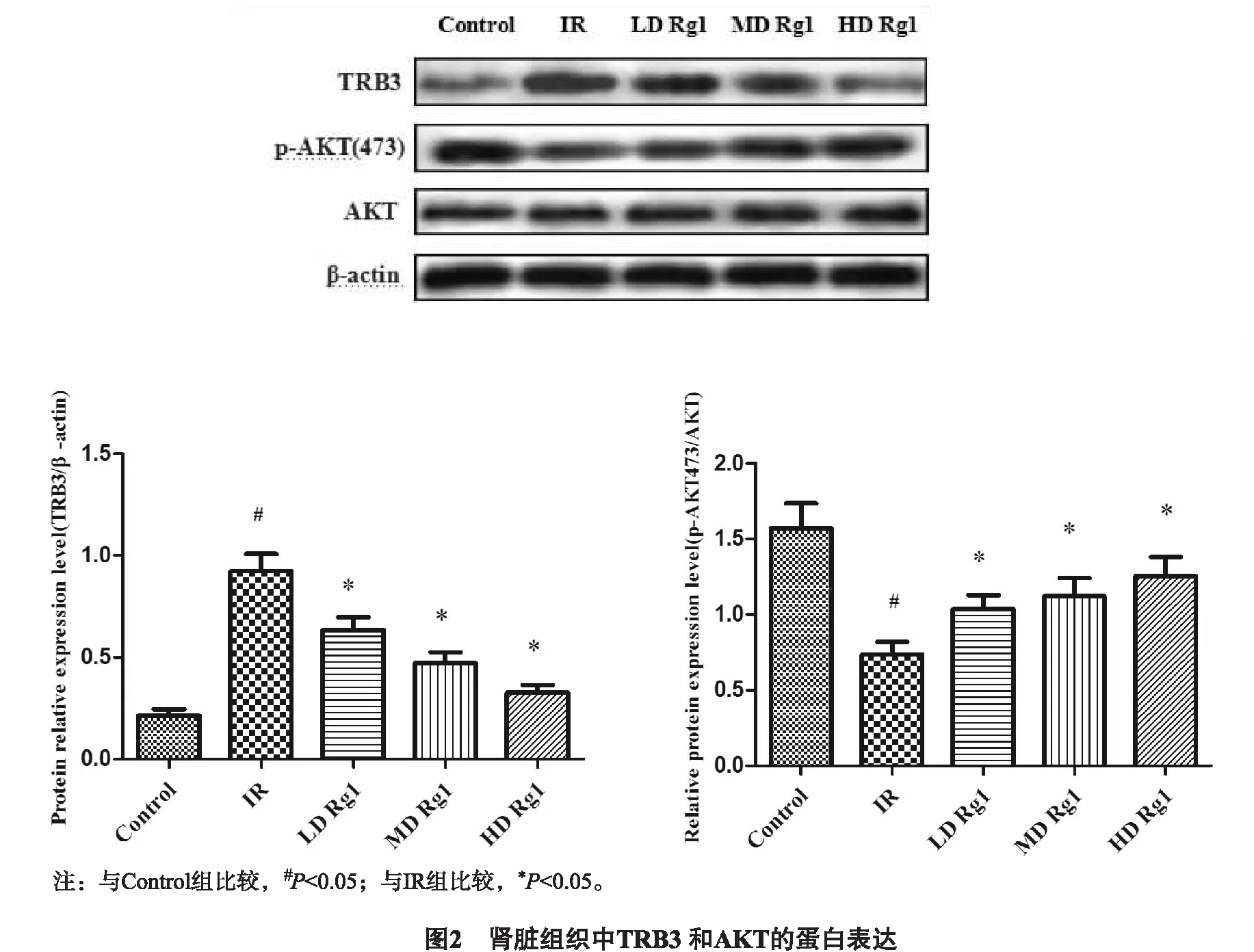
4 讨论
随着人们生活水平的提高,糖尿病,脂肪肝,肥胖症等代谢性疾病的发生不断年轻化,发病率也日渐增长,严重影响人们的生活质量。研究表明,IR在上述疾病发生发展的过程中起到重要作用[12-14],因此研究IR的发病机制以及寻找有效的治疗方法刻不容缓。体内胰岛素水平长期的相对缺乏不仅会引起高血糖,还经常会伴有脂质代谢紊乱现象,其典型表现为血清 TG、 TC和LDL-C的升高。根据我国临床IR患者高碳水化合物饮食的特点,建立高脂饮食诱导的IR大鼠模型,通过HOMA-IR、血脂含量和炎症因子等指标来评价成模情况。本实验结果显示经过4周的高脂饲料喂养,与Control组比较,IR模型组大鼠血清中Glucose含量、Insulin含量以及HOMA-IR都升高明显(P<0.05);IL-6、IL-1β和TNF-α等炎症因子的含量增加明显(P<0.05);TC、TG和LDL-C等血脂指标均明显升高(P<0.05),与前述结果一致,提示造模成功。另有研究表明,氧化应激被广泛认为是许多疾病的一个重要特征,骨骼肌和肝脏中的抗氧化能力的降低、脂肪酸氧化不足,可以引起或加重IR[15],本文结果表明,IR组大鼠机体内脂质过氧化的终末产物MDA增多,而SOD和GSH得活性及清除自由基的能力下降,IR大鼠存在氧化应激反应。三七为传统中药,普遍用于治疗心脑血管疾病、保护肝脏功能、抗炎症反应、增强抵抗力等。而人参皂苷 Rg1 是三七的主要有效单体成分之一,具有极强的抗氧化能力[16]。研究中,IR模型组大鼠经灌胃治疗后,HOMA-IR、血脂含量、炎症因子及氧化因子MDA含量都明显降低,抗氧化因子SOD和GSH含量都明显升高,且具有剂量依赖性,也从一定程度上验证了人参皂苷Rg1降血脂、清除自由基、抗炎、抗氧化的药理作用。
TRB3是一种在细胞内调节能量代谢的蛋白质分子, 广泛存在于骨骼肌和肝脏等组织中。文献报道[17-19], TRB3 在不同物种体内的表达水平也存在差异,在人和鼠的中表达最高。过往研究发现,Akt /PKB 分子在胰岛素信号传导通路上发挥着重要作用,其磷酸化水平改变可直接影响IR的发展程度,而TRB3 能够通过抑制Akt(Serine473) 位点的磷酸化水平,干扰胰岛素信号传导通路,导致 IR的发生;TRB3还可以通过干扰 Akt 的转膜,干扰其和细胞膜上相应信号位点的结合,从而阻断胰岛素信号通路的传导。笔者发现T2DM 患者的骨骼肌中 TRB3 蛋白水平明显升高,骨骼肌TRB3蛋白的表达水平与大鼠IR程度呈正相关。骨骼肌细胞中TRB3的高表达阻碍了胰岛素刺激的糖转运,导致胰岛素信号通路中Akt的磷酸化受损,骨骼肌细胞中的高糖环境及胰岛素缺乏都会增加TRB3 mRNA及蛋白的表达。经RT-qPCR及Western Blot检测发现:与Control组比较,IR组大鼠骨骼肌TRB3的mRNA和蛋白表达水平明显升高(P<0.05),经人参皂苷Rg1治疗后,TRB3的表达水平下降(P<0.05),且随Rg1剂量的增加,下降更加明显;AKT的mRNA和蛋白水平在各组大鼠骨骼肌组织中的表达变化不明显(P>0.05)。而与Control组相比,IR组大鼠骨骼肌组织中p-AKT(Ser473位点)的表达水平明显降低(P<0.05),Rg1治疗后,大鼠骨骼肌组织中AKT的磷酸化水平升高(P<0.05),且具有剂量依赖性,表明人参皂苷Rg1可能通过调控骨骼肌TRB3/AKT信号通路改善大鼠IR。
综上所述,高血糖、炎症反应、脂质代谢紊乱及氧化应激都参与了大鼠IR的发生与发展,骨骼肌TRB3/AKT信号通路在IR的病变过程中起着至关重要的作用。人参皂苷Rg1可以降低机体HOMA-IR、减轻炎症和氧化应激反应、改善血脂,并通过调控骨骼肌TRB3/AKT信号通路保护大鼠骨骼肌代谢,治疗IR。
[1]朱责梅, 杨丝丝, 伍迪,等.胰岛素抵抗与糖尿病脑病[J].生理科学进展, 2016, 47(5):395-400.
[2]Ma L, Wang J, Li Y.Insulin resistance and cognitive dysfunction[J].Clin Chim Acta, 2015, 44(4):18-23.
[3]李兰芳, 郭玉, 唐国涛,等.高脂饮食导致大鼠肝脏胰岛素抵抗的作用机制研究[J].中国病理生理杂志, 2011, 27(2):310-314.
[4]王思为, 夏道宗, 方月娟,等.莲房提取物对2型糖尿病大鼠胰岛素抵抗的影响[J].中草药, 2015, 46(5):721-726.
[5]姚春艳, 马建, 李永华.护肝调脂方治疗非酒精性脂肪性肝炎的临床观察[J].北京中医药, 2016(1):76-78.
[6]高啸, 彭旖旎, 朱琳,等.硫化氢对2型糖尿病大鼠肝脏胰岛素抵抗的影响[J].华中科技大学学报(医学版), 2016, 45(5):490-495.
[7]董静, 刘尊.TRB3在运动改善胰岛素抵抗中的作用[J].医学综述, 2012, 18(14):2172-2174.
[8]边德志, 赵青松, 随萍,等.高脂饮食对大鼠肝脏PGC-1α、TRB3、Akt的影响[J].中国现代医生, 2011, 49(35):14-16.
[9]郭燕, 张东铭, 刘爱萍,等.饮食干预对高脂高糖妊娠大鼠肝组织中TRB3和AktmRNA的表达及胰岛素抵抗的影响[J].郑州大学学报(医学版), 2014(2):230-233.
[10]林卫东, 陈超, 梁生旺,等.人参皂苷改善胰岛素抵抗的网络药理学[J].中成药, 2016, 38(7):1455-1461.
[11]张声生, 吴震宇, 陈剑明,等.三七总皂苷改善高脂诱导脂肪肝大鼠模型氧化应激及胰岛素抵抗的研究[J].中国中西医结合杂志, 2014, 34(1):56-61.
[12]涂珺, 罗新新, 李冰涛,等.小檗碱对脂肪胰岛素抵抗细胞PPARγ及脂肪分泌因子表达的影响[J].中国中药杂志, 2016, 41(11):1983-1989.
[13]朱小花, 蒋爱民, 余铭,等.香蕉粉对Ⅱ型糖尿病模型大鼠血糖及胰岛素抵抗的影响[J].现代食品科技, 2016(3):7-11.
[14]匡荣, 刘璐, 刘艳,等.葫芦巴籽和桑叶提取混合物对胰岛素抵抗糖脂代谢紊乱大鼠模型的降血糖作用及其机制研究[J].中国现代应用药学, 2016, 33(5):551-556.
[15]盛冲霄,黎红华,崔敏,等.糖尿病与氧化应激左动脉硬化大鼠内皮功能障碍中的作用研究[J].中国全科医学,2016,19(9):1015-1020.
[16]林彦萍, 张美萍, 王康宇,等.人参皂苷生物合成研究进展[J].中国中药杂志, 2016, 41(23).
[17]张雪, 乔杰.TRB3与胰岛素抵抗的研究进展[J].中国优生与遗传杂志, 2011(1):6-7.
[18]Cho H, Mu J, Kim JK, et al.Insulin resistance and a diabetes mellitus-like syndrome in mice lacking the protein kinase Akt2(PKB beta)[J].Science, 2001, 292: 1728-1731.
[19]Oku A, Nawano M, Ueta K, et al.Inhibitory effect of hyperglycemia on insulin-induced Akt /protein kinase B activation in skeletal muscle[J].Am J Physiol Endocrinol Metab, 2001 (280):E816-824.
The Molecular Mechanism of Ginsenoside Rg1 Alleviates Insulin Resistance by Regulating the TRB3/AKT Signal Pathway
ZHENG Yongren1WANG BO1LIU Chuanfeng2YANG Xiaomi1*
1.Scientific Research Experiment Center of Traditional Chinese Medicine,Kunming 650500,China;2.Yunnan Baiyao Group Corporation Limited,Kunming 650500,China
Objective To investigate the effect of ginsenoside Rg1 protect the skeletal muscle of rats, and discuss the molecular mechanism of Rg1 ameliorates the insulin resistance through the TRB3/AKT signal pathway.Methods 50 male SD rats were divided into five groups randomly.The rats in control group were feed on an ordinary chow, and the rats in IR, LD Rg1, MD Rg1, and HD Rg1 groups were fed with a high-fat diet.After 4 weeks, the rats of treatment groups were treated with ginsenoside Rg1 (25 mg/kg·day, 50 mg/kg·day and 100 mg/kg·day) by gavage respectively, while the rats of IR group
normal saline with the same method, all of the rats were sacrificed after 4 weeks, the serums and skeletal muscle tissues were collected.The related factors were determined by ELISA, RT - qPCR and Western blott respectively.Results Compared with the control group, the concentrations of TG, TC, LDL-C, HOMA-IR, MDA, TNF-α, IL-6 and IL-1β in the serum of the rats of the IR group were upregulated, and downregulated obviously after Rg1 treatment for 4 weeks (P<0.05), the concentrations of GSH and SOD in the serum of the rats of the IR group were downregulated, and increased after Rg1 treatment (P<0.05); Compared with the control group, the expression levels of mRNA and protein of TRB3 in the skeletal muscle tissues of IR group were increased(P<0.05), after Rg1 adminisration for 4 weeks, the expression levels of TRB3 were decreased obviously(P<0.05), the phosphorylation levels of AKT were upregulated(P<0.05), the effect of ginsenoside Rg1 has a dose-dependent manner.Conclusion Ginsenoside Rg1 is capable to alliviate the HOMA-IR, dyslipidemia, inflammatory and oxidative stress and ameliorate the IR by regulating the the TRB3/AKT signal pathway in skeletal muscle.
Ginsenoside Rg1;Insulin Resistance;Skeletal Muscle; TRB3; AKT
云南省教育厅科学研究基金一般项目(NO:2014Y245)。
郑永仁(1965-),男,汉族,本科,高级实验师,研究方向为实验动物和动物实验。E-mail:404713576@qq.com
杨晓密(1979-),女,汉族,硕士研究生,实验师,研究方向为动物实验和实验动物管理。E-mail:12986263@qq.com
R285.5
A
1007-8517(2017)13-0033-06
2017-04-15 编辑:梁志庆)

