超声内镜引导下胆总管管壁穿刺活组织检查诊断胆总管恶性肿瘤1例报告
温红旭, 薛迪强, 杜宏伟, 明玉珍
(兰州市第二人民医院, 兰州 730000)
超声内镜引导下胆总管管壁穿刺活组织检查诊断胆总管恶性肿瘤1例报告
温红旭, 薛迪强, 杜宏伟, 明玉珍
(兰州市第二人民医院, 兰州 730000)
胆总管肿瘤; 腔内超声检查; 活组织检查, 针吸; 诊断; 病例报告
随着超声内镜(EUS)技术的发展,其在疾病的诊断、治疗中的作用愈发重要。胆总管不明原因狭窄临床多见,但诊断困难,经常出现误诊误治。本院成功完成1例EUS引导下胆总管管壁细针穿刺活组织检查,从组织学明确胆总管狭窄原因,现总结如下,旨在为临床胆总管不明原因狭窄的患者提供参考。
1 病例资料
患者男性,69岁,于2016年5月8日因上腹胀痛伴黄疸1周入本院治疗。入院前1周患者无明显诱因出现右上腹胀痛,多于餐后出现,伴有黄疸,无发烧、寒战、恶心、消瘦。既往行冠状动脉支架置入术,无肝病史。查体:一般状态好,皮肤、巩膜黄染,心肺未见异常,右上腹轻压痛。腹部彩超提示:胆总管内径增宽,胆总管下段胆泥淤积,胰腺回声正常,胰管未见明显扩张。血生化检查:ALT 129 U/L、AST 61 U/L、ALP 136 U/L、TBil 269.1 μmol/L、DBil 186.1 μmol/L、IBil 83.0 μmol/L。肿瘤标志物:CA19-9 454.58 U/ml、AFP 3.2 ng/ml、CEA 1.3 ng/ml、CA12-5 8.8 U/ml、IgG4 0.38 g/L。增强CT提示:胆总管末端狭窄,多考虑炎性狭窄。经内镜逆行胰胆管造影(ERCP)提示:胆总管下段狭窄,腔内未见明显充盈缺损。综合考虑诊断胆总管炎性狭窄可能。为解除胆道梗阻建议行胆道支架置入术,考虑单根塑料支架引流效果差,需同时放置多根塑料支架,且塑料支架容易脱落,继发肠穿孔、胆道结石等风险,故行胆道全覆膜金属支架置入术,术后降酶、退黄治疗1周,病情好转出院。1个月后门诊复查转氨酶、胆红素均恢复正常,CA19-9>700 U/ml较前明显升高,不排除肿瘤可能。PET-CT检查提示:(1)胆总管支架术后,肝内外胆管扩张;(2)沿支架走行区胆总管呈高代谢改变,最大标准摄取值为1.7,考虑炎症。向患者家属充分告知病情,家属不同意行EUS检查及剖腹探查,要求继续随访。5个月后复查再次入院,患者一般状态尚可,无黄疸、消瘦。血生化检查:ALT、AST、ALP、胆红素水平均正常。肿瘤标志物:CA19-9>700 U/ml,CA12-5、AFP、CEA正常。再次行增强CT提示:胆道支架术后,肝内胆管积气。临床高度考虑恶性肿瘤,与家属沟通同意后拔除胆道金属支架,行线阵EUS检查,必要时行穿刺活组织检查。EUS探头置于胃内及十二指肠全面扫查胰腺各部,胰腺回声正常,胰管未见明显扩张;腹腔干周围未见肿大淋巴结;肝门部扫查见胆总管扩张直径约1.6 cm;十二指肠球部扫查见胆总管扩张,直径约1.7 cm,胆总管十二指肠段近胰头处可见管壁局限性低回声增厚,部分向腔内隆起至管腔狭窄,管壁层次消失,最厚处约5 mm,病变范围约1 cm(图1)。用19G穿刺活检针(Olympus公司)在超声引导下对局限性增厚胆总管管壁穿刺行活组织检查,共穿刺2次,每次抽查10针,零负压,获取组织条及少量组织碎片涂片送检(图2)。术后禁食水24 h,给予监护、抗炎、止血、补液等治疗,未出现胆漏、出血、感染、穿孔等并发症。病理检查:涂片见少许重度异型性细胞;穿刺组织条血凝块中见肿瘤组织呈腺样结构,瘤细胞核大、深染、异型性明显,诊断为胆总管腺癌(图3)。告知患者病情,其拒绝手术,获得知情同意后放置胆道全裸金属支架以解除覆膜支架拔除后再次出现的胆道梗阻。
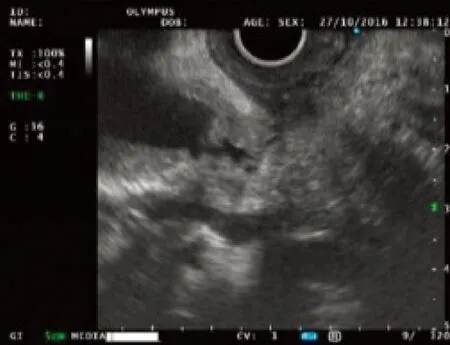
图1 EUS十二指肠扫查胆总管 管壁局限性增厚,层次消失,管腔狭窄,近端胆总管扩张
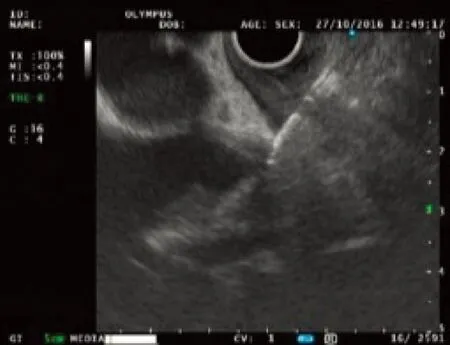
图2 EUS细针穿刺活组织检查(EUS-FNA)
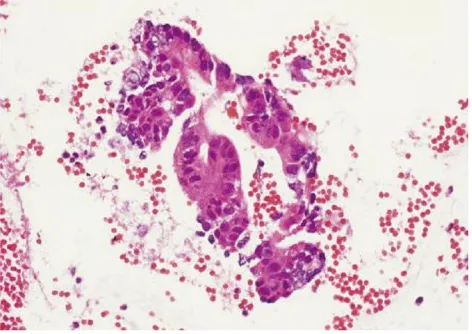
图3 病理诊断胆总管腺癌(HE染色,×400)
2 讨论
胆总管不明原因狭窄临床诊断方法较多,常规方法主要包括腹部彩超、磁共振胰胆管造影(MRCP)、经内镜逆行胰胆管造影(ERCP),上述方法可对胆总管狭窄进行诊断,但鉴别狭窄的良恶性较困难,经常出现误诊误治。MRCP对梗阻部位显示率为90%[1],对狭窄性质的判断主要依靠影像学表现,效果不理想,同时无法取得最终病理诊断,且体内有金属置入者无法行核磁检查。ERCP能够清晰地显示肝内外胆管全貌,确定病变的部位和范围,但单靠ERCP明确狭窄的性质效果欠佳,有研究[2]显示其特异性约为47%,准确性约为73%。
随着胆管腔内超声(intraductal ultrasonography,IDUS)、EUS及EUS-FNA的发展,为胆总管狭窄性质的诊断提供了新的方法[3-6]。IDUS是在胆管腔内对不明原因胆管病变进行超声学诊断,可以较好的显示胆管管壁层次及腔内病变的性质,对胆总管狭窄的诊断有一定优势。国外研究[7]显示ERCP结合IDUS可以更好地区分胆总管良恶性狭窄;IDUS结合细胞学刷检和Kras、P53基因突变检测可进一步提高诊断的准确性[8]。然而,IDUS设备比较昂贵且易损坏,在一定程度上限制了其在临床上的推广应用。EUS是在胃内或十二指肠扫查胆胰,可以显示胆管的形态、管壁的层次、病变的范围,还能观察管腔外周围脏器尤其是胰腺的状况,是胆胰疾病诊断和分期的重要影像工具,研究[9-10]显示EUS比ERCP、MRCP在胆管狭窄中更具有诊断价值。EUS-FNA可以对可疑病变进行靶向活组织检查获得病理学诊断,具有其他检查无法比拟的优势,国外研究[11-12]显示,EUS-FNA是胰内胆总管狭窄高敏感性和高特异性的诊断方法,但十二指肠段胆总管狭窄经EUS-FNA获取组织明确诊断的相关报道很少。
胆总管管壁的穿刺活组织检查之所以报道较少,其主要原因可能为并发症。穿刺针的选择一直是EUS-FNA讨论的热点,多项研究[13-15]显示,在胰腺病变的穿刺活组织检查中19G、22G、25G针均没有显现出独特优势,更多的是操作者的偏好和技巧,而胆管壁穿刺活组织检查使用哪种型号的穿刺针缺乏报道。本例患者使用19G穿刺针,是基于以下考虑:(1)在保证获取足够组织的同时减少穿刺次数,达到“一针见血”的目的;(2)19G穿刺针针头在超声下显示更清楚,便于观察,避免穿刺时贯穿病变组织出现胆漏;(3)十二指肠球部穿刺19G针进针的困难可以通过微调内镜与病变的位置关系克服,即保证病变穿刺位置的情况下尽可能“放松”内镜,避免过分推镜,尽量把病变置于探头正下方略偏左,穿刺针自然状态下穿刺病变,避免使用抬钳器。EUS显示胆总管管壁最厚处约5 mm,病变范围约1 cm,这样小的病变在保证安全的前提下穿刺是非常困难的,穿刺针没有足够的抽插空间,笔者主要是通过调整内镜与病变位置关系调节进针角度,尽可能小角度进针,增加有效抽插空间,提高获取组织条的可能,同时减少胆漏的可能。
综上所述,胆总管狭窄性质的诊断虽然是临床工作中的难点,但随着EUS及EUS-FNA技术的成熟,从组织学为临床医师明确诊断提供了一条途径,熟练仔细的操作可以避免并发症的发生,值得临床推广。
[1] LIU SY, CHEN XB, HUANG P, et al. The different value of MRCP and color Doppler ultrasound in diagnosis of obstructive jaundice[J]. Jilin Med J, 2014, 35(16): 3433-3434. (in Chinese) 刘思义, 陈小保, 黄鹏, 等. 彩超与MRCP在梗阻性黄疸鉴别诊断中的不同价值[J]. 吉林医学, 2014, 35(16): 3433-3434.
[2] VAZQUEZ-SEQUEIROS E, BARON TH, CLAIN JE, et al. Evaluation of indeterminate bile duct strictures by intraductal US[J]. Gastrointest Endosc, 2002, 56(3): 372-379.
[3] ZHANG L, WANG ZY, LI HX, et al. Value of endoscopic ultrasonography for differential diagnosis of benign and malignant bile duct distal stenosis[J]. Chin J Dig Endosc, 2015, 32(4): 250-252. (in Chinese) 张莉, 王震宇, 李焕喜, 等. 超声内镜鉴别诊断胆管下端狭窄良恶性的临床研究[J]. 中华消化内镜杂志, 2015, 32(4): 250-252.
[4] SHEN YH, LIU AQ, LIU LY, et al. Endoscopic ultrasonography for differentiation of malignant and benign common bile duct strictures[J]. World Chin J Dig, 2015, 23(30): 4892-4897. (in Chinese) 沈妍华, 刘爱群, 刘立义, 等. 超声内镜对胆总管良恶性狭窄的鉴别诊断价值[J]. 世界华人消化杂志, 2015, 23(30): 4892-4897.
[5] PENG HX, YANG DM, CHU YM, et al. Endoscopic ultrasonography guided fine needle aspiration for diagnosis of occupying lesions in upper digestive tract and its peripheral areas[J]. Clin J Med Offic, 2015, 43(7): 680-683. (in Chinese) 彭海霞, 杨大明, 褚以忞, 等. 内镜超声引导下细针穿刺抽吸术在诊断上消化道及其周围占位病变中的价值[J]. 临床军医杂志, 2015, 43(7): 680-683.
[6] BERTANI H, FRAZZONI M, MANGIAFICO S, et al. Cholangiocarcinoma and malignant bile duct obstruction: a review of last decades advances in therapeutic endoscopy[J]. World J Gastrointest Endosc, 2015, 7(6): 582-592.
[7] CHEN L, LU Y, WU JC, et al. Diagnostic utility of endoscopic retrograde cholangiography/intraductal ultrasound (ERC/IDUS) in distinguishing malignant from benign bile duct obstruction[J]. Dig Dis Sci, 2016, 61(2): 610-617.
[8] HUANG P, ZHANG H, ZHANG XF, et al. Evaluation of intraductal ultrasonography, endoscopic brush cytology and K-ras, P53 gene mutation in the early diagnosis of malignant bile duct stricture[J]. Chin Med J (Engl), 2015, 128(14): 1887-1892.
[9] RÖSCH T, MEINING A, FRÜHMORGEN S, et al. A prospective comparison of the diagnostic accuracy of ERCP, MRCP, CT, and EUS in biliary strictures[J]. Gastrointest Endosc, 2002, 55(7): 870-876.
[10] JIA L, GUO YN, GUO XL, et al. Value of endoscopic ultrasound and magnetic resonance cholangiopancreatography in diagnosis of obstructive jaundice[J]. J Clin Hepatol, 2016, 32(9): 1753-1755. (in Chinese) 贾雷, 郭玉宁, 郭秀丽, 等. 超声内镜与磁共振胰胆管造影诊断梗阻性黄疸的效果比较[J]. 临床肝胆病杂志, 2016, 32(9): 1753-1755.
[11] SADEGHI A, MOHAMADNEJAD M, ISLAMI F, et al. Diagnostic yield of EUS-guided FNA for malignant biliary stricture: a systematic review and meta-analysis[J]. Gastrointest Endosc, 2016, 83(2): 290-298.
[12] SINGHI AD, SLIVKA A. Evaluation of indeterminate biliary strictures: is it time to FISH or cut bait?[J]. Gastrointest Endosc, 2016, 83(6): 1236-1238.
[13] AFFOLTER KE, SCHMIDT RL, MATYNIA AP, et al. Needle size has only a limited effect on outcomes in EUS-guided fine needle aspiration: a systematic review and meta-analysis[J]. Dig Dis Sci, 2013, 58(4): 1026-1034.
[14] RAMESH J, BANG JY, HEBERT-MAGEE S, et al. Randomized trial comparing the flexible 19G and 25G needles for endoscopic ultrasound-guided fine needle aspiration of solid pancreatic mass lesions[J]. Pancreas, 2015, 44(1): 128-133.[15] JANI BS, RZOUQ F, SALIGRAM S, et al. Endoscopic ultrasound-guided fine-needle aspiration of pancreatic lesions: a systematic review of technical and procedural variables[J]. N Am J Med Sci, 2016, 8(1): 1-11.
引证本文:WEN HX, XUE DQ, DU HW, et al. Common bile duct wall puncture and biopsy guided by endoscopic ultrasonography in diagnosis of common bile duct malignant tumor: a case report[J]. J Clin Hepatol, 2017, 33(7): 1346-1348. (in Chinese) 温红旭, 薛迪强, 杜宏伟, 等. 超声内镜引导下胆总管管壁穿刺活组织检查诊断胆总管恶性肿瘤1例报告[J]. 临床肝胆病杂志, 2017, 33(7): 1346-1348.
(本文编辑:葛 俊)
Common bile duct wall puncture and biopsy guided by endoscopic ultrasonography in diagnosis of common bile duct malignant tumor: a case report
WENHongxu,XUEDiqiang,DUHongwei,etal.
(TheSecondPeople′sHospitalofLanzhou,Lanzhou730000,China)
common bile duct neoplasms; endosonography; biopsy, needle; diagnosis; case reports
10.3969/j.issn.1001-5256.2017.07.031
2016-12-29;
2017-01-16。
温红旭(1981-),男,主治医师,主要从事胆胰疾病及超声内镜的研究。
R735.8
B
1001-5256(2017)07-1346-03

