水温对草鱼血清活性氧含量及抗氧化防御系统的影响
罗 伟,许 艳,刘晓娟,王春芳
(华中农业大学水产学院,池塘健康养殖湖北省工程实验室,淡水水产健康养殖湖北省协同创新中心,武汉 430070)
水温对草鱼血清活性氧含量及抗氧化防御系统的影响
罗 伟,许 艳,刘晓娟,王春芳
(华中农业大学水产学院,池塘健康养殖湖北省工程实验室,淡水水产健康养殖湖北省协同创新中心,武汉 430070)
研究不同水温(22、26、30和33 ℃)对草鱼(Ctenopharynodonidellus)血清活性以及抗氧化系统的影响。实验选取180尾均重为55.4 g的草鱼,随机分为4组,每组设3个重复,每重复15尾鱼。在室内微循环系统中,采用加热棒(EHEIM 3619 aquarium Heater)进行控温,投喂含粗蛋白33.78%的配合饲料。8周养殖试验结束后,计算草鱼生长指标,测定草鱼血清ROS、SOD、CAT、T-AOC含量和GSH-Px活性。结果显示:温度显著影响到草鱼生长,当水温为30 ℃,草鱼生长最快;血清中ROS、SOD随着温度的升高显著升高;T-AOC、GSH-Px随着温度的升高呈现先上升后下降的趋势,水温为30 ℃达到最高;CAT随着养殖水温的变化,各组之间无显著性差异。结果表明,30 ℃为草鱼生长最适温度,水温22~30 ℃,草鱼体内的抗氧化酶系统能够维持体内自由基的“自稳态”,当水温过高(33 ℃)时,则会造成草鱼高温损伤,从而影响草鱼代谢和生长。
水温;活性氧;抗氧化;草鱼(Ctenopharynodonidellus)
草鱼(Ctenopharynodonidellus)是我国四大家鱼之一,是我国产量最高的淡水鱼养殖品种。研究发现,在养殖池塘中,草鱼在夏季会遭受到高温胁迫,进而影响到草鱼的存活、生长和免疫应答,严重影响到草鱼养殖的经济效益[1-2]。
鱼类是变温动物,水温不仅影响鱼类的生长和代谢,也影响鱼类的抗氧化防御体系[3],由于水温随着季节和昼夜会不断发生变化,鱼类细胞内线粒体的数量和功能为了适应这种变化也会随之发生变化[4],这种变化直接影响着鱼体内活性氧(ROS)和鱼类抗氧化防御体系[5]。而大量产生的ROS会造成机体蛋白质、脂质和DNA等大分子物质的损伤[6],正常机体内,ROS能够由机体抗氧化系统所降解,从而维持机体稳态。机体的抗氧化系统包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等,而总抗氧化能力(T-AOC)是反映机体抗氧化总体性能的一个指标[7]。
已有研究表明,水温对于草鱼的生长、消化率、能量收支具有显著影响[8-9]。高温对草鱼hsp70和hsp90热休克蛋白的表达有显著影响[10],但是关于草鱼的氧化应激的研究较少,关于水温和草鱼氧化应激之间的关系未见报道。草鱼生长最适温度为30 ℃,过高水温会导致草鱼热休克蛋白表达所需能量由无氧代谢提供[11-12],从而影响草鱼生存和生长。为研究不用水温对草鱼血清活性氧和抗氧化系统的影响,本研究测定了在不同水温养殖条件下草鱼血清ROS含量、SOD活性、CAT活性、T-AOC和GSH-Px活性的变化,进一步探讨在不同温度养殖条件下草鱼机体抗氧化体系变化规律,比较不同水温对草鱼抗氧化防御系统的影响,从而进一步为草鱼精准化养殖提供一定的定量指标和理论基础。
1 材料和方法
1.1 实验材料
实验用草鱼购买于湖北省黄冈市红安县高桥渔场,选取较为活跃的草鱼在华中农业大学地下室循环水养殖系统中暂养,养殖缸的体积为300 L,并在实验条件下驯化一周以适应实验室养殖环境。
实验饲料按配方混合后经颗粒饲料机制成直径为0.35 mm,长度为1~2 mm的颗粒,并于4 ℃冰箱保存。实验饲料粗蛋白含量为33.78%,饲料配方及化学组成见表1。
1.2 试验鱼养殖

表1 实验饲料配方及化学成分Tab.1 Formulation and chemical composition of the experiment diet
注:维生素预混物:维生素A110万IU,维生素D324万IU,维生素E 8 g,维生素K30.3 g,维生素B10.6 g,维生素B20.7 g,维生素B60.7 g,维生素B124 mg,维生素C 15 g,烟酸4 g,泛酸钙4 g,叶酸200 mg。2.矿物质预混物:铁15 g,铜400 mg,锌6 g,锰2 g,碘60 mg,硒20 mg。
1.3 取样测定
养殖试验前后,称量各组鱼体重量计数,计算草鱼增重率和特定增长率。养殖试验结束后,试验鱼饥饿 24 h 取血清样。每缸随机取5 尾鱼尾静脉采血,混合血样3 000 r /min 离心 15 min,取血清-20 ℃保存备用。活性氧(ROS)超氧化物歧化酶(SOD)、过氧化氢酶(CAT)谷胱甘肽过氧化物酶(GSH-Px)和总抗氧化能力(T-AOC)均采用南京建成生物工程研究所的试剂盒的测定方法测定,每个指标重复测定 3 次。
1.4 计算公式
草鱼生长指标计算公式:
(1)存活率= (N2/N1) × 100%
(1)增重率(WG)=100%×(Wt-W0)/W0
(2)特定增长率(SGRw) = 100 %×(lnWt-lnW0)/t
上述公式中N1代表实验前草鱼数量,N2代表试验结束后草鱼存活数,Wt(g)和W0(g)分别是鱼体终末和初始湿重,t为养殖时间。
1.5 数据处理
数据整理使用Microsoft Excel 2003进行,使用SPSS软件进行数据的单因素方差分析(One-way ANOVA),并进行Duncan’s 多重比较,以P<0.05作为显著性差异水平。
2 结果和分析
2.1 不同水温下草鱼生长指标
表2显示了4种温度对草鱼的存活率没有显著影响(P>0.05),随着温度的上升草鱼的的增重率(WG)、特定增长率(SGR)呈现先上升后下降的趋势,各组之间存在显著性差异(P<0.05),水温为30 ℃时,草鱼生长性能最佳。
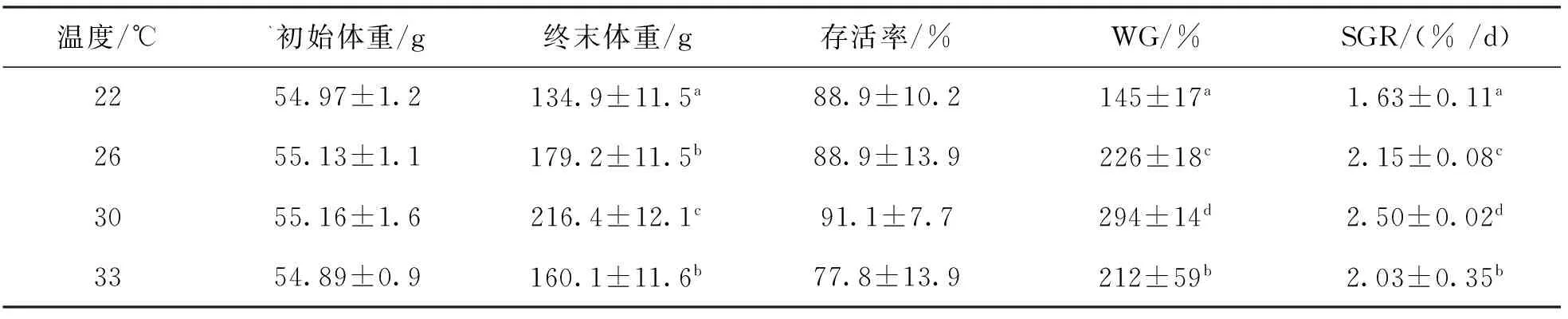
表2 不同温度下草鱼幼鱼生长的影响Tab.2 Effect of water temperature on the growth performance of grass carp
注:数据是来自3个平行缸的平均值±标准误,同列数据后上标字母不同(P<0.05),下同
2.2 不同温度对草鱼血清活性氧(ROS)和抗氧化指标的影响
从表3可以看出,随着水温的上升,草鱼血清中活性氧含量随着水温的升高而升高,33 ℃水温中草鱼血清ROS含量最高,22 ℃的ROS含量最低,并且4个温度组之间均具有显著性差异(P<0.05),22-26 ℃水温间,SOD酶活力无显著性差异(P>0.05),26 ℃以上,血清中SOD酶活力随着温度的升高而升高,在33 ℃水温中达到最大值,且两组之
间SOD酶活力存在显著性差异(P<0.05)。
随着水温的升高,血清中CAT酶活呈上升的趋势,并在水温为33 ℃时达到最大值,但各水温组间无显著差异(P>0.05),说明水温对CAT活性影响不大。
血清T-AOC酶活随着水温的上升呈先上升后下降的趋势,在水温为30 ℃时达到最高值,30 ℃水温和22 ℃水温之间存在显著性差异(P<0.05),其余各组无显著性差异(P>0.05)。
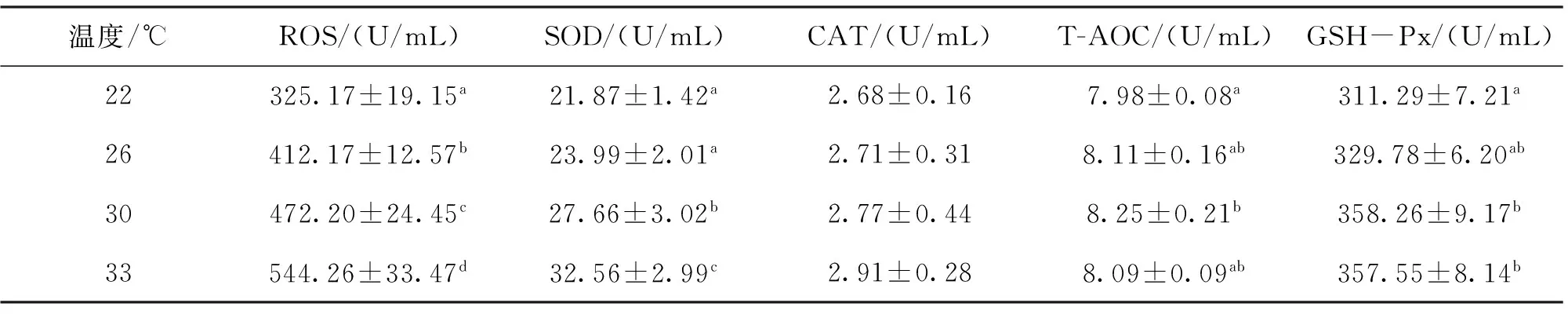
表3 不同温度对草鱼血清活性氧(ROS)和抗氧化指标的影响Tab.3 Effects of temperature on ROS and hermal biochemical of grass carp.
草鱼血清GSH-Px活性随着水温的升高呈上升的趋势,并在33 ℃达到最大值, 33 ℃和30 ℃水温组较22 ℃水温组存在显著性差异(P<0.05)。
3 讨论
水温作为池塘养殖中重要的环境因子,不仅会影响池塘中的理化因子,亦会直接影响到鱼类的代谢速率,从而进一步影响到鱼类的摄食和生长[13-15]。本研究表明,草鱼的最适生长温度为30 ℃,和崔奕波[16]研究结果一致,当水温超过30 ℃时,草鱼的生长会显著下降。实验中的高温环境(33 ℃)会对草鱼造成一定程度的热应激反应,产生高温胁迫。研究表明,水温升高会导致鱼体耗氧量增加,从而很可能促进机体内ROS的产生和机体细胞组分的氧化状态,引起机体抗氧化酶体系的相应变化[17-18]。从本次实验结果来看,ROS含量随着水温的升高而升高,说明高温促进了草鱼血清内ROS的产生,这和不同水温对中华鲟血清活性氧影响的研究结果类似[19]。
研究表明,机体内ROS的增加,如不及时清除,极可能会对机体造成氧化损伤或氧化应激,机体可通过提高体内抗氧化酶活力和其他防御形式,对氧化损伤进行修复[20]。本次研究表明,在不同的水温下,草鱼血清内各种抗氧化酶活性和氧化剂随着水温呈现出不同的变化。
SOD使得机体内超氧阴离子(O2-)转化为过氧化氢(H2O2),是细胞抗氧化系统的一道重要防线,同时SOD酶能够间接反映机体消除自由基的能力[21]。本次试验中,33 ℃的水温并没有使草鱼血清中SOD酶活下降,SOD酶活随着水温的升高而升高,结果和尼罗罗非鱼(Oreochromisniloticus)、褐牙鲆(Paralichthysolivaceus)[22-23]的研究结果相同,说明SOD酶在高温环境下,能够抵抗由于高温胁迫带来的氧化损伤。
Abele等[24]认为在一定温度范围内,水生生物的CAT活性对温度变化的响应存在不显著的现象。本实验中,草鱼血清中CAT酶活随着温度的升高呈现上升的趋势,但是各组之间无显著性差异,这与李大鹏等[19]在中华鲟(Acipensersinensis)中的研究结果一致。但有研究报道,水温对华贵栉孔扇贝(Chlamysnobilis)和大黄鱼(Pseudosciaenacrocea)血清CAT活性有显著性影响[25-26],可见,水温对养殖对象血清CAT活性随品种不同而异。
T-AOC是反映机体总抗氧化能力的一个指标。草鱼血清总抗氧化能力(T-AOC)随着水温的升高而升高,到30 ℃达到最大值,随后出现下降,试验结果和对大菱鲆(ScophthalmusmaximusL.)的研究结果类似[27]。33 ℃的高温胁迫使得草鱼血清T-AOC显著下降,说明在一定温度范围内,随着水温的升高,草鱼血清T-AOC随之升高,一旦发生高温胁迫时,草鱼血清T-AOC会随着温度的上升而下降。草鱼血清T-AOC在高温胁迫时出现下降,原因可能与机体内抗氧化酶的活性和氧化剂含量的联合作用有关。高温环境下(33 ℃),草鱼血清中ROS显著升高,而T-AOC反而略有下降,提示当环境温度超过一定的范围之后,草鱼会受到不同程度的氧化损伤。GSH-Px是生物体在长期进化过程中形成的抗氧化系统中的酶类抗氧化剂,在体内广泛存在,可防止因自由基产生的脂质过氧化物堆积所造成的生物膜损害,降解过氧化氢,保护细胞膜的结构及功能不受过氧化物的干扰及损害[28]。本研究结果显示:草鱼血清中GSH-Px活性是所测定的抗氧化酶种类中活力最强的一种。草鱼血清中GSH-Px活性随着温度的升高而升高,且33 ℃时,该酶仍能保持较高活力,表明该酶在清除和抵御体内ROS增加造成的氧化应激反应中起着重要的作用。由于GSH可以和ROS反应起到防御氧化应激的作用,同时GSH-Px能够催化GSH变为GSSG[29],使得有毒的过氧化物还原转变成无毒的羟基化合物。因此,草鱼血清中ROS随着温度升高而增加,为抵御ROS增加,GSH消耗也随之增加,进而导致能够催化GSH所需要的酶GSH-Px增加,从而抵御高温环境所带来的胁迫。
综上所述,草鱼在适当的水温中,可依靠自身的抗氧化防御系统,抵御活性氧增加带来的机体损伤,当温度超过一定范围后,草鱼机体内抗氧化酶系统虽然会起到一定的抗氧化防御作用,但是ROS的快速产生,消除ROS速度不能减缓,将会导致高温环境下LP的程度显著高于低温环境,而低温环境ROS随着水温的增加而增加,但抗氧化酶和抗氧剂始终能够维持着自由基的稳态,从而进一步解释了高温会影响草鱼的摄食和生长。
[1]张扬宗,谭玉钧.中国池塘养鱼学[M].北京: 科学出版社,1989:72-221.
[2]杨先乐,左文功.水温与草鱼免疫应答关系的研究[J].动物学报,1997,43( 1) :42-48.
[3]Opuszynski K.Production of herbivorous fish (CtenopharyngodonidellaVal.andHypophthalmichthysmolitrixVal.) in carp ponds.[J].Rocznik Nauk Rolniczych Seria H,1969:21-35.
[4]Portner H O.Climate variations and the physiological basis of temperature dependent biogeography: systemic to molecular hierarchy of thermal tolerance in animals.[J].CompBiochem Physiol Part A Mol Integrat Physiol,2002,132(4):739-761.
[5]Martínez-álvarez R M,Morales A E,Sanz A.Antioxidant defenses in fish: Biotic and abiotic factors[J].Rev Fish Biol Fish,2005,15(1):75-88.
[6]Heffner J E,Repine J E.Pulmonary strategies of antioxidant defense.[J].Am Rev Respir Dis,1989,140(2):531-54.
[7]Sies H.Strategies of Antioxidant Defense: Relations to Oxidative Stress[M]// Signalling Mechanisms—from Transcription Factors to Oxidative Stress.Springer Berlin Heidelberg,1995:165-186.
[8]崔奕波,陈少莲.温度对草鱼能量收支的影响[J].海洋与湖沼,1995(2):169-174.
[9]李亚南,王冀平.鱼类免疫应答中的温度效应研究[J].浙江大学学报(理学版),2006,52(323):128-135.
[10]宋文华,Gladys Ludevese,董云伟,等.高温对草鱼热休克蛋白表达的影响[J].海洋湖沼通报,2012,(1):27-32.
[11]]Wiech H,Buchner J ,Zimmermann R ,et al.Hsp90 chaperones protein folding in vitro.[J].Nature,1992,358(6382):169-170.
[12]Deane E E,Woo N Y S.Impact of heavy metals and organochlorines on hsp70 and hsc70 gene expression in black sea bream fibroblasts[J].Aquatic Toxicol,2006,79:9-15.
[13]丁福江,杨 明,戴习林,等.温度对黄金鲈(Percaflavescens)耗氧率和排氨率的影响[J].淡水渔业,2010,40(5):68-71.
[14]左文功.草鱼出血病发病与水温的关系[J].淡水渔业,1980,(1):21-23.
[15]张晓华,苏锦祥.不同温度条件对鳜仔鱼摄食和生长发育的影响[J].水产学报,1999,(1):91-94.
[16]崔奕波.草鱼生物能量学研究进展[J].中国科学基金,1998,12(1):9-13.
[17]Lushchak V I,Bagnyukova T V.Temperature increase results in oxidative stress in goldfish tissues.2.Antioxidant and associated enzymes[J].Comp Biochem Physiol Part C: Toxicol Pharmacol,2006,143(1):36-41.
[18]Rau M A,Whitaker J,Freedman J H,et al.Differential susceptibility of fish and rat liver cells to oxidative stress and cytotoxicity upon exposure to prooxidants.[J].Comp Biochem Physiol Part C: Toxicol Pharmacol,2004,137(4):335-42.
[19]李大鹏,刘松岩,谢从新,等.水温对中华鲟血清活性氧含量及抗氧化防御系统的影响[J].水生生物学报,2008,32(3):327-332.
[20]Viarengo A,Canesi L,Martinez P G,et al.Pro-oxidant processes and antioxidant defence systems in the tissues of the Antarctic scallop (Adamussiumcolbecki) compared with the Mediterranean scallop (Pectenjacobaeus)[J].Comp Biochem Physiol Part B :Biochem Mol Biol,1995,111(1):119-126.
[21]段鸣鸣,王春芳,谢从新.维生素 D3对黄颡鱼幼鱼抗氧化能力及免疫功能的影响[J].淡水渔业,2014,44(3):80-84.
[22]强 俊,任洪涛,徐 跑,等.温度与盐度对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化酶活力的协同影响[J].应用生态学报,2012,23(1):255-263.
[23]徐冬冬,楼 宝,詹 炜,等.高温胁迫对褐牙鲆生长及肝脏抗氧化酶活性的影响[J].水产学报,2010,34(7):1099-1105.
[24]Abele D,Tesch C,Wencke P,et al.How does oxidative stress relate to thermal tolerance in the Antarctic bivalve Yoldia eightsi?[J].Antarc Sci,2001,13(2):111-118.
[25]钱佳慧,栗志民,申玉春,等.温度和盐度对华贵栉孔扇贝抗氧化酶活性的联合效应研究[J].南方水产科学,2015,(6):49-57.
[26]张晓丽,胡玉珍,李明云,等.养殖大黄鱼在自然海区降温不同阶段抗氧化水平及血清酶活性的变化[J].海洋科学,2013(11):27-34.
[27]郭 黎,马爱军,王新安,等.盐度和温度对大菱鲆幼鱼抗氧化酶活性的影响[J].大连海洋大学学报,2012,27(5):422-428.
[28]陶 勇,李亚东.硒的作用机制及其对动物免疫机能的作用[J].动物科学与动物医学,2000,(4):11-12.
[29]Güven A,Güven A,Gülmez M.The effect of kefir on the activities of GSH-Px,GST,CAT,GSH and LPO levels in carbon tetrachloride-induced mice tissues[J].J Veterin Med,2003,50(8):412-416.
Effect of water temperature on serum content of reactive oxygen species and antioxidant defense system in grass carpCtenopharyngodonidellusin
LUO Wei,XU Yan,LIU Xiao-juan,WANG Chun-fang
(HubeiProvincialEngineeringLaboratoryforPondAquaculture/FreshwaterAquacultureCollaborativeInnovationCenterofHubeiProvince/CollegeofFisheries,HuazhongAgriculturalUniversity,Wuhan430070,China)
The present study investigated effects of different temperature (22℃,26℃,30℃ and 33℃) on growth and serum antioxidant system of grass carp.Grass carp whose average weight was 55.4 g were randomly divided into four groups,with 3 replications and 15 fish each tank.The diet contained 33.78% crude protein.Fish were raised in indoor micro-circulation system and heating rods (EHEIM 3619 aquarium Heater) were used for temperature control.After 8 weeks of feeding trial,growth indexes,activities of SOD,CAT and GSH-Px,contents of ROS and T-AOC were determined.The results showed that temperature significantly affected the growth of grass carp and growth rate peaked at 30℃.ROS and SOD in serum significantly increased by temperature.T-AOC and GSH-Px increased firstly and then decreased and peaked at 30℃.There was no significant difference among groups in terms of CAT as temperature changed.Therefore,it can be concluded that 30℃ is the best temperature for the growth of grass carp.When the water temperature is in the lower range,antioxidant enzymes and antioxidants could maintain the homeostasis of free radicals.If the water temperature is too high,it will cause damage to grass carp and thereby affects metabolism and growth of grass carp.
water temperature;reactive oxygen species;antioxidant defense system;Ctenopharyngodonidellus
2016-03-08;
2017-03-28
现代农业产业技术体系专项基金CARS-46;中央高校基本科研业务费专项资金(2013PY076)
罗 伟(1990- ),硕士研究生,专业方向为鱼类营养与环境。
王春芳。E-mail:cfwang@mail.hzau.edu.cn
S931.3
A
1000-6907-(2017)04-0003-05

