羟基自由基快速杀灭典型水华藻的研究
丁丽飞,李海燕,白敏冬*,郑 武,郭 枫,张芝涛(.厦门大学环境与生态学院,海洋生物资源开发利用协同创新中心,福建 厦门 3602;2.大连海事大学环境工程研究所物理系,辽宁 大连 6026)
羟基自由基快速杀灭典型水华藻的研究
丁丽飞1,李海燕1,白敏冬1*,郑 武1,郭 枫1,张芝涛2*(1.厦门大学环境与生态学院,海洋生物资源开发利用协同创新中心,福建 厦门 361102;2.大连海事大学环境工程研究所物理系,辽宁 大连 116026)
以典型水华藻铜绿微囊藻、针杆藻和四尾栅藻为研究对象,利用大气压强电离放电高效生成的羟基自由基(•OH)对3种藻进行杀灭.采用荧光染色、流式细胞仪和光合活性等生物学方法,确定⋅OH杀灭的阈值浓度和时间,并观察细胞形态变化.结果表明,当混合藻中铜绿微囊藻、针杆藻和四尾栅藻的初始藻密度分别为19.5×104、21.8×104和4.90×104cells/mL时, ⋅OH杀灭的阈值浓度为1.07mg/L,致死时间为4.5s;形态观察结果表明,处理后各种藻的形态是完整的,无内溶质溢出.因此,采用•OH可实现高效快速杀灭水华藻,有效保障饮用水安全.
羟基自由基;水华藻;致死阈值;暴露时间
藻华是世界性的水环境问题,而我国的诸多湖泊与河流库区的高藻爆发形势日益严峻.这些湖库水是我国饮用水水源的重要组成部分,高藻爆发时,藻密度、化学需氧量、氨氮等水质指标超过地表水Ⅲ类标准,不仅会增加自来水厂的生产成本,甚至引起减产或停产.常规饮用水处理工艺难以解决藻类毒素、嗅味物质等高藻引发的水质超标问题,严重威胁城市供水和饮用水安全[1].
目前,采用化学氧化法控制藻华已成为全世界范围内的研究热点.Daly等[2]研究氯法杀灭密度为30×104cells/mL的铜绿微囊藻,当CT值(氧化剂的暴露总量)为7~29(mg·min)/L时,所有藻细胞失去活性,但产生三氯甲烷、卤乙酸等卤代有机消毒副产物[3].Zhou等[4]研究了二氧化氯法杀灭密度为100×104cells/mL的铜绿微囊藻,作用时间为10min时,藻细胞去除率达到91.5%,但产生的副产物 ClO2-和 ClO3-具有较大的潜在毒性[5]. Huo等[6]采用浓度为0~60mg/L的H2O2杀灭铜绿微囊藻,作用时间为3h时,致死率达到99%,然而H2O2浓度大,杀灭高藻的成本过高[7], H2O2在使用和运输过程中存在爆炸隐患.Coral等[8]研究臭氧法致死细胞密度为25×104和150×104cells/ mL的铜绿微囊藻,在CT值小于0.2mg·min/L时,所有细胞失活,若水中Br-和Cl-浓度较高,O3氧化会生成 HOBr等消毒副产物[9],且臭氧法的一次性设备投资、运行成本高,设备及附属设备庞大.Li等[10]利用水利空化产生羟基自由基技术,处理初始叶绿素含量为 0.17mg/m3的铜绿微囊藻,当羟基浓度为 2.03µmol/L,3d内对藻的去除率可达91.2%.顾雨辰等[11]利用高压脉冲气液混合放电杀灭铜绿微囊藻,结果表明在优化条件下,该方法在5d时间内,对叶绿素含量为0.15mg/m3的铜绿微囊藻的致死率可达 99%以上.因此采用氯气、二氧化氯、H2O2和O3等常规氧化剂去除水中藻细胞时,存在生成具有潜在毒性的消毒副产物、反应时间长、投资和运行成本高、安全性差、设备庞大等多种问题.而采用电离放电法除藻成为当今热点[12].
本文针对 3种典型的水华藻,即铜绿微囊藻、针杆藻和四尾栅藻,在大气压条件下采用强电离放电高效制备⋅OH溶液,开展了⋅OH对上述3种典型水华藻的杀灭研究.结合SYTOX Green荧光染色技术、流式细胞仪法和光合活性参数Fv/Fm值,分别确定了⋅OH对3种典型水华藻的致死阈值和时间,为高藻水高效安全处理提供新方法,为高藻爆发时期饮用水处理工艺的改进提供新思路.
1 材料与方法
1.1 材料
实验所用的铜绿微囊藻(Microcystis aeruginosa, FACHB-905)、针杆藻(Synedra sp., FACHB-843)和 四 尾 栅 藻 (Scenedesmus quadricuauda, FACHB-44)购自中科院武汉水生所.铜绿微囊藻属蓝藻门色球藻科微囊藻属,细胞球形、圆球形,直径3~5µm左右,细胞淡蓝色或绿色,常聚集生长,群体具无色柔和溶解性的胶被,以二分裂形式进行繁殖.针杆藻属硅藻门羽纹纲无壳缝目,细胞长杆形,长10µm左右,壳面披针形,中部宽,从中间到两端逐渐狭窄;四尾栅藻属绿藻门栅藻科栅藻属,细胞为长圆形、圆柱形,长15~20µm,常由4个细胞构成,群体中的各个细胞以其长轴相互平行、其细胞壁彼此紧密排列在一个平面上,互相平齐,群体两侧细胞的上下两端各具 1刺,刺长 10~13µm.3种藻的培养基依次为BG11、Erdschreiber和SE,培养条件均为(25±1)℃, pH=(7.1±0.1),光照 2000lux,光:暗=12h:12h.实验过程中取对数期的藻细胞完成杀灭实验.
实验配水是由纯水机(Millipore Milli-Q,美国)制取,用于实验系统配制试剂.
1.2 实验系统
⋅OH快速杀灭典型水华藻的实验系统如图1所示,待处理高藻水流量为 4L/min,由泵泵入管路中,O2(纯度为99.9%)的流量为0.5L/min,通入到氧等离子体发生器中,在大气压下微辉光与微流注交替促成的强电离放电作用下,O2被电离、离解生成O2+、O(1D)、O、O2-、O2(a1∆g)、O3等氧活性粒子,通过高压射流空化效应高传质效率地注入到水中,生成以⋅OH为主的氧自由基溶液,其中还包括H2O2、HO2¯、O2⋅¯、O3⋅¯、HO3⋅等自由基[10-11],统称为总氧化剂 TRO.在管路中⋅OH对藻细胞进行快速高效的杀灭,取样点的杀灭时间分别为0.4s、1.3s、2.1s、2.9s、3.7s、4.5s.

图1 ⋅OH处理高藻水系统Fig.1 ⋅OH treating system of algae-laden water
1.3 实验方法
1.3.1 总氧化剂TRO浓度检测 TRO是以⋅OH为主,包括H2O2、HO2¯、O2⋅¯、O3⋅¯、HO3⋅和O2+H2O等氧自由基的总氧化剂浓度,由在线监测仪(ATi Q45H,美国)检测,同时依据USEPA 330.5标准中的 DPD(N,N-二乙基对苯二胺)分光光度法进行测定[13].
1.3.2 藻细胞活性分析 荧光显微镜计数法,染色剂为SYTOX®Green(Life Technologies,美国)核酸染色剂是带 3个正电荷的不对称花青染色,与表面带正电荷的活体藻细胞互相排斥,并且由于其大分子染色结构,它不能穿透活细胞膜.相反,⋅OH影响藻细胞膜的通透性,允许 SYTOX Green核酸染色剂进入失去活性的藻细胞内,与核酸结合,在488nm蓝激发光激发下,呈现绿色荧光;活细胞呈现叶绿素的自体红色荧光[14-15].通过观察红色荧光和绿色荧光清晰地辨别藻细胞死活.采用徕卡DM6000B全自动荧光显微镜,放大400倍,在自然光下找到藻细胞,分别在绿色激发光和蓝色激发光下判别死活、计数,以 100格为一个计数单位,按1mL记录.
流式细胞仪(Accuri C6,BD,美国)检测,加入适量的染色剂(SYTOX®Green)于 1mL样品中,避光,置于涡旋振荡后静置7min,经60µm筛绢过滤,发出的绿色荧光在 FL1(525nm)通道被收集,发出的红色荧光在FL3(620nm)通道被收集,数据通过FlowJo 7.6分析处理[16-17].
1.3.3 藻细胞的光合能力分析 光合活性参数Fv/Fm表示藻细胞光合反应中心PSII的最大光量子产量,反应了植物的最大潜在光合能力,该值越大说明光和潜力越大.样品经15min的暗适应,使用叶绿素荧光仪脉冲仪(PHYTO-PAM Walz,德国)和Photo win v2.13(ED)操作软件测定,其计算公式为:

2 结果与讨论
2.1 采用荧光染色法确定⋅OH杀灭阈值
基于⋅OH致死混合藻的实验,铜绿微囊藻、针杆藻和四尾栅藻的初始藻浓度分别为19.5×104、21.8×104和 4.90×104cells/mL,总藻为46.2×104cells/mL,总氧化剂TRO浓度设置为0、0.51、0.79、0.96、1.07、1.24和1.31mg/L,反应时间为4.5s.TRO致死混合藻的关系曲线如图2所示,随着TRO浓度的增高,活藻密度急剧下降,⋅OH杀灭3种藻的阈值浓度为1.07mg/L.

图2 TRO对3种藻致死阈值的影响Fig.2 Effect of TRO on the lethal threshold of 3algae species

图3 ⋅OH致死3种藻前后的荧光显微镜观察结果Fig.3 Light and fluorescence microscope of 3kinds of algae before and after ⋅OH inactivation
采用显微镜分析原藻细胞及阈值(1.07mg/L)致死藻细胞形态的变化,如图3所示.自然光下观察,原藻细胞(图A、B、C)通体周圆,细胞壁光滑完好,胞内结构分布清晰,颜色鲜亮稠密;处理后(图A1、B1、C1),藻细胞外形基本没有变化,但颜色暗淡,胞内分布模糊.在荧光下观察,原藻细胞(图a、b、c)发出红色的叶绿素自体荧光;处理后(图a1、b1、c1)细胞核发出强烈的绿色荧光,证明细胞死亡,染色剂通过细胞膜进入细胞,与细胞核中的 DNA结合,使细胞核染色.根据藻细胞形态学分析,阈值浓度下细胞形态完整,无观察到内溶质溢出.
2.2 采用光合能力确定⋅OH杀灭阈值
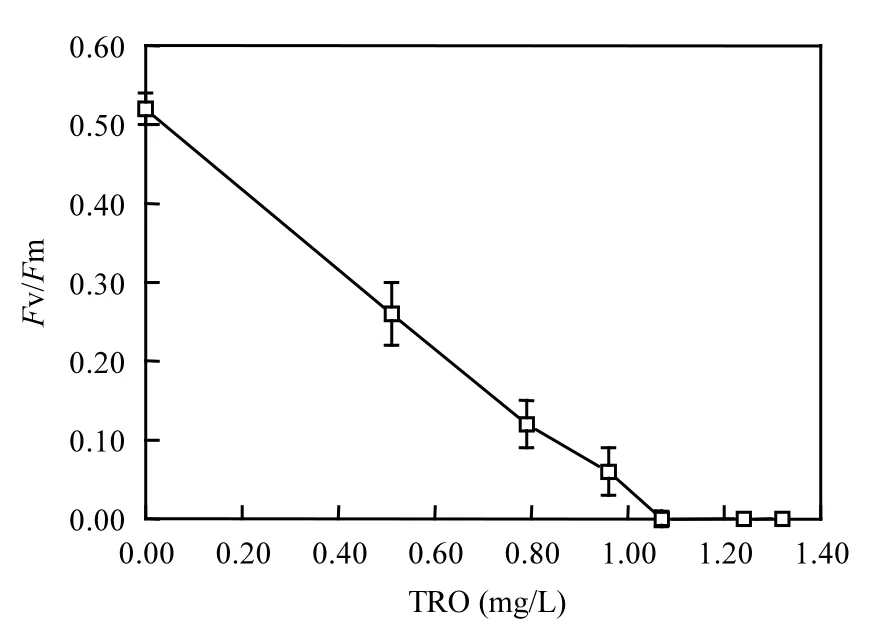
图4 TRO对藻的光合参数Fv/Fm的影响Fig.4 Effect of TRO on photosynthetic parameter Fv/Fmof algae
2.3 采用流式细胞仪确定⋅OH杀灭阈值
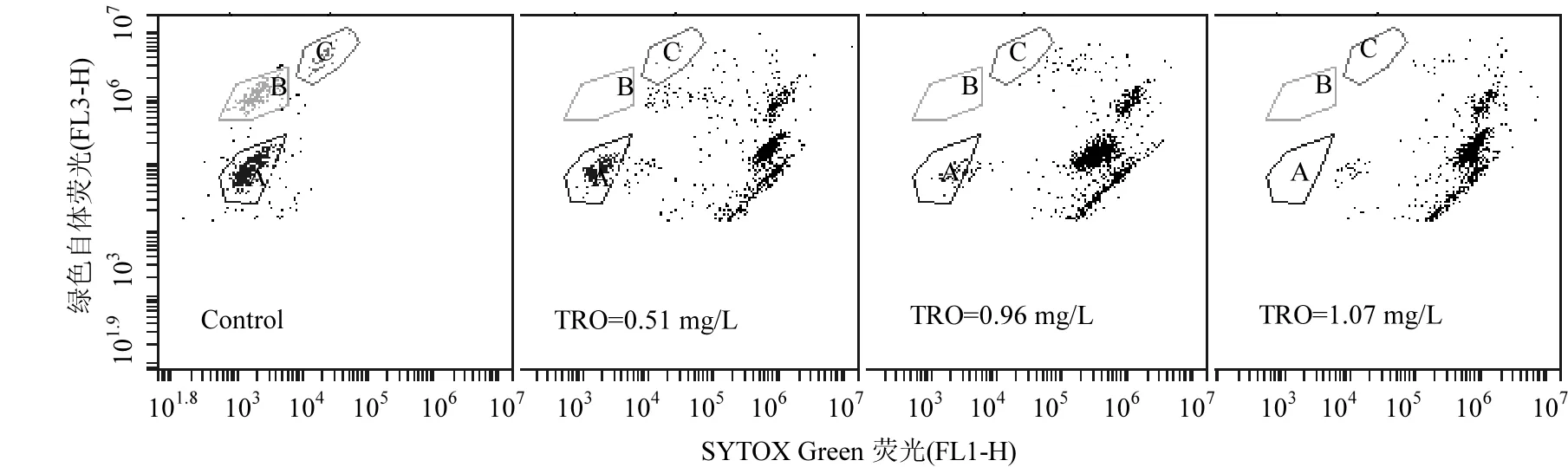
图5 ⋅OH致死3种藻的流式细胞仪检测结果Fig.5 Flow cytometry results of ⋅OH inactivation of 3algae species Control为对照组;A:铜绿微囊藻;B:针杆藻;C:四尾栅藻
⋅OH致死 3种藻的流式细胞仪检测结果如图5所示,横坐标反应了SYTOX Green染色剂与细胞核酸结合后发出的绿色荧光强度,通过FL1-H通道收集;纵坐标反应了叶绿素的自发红色荧光强度,通过FL3-H通道收集;3种藻分布在不同区域,其中A、B、C依次为铜绿微囊藻、针杆藻和四尾栅藻,3部分总和占总藻 99.8%(如图Control),随着TRO浓度增高,A、B、C部分的藻细胞数量逐渐减少,并向右边偏移;当 TRO浓度为0.51mg/L时,A、B、C部分的藻细胞占34.8%;当TRO浓度为0.96mg/L时,A、B、C部分的藻细胞占16.4%;当TRO浓度为阈值浓度1.07mg/L时,3部分的藻细胞数量为 0,且在荧光显微镜下观察,所有藻细胞发绿色荧光,藻细胞结构完整,由此表明,强氧化剂⋅OH可能对藻细胞中的DNA造成损伤,进而致死藻细胞.
2.4 ⋅OH杀灭3种藻的时间效应
在致死阈值浓度1.07mg/L时,将初始藻密度为46.2×104cells/mL的混合藻液注入到实验系统中(图1),以氧活性粒子注入到管路中的高压射流器处为0s,分别依次于不同作用时间(分别为0.3、2.1、2.9、3.7、4.5s)的取样口取样,同时用过量的饱和硫代硫酸钠终止反应,测定样品的光合活性参数Fv/Fm,结果如图6所示.由图6可知,随着作用时间的增加,藻细胞光合活性呈现明显下降趋势.Fv/Fm值在4.5s内快速由0.65降至0(仪器显示为不能检出),表明⋅OH能快速进入细胞,在4.5s内使藻细胞的光合系统损伤而失去光合活性.藻细胞形态分析结果显示,阈值浓度下细胞结构没有变化,无内溶质溢出,细胞形态完整.

图6 ⋅OH致死藻时间对光合参数Fv/Fm的影响Fig.6 Effect of ⋅OH inactivation time for algae on photosynthetic parameter Fv/Fm
据 Zhou等[4]研究二氧化氯法杀灭密度为100×104cells/mL 的铜绿微囊藻,在 ClO2为 1.0mg/L,作用时间 10min时,藻细胞去除率达91.5%,但藻的细胞膜破裂,产生的副产物ClO2-和具有较大的潜在毒性[5];Coral等[8]研究臭氧法杀灭细胞密度为150×104cells/mL的铜绿微囊藻,在O3为4.0mg/L,作用时间10min时,所有细胞失活,内溶质溢出;据Huase等[22]研究表明高锰酸钾法杀灭密度为390×104cells/mL的铜绿微囊藻,在KMnO4为5mg/L,当作用2h时,Fv/Fm由0.45降至0.07,藻细胞去除率达84.6%,大量内溶质溢出;Zhou等[23]研究过氧化氢法和硫酸铜法杀灭密度为400×104cells/mL的铜绿微囊藻,当作用4h时,在0.5mmol/L(即17mg/L)H2O2作用下,藻细胞的光合参数由 0.42降至 0.05;在 2.5µmol/L(即0.4mg/L)CuSO4作用下,藻细胞的光合参数由0.42降至0.04,但细胞膜破裂,藻毒素MC-LR外溢.常规氧化剂与藻细胞长时间接触作用是导致藻细胞失活和破损的主要原因.而⋅OH法可实现快速杀灭,这是由于⋅OH具有非常高的反应速率常数(109mol/L·s),是其它氧化剂的107倍以上,反应速度极快,可在数秒内完成整个生化反应过程.
3 结论
3.1 采用⋅OH开展致死铜绿微囊藻、针杆藻和四尾栅藻混合藻的实验研究,当初始藻密度分别为19.5×104、21.8×104和4.90×104cells/mL时,混合藻的致死 TRO阈值为 1.07mg/L,致死时间为4.5s.
3.2 在低剂量致死阈值条件下,⋅OH氧化铜绿微囊藻、针杆藻和四尾栅藻后,藻细胞失去活性,且藻细胞形态完整,细胞未发生破裂.
3.3 本研究规模化制备的⋅OH为高藻水的高效快速安全处理提供了新方法.
[1] Merel S, Clement M, Thomas O. State of the art on cyanotoxins in water and their behavior towards chlorine [J]. Toxicon, 2010,55: 677-691.
[2] Daly R I, HO L, Brookes J D. Effect of chlorination on Microcystis aeruginosa cell integrity and subsequent microcystin release and degradation [J]. Environmental Science and Technology, 2007,41:4447-4453.
[3] Fang J Y, Ma J, Yang X, et al. Formation of carbonaceous and nitrogenous disinfection by-products from the chlorination of Microcystis aeruginosa [J]. Water Research, 2010,44(6):1934-1940.
[4] Zhou S Q, Shao Y S, Gao N Y, et al. Effect of chlorine dioxide on cyanobacterial cell integrity, toxin degradation and disinfection by-product formation [J]. Science of the Total Environment, 2014,482:208-213.
[5] Carlton B D, Habash D L, Basaran A H, et al. Sodium chlorite administration in Long-Evans rats: reproductive and endocrine effects [J]. Environmental Research, 1987,42(1):238-245.
[6] Huo X, Chang D W, Tseng J H, et al. Exposure of Microcystis aeruginosa to hydrogen peroxide under light: kinetic modeling of cell rupture and simultaneous microcystin degradation [J]. Environmental Science and Technology, 2015,49(9):5502-5510.
[7] Gao L, Pan X, Zhang D, et al. Extracellular polymeric substances buffer against the biocidal effect of H2O2on the bloom-forming cyanobacterium Microcystis aeruginosa [J]. Water Research, 2015,69:51-58.
[8] Coral L A, Zamyadi A, Barbeau B, et al. Oxidation of Microcystis aeruginosa and Anabaena flos-aquae by ozone: impacts on cell integrity and chlorination by-product formation [J]. Water Research, 2013,47(9):2983-2994.
[9] Jung Y, Yoon Y, Hong E, et al. Inactivation characteristics of ozone and electrolysis process for ballast water treatment using B. subtilis spores as a probe [J]. Mar Pollut Bull, 2013,72(1):71-79.
[10] Li P, Song Y, Yu S L. Removal of Microcystis aeruginosa using using hydrodynamic cavitation: Performance and mechanisms [J]. Water Research, 2014, 62: 241–248.
[11] 顾雨辰,张光生,郝小龙,等.高压脉冲气液混合放电等离子体对铜绿微囊藻的灭活研究 [J]. 上海环境科学, 2013,32(6):257-263.
[12] 洪伟辰,白敏冬,满化林,等.气浮-⋅OH强氧化组合工艺处理高藻水的研究 [J]. 中国环境科学, 2015,35(12):3634-3639.
[13] Bai M D, Zhang, Z T, Bai M D, et al. Synthesis of ammonia using CH4/N2plasmas based on micro-gap discharge under environmentally friendly condition [J]. Plasma Chem Plasma P, 2008,28(4):405-414.
[14] Bai M D, Zhang Z T, Zhang N H, et al. Treatment of 250 t/h Ballast Water in Oceanic Ships Using ·OH Radicals Based on Strong Electric-Field Discharge [J]. Plasma Chem Plasma P, 2012, 32(4):693-702.
[15] US EPA Method 330.5. Chlorine, Total Residual (Spectrophotometric, DPD) [S].
[16] Machado M D, Soares E V. Development of a short-term assay based on the evaluation of the plasma membrane integrity of the alga Pseudokirchneriella subcapitata [J]. Appl Microbiol Biotechnol, 2012,95(4):1035-1042.
[17] Zhou S Q, Shao Y S, Gao N Y, et al. Effects of different algaecides on the photosynthetic capacity, cell integrity an microcystin-LR release of Microcystis aeruginosa [J]. J Hazard Mater, 2013,219-220:267-275.
[18] 李 芳,白敏冬,洪伟辰,等.羟基自由基快速致死水华针杆藻的研究 [J]. 环境科学学报, 2016,32(2):550-556.
[19] Bai M D, Zheng Q L, Tian Y P, et al. Inactivation of invasive marine species in the process of conveying ballast water using•OH based on a strong ionization discharge [J]. Water Research, 2016,96:217-224.
[20] Renger G, Volker M, Eckert H, et al. On the mechanism of photosystem II deterioration by UV-B irradiation [J]. Photochem Photobiol, 1989,49(1):97-105.
[21] Matsubara S, Chow W S. Populations of photo inactivated photosystem II reaction centers characterized by chlorophylla fluorescence [J]. Plant Biology, 2004,101:18234-18239.
[22] Huase Ou, Gao N Y, Wei C W, et al. Immediate and long-term impacts of potassium permangante on photosynthetic capacity, survival and microcystin-LR release risk of Microcystis aeruginosa [J]. J Hazard Mater, 2012,219-220:267-275.
[23] Zhou S Q, Shao Y S, Gao N Y, et al. Effects of different algaecides on the photosynthetic capacity, cell integrity and microcystin-LR release of Microcystis aeruginosa [J]. Science of the Total Environment, 2013,463–464:111-119.
Research on the rapid inactivation of typical algae blooms by hydroxyl radical.
DING Li-fei1, LI Hai-yan1, BAI min-dong1*, ZHENG Wu1, GUO Feng1, ZHANG Zhi-tao2*(1.College of Environment &Ecology, Xiamen University, Xiamen 361102, China;2.Environmental Engineering Institute, Dalian Maritime University, Dalian 116026, China). China Environmental Science, 2017,37(7):2633~2638
Algae blooming in water sources breaks out increasingly and seriously threatened the water supply safety. Bench scale tests were conducted to study the effects of ⋅OH generated from strong ionization discharge and high pressure water jet cavitation on cell density, cell integrity and photosynthetic capacity of 3kinds of typical freshwater algae. Algae species including Microcystis aeruginosa, Synedra sp., and Scenedesmus quadricuauda were respectively prepared at concentrations of 19.5×104, 21.8×104and 4.90×104cells/mL, and the cell integrity was assessed by flow cytometry. Results suggested that the⋅OH lethal threshold of the algae was 1.07mg/L within the exposure time of 4.5s. The cell morphological observation results showed that all the cells were integral and no cytoplasm composition spilled. Hence, large-scale production of ⋅OH is a novel method to inactive typical algae species efficiently and to protect drinking water safety simultaneously.
hydroxyl radical;algae blooms;lethal threshold;exposure time
X52
A
1000-6923(2017)07-2633-06
丁丽飞(1990-),女,福建宁德人,硕士研究生,主要从事水污染防控研究.
2016-11-01
国家科技支撑计划资助项目(2013BAC06B01, 2013BAC06B02);国家重大科研仪器研制项目(61427804)
* 责任作者, 白敏冬, 教授, mindong-bai@163.com; 张芝涛, 教授, newzhangzhitao@163.com

