MicroRNA-9通过NRP1抑制胃癌SGC-7901细胞上皮-间充质转化功能*
南寿山, 王珏磊
(天津市第五中心医院消化科,天津 300450)
MicroRNA-9通过NRP1抑制胃癌SGC-7901细胞上皮-间充质转化功能*
南寿山△, 王珏磊
(天津市第五中心医院消化科,天津 300450)
目的: 研究微小RNA-9 (microRNA-9,miR-9)对胃癌SGC-7901细胞上皮-间充质转化(EMT)功能的影响及其相关机制。方法: SGC-7901胃癌细胞株分别转染miR-9 mimics和阴性对照序列(negative control mi-mic,NCM),作为miR-9组和NCM组,并设立未转染对照(control)组,采用RT-qPCR法检测各组细胞miR-9的含量,Transwell实验检测3组细胞迁移能力和侵袭能力,Western blot法检测3组细胞的N-cadherin、E-cadherin、α-catenin和神经纤毛蛋白1(NRP1)表达水平。采用Western blot法检测NRP1过表达对miR-9抑制EMT的拮抗作用。双萤光素酶实验检测miR-9与NRP1的关系。结果: miR-9组的miR-9 表达水平明显上调,为control组的538倍(P<0.05)。miR-9组的迁移细胞数量明显低于control组(P<0.05)。miR-9组的侵袭细胞数量明显低于control组(P<0.05)。miR-9组细胞的N-cadherin和NRP1蛋白表达量明显降低,E-cadherin及α-catenin蛋白表达量明显升高。而NRP1及miR-9均过表达组胃癌细胞中N-cadherin蛋白表达量明显升高, E-cadherin及α-catenin蛋白表达量明显降低。双萤光素酶检验结果显示NRP1为miR-9的下游靶基因(P<0.05)。结论: miR-9可能通过降低下游靶基因NRP1水平影响EMT相关蛋白表达,抑制胃癌SGC-7901细胞的EMT功能。
胃癌; 微小RNA-9; 上皮-间充质转化
胃癌发病率居全球恶性肿瘤的第4位,死亡率居第2位,进展快,预后不良。由于其恶性度高,早期侵袭转移等特点,5年生存率仅约30%~50%。虽然手术及放化疗为主的胃癌综合治疗手段不断更新,技术长足发展,但其总体生存率仍没有明显提高。所以目前迫切需要开发可以在胃癌发生发展过程中抑制其侵袭转移的手段,以提出新的治疗策略,提高胃癌的总体疗效。因此,寻找和研究在胃癌的上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程中可以起到确切抑制作用的关键分子具有重要的科学意义。
近年的研究发现,微小RNA-9(microRNA-9,miR-9)与多种恶性肿瘤的发生发展有密切关系,可能通过多种分子生物途径发挥抑癌作用,并其可能通过影响原癌基因神经纤毛蛋白1(neuropilin-1,NRP1)等多种细胞功能蛋白的表达实现治疗效果,有望成为包括胃癌在内的多种肿瘤的治疗靶点。但在对胃癌进行miR-9含量的靶向干预后,对EMT和侵袭转移的影响及其机制尚不明确[1]。本研究采用miR-9模拟物(mimics)转染人胃癌细胞系SGC-7901细胞,观察其对胃癌细胞EMT过程的影响,并进一步研究其胃癌细胞中对NRP1等功能蛋白表达水平的影响。
材 料 和 方 法
1 材料
胃癌细胞株SGC-7901由本实验室冻存。IMDM培养基和胎牛血清购自Gibco;胰酶、PBS液、Trizol液和脂质体2000(LipofectamineTM2000)购自Invitrogen; Transwell小室购自NUNC; real-time PCR试剂盒购自TaKaRa;兔抗人NRP1、兔抗人N-cadherin、兔抗人α-catenin、兔抗人E-cadherin抗体及兔抗人β-actin抗体购自Abcam;miR-9模拟物及其阴性对照序列(negative control mimic,NCM)、miR-9及内参照RNU6的PCR引物购自广州亚科生物科技有限公司;双萤光素酶检验试剂盒、野生型的WT-NRP1 psiCHECKTM-2载体、3’UTR定点突变后的MT-NRP1 psiCHECKTM-2载体和3’UTR定点突变的NRP1过表达质粒载体购自广州爱科生物技术有限公司。
2 方法
2.1 miRNA转染和miR-9含量的RT-qPCR检测 复苏培养SGC-7901胃癌细胞株,以含有20%胎牛血清的IMDM培养基常规培养于37 ℃、5% CO2、饱和湿度的细胞培养箱中。细胞融合度达40%时,按照转染试剂LipofectamineTM2000试剂说明书,以终浓度为45 nmol/L分别转染miR-9 mimics和NCM 48 h,作为miR-9和NCM组,并设立未转染对照(control)组,同时进行后续功能实验检测。
Trizol法提取各组总细胞RNA,逆转录合成cDNA。以RNU6 作为内参照,进行RT-qPCR检测。miR-9的上游引物为5’-GAGGCAGACAGCCAGACA-3’,下游引物为5’-CAAGGGTCCGAGGTGCGT-3’;RNU6的上游引物为5’-CTCGCTTCGGCAGCACA-3’,下游引物为5’-AACGCTTCACGAATTTGCGT-3’。PCR反应条件按照课题组既往报道方法进行[2-3],所得数据用2-ΔΔCt法进行分析计算。
2.2 Transwell实验检测细胞迁移能力和侵袭能力 分组转染后,各组细胞分别取对数期1×105个细胞150 μL无血清培养基重悬后加入Transwell小室上室,Transwell下室加入500 μL含血清完全培养基。细胞培养箱37 ℃常规培养48 h,弃去上室培养液,取下上室底膜,清除未穿膜上室细胞,甲醇固定穿膜细胞15 min,PBS冲洗3遍。1%结晶紫染色20 min,PBS冲洗3遍。取下上室底膜,光镜下观察并计数穿过小孔细胞评价细胞迁移能力。将Matrigel胶稀释后,每个Transwell小室加入50 μL,37 ℃孵育3 h凝固。同前Transwell实验方法,将分组转染后的细胞重悬于无血清培养基后,接种入Transwell小室上室,下室加入500 μL完全培养基。常规培养48 h后取出小室。擦除未过膜细胞后甲醇固定,1%结晶紫染色,显微镜下拍照,光镜下观察并计数穿过小孔细胞评价细胞侵袭能力。
2.3 Western blot法检测细胞蛋白表达的变化 胃癌细胞分组转染后48 h,按照既往报道方法收集细胞,提取总蛋白,进行Western blot实验检测NRP1蛋白,间充质细胞标志物E-cadherin,上皮细胞标志物α-catenin及E-cadherin,内参照β-actin蛋白的表达。
2.4 NRP1过表达对miR-9抑制EMT的拮抗作用 采用NRP1过表达质粒转染miR-9组细胞系,并通过Western blot检测NRP1过表达后miR-9组SGC-7901细胞中间充质细胞标志物和上皮细胞标志物的表达情况。
2.5 双萤光素酶实验检测miR-9与NRP1的关系 采用野生型的NRP1 psiCHECKTM-2载体及定点突变后的NRP1 psiCHECKTM-2载体,分别和miR-9 mimics一起通过脂质体共转染,转染48 h后行双萤光素酶检验。
3 统计学处理
采用SPSS 13.0软件进行分析。实验数据用均数±标准差(mean±SD)表示,多组间比较用单因素方差分析,多组间两两比较采用Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 SGC-7901细胞中miR-9的水平
miR-9 mimics转染SGC-7901细胞24 h 后,检测各组细胞中miR-9 和内参照RNU6的表达水平。结果显示,miR-9组miR-9 的表达水平明显上调,其表达水平约是control组的538倍左右(P<0.05),而NCM组的miR-9表达水平与control组的差异没有统计学显著性,见图1。
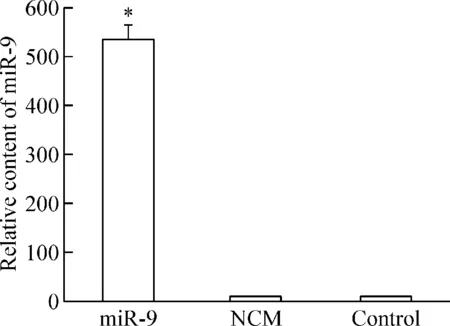
Figure 1.Comparison of the miR-9 levels in 3 groups of SGC-7901 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图1 3组SGC-7901细胞miR-9水平的比较
2 miR-9对SGC-7901细胞迁移能力的影响
Transwell实验发现,经过48 h培养,miR-9组迁移细胞数量明显低于control组,而NCM组的细胞数量与control组之间的差异无统计学显著性(P<0.05),见图2。
3 miR-9对SGC-7901细胞侵袭能力的影响
Transwell实验发现,经过48 h培养,观察受到染色的穿膜细胞数量。发现miR-9组侵袭细胞数量明显低于control组,而NCM组的细胞数量与control组之间的差异无统计学意义(P<0.05),见图3。

Figure 2.The effect of miR-9 on the migration ability of SGC-7901 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图2 miR-9对SGC-7901细胞迁移能力的影响
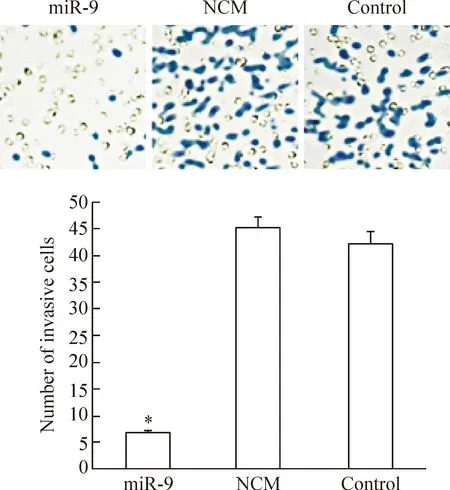
Figure 3.The effect of miR-9 on the invasion ability of SGC-7901 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图3 miR-9对SGC-7901细胞侵袭能力的影响
4 miR-9对SGC-7901细胞EMT相关功能蛋白表达的影响
Western blot实验结果显示,与control组相比,miR-9组间充质细胞标志物N-cadherin蛋白表达量明显降低,上皮细胞标志物E-cadherin及α-catenin蛋白表达量明显升高(P<0.05),而NCM组与对照组之间的蛋白表达无明显差异,见图4。这说明miR-9抑制EMT过程的效果显著,且同时抑制间充质细胞标志物的表达,促进上皮细胞标志物的表达。
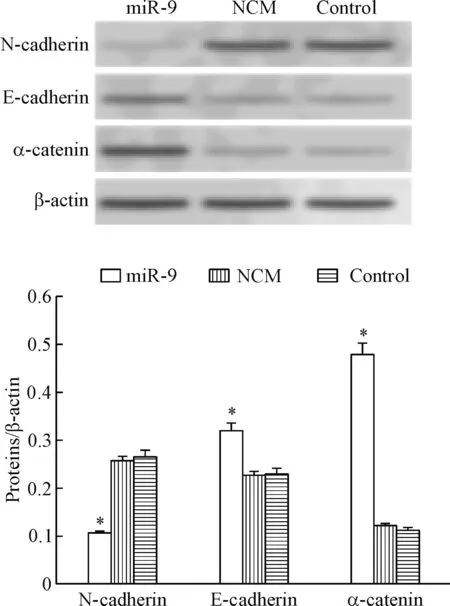
Figure 4.The effect of miR-9 on the expression of EMT-related proteins in the SGC-7901 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图4 miR-9对SGC-7901细胞EMT相关功能蛋白表达的影响
5 miR-9对SGC-7901细胞NRP1蛋白表达的影响
Western blot实验结果显示,与control组相比,miR-9组的NRP1蛋白表达量明显降低(P<0.05),而NCM组与对照组之间的NRP1蛋白表达量的差异无统计学显著性,见图5。NRP1的蛋白表达量与miR-9的RT-qPCR结果表现出负相关关系。这说明miR-9抑制NRP1蛋白表达的效果显著。
6 NRP1过表达对miR-9抑制胃癌细胞EMT的拮抗效果
Western blot实验发现,采用NRP1过表达质粒转染miR-9组细胞,伴随NRP1表达量的升高,miR-9组胃癌细胞中间充质细胞标志物N-cadherin蛋白表达量明显升高,上皮细胞标志物E-cadherin及α-catenin蛋白表达量明显降低(P<0.05),见图6。
7 miR-9与NRP1相互作用关系的双萤光素酶实验检测
双萤光素酶检验结果显示miR-9能明显抑制野生型WT-NRP1 psiCHECKTM-2载体的萤光强度(P<0.05),而无法抑制3’UTR定点突变后MT-NRP1 psiCHECKTM-2载体的萤光强度,说明NRP1为miR-9的下游靶基因,见图7。
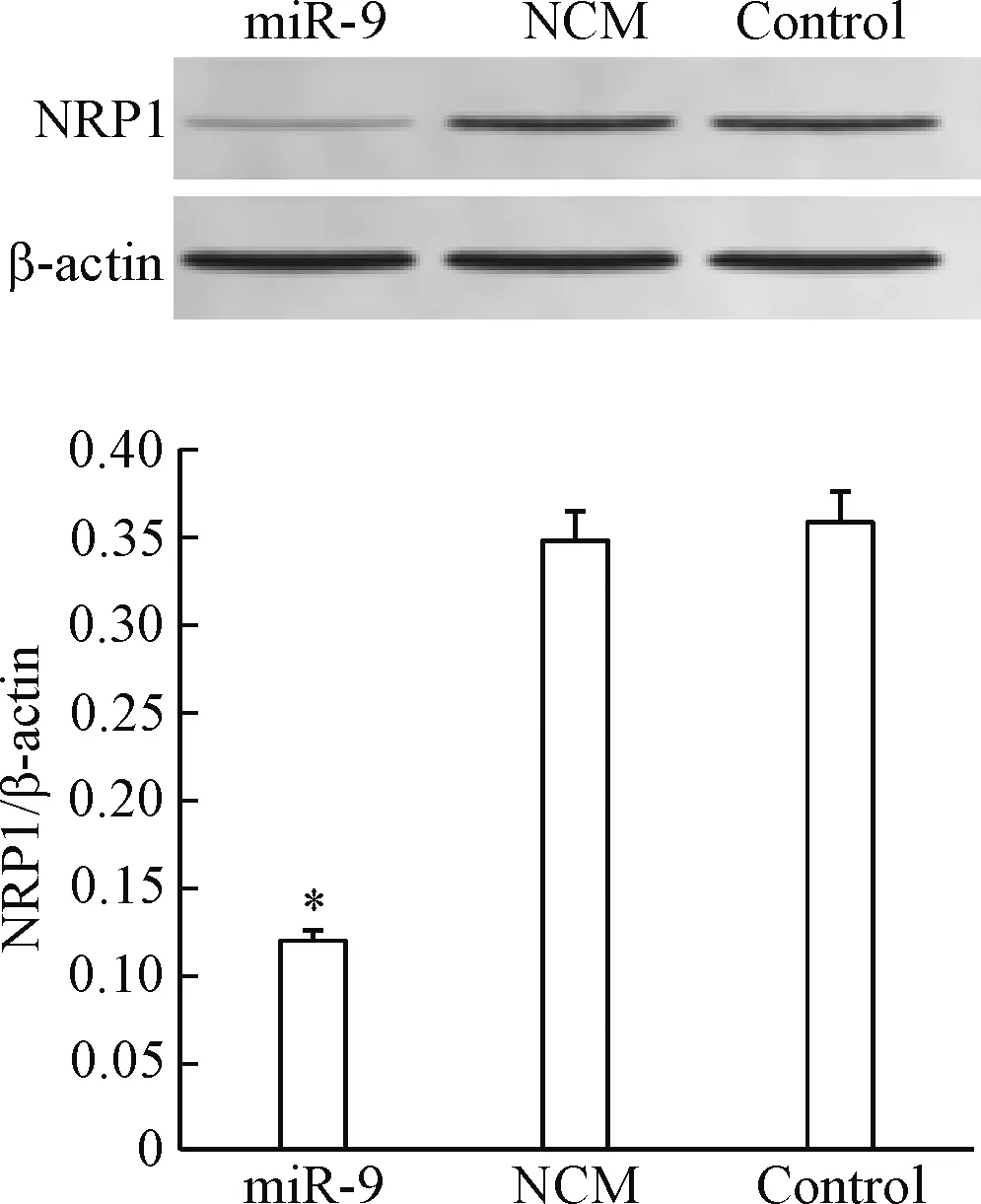
Figure 5.The effect of miR-9 on the protein expression of NRP1 in the SGC-7901 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图5 miR-9对SGC-7901细胞NRP1蛋白表达的影响
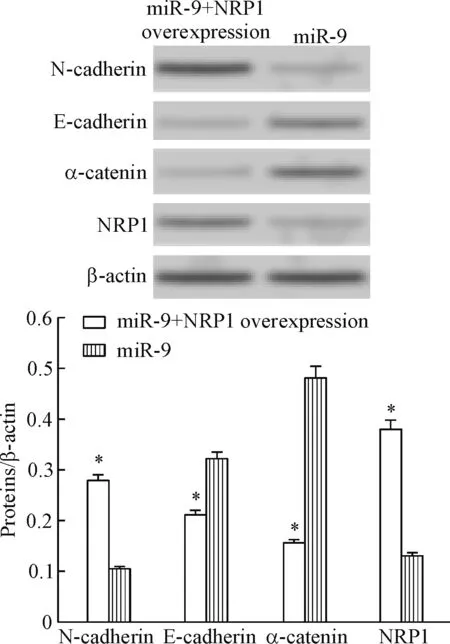
Figure 6.The effect of miR-9 on the expression of EMT-related proteins in SGC-7901 cells with or without NRP1 overexpression. Mean±SD.n=3.*P<0.05vscontrol group.
图6 NRP1过表达拮抗miR-9对SGC-7901细胞EMT相关功能蛋白表达的影响
讨 论
MicroRNA是一类在动植物细胞中对多种基因起到广泛调控作用的重要非编码RNA,在细胞的发育、增殖、分化中发挥重要的功能。其主要可以与靶蛋白的mRNA 3’ UTR形成互补配对,进而使其降解,从而抑制其翻译,负性调控靶基因的表达[4]。miR-9是较早发现的microRNA之一,最早发现其在神经发育调节中具有重要作用,进而研究发现其在多种类型的肿瘤中发生表达水平异常,广泛参与恶性肿瘤的发生、发展、侵袭和转移[5]。本研究采用miR-9 mimics成功实现了对胃癌SGC-7901细胞迁移能力和侵袭能力的抑制,说明miR-9对胃癌细胞具有基因治疗效果。
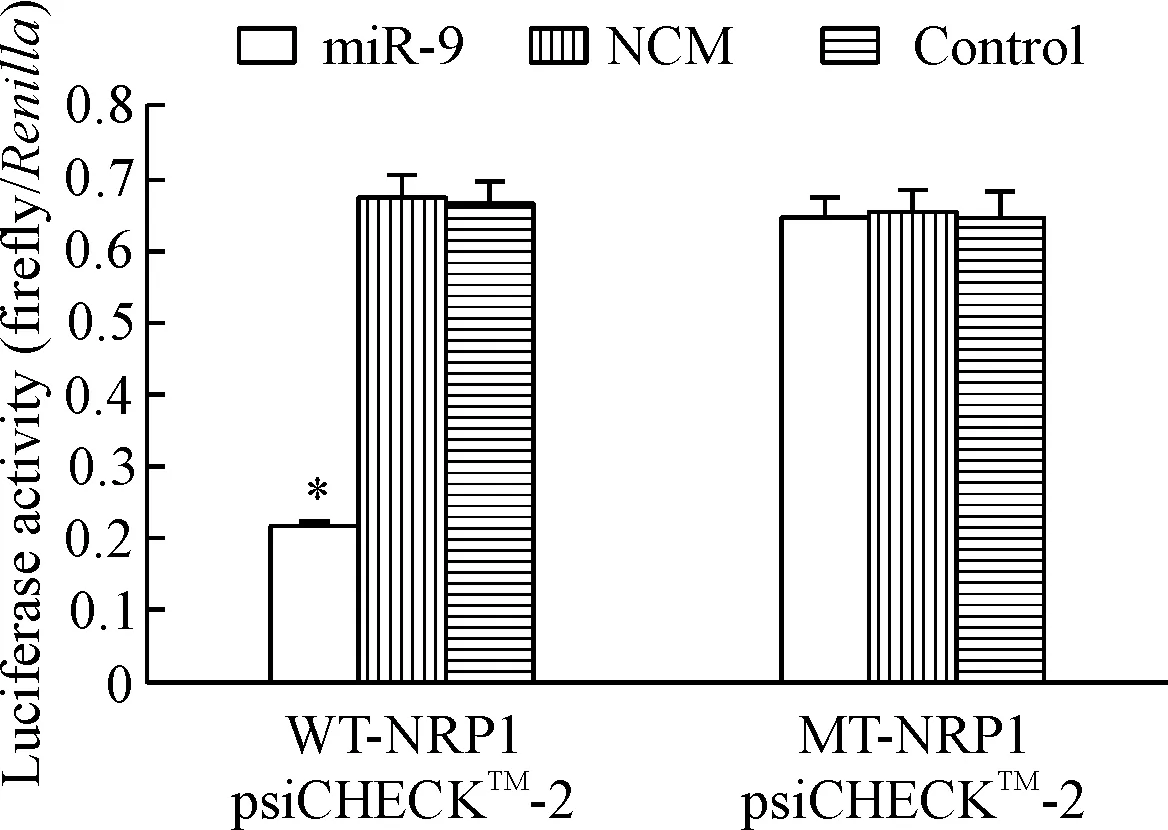
Figure 7.The relative luciferase activity of NRP1. Mean±SD.n=3.*P<0.05vscontrol group.
图7 NRP1萤光素酶活性的比较
目前认为,肿瘤迁移和侵袭的发生是一种多因素多步骤的动态过程,EMT功能在肿瘤的迁移和侵袭过程中具有决定性作用[6]。本研究结果显示,miR-9对胃癌细胞迁移能力和侵袭能力的抑制作用,可能是通过影响EMT过程实现的。
miR-9可在肿瘤细胞中,参与调节多种靶基因,调控多种靶蛋白的翻译和表达,参与对肿瘤细胞生物学过程的调节[5]。研究发现,miR-9参与调控CXCR4蛋白水平,抑制鼻咽癌细胞的侵袭和转移。也有研究发现,通过下调CBX7蛋白的表达,抑制胶质瘤细胞的发生发展[7]。同时有研究发现,miR-9对卵巢癌细胞的抑制作用是通过NF-κB蛋白实现的[8]。但是目前对miR-9作用于胃癌细胞的靶蛋白仍不明确[9]。有研究认为,miR-9在部分恶性肿瘤细胞中,可能通过降低下游靶基因NRP1水平而影响EMT相关蛋白表达[10]。NRP1是广泛存在于真核细胞中的一种跨膜信号转导蛋白,其表达水平与包括胃癌在内的多种恶性肿瘤细胞的增殖和转移呈正相关关系。所以,本课题对miR-9作用于胃癌细胞后,细胞中的NRP1蛋白表达水平进行了检测,发现miR-9水平升高后, NRP1水平明显降低。我们同时发现,国际上有相关类似研究,报道了miR-9可能在恶性黑色素瘤细胞、神经母细胞瘤细胞及人脐静脉细胞融合细胞等细胞中通过与NRP1的mRNA 3’ UTR形成互补配对,进而使其降解,从而实现抑制其翻译,负性调控靶基因的表达。这促使我们对NRP1是否在胃癌细胞是miR-9的靶蛋白进行深入探索。本研究进而通过采用3’ UTR突变的NRP1过表达质粒转染实验及双荧光素酶实验证实,NRP1在胃癌SGC-7901细胞中为miR-9的下游靶基因,miR-9对NRP1蛋白表达抑制作用的起效途径是通过与NRP1 mRNA的3’ UTR互补配对产生的。
综上所述,miR-9可能通过降低下游靶基因NRP1水平影响EMT相关蛋白表达,进而抑制胃癌SGC-7901细胞的EMT功能,有可能成为胃癌基因治疗的良好靶点。
[1] Cui Y, Han Z, Hu Y, et al. MicroRNA-181b and microRNA-9 mediate arsenic-induced angiogenesis via NRP1[J]. J Cell Physiol, 2012, 227(2):772-783.
[2] Wang J, Ou J, Guo Y, et al. TBLR1 is a novel prognostic marker and promotes epithelial-mesenchymal transition in cervical cancer[J]. Br J Cancer, 2014, 111(1):112-124.
[3] 南寿山, 靳 荣, 窦广仙. 胃黏膜相关淋巴组织淋巴瘤的病理特征与疗效相关性分析[J]. 吉林医学, 2013, 34(8):1434-1435.
[4] 谭晓勇, 罗 茂, 卢培林, 等.miR-30c 调控 PAI-1对血管内皮细胞活力和迁移的影响[J]. 中国病理生理杂志, 2016, 32(12):2199-2204.
[5] 郑朝攀, 韩 灵, 侯伟坚, 等.负向调控miR-9抑制鼻咽癌细胞的增殖、迁移和侵袭[J].中国病理生理杂志, 2014, 30(4):640-644.
[6] Yang J, Li T, Gao C, et al. FOXO1 3’ UTR functions as a ceRNA in repressing the metastases of breast cancer cells via regulating miRNA activity[J]. FEBS Lett, 2014, 588(17):3218-3224.
[7] Yang DS. Novel prediction of anticancer drug chemosensitivity in cancer cell lines: evidence of moderation by microRNA expressions[J]. Conf Proc IEEE Eng Med Biol Soc, 2014, 2014:4780-4786.
[8] Huang X, Teng Y, Yang H, et al. Propofol inhibits invasion and growth of ovarian cancer cells via regulating miR-9/NF-κB signal[J]. Braz J Med Biol Res, 2016, 49(12):e5717.
[9] Suarez-Arriaga MC, Ribas-Aparicio RM, Ruiz-Tachiquin ME. MicroRNAs in hereditary diffuse gastric cancer[J]. Biomed Rep, 2016, 5(2):151-154.
[10]Xu D, Chen X, He Q, et al. MicroRNA-9 suppresses the growth, migration, and invasion of malignant melanoma cells via targeting NRP1[J]. Onco Targets Ther, 2016,9:7047-7057.
(责任编辑: 陈妙玲, 罗 森)
MicroRNA-9 inhibits epithelial-mesenchymal transition in gastric cancer SGC-7901 cells by NRP1
NAN Shou-shan, WANG Jue-lei
(DepartmentofGastroenterology,TianjinFifthCentralHospital,Tianjin300450,China.E-mail:nanshoushan@163.com)
AIM: To investigate the inhibitory effect of microRNA-9 (miR-9) on epithelial-mesenchymal transition (EMT) in the gastric cancer SGC-7901 cells and its mechanism. METHODS: The gastric cancer cell line SGC-7901 was transfected with miR-9 mimics or negative control mimic (NCM), as miR-9 or NCM group, respectively. The SGC-7901 cells without transfection were used as control group. The expression level of miR-9 in each group was detected by RT-qPCR. The migration and invasion abilities of the SGC-7901 cells in the 3 groups were detected by Transwell assay. The protein expression of N-cadherin, E-cadherin, α-catenin and neuropilin-1 (NRP1) was determined by Western blot. Antagonistic effect of NRP1 over-expression on miR-9 inhibition of EMT was detected by Western blot. The relationship between miR-9 and NRP1 was analyzed by dual luciferase assay. RESULTS: The expression level of miR-9 in miR-9 group was significantly up-regulated, which was 538 times higher than that in control group (P<0.05). The number of migratory cells in miR-9 group was significantly lower than that in control group (P<0.05). Compared with control group, the protein expression of N-cadherin and NRP1 in miR-9 group was significantly decreased, while the protein expression of E-cadherin and α-catenin protein was significantly increased. Over-expression of NRP1 resulted in the increase in the protein expression of N-cadherin in the gastric cancer cells of miR-9 group, and the decrease in the protein expression of E-cadherin and α-catenin significantly. The result of dual luciferase assay showed thatNRP1 was a downstream target gene of miR-9 (P<0.05). CONCLUSION: miR-9 may inhibit the expression of EMT-related proteins through the downstream target geneNRP1, thus inhibiting the EMT of gastric cancer SGC-7901 cells.
Gastric cancer; MicroRNA-9; Epithelial-mesenchymal transition
1000- 4718(2017)07- 1191- 05
2017- 01- 03
2017- 03- 14
滨海新区卫生局基金资助项目(No.2013BWKY031)
R730.23
A
10.3969/j.issn.1000- 4718.2017.07.006
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 022-65665412; E-mail: nanshoushan@163.com

