肝动脉化疗栓塞联合CT引导射频消融治疗肝尾状叶原发性肝癌
生守鹏,孙 斌,郑加生,崔雄伟,崔石昌,袁春旺,钱智玲,李建军,李 聪,张洪海,马 良
(首都医科大学附属北京佑安医院肿瘤微创介入中心,北京 100069)
·临床研究·
肝动脉化疗栓塞联合CT引导射频消融治疗肝尾状叶原发性肝癌
生守鹏,孙 斌,郑加生*,崔雄伟,崔石昌,袁春旺,钱智玲,李建军,李 聪,张洪海,马 良
(首都医科大学附属北京佑安医院肿瘤微创介入中心,北京 100069)
目的 探讨经肝动脉化疗栓塞(TACE)联合CT引导射频消融(RFA)治疗肝尾状叶原发性肝癌的疗效及安全性。方法 回顾性分析肝尾状叶原发性肝癌患者16例,均先行TACE治疗,再行CT引导下RFA治疗,随访患者的手术并发症、无瘤生存时间及总生存时间。结果 15例患者实现完全消融,完全消融率为93.75%(15/16)。完全消融患者的无瘤生存时间为19.35个月。16例患者的总生存时间为44.62个月,1、3、5年的总生存率分别为88.23%、66.65%及33.18%。结论 TACE联合RFA治疗肝尾状叶原发性肝癌安全、有效。
尾状叶;肝肿瘤;肝动脉化疗栓塞;导管消融
尾状叶位于肝左、右叶背部中央,上端紧邻第2肝门区的3支肝静脉,下前方紧邻门静脉主干;后侧环绕下腔静脉。Kumon[1]将尾状叶分为Sipegle部、腔静脉旁部、尾状突部。发生于肝尾状叶的原发性肝癌相对其他部位较少,但患者的预后较差。目前肝尾状叶肿瘤首选治疗手段仍为外科切除,但由于肝尾状叶的位置深、血供复杂,导致切除难度大、并发症发生率较其他位置肝癌患者高。近年来,经肝动脉化疗栓塞(transcatheter hepatic arterial chemoembolization,TACE)联合经皮射频消融(radiofrequency ablation, RFA)治疗已广泛用于肝癌的治疗,效果肯定。笔者采用TACE联合CT引导RFA治疗肝尾状叶原发性肝癌,效果良好,现报道如下。
1 资料与方法
1.1一般资料 回顾性分析2007年1月—2011年9月于我科接受治疗的肝癌患者16例,共26个病灶,男14例,女2例,年龄47~76岁,平均(60.4±9.0)岁。其中肝尾状叶病灶均为单发,病灶单纯位于肝尾状叶者8例。2例经病理证实,14例均符合美国肝病学会诊断标准。患者的一般资料见表1。纳入标准:①肝尾状叶病灶最大径≤6.0 cm;②其他肝叶病灶不超过2个,病灶最大径≤3.0 cm,并实现了完全消融;③肝功能Child-Pugh A或B级;④无血管、胆道侵犯及肝外转移;⑤血小板计数≥50×109/L,无凝血功能障碍。
1.2仪器与方法 采用Siemens AXIOM Artis dTA平板数字减影机,GE HiSpeed螺旋CT机,RITA 1 500X型射频发生器及射频电极针StarBurstTM XL、Valleylab的Cool-tipTMRF系统。先行TACE治疗,其后2周行CT引导下RFA(图1)。
TACE:采用Seldinger技术,经右股动脉插管,5F导管于肝固有动脉造影,明确肿瘤的位置、大小及滋养动脉。采用导管、微导管尽可能超选择至肿瘤滋养动脉,经导管由肿瘤供血动脉注入羟基喜树碱20 mg,吡柔比星20 mg和5-氟尿嘧啶1 000 mg;随后给予超液化碘油—化疗药物乳剂及明胶海绵颗粒栓塞该动脉。
RFA:先经CT扫描定位。2%利多卡因局部麻醉后,在22G导引针引导下射频消融电极针经左肝/右肝穿刺至肝尾状叶,行肝尾状叶肿瘤消融治疗。穿刺路径选择:对于Sipegle部病灶,选择剑突下为穿刺点,经左肝—腹腔穿刺路径(路径1);对于尾状突部病灶,选择右侧腋中/后线为穿刺点,经右肝穿刺路径(路径2);对于腔静脉旁部病灶,根据术前CT扫描选择2个路径中适合者。对于尾状叶较大的肿瘤,可采用联合进针。消融范围满意后,撤针行针道消融。消融后3天内行腹部增强CT/MR检查,除外并发症并明确消融情况,原病灶无异常强化为肿瘤完全消融,消融不完全的患者待肝功能符合RFA要求后再次行消融治疗。
1.3随访 所有患者均定期来我院接受随访治疗,治疗结束后第1个月及第3个月复查肝脏增强CT/MR并评价疗效,以后每3个月复查1次。
1.4 疗效评价 原病灶或紧贴原病灶出现新的异常强化即为局部复发。远处复发是指肝内发生与原病灶无直接相连的新肿瘤结节、脉管内癌栓或肝外组织脏器的转移。对于复发病灶,符合条件的患者可进一步行TACE联合RFA治疗。无瘤生存时间为消融结束至腹部增强CT发现肿瘤局部/远处复发的时间。总体生存时间定义为患者第1次接受RFA治疗至患者死亡。患者疼痛程度评价参照WHO疼痛分级标准,见表2。

表1 患者一般资料及病灶情况
注:S11:Sipiegle部;S12:腔静脉旁部;S13:尾状突部
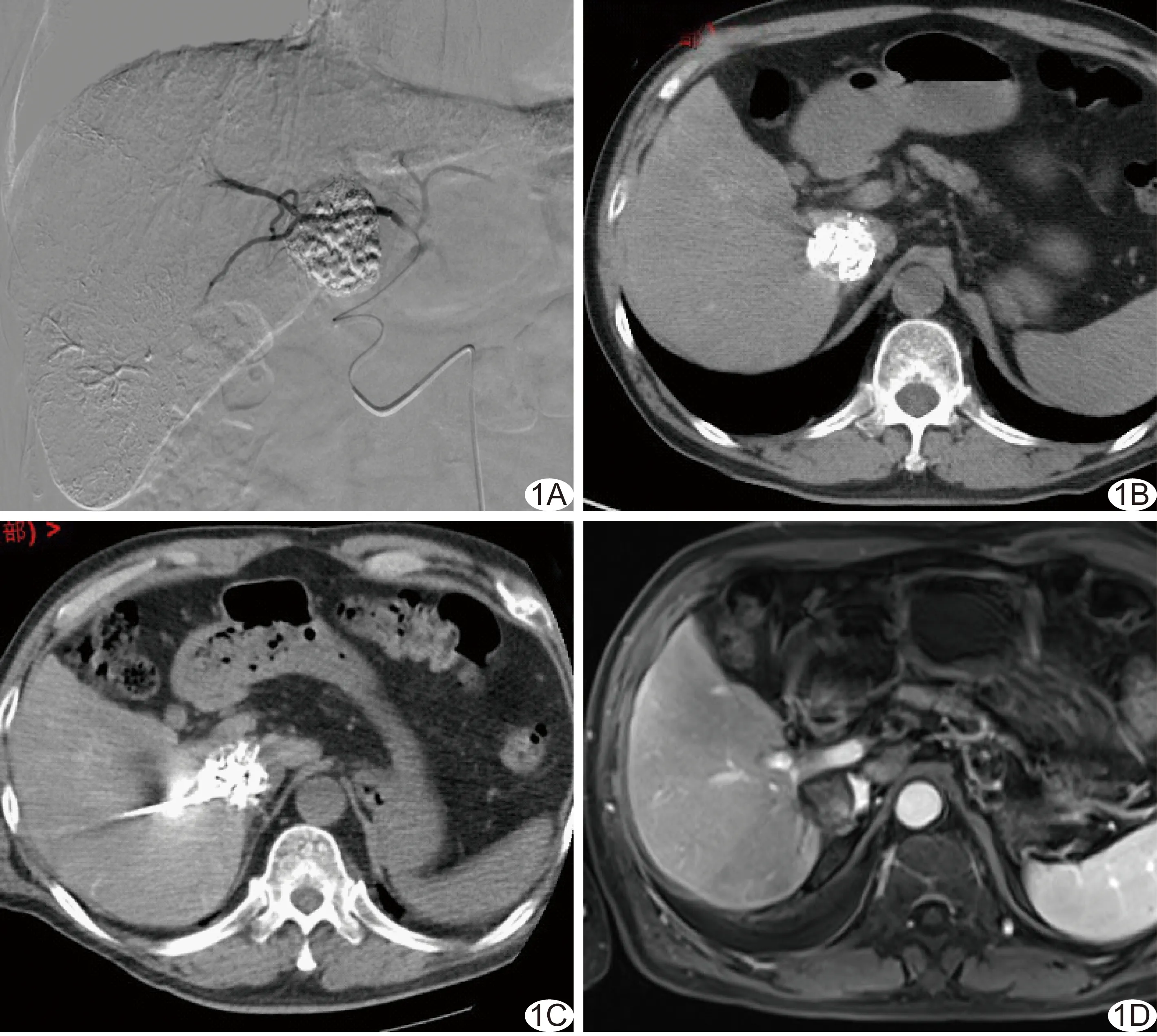
图1 患者女,70岁,肝尾叶原发性肝癌 A.肝尾状叶肿瘤TACE治疗; B.TACE后2周复查腹部CT示栓塞效果满意; C.行肝尾状叶肿瘤射频消融治疗; D.消融术后1个月复查腹部增强MRI示病灶未见异常强化

图2 肝尾状叶肝癌患者无瘤生存曲线 图3 肝尾状叶肝癌患者总生存曲线

分级 表现0度不痛Ⅰ度轻度痛,为间歇痛,可不用药Ⅱ度中度痛,为持续痛,影响休息,需用止痛药Ⅲ度重度痛,为持续痛,不用药不能缓解疼痛Ⅳ度严重痛,为持续剧痛伴血压、脉搏等变化
1.5统计学分析 采用SPSS 10.0统计分析软件。采用寿命表法计算患者的无瘤生存率及总体生存率,采用Kaplan-Meier法计算患者的无瘤生存时间及总体生存时间,描述生存曲线。
2 结果
2.1疗效 通过TACE,16个肝尾状叶病灶均实现满意栓塞,复查CT显示碘油沉积良好。本组16例患者RFA穿刺选择路径1者9例,路径2者5例,联合进针2例。16个肝尾状叶病灶中15个病灶实现完全消融,完全消融率为93.75%(15/16)。未实现完全消融的患者肝尾状叶病灶距离下腔静脉较近。随访时间截止到2013年7月,共11~76个月,平均(34.9±17.6)个月。至随访结束,死亡8例,其中因肝功能衰竭死亡5例,因上消化道出血难以控制死亡3例。完全消融患者的总体无瘤生存时间为19.35个月。16例患者的总生存时间为44.62个月,1、3、5年总生存率分别为88.23%、66.65%及33.18%。患者的无瘤和总体生存曲线分别见图2、3。
2.2并发症 16个病灶共进行TACE治疗16例次,射频消融治疗20例次。栓塞术后体温≥38.5℃者2例,出现Ⅱ级疼痛者2例;消融术后体温超过38.5℃者1例,出现Ⅱ级疼痛者2例,Ⅲ级疼痛者2例。上述患者给予退热、镇痛治疗后症状缓解。
3 讨论
肝脏尾状叶位于3个肝门结构之间,位置深,显露困难。尾状叶前方是肝门Glisson's系统,后方为下腔静脉,左侧为静脉韧带,右侧与肝右后叶相连。尾状叶有多支入肝血管,可来自左、右门静脉和肝动脉,静脉回流同样有多支静脉直接汇入下腔静脉和肝静脉。由于尾状叶的特殊解剖特点,外科切除风险大。分离尾状叶前方时易损伤肝门结构造成出血或胆管损伤,分离后方时易损伤下腔静脉导致难以控制的大出血。Liu等[2]对114例肝尾状叶肿瘤进行手术切除,死亡率及并发症发生率分别为0及18%,1、3、5年无瘤生存率分别为65.7%、38.1%及18.4%,1、3、5年总生存率分别为76.1%、54.7%及31.8%。
TACE治疗肝尾状叶肿瘤,较其他部位肿瘤更加难以实现肿瘤的完全坏死,其主要原因有[3]:①尾状叶肝癌供血动脉具有多支、细小及多起源的特点;②尾状叶位于肝中心位置,血管造影显示尾状叶动脉通常与其他肝叶(段)动脉分支重叠,导致确定肿瘤供血动脉及其起源较困难。随着微导管及平板数字减影设备的推广,TACE治疗肝尾状叶肿瘤的效果大幅提高。一般Spiegle部肿瘤的血供主要来自左肝动脉;腔静脉旁肿瘤血供多来自右肝动脉,少部分来自左肝动脉,单纯左肝动脉供血者少见;尾状突部肿瘤的血供多数来自右肝动脉[4]。
笔者认为结合肝尾状叶肿瘤的血供特点,要实现最大程度肿瘤坏死,需注意:①肿瘤供血动脉的超选择,在避免损伤正常肝实质的前提下,实现肿瘤的充分栓塞。②肿瘤血管全面栓塞,一方面需左右肝动脉的全面造影,对比剂的总量及流速要足,栓塞完毕后行肝总动脉造影,避免遗漏肿瘤的供血动脉及侧支供血动脉;另一方面,在栓塞的过程中可逐步栓塞。微导管到达肿瘤门后栓塞材料尽量采用聚乙烯醇等永久性栓塞剂,栓塞程度要实现对比剂的瘀滞。动脉肿瘤门部位栓塞后,可适当撤管,进行肿瘤周围血管的栓塞,为避免正常肝组织的过度损伤,可使用明胶海绵等可再通栓塞剂。③尽量配合化疗药物,如铂类等,化疗药物可与碘化油混合,以延长药物的作用时间。尾状叶肿瘤栓塞治疗一个少见的并发症是肝门胆管扩张,原因是少数肝总管的动脉血供来自尾状叶动脉[4],因此在栓塞过程中应尽量将微导管推送至肿瘤门位置。
近年来,RFA已广泛应用于原发性肝癌治疗,与TACE相比RFA虽然亦受解剖特点影响,但可以实现肿瘤的完全坏死。尾状叶肝癌RFA的难度在于:①解剖位置特殊,周围被重要的脏器包绕,穿刺过程中易造成门静脉、下腔静脉、胆道及胃肠道损伤,出现腹腔出血、消化道穿孔等严重并发症;②超声引导下肝尾状叶肝癌的消融治疗中,由于肝尾状叶位置深,肿瘤显示相对较差,难以实现精准穿刺;③尾状叶邻近下腔静脉、门静脉,受“热沉降效应”的影响,不易达到肿瘤的完全消融。Peng等[5]应用超声引导下RFA/酒精注射治疗肝尾状叶肝癌患者17例,病灶大小2.0~6.5 cm(平均3.1 cm),肿瘤的完全消融率为82%,随访3~60个月(平均29.1个月),患者的1、2、4年总生存率分别为88%、80%及72%。Dong等[6]采用CT引导下射频/酒精消融的方法治疗7例患者共8个尾状叶病灶,病灶大小1.8~6.9 cm,平均2.9 cm,病灶的完全消融率100%,随访8个月,未见肿瘤复发。Nakaji等[7]采用超声引导下酒精消融的方法治疗尾状叶肝癌12例,平均随访31个月,1、2、3年生存率分别为91.7%、75.0%及53.3%,无严重并发症发生。本研究16例患者的总生存时间为44.62个月,1、3、5年总生存率分别为88.23%、66.65%及33.18%。
本研究采用TACE后行CT引导下RFA的方法治疗肝尾状叶原发性肝癌。消融前进行TACE的优点[8]:①可发现肝内的微小卫星灶、标记肿瘤的范围和大小,便于CT引导下选择合适的进针路径,准确到达病灶;②在RFA治疗前l~2周行TACE治疗,造成肿瘤局部缺血,可防止癌细胞的扩散,减少“热沉降效应”,缩短RFA治疗时间,扩大组织凝固坏死范围[9],同时可减少术中出血;③通过TACE可使病灶不同程度减小,增加病灶与周围血管的安全距离,减少腹腔出血的风险。CT引导不受气体、骨骼等干扰,病灶及尾状叶周围脏器的解剖关系显示清晰,便于选择合适的穿刺路径,避免损伤血管、胆管、消化道,实现肿瘤的精准穿刺。但CT引导无法实时显示,故在穿刺过程中需在引导针引导下逐步穿刺,避免一步到位[10]。Fujimori等[11]采用TACE联合RFA治疗20例尾状叶单发肝癌,病灶直径≤5 cm,完全消融率达100%,严重并发症的发生率为10%;患者1、3、5年的总体生存率分别为94.4%、86.6%及67.5%。
尾状叶射频消融的关键在于穿刺路径的选择,对位于Sipegle叶的肿瘤,因其与门静脉、肝动脉和胃左动脉相邻,应选用左侧入路,肝硬化患者常有冠状静脉扩张,左侧入路穿刺路程短,易避开以上大血管。对于尾状突和腔静脉旁部的肿瘤,选用右侧入路更适合,穿刺时应避开门静脉、胆总管、下腔静脉和肝动脉,患者取左前卧位后,穿刺点在右腋中或腋后线。对于大肿瘤侵犯大部分尾状叶和多发尾状叶肿瘤者,左右联合入路更合适。
总之,本组采用TACE联合CT引导下RFA治疗,取得了满意的完全消融率、无瘤生存率及总生存率,并发症少,效果确切、安全可靠。
[1] Kumon M. Anatomy of the caudate lobe with special reference to portal vein and bile duct. Kanzo, 1985,26(9):1193-1199.
[2] Liu P, Yang JM, Niu WY, et al. Prognostic factors in the surgical treatment of caudate lobe hepatocellular carcinoma. World J Gastroenterol, 2010,16(9):1123-1128.
[3] 王华明,赵云,张军华,等.尾状叶肝癌的经导管肝动脉化疗栓塞治疗.中华临床医师杂志(电子版),2012,6(4):1060-1061.
[4] Miyayama S, Yamashiro M, Yoshie Y, et al. Hepatocellular carcinoma in the caudate lobe of the liver: Variations of its feeding branches on arteriography. Jpn J Radiol, 2010,28(8):555-562.
[5] Peng ZW, Liang HH, Chen MS, et al. Percutaneous radiofrequency ablation for the treatment of hepatocellular carcinoma in the caudate lobe. Eur J Surg Oncol, 2008,34(2):166-172.
[6] Dong J, Li W, Zeng Q, et al. CT-guided percutaneous step-by-step radiofrequency ablation for the treatment of carcinoma in the caudate lobe. Medicine (Baltimore), 2015,94(39):e1594.
[7] Nakaji S, Hirata N, Mikata R, et al. Clinical outcomes of endoscopic ultrasound-guided ethanol injection for hepatocellular carcinoma in the caudate lobe. Endosc Int Open, 2016,4(10):E1111-E1115.
[8] 郑加生,孙斌,生守鹏,等.合并门静脉癌栓的原发性肝癌的综合介入治疗.中国介入影像与治疗学,2011,8(2):86-89.
[9] Dodd GD 3rd, Soulen MC, Kane RA, et al. Minimally invasive treatment of malignant hepatic tumors: At the threshold of a major breakthrough. Radiographics, 2000,20(1):9-27.
[10] 郑加生,李宁,袁春旺.CT引导肝肿瘤消融治疗.北京:人民卫生出版社,2011:1.
[11] Fujimori M, Takaki H, Nakatsuka A, et al. Combination therapy of chemoembolization and radiofrequency ablation for the treatment of hepatocellular carcinoma in the caudate lobe. J Vasc Interv Radiol, 2012,23(12):1622-1628.
Transcatheter hepatic arterial chemoembolization combined with CT guided radiofrequency ablation for treatment of primary liver cancer in caudate lobe
SHENGShoupeng,SUNBin,ZHENGJiasheng*,CUIXiongwei,CUIShichang,YUANChunwang,QIANZhiling,LIJianjun,LICong,ZHANGHonghai,MALiang
(CenterforInterventionalOncology,BeijingYouanHospital,CapitalMedicalUniversity,Beijing100069,China)
Objective To evaluate the efficacy and safety of transcatheter hepatic arterial chemoembolization (TACE) combined with CT guided radiofrequency ablation (RFA) for primary liver cancer in the caudate lobe. Methods Sixteen patients with primary liver cancer in the caudate lobe were treated with combination therapy of TACE and RFA. Complet ablation rate, overall and recurrence-free survival, and complications were evaluated. Results A total of 15 cases achieved complet ablation, complet ablation rate was 93.75% (15/16). Recurrence-free survival time was 19.35 months, overall survival time was 44.62 months. Overall survival rates were 88.23%, 66.65% and 33.18% at 1, 3, 5 years after therapy, respectively. Conclusion TACE combined with RFA is a safe and useful therapeutic option for treatment of primary liver cancer in the caudate lobe.
Caudate lobe; Liver neoplasms; Transcatheter hepatic arterial chemoembolization; Catheter ablation
生守鹏(1982—),男,山东潍坊人,博士,主治医师。研究方向:肿瘤的微创及综合治疗。E-mail: shengshoupeng@163.com
郑加生,首都医科大学附属北京佑安医院肿瘤微创介入中心,100069。E-mail: zhengjiasheng6@163.com
2017-02-06
2017-05-26
R735.7; R816
A
1672-8475(2017)07-0391-05
10.13929/j.1672-8475.201702003

