体外冲击波对肌肉骨骼痛症的抗炎镇痛机制
周迪远,陶惠红,杨耀琴,茅凌洲,蔡新宇,丛锐军*,段婷慧,郝振宏,莫向荣
(1.苏州大学,江苏 苏州 215006;2.同济大学,上海 200092;3.同济大学附属上海市第十人民医院骨科,上海 200072)
实验研究
体外冲击波对肌肉骨骼痛症的抗炎镇痛机制
周迪远1,陶惠红2,杨耀琴2,茅凌洲3,蔡新宇3,丛锐军3*,段婷慧1,郝振宏3,莫向荣3
(1.苏州大学,江苏 苏州 215006;2.同济大学,上海 200092;3.同济大学附属上海市第十人民医院骨科,上海 200072)
目的 近年来,冲击波疗法因其无创、副作用少的特点而在治疗方面的应用愈加受到关注。本文探究体外冲击波疗法治疗骨关节和肌肉疼痛性疾病的机制,各炎症因子在治疗过程中的变化与作用。方法 采用随机对照试验实验的方法,将40只雄性SD大鼠随机分为正常对照组、模型对照组、实验组1、实验组2,每组10只,通过比较各组间炎症消退时间、肿胀程度、血清中炎性因子含量、组织切片中的炎症细胞的差异以研究冲击波在消炎、镇痛中的作用机制。结果 冲击波疗法能明显缓解炎症局部红肿,减轻炎症渗出和炎症细胞浸润,对局部组织无明显损伤。其治疗作用可能与组织中抗炎镇痛因子含量上升,致炎性因子含量下降有关。结论 冲击波处理有明显减轻局部炎症反应,加速炎症的吸收消散效应,从而改善症状,减轻疼痛。其机制与促进β-内啡肽产生,抑制前列腺素E2(prostaglandin E2,PGE2)、5-羟色胺等疼痛因子释放有关。一氧化碳在冲击波的治疗中也发挥重要调节作用,但其作用方式尚不明确。
体外冲击波;炎症;镇痛;抗炎;随机对照实验
体外冲击波疗法(extracorporeal shock wave therapy)是一种无创的治疗手段,副作用小,并发症少,已经成为治疗肾结石等病症的重要疗法[1-3]。近几年产生了一种新型设备,它可以输出较为柔和的体外冲击波,用于肌肉系统中的疼痛激发区治疗。临床研究显示,冲击波对骨关节、肌肉疼痛性疾病有着显著的治疗作用[4-8],其作用机制仍不很清楚,目前的研究认为可能与冲击破的机械应力效应、空化效应、神经阻滞效应有关。本研究通过建立大鼠佐剂性关节炎模型,在不同水平探讨体外冲击波的抗炎镇痛作用和部分抗炎机制,为其临床推广应用提供依据[9-11]。
1 资料与方法
1.1 主要材料与仪器 海滨冲击波治疗仪HB-ESWT-01(海滨,广州,中国)、弗氏完全佐剂(Sigma),前列腺素E2(prostaglandin E2,PGE2)、一氧化氮(nitric oxide,NO)、β-内啡肽的测定,按各检测试剂盒说明书步骤进行(ADL公司ELISA试剂盒,美国)。
1.2 大鼠佐剂性关节炎模型的建立 40只雄性SD,体重200~250 g,随机分为正常对照组、模型对照组、实验组1、实验组2,每组10只。佐剂性慢性炎症大鼠模型通过大鼠双小腿(跖)关节下0.5 cm处皮下注入0.1 mL弗氏完全佐剂诱导建立[12-13]。正常组注射0.1 mL生理盐水作为对照。
1.3 冲击波处理方法 造模后48 h开始进行分组处理,模型组常规喂养,不做冲击波处理;实验组在戊巴比妥麻醉下给予冲击波处理。实验参数为:2 000个压力脉冲/次,4级能量级,间隔0.6 s。实验组1治疗3次(一个疗程),实验组2治疗6次(两个疗程)。每次治疗间隔2 d。正常组大鼠给予同实验组1冲击波处理。
1.4 大鼠足肿胀度测定 于治疗前、治疗后分别测量大鼠双后足三胫,按公式计算足肿胀度,取平均值。
1.5 血清相关炎症介质测定 于治疗前、治疗中(疗程结束即刻)、治疗后(疗程结束后48 h)分别由尾静脉取血1 mL,制备血清用于PGE2、一氧化氮、β-内啡肽的测定,测定方法按各检测试剂盒说明书步骤进行(ADL公司ELISA试剂盒,美国)。
1.6 致炎足炎症浸出液中PEG2,5-羟色胺(5-HT)含量的影响 治疗结束立即在每组取5只大鼠采用颈椎脱臼法处死,于踝关节处剪下各组致炎足,称重,剥皮,剪碎置于5 mL生理盐水中浸泡1 h后,将浸泡液离心,得上清液。
PEG2含量的测定:取上述上清液0.3 mL按文献方法加入0.5 mol/L KOH-甲醇溶液2 mL,在50℃水浴中异构化20 min,然后加甲醇稀释至9 mL,空白管亦同上述操作(不加上清液)用紫外分光光度计于278 nm处测紫外线光度值(A),以每克炎症组织的吸光度值表示PEG2的相对含量。
5-HT含量的测定:取上述上清液2 mL按文献方法于荧光分光光度计激发波长365 nm,发射波长470 nm测定荧光强度,以每克炎症组织的荧光强度表示5-HT的相对含量。
1.7 病理学形态观察 治疗结束后,颈椎脱臼法处死大鼠,于踝关节处剪下各组致炎足,以中性甲醛溶液固定,EDTA法脱钙,常规石蜡包埋、切片,HE染色观察。
1.8 统计学方法 所有资料采用SPSS 11.0软件进行处理,采用t和χ2检验,多组间比较采用单因素方差分析检验。
2 结 果
2.1 冲击波治疗对佐剂性关节炎大鼠足肿胀度的影响 注射弗氏完全佐剂后,大鼠踝关节以下明显红肿,48 h大鼠炎症足的肿胀度与正常组比较有显著性差异(P<0.01),冲击波作用能显著减轻炎症足的肿胀度(见表1),随着治疗剂量的增大,效果更为显著。
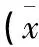
表1 冲击波作用对炎症足肿胀度的影响±s)
2.2 血清β-内啡肽、NO和炎症介质PGE2测定 正常组血清内啡肽处于较低水平,在治疗过程中无明显变化。炎症模型的建立可明显提高大鼠血清内啡肽基础水平,并可维持较长时间[14-15]。冲击波治疗处理可使内啡肽水平进一步提高,较模型组有显著差异(P<0.05)。实验组2在治疗后内啡肽水平较实验组1有所回落,推测与随着疗程时间的延长炎症逐渐消退有关(见表2)。

表2 冲击波作用对炎症大鼠血清内啡肽的影响
造模可使大鼠血清NO水平短暂升高,随后逐渐降至正常水平;冲击波处理对正常鼠血清NO水平无明显影响(P>0.05)。在实验组,冲击波治疗处理可使大鼠血清NO水平显著升高,差异有极显著意义(P<0.01),治疗结束后NO水平有所下降,但仍明显高于正常组(P<0.01,见表3)。
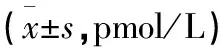
表3 冲击波作用对炎症大鼠血清NO的影响
正常组大鼠血清PGE2处于较低水平,在冲击波处理过程中无明显变化。炎症模型的建立可使大鼠血清PGE2显著升高,并且有随病程的延长而逐渐上升的趋势。在实验组,冲击波治疗处理后即时测定大鼠血清PGE2升高,但与同期模型组比较差异无统计学意义(P>0.05),推测主要为炎症模型所致。但治疗结束48 h后PGE2水平明显低于模型组,实验组2长疗程结束即可见PGE2水平明显降低,48 h后更为显著(见表4)。
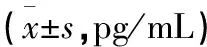
表4 冲击波作用对炎症大鼠血清PGE2的影响
2.3 致炎足炎症浸出液中PGE2,5-HT含量的测定 冲击波作用对炎症局部组织中炎症介质PGE2,5-HT有明显抑制作用(见表5)。

表5 冲击波作用对局部炎症浸出液中PGE2、5-HT的影响
2.4 形态学改变 正常鼠足肉眼观察无红肿,HE染色切片观察,真皮和皮下组织层次结构清楚,结缔组织未见炎症细胞渗出,可见肌肉、软骨及神经等结构(见图1)。模型鼠炎症足肉眼观察有明显红肿,皮肤有饱胀感;镜下可见真皮结缔组织间有大量炎症细胞弥散性浸润,胶原纤维被冲散,结构不清(见图2)。经冲击波治疗一个疗程(3次)后,可见肿胀明显减轻,镜下炎症细胞渗出减少,呈局灶性分布(见图3)。经两个疗程治疗(6次),大多数鼠足肿胀消退,皮肤出现皱缩,显微镜下观察炎症渗出基本消散,可见残留的少量散在炎症细胞,组织结构清楚,无明显肉芽组织增生(见图4)。未经治疗的模型组大鼠炎症足在第10天(相当于一个疗程时间)肿胀减轻不明显,至第18天(相当于第二疗程结束)红肿有不同程度减轻,炎症渗出虽较建模初有一定减少,但仍可见大量浸润的炎症细胞存在,血管周围尤为明显(见图5)。对实验大鼠心脏、肾脏、脾脏等重要器官的观察未见明显异常。治疗中全部动物无意外死亡发生。

图1 正常大鼠足,未见炎症细胞浸润(HE,×100) 图2 建模48 h炎症足可见密集炎症细胞浸润(HE,×100)

图3 冲击波治疗3次后,可见炎症细胞浸润明显减轻,部分消散(HE,×100)

图4 冲击波治疗6次后,炎症明显消散(HE,×100) 图5 模型对照组炎症细胞浸润仍较为明显(HE,×100)
3 讨 论
本研究运用体外冲击波治疗模型关节炎症,结果显示冲击波作用能明显缓解炎症局部红肿,减轻炎症渗出和炎症细胞浸润,改善症状,从而减轻疼痛,对局部组织无明显损伤[16-17]。
炎症反应涉及多种介质分子,我们初步观察了冲击波治疗过程中模型大鼠血清和局部组织中β-内啡肽、一氧化氮、前列腺素E2、5-羟色胺等炎症相关介质的变化,对冲击波的镇痛机制进行探讨。β-内啡肽是内啡肽家族前体前阿黑皮素的单拷贝阿片肽,生理作用十分广泛,其最大的特性就是在哺乳动物中有缓解疼痛的作用。本研究结果显示冲击波处理可促进β-内啡肽的产生,使血清内啡肽水平提高,并可维持较长时间,提示β-内啡肽参与冲击波治疗的镇痛效应。一氧化氮是20世纪80年代发现的一种非经典的新型递质和信息分子,参与外周组织炎性疼痛的形成和传递,在脊髓水平,NO 还可以通过多种途径参与对疼痛传递的调制。目前,已有大量证据表明NO在外周和中枢不同水平的痛觉调节中发挥重要作用。在外周,NO作用于不同的靶细胞,表现出致痛或镇痛作用[18-20]。我们的初步研究发现,正常大鼠血清NO处于较低水平,炎症模型建立使NO短暂升高。冲击波处理可使大鼠血清NO水平短时内明显升高,但对正常鼠无此效应,治疗结束后NO迅速降低。推测冲击波作用于炎症部位,促进了NO从白细胞、内皮细胞的释放,可扩张局部微血管,提高微动脉血管的通透性,进而有利于炎症的消散。PGE2、5-HT是重要的疼痛因子[18]。本研究的初步观察显示,在炎症模型大鼠的血清及炎症组织中PGE2、5-HT显著升高,冲击波治疗后即刻观察,炎症局部PGE2、5-HT的释放显著降低,统计学有极显著意义(P<0.01),提示冲击波有直接抑制疼痛因子效应。血清PGE2水平在治疗后也明显降低,并于治疗次数有关,也间接表明炎症的缓解[21-23]。
综上所述,本研究结果表明冲击波处理有明显减轻局部炎症反应,加速炎症的吸收消散效应。其机制与促进β-内啡肽产生,抑制PGE2、5-HT等疼痛因子释放有关,NO在冲击波的治疗中也发挥重要调节作用,其确切效应尚需进一步探讨。
[1] Kondo H,Naitoh I,Ohara H,et al.Efficacy of pancreatic stenting prior to extracorporeal shock wave lithotripsy for pancreatic stones[J].Dig Liver Dis, 2014,47(2):178-179.
[2] Nguyen DP,Hnilicka S,Kiss B,et al.Optimization of extracorporeal shock wave lithotripsy delivery rates achieves excellent outcomes for ureteral stones:results of a prospective randomized trial[J].J Urol, 2015,194(2):418-423.
[3] 施国伟,张何.体外冲击波碎石治疗输尿管结石疗效 分析[J].现代泌尿外科杂志,2012,17(1):64-66.
[4] Park C,Lee S,Yi CW,et al.The effects of extracorporeal shock wave therapy on frozen shoulder patients' pain and functions[J].J Phys Ther Sci,2015, 27(12):3659-3661.
[5] Lizis P.Analgesic effect of extracorporeal shock wave therapy versus ultrasound therapy in chronic tennis elbow[J].J Phys Ther Sci,2015,27(8):2563- 2567.
[6] Han H,Lee D,Lee S,et al.The effects of extracorporeal shock wave therapy on pain,disability,and depression of chronic low back pain patients[J].J Phys Ther Sci,2015,27(8):397-399.
[7] 赵一瑾,樊黄,李吴,等.X线定位与痛点定位体外冲 击波治疗腰脊神经后支综合征的临床观察[J].中国 康复医学杂志,2011,26(5):429-432.
[8] 姜长林,曲李,孙纪,等.冲击波治疗颈背肌筋膜综合 征47例[J].中国疼痛医学杂志,2010,16(2):122- 123.
[9] Sukubo NG,Tibalt E,Respizzi S,et al.Effect of shock waves on macrophages:A possible role in tissue regeneration and remodeling[J].Int J Surg, 2015,24(Pt B):124-130.
[10] Mariotto S,de Prati AC,Cavalieri E,et al.Extracorporeal shock wave therapy in inflammatory diseases: molecular mechanism that triggers anti-inflammatory action[J].Curr Med Chem,2009,16(19): 2366-2372.
[11] de Girolamo L,Stanco D,Galliera E,et al.Soft-focused extracorporeal shock waves increase the expression of tendon-specific markers and the release of anti-inflammatory cytokines in an adherent culture model of primary human tendon cells[J].Ultrasound Med Biol,2014,40(6):1204-1215.
[12] Shi F,Zhou D,Ji Z,et al.Anti-arthritic activity of luteolin in Freund's complete adjuvant-induced arthritis in rats by suppressing P2X4pathway[J]. Chem Biol Interact,2015(226):82-87.
[13] Qian B,Li F,Zhao LX,et al.Ligustilide ameliorates inflammatory pain and inhibits TLR4upregulation in spinal astrocytes following complete freund's adjuvant peripheral injection[J].Cell Mol Neurobiol, 2016,36(4):143-149.
[14] Alves DP,da Motta PG,Lima PP,et al.Inflammation mobilizes local resources to control hyperalgesia: the role of endogenous opioid peptides[J].Pharmacology, 2012,89(1-2):22-28.
[15] Schreiter A,Gore C,Labuz D,et al.Pain inhibition by blocking leukocytic and neuronal opioid peptidases in peripheral inflamed tissue[J].FASEB J,2012, 26(12):5161-5171.
[16] Krukowska J,Wrona J,Sienkiewicz M,et al.A comparative analysis of analgesic efficacy of ultrasound and shock wave therapy in the treatment of patients with inflammation of the attachment of the plantar fascia in the course of calcaneal spurs[J].Arch Orthop Trauma Surg,2016,136(9):1289-1296.
[17] Chen YT,Yang CC,Sun CK,et al.Extracorporeal shock wave therapy ameliorates cyclophosphamideinduced rat acute interstitial cystitis though inhibiting inflammation and oxidative stress-in vitro and in vivo experiment studies[J].Am J Transl Res,2014, 6(6):631-648.
[18] Du Y,Cramer M,Lee CA,et al.Adrenergic and serotonin receptors affect retinal superoxide generation in diabetic mice:relationship to capillary degeneration and permeability[J].FASEB J,2015,29(5): 2194-2204[19] Hossain E,Sarkar D,Chatterjee M,et al.Effect of methanol extract of Bombax malabaricum leaves on nitric oxide production during inflammation[J].Acta Pol Pharm,2013,70(2):255-260.
[20] Lee MY,Sun KH,Chiang CP,et al.Nitric oxide suppresses LPS-induced inflammation in a mouse asthma model by attenuating the interaction of IKK and Hsp90[J].Exp Biol Med(Mayuood),2015,240(4): 498-507.
[21] Kawahara K,Hohjoh H,Inazumi T,et al.Prostaglandin E2-induced inflammation:Relevance of prostaglandin E receptors[J].Biochim Biophys Acta, 2015,1851(4):414-421.
[22] Wu Q,Martin RJ,LaFasto S,et al.A low dose of Mycoplasma pneumoniae infection enhances an established allergic inflammation in mice:the role of the prostaglandin E2pathway[J].Clin Exp Allergy, 2009,39(11):1754-1763.
[23] Sugita R,Kubota K,Sugimoto K,et al.A novel selective prostaglandin E2synthesis inhibitor relieves pyrexia and arthritis in Guinea pigs inflammatory models[J].J Pharmacol Sci,2016,130(2):128-135.
Anti-inflammatory and Analgesic Mechanism of Extracorporeal Shock Wave on Musculoskeletal Pain
Zhou Diyuan1,Tao Huihong2,Yang Yaoqing2,et al
(1.Soochow University,Suzhou 215006,China;2.Tongji University,ShangHai 200092,China)
Objective In recent years,attention to non-invasive shock wave therapy which characteristic of fewer side effects and its application in the treatment has increased,this paper intends to explores the mechanisms of extracorporeal shock wave therapy for bone and joint and muscle pain;the function and transformation of Inflammatory during treatment.Methods Forty male Sprague-Dawley rats were randomly divided into normal control group,model control group,experimental group 1 and experimental group 2,10 rats in each group.By comparing the time of inflammation resolution and swelling extent,serum levels of inflammatory factors,inflammatory cells in tissue sections to study the mechanism of shock wave in anti-inflammatory and analgesia.Results The shock wave therapy could alleviate local inflammation,alleviate inflammatory exudation and infiltration of inflammatory cells,improve symptoms,relieve pain,and do no obvious damage to local tissue.It may be related to the increase of anti-inflammatory analgesic factor and the decrease of Inflammatory factor.Conclusion Extracorporeal shock wave therapy alleviate local inflammation and accelerate the dissipation of inflammation which improve symptoms,reduce pain.The mechanism may be related to promote β-endorphin production,inhibition of PGE2,5-HT and other pain factor release and Nitric oxide is also play an important regulatory role in therapy,but it’s mode of action is not clear.
extracorporeal shock wave;inflammation;analgesia;anti-inflammatory;randomized controlled trial
同济大学人才基金(2014KJ091);*本文通讯作者:丛锐军
1008-5572(2017)07-0618-05
R493
B
2017-02-07
周迪远(1994- ),男,研究生在读,苏州大学,215006。
周迪远,陶惠红,杨耀琴,等.体外冲击波对肌肉骨骼痛症的抗炎镇痛机制[J].实用骨科杂志,2017,23(7):618-621;625.

