一期后路病灶清除椎间植骨内固定治疗强直性脊柱炎A n d e r s s o n 病变的疗效观察
李伟伟 弓立群 刘军 卫文博 段大鹏 段亮
. 临床研究与实践 Clinical research and practice .
一期后路病灶清除椎间植骨内固定治疗强直性脊柱炎A n d e r s s o n 病变的疗效观察
李伟伟 弓立群 刘军 卫文博 段大鹏 段亮
目的 探讨一期后路病灶清除椎间植骨内固定对强直性脊柱炎 A n d e r s s o n 病变的治疗疗效。方法 回顾性分析 2 0 0 8 年 1 月至 2 0 1 4 年 7 月,于我院确诊为强直性脊柱炎 A n d e r s s o n 病变且采用一期后路病灶清除椎间植骨内固定治疗的患者 9 例,均为男性,年龄 3 9~6 7 岁,平均 ( 5 2.6±7.5 ) 岁。病变节段:T10~111 例,T11~127 例,T12~L11 例。F r a n k e l 分级:C 级 6 例,D 级 3 例。评估获得随访患者的手术时间、出血量,手术前后 V A S 评分、F r a n k e l 评分及病变节段后凸 C o b b’s 角改善情况。结果 所有患者均获随访,随访时间 2 4~5 6 个月,平均 ( 3 2.8±8.7 5 ) 个月,手术时间 1 0 5~1 7 5 m i n,平均 ( 1 3 3.9±2 5.3 ) m i n,失血量 4 5 0~8 5 0 m l,平均 ( 5 9 6.7±1 4 6.3 ) m l。术后 3 个月 V A S 评分平均为 ( 2.8 0±0.4 3 ),较术前 ( 8.5 3±1.1 1 ) 显著降低,差异有统计学意义 ( P<0.0 5 );术后 2 4 个月 V A S 评分平均为 ( 1.6 0±0.4 5 ),较术后 3 个月显著降低,差异有统计学意义 ( P<0.0 5 )。术后 2 4 个月 F r a n k e l 评分:D 级 2 例,E 级 7 例。术后 3 个月 C o b b’s 角为 ( 1 5.2± 3.7 3 ) °,较术前 ( 2 8.3±5.9 3 ) ° 明显改善,差异有统计学意义 ( P<0.0 5 ),且在术后 2 4 个月时 ( 1 5.6±4.0 9 ) °矫正角度无明显丢失 ( P>0.0 5 )。所有植骨均发生融合,融合时间 6~1 3 个月,平均 8.6 个月。结论 一期后路病灶清除椎间植骨内固定可有效去除 A n d e r s s o n 病变、恢复正常脊柱序列及显著改善患者神经功能。
脊柱;脊柱炎,强直性;骨移植;A n d e r s s o n 病变;病灶清除
强直性脊柱炎 ( a n k y l o s i n g s p o n d y l i t i s,A S ) 是一种全身的慢性炎症性疾病,主要累及骶髂关节和脊柱;可导致脊柱骨性强直、椎体骨质疏松及脊椎脆性增加,无外力或遭受轻微外力即可出现骨折[1]。脊柱骨折节段若持续不稳定易继发椎间假关节形成,表现为椎间盘-椎体破坏性病损或 A n d e r s s o n 病变 ( a n d e r s s o n l e s i o n,A L )。C a w l e y 等[2]将 A L 分为3 种类型,I 型:椎间盘及椎体中央区域出现病变,外观与 S c h m o r l’s 结节类似;I I 型:病变累及椎间盘及椎体的边缘部分;I I I 型:椎间盘及椎体的中央、边缘部分均受累,通常见于 A S 的晚期阶段。
由于 A S 患者 A L 部位局部的稳定性丧失,可出现严重的腰背痛或胸腰椎后凸畸形。大多数患者起初仅表现为偶发的轻微腰背痛,但经过一定时间的稳定期后,疼痛突然加剧,发作频率逐渐增加,最后出现持续的剧烈腰背痛,同时胸腰椎后凸畸形也在短期内迅速进展,至晚期可导致病变节段椎管狭窄和脊髓受压,从而出现神经功能障碍。由于 A L部位多位于活动度较大的胸腰段,所以多需手术治疗[3-4]。回顾性分析 2 0 0 8 年 1 月至 2 0 1 4 年 7 月,在我院确诊为 A L 且采用一期后路病灶清除椎间植骨内固定治疗的 9 例 A S 患者的临床资料,探讨一期后路病灶清除椎间植骨内固定在该类疾病中的应用价值。报告如下。
资料与方法
一、一般资料
本组 9 例,均为男性,年龄 3 9~6 7 岁,平均( 5 2.6±7.5 ) 岁。采用 A S A S 标准[5]进行 A S 诊断。病变节段:T10~111 例,T11~127 例,T12~L11 例。首诊科室:风湿科 4 例,骨科 2 例,疼痛科 1 例,中医科 1 例,神经内科 1 例。术前误诊为脊柱结核且给予抗结核治疗者 7 例,延误时间 1 4~6 9 天,平均 ( 3 6.4±8.9 6 ) 天。存在轻度外伤史者 ( 平地跌倒 ) 1 例,其余均无外伤史。
首诊症状:7 例表现为持续的腰背痛,经保守治疗不能缓解;2 例表现为双下肢无力、神经源性跛行及胸腰段后凸畸形逐渐加重。体征:胸腰段呈轻、中度后凸畸形且活动明显受限,胸腰段棘突及椎旁压痛阳性者 7 例,仅活动后诱发腰背痛者2 例;脊髓损伤程度按照 F r a n k e l 评分标准:C 级6 例,D 级 3 例;影像学表现:X 线及 C T 表现为:脊柱广泛融合,严重的骨质疏松,病变节段相邻终板及椎体出现广泛性溶骨性破坏伴周围骨质硬化;病变节段 M R I 表现为 T1加权像低信号、T2加权像高或低信号,硬脊膜明显受压者 7 例。
二、术前处理
嘱患者卧床以避免神经损伤加重,给予止痛、抗骨质疏松处理,有神经功能障碍者给予脱水、营养神经治疗。常规行肺功能测定,胸、腰椎正侧位X 线片,骨盆平片及病变部位的 C T、M R I 检查;无法行肺功能测定者筛查血气分析。服用激素或生物制剂者停药 2 周以上。
三、手术方法
纤维支气管镜引导下经鼻气管插管全麻,俯卧位,腹部悬空,后正中纵形手术切口,长约 1 2~1 5 c m,骨膜下完成椎板剥离,显露病变部位以远上、下各 2 个椎板、关节突,并置入椎弓根螺钉,置钉由经验丰富的术者一次性置入,置钉点破口后使用探针沿拟定方向及角度轻轻往前送即可探入椎弓根,勿需攻丝,若出现钉道松动者,可在钉道内灌注骨水泥或植骨加固,安装一侧钛棒以临时稳定手术节段,行病变节段全椎板减压,咬除病变部位一侧关节突关节、部分椎弓根,保留部分椎弓根内壁完整,使用刮匙、髓核钳及磨钻进入病变部位,行病灶彻底清除,取出坏死、炎性组织,彻底打通并去除硬化骨质,高压冲洗病变部位,通过椎弓根植入小块状自体髂骨或异体颗粒骨,打压填实,安装钛棒适度矫形,安装横连,放置引流,逐层缝合。
四、术后处理
卧床期间勤翻身,防止出现伤口及腰骶部压疮,给予脱水、营养神经及抗骨质疏松等治疗,引流量<5 0 m l / 天拔除伤口引流管,卧床期间积极行腰背部、双下肢功能锻炼;术后 1 周复查胸、腰椎X 线片,术后 2 周可在支具保护下适度下床活动。出院后前 3 个月每月来医院复查,以后每 3 个月或6 个月复查。
五、评价指标
手术时间,出血量,疼痛视觉模拟评分 ( v i s u a l a n a l o g u e s c a l e,V A S )、F r a n k e l 评分、病变节段后凸C o b b’s 角及融合率 ( 融合标准:有连续的骨小梁通过骨折部位 )。
六、统计学处理
采用 S P S S 1 7.0 软件进行统计学分析;计量资料采用±s 表示,术前、术后观察指标比较采用配对t 检验;检测水准 α 值取双侧 0.0 5。
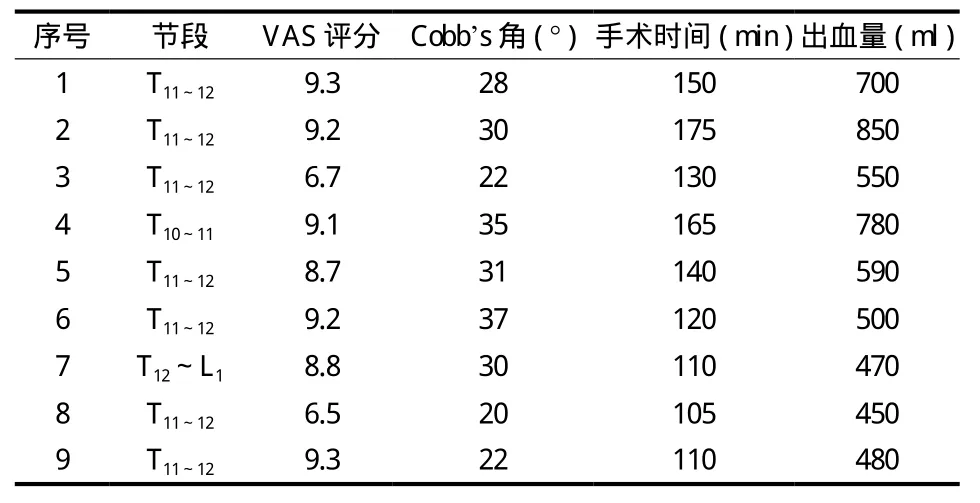
表1 患者基本资料Tab.1 Patients’ basic information
结 果
所有患者均获随访,随访 2 4~5 6 个月,平均 ( 3 2.8±8.7 5 ) 个月。手术时间 1 0 5~1 7 5 m i n,平均 ( 1 3 3.9±2 5.3 ) m i n、失血量 4 5 0~8 5 0 m l,平均( 5 9 6.7±1 4 6.3 ) m l ( 表 1 )。术后 3 个月 V A S 评分术前显著降低,差异有统计学意义 ( t=1 4.1 9,P=0.0 0 0 );术后 2 4 个月 V A S 评分较术后 3 个月显著降低,差异有统计学意义 ( t=9.0,P=0.0 0 0 )。术后2 4 个月 F r a n k e l 分级 D 级 2 例,E 级 7 例 ( 表 2 )。术后 3 个月 C o b b’s 角术前明显改善,差异有统计学意义 ( t=1 0.2 9,P=0.0 0 0 ),且在术后 2 4 个月时矫正角度无明显丢失 ( P=0.0 9 ) ( 表 3 )。所有病例无脊髓损伤加重、脑脊液漏及硬膜外血肿形成等并发症发生。植骨均发生融合,融合时间 6~1 3 个月,平均 8.6 个月。随访期间无内固定松动、断裂及移位病例出现。典型病例见图 1。
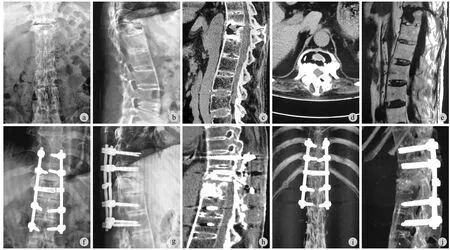
图 1 患者,男,59 岁 a~b:T11~12间隙椎间盘及椎体骨质破坏伴轻度后凸畸形,骨质疏松严重;c~d:CT 示 T11~12间隙椎间盘及椎体骨质破坏累及三柱,椎间隙、椎板后方真空征伴周围骨质硬化;e:MRI 示 T11~12间隙 T2均匀低信号继发后方椎管狭窄;f~g:术后内固定良好,后凸畸形有所改善;h:术后 12 个月椎间植骨发生融合;i~j:术后 12 个月三维重建示:病变节段三柱均融合,内固定位置良好,后凸畸形无丢失Fig.1 A male patient who was 59 years old a - b: Disc and vertebrae destruction of T11-12complicated with severe osteoporosis and mild kyphosis; c - d: CT showed bone destruction of three columns, intervertebral and lamina vacuum sign and circumjacent osteosclerosis; e: MRI showed homogeneous low signal of T2in T11-12intervertebral space and canal stenosis; f - g: Good position of postoperative fi xation and improved kyphosis; h: Interbody fusion occurred at 12 months after the operation; i - j: 3D CT reconstruction at 12 months after the operation: Three columns of lesion segment were fused, internal fi xation in good position and no kyphosis loss in the follow-up
讨 论
A L 是 A n d e r s s o n 于 1 9 3 7 年首次提出并命名的[2],他将 A S 患者出现的椎间盘-椎体破坏性病损称为 A n d e r s s o n l e s i o n,其在 A S 患者中的发生率为 8%~1 5.9%,发病原因可能由感染、炎症反应或机械应力等引起[6-7]。S i m m o n s 等[8]认为椎间盘破坏是 A L 的主要病理改变,主张使用椎间盘炎命名;Z h a n g 等[9]认为导致 A L 的主要原因系脊柱在极小的积累性外力作用下发生了骨折,建议使用脊柱应力性骨折这一名称,而 P e t t e r s s o n 等[10]认为椎间不稳定、假关节形成是导致椎间病损的主要原因,主张使用“假关节形成”这一名称。本组病例术后均送病理组织检查,结果显示:中央坏死组织区伴周围中性粒细胞、巨噬细胞及淋巴细胞增生,支持 A L 为炎性病变这一学说,同时所有标本均送细菌及结核分枝杆菌培养,结果均为阴性,排除 A L 为感染性炎症这一假说。
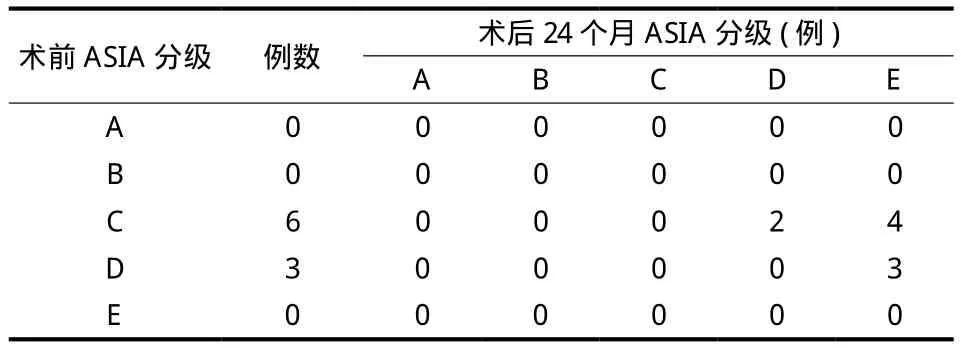
表2 术后 Frankel 分级改善情况Tab.2 Postoperative improvement of Frankel Grade

表3 术前、术后 3 个月及 24 个月 VAS 评分、Cobb’s 角比较( x ± s )Tab.3 Comparison of VAS score and Cobb an-gle before the operation and at 3 and 24 months after the operation ( x ± s )
A L 好发于胸腰段,这是由于胸腰段为相对固定的胸椎和活动度较大的腰椎连接处、承受的应力较大,同时由于 A S 患者脊椎骨质变脆、椎间盘弹性降低,所以可在轻度外伤甚至无外伤的情况下即发生骨折,该骨折线多沿着力学相对薄弱的椎间隙延伸,由于椎间隙存在不断的异常活动,从而出现椎间盘、软骨终板及椎体破坏表现为 A L[11]。本组病例中无外伤史患者 8 例,占所有病例的 8 8.9%,说明该病损在患者无意识的状况即可诱发,从而导致本病误诊率及延误诊治率均较高。
A L 典型的 X 线表现为椎间隙水平累及三柱的破坏性病损伴周围骨质硬化[12],本组所有病例 X 线片均出现上述表现,这说明 X 线片对 A L 病变的漏诊率并不低,这与钱邦平等[6]报道相反,但 X 线片仅局限于发现该类疾病,如果对 A L 进行定性诊断,还需进一步行 C T 及 M R I 检查。矢状位 C T 重建对明确本病的诊断及确定治疗方案极其重要,可以准确显示病变破坏的范围、程度,主要表现为骨化的前纵韧带连续性中断,椎间盘、终板及椎体中央侵蚀性腔隙继发后方的椎管或椎间孔狭窄。M R I 可表现为 T1、T2低信号;也可表现为 T1低信号、T2高信号[13-14]。本组病例共有 4 例表现为 T1低信号、T2高信号,该类病变单纯依靠影像学表现很难与脊柱结核区分,一般需等术后的病理结果出来后方可确诊。
对于 A L 的治疗,可采取石膏或支具制动等保守治疗[15-16]。但因病变程度或节段不同治疗效果存在明显差异,对于上胸椎 A L,由于胸骨肋骨复合体 ( 被称为“第四柱”) 提供了部分稳定性一般采取保守治疗效果好[17];但对于颈段、胸腰段或广泛的A L,由于该部位活动度较大或持续微动,保守治疗效果往往较差,多推荐手术治疗。手术目的是彻底清理病灶组织、重建正常的脊柱序列及使病变部位获得永久的稳定性。R i v e l i s 等[18]建议对进展性后凸畸形的 A L 行前方病灶清除支撑植骨融合手术,但该技术纠正局部后凸畸形的能力差,且由于 A S 多合并椎体严重的骨质疏松,椎体螺钉把持力较差,易导致内固定失败。V a n R o y e n 等[19]报道了 2 例伴后凸畸形、A L 的 A S 患者采取了后路经椎弓根楔形截骨术,术后分别将局部后凸畸形矫正了 2 4° 和 3 1°,对其随访 2 年无矫正角度丢失及其它并发症发生。Z h a n g 等[20]报道了 1 7 例采取经椎弓根及椎间盘截骨术治疗的合并 A L 的 A S 患者,术后临床症状及后凸畸形矫形满意。本组病例中,其中 2 例初期按脊柱结核给予胸腰支具固定结合抗结核药物治疗,但随着病程的延长其病变程度和范围均发生了不同程度的加重,这与王尧等[21]报道的结果一致。王红强等[22]对 1 3 例伴有应力性骨折的 A S 患者采取了后路 3 6 0° 植骨融合治疗,他认为后路放置椎间融合器可增加椎间融合率,有利于后凸畸形矫正,但对于伴严重后凸畸形患者,建议行假关节部位椎体截骨术。本组所有病例由于后凸畸形并不严重因此未行病变部位截骨术,其中 4 例偏侧病灶者仅通过椎间隙及切除一侧椎弓根实施了病灶清除、椎间植骨术从而保留了另外一侧椎弓根的完整性;其余 5 例通过椎间隙及切除双侧椎弓根进入病灶区域,实施了广泛的病变清除及椎间植骨。随访期间无病变复发及矫正角度的丢失,所有植骨均融合良好。
由于伴 A L 的 A S 患者椎间存在明显的骨缺损,单纯行后外侧植骨融合失败率高,建议行在内固定稳定的基础上积极行前、中柱植骨以减少内固定承担的负荷。在病灶清理过程中,要彻底清除坏死的椎间盘、死骨及炎性肉芽组织,要打通病灶周围的硬化骨至骨面出现广泛的点状渗血以促进植骨融合,椎间植骨可采取小块结构骨联合颗粒骨打压植骨的方法,这样可避免大块植骨产生的相关神经并发症,而且植骨接触面较广,融合率高。由于 A S 患者 A L 部位应力较为集中,后方固定范围应包括骨折椎体上下各 2~3 个节段。
一期后路病灶清除椎间植骨内固定可有效去除A L、恢复正常脊柱序列及显著改善患者神经功能。
[1]Werner BC, Samartzis D, Shen FH. Spinal fractures in patients with ankylosing spondylitis: etiology, diagnosis, and management[J]. J Am Acad Orthop Surg, 2016, 24(4):241-249.
[2]Cawley MI, Chalmers TM, Ball J. Destructive lesions of vertebral bodies in ankylosing spondylitis[J]. Ann Rheum Dis, 1972, 31(5):345-358.
[3]Russo VM, Casey AT. Andersson lesion in ankylosing spondylitis[J]. Spine J, 2014, 14(7):1357.
[4]李国, 李家顺, 贾连顺, 等. 强直性脊柱炎并发椎间假关节形成的病理病因和治疗[J]. 中国脊柱脊髓杂志, 2003, 13(12): 727-730.
[5]Zochling J, Heijde DVD, Burgosvargas R, et al. ASAS/ EULAR recommendations for the management of ankylosing spondylitis[J]. Ann Rheum Dis, 2009, 65(4):442-452.
[6]钱邦平, 邱勇, 王斌, 等. 强直性脊柱炎患者胸腰椎应力骨折的临床及影像学特点[J]. 中国脊柱脊髓杂志, 2008, 18(10): 747-751.
[7]Park YS, Kim JH, Ryu JA, et al. The Andersson lesion in ankylosing spondylitis: distinguishing between the inf l ammatory and traumatic subtypes[J]. J Bone Joint Surg Br, 2011, 93(7):961-966.
[8]Simmons EH, Goodwin CB. Spondylodiscitis: A manifestation of ankylsoing spondylitis[J]. Orthop Transactions, 1984, 8(1): 165-169.
[9]Zhang W, Zheng M. Operative strategy for different types of thoracolumbar stress fractures in ankylosing spondylitis[J]. J Spinal Dis Tech, 2014, 27(8):423-430.
[10]Pettersson T, Laasonen L, Leirisalo-Repo M, et al. Spinal pseudoarthrosis complicating ankylosing spondylitis: a report of two patients[J]. Br J Rheumatol, 1996, 35(12):1319-1323.
[11]Rasker JJ, Prevo RL, Lanting PJ. Spondylodiscitis in ankylosing spondylitis, inf l ammation or trauma? A description of six cases[J]. Scand J Rheumatol, 1996, 25(1):52-57.
[12]Hermann KG, Althoff CE, Schneider U, et al. Spinal changes in patients with spondyloarthritis: comparison of MR imaging and radiographic appearances[J]. Radiographics, 2005, 25(3): 559-569.
[13]刘家明, 沈建雄, 余可谊. 强直性脊柱炎合并 Andersson 损害误诊为脊柱结核 1 例报道并文献复习[J]. 中国骨与关节外科, 2012, 5(3):261-264.
[14]Naqi R, Ahsan H, Azeemuddin M. Spinal changes in patients with ankylosing spondylitis on MRI: case series[J]. J Pak Med Assoc, 2010, 60(10):872-875.
[15]刘晖, 王岩. 强直性脊柱炎 Andersson 椎体椎间盘病变研究进展[J]. 中国骨与关节损伤杂志, 2012, 27(5):476-478.
[16]Dave BR, Ram H, Krishnan A. Andersson lesion: are we misdiagnosing it? A retrospective study of clinico-radiological features and outcome of short segment fi xation[J]. Eur Spine J, 2011, 20(9):1503-1509.
[17]Bron JL, de Vries MK, Snieders MN, et al. Discovertebral (Andersson) lesions of the spine in ankylosing spondylitis revisited[J]. Clin Rheumatol, 2009, 28(8):883-892.
[18]Rivelis M, Freiberger RH. Vertebral destruction at unfused segments in late ankylosing spondylitis[J]. Radiology, 1969, 93(2):251-256.
[19]Van Royen BJ, Kastelijns RCA, Noske DP, et al. Transpedicular wedge resection osteotomy for the treatment of a kyphotic Andersson lesion-complicating ankylosing spondylitis[J]. Eur Spine J, 2006, 15(2):246-252.
[20]Zhang X, Wang Y, Wu B, et al. Treatment of Andersson lesion-complicating ankylosing spondylitis via transpedicular subtraction and disc resection osteotomy, a retrospective study[J]. Eur Spine J, 2016, 25(8):2587-2595.
[21]王尧, 张雪松, 胡文浩, 等. 经椎弓根及椎间盘截骨治疗强直性脊柱炎合并 Andersson 骨折[J]. 脊柱外科杂志, 2016, 14(2):65-69.
[22]王红强, 高延征, 余正红, 等. 后路 360° 植骨融合治疗强直性脊柱炎胸腰椎应力骨折的临床研究[J]. 中国现代医学杂志, 2016, 26(3):126-130.
Clinical observation of one-stage posterior debridement, interbody bone graft and internal fixation for Andersson lesion in ankylosing spondylitis
LI Wei-wei, GONG Li-qun, LIU Jun, WEI Wen-bo, DUAN Da-peng,
DUAN Liang. Department of Orthopedics, Shaanxi Provincial People’s Hospital, Xi’an, Shaanxi, 710068, China
Objective To investigate the clinical results of one-stage posterior debridement, interbody bone graft and internal fixation for Andersson lesion in the patients with ankylosing spondylitis ( AS ). Methods The clinical data of 9 cases of AS complicated with Andersson lesion who underwent one-stage posterior debridement, interbody bone graft and internal fi xation from January 2008 to July 2014 were retrospectively analyzed. They were all males, whose mean age was ( 52.6 ± 7.5 ) years ( range: 39 - 67 years ). As to the lesion segment, there was 1 case of T10-11, 7 cases of T11-12and 1 case of T12- L1. As to the preoperative Frankel grade, there were 6 cases of Grade C and 3 cases of Grade D. The operation time, blood loss, preoperative and postoperative visual analogue scale ( VAS ) scores, Frankel grade and Cobb’s angle improvement of the lesion segment were measured to evaluate the therapeutic effects. Results All the patients were followed up for an average period of ( 32.8 ± 8.75 ) months ( range: 24 - 56 months ). The mean operative time was ( 133.9 ± 25.3 ) min ( range: 105 - 175 min ), and the average blood loss was ( 596.7 ± 146.3 ) ml ( range: 450 - 850 ml ). The mean VAS score at 3 months after the operation was ( 2.80 ± 0.43 ), which was obviously lower than ( 8.53 ± 1.11 ) before the operation, and the differences were statistically signif i cant ( P < 0.05 ). The mean VAS score at 24 months after the operation was ( 1.60 ± 0.45 ), which was obviously lower than that at 3 months after the operation, and the differences were statistically significant ( P < 0.05 ). The Frankel grade distribution at 24 months after the operation: 2 cases of grade D and 7 cases of grade E. The mean Cobb’s angle at 3 months after the operation was ( 15.2 ± 3.73 ) °, which was lower than ( 28.3 ± 5.93 ) ° before the operation, and the differences were statistically signif i cant ( P < 0.05 ). The mean Cobb’s angle at 24 months after the operation maintained at the level of ( 15.6 ± 4.09 ) ° ( P > 0.05 ). All the cases acquired bone fusion, and the mean fusion time was 8.6 months ( range: 6 - 13 months ). Conclusions One-stage posterior debridement, interbody bone graft and internal fi xation can effectively remove the lesion, restore normal spinal alignment and signif i cantly improveneurological functions for the AS patients complicated with Andersson lesion.
Spine; Spondylitis, ankylosing; Bone transplantation; Andersson lesion; Debridement
10.3969/j.issn.2095-252X.2017.07.015
R593.23, R687.3
2016-10-14 )
( 本文编辑:王萌 )
7 1 0 0 6 8 西安,陕西省人民医院骨科一病区

