微生物乳糖酶研究进展
贺璐,龙承星,刘又嘉,惠华英,谭周进
1(湖南中医药大学 药学院,湖南 长沙,410208) 2(湖南中医药大学 中医学院,湖南 长沙,410208)3(湖南中医药大学 医学院,湖南 长沙,410208) 4(湖南人文科技学院 数学与金融学院,湖南 娄底,417000)
微生物乳糖酶研究进展
贺璐1,龙承星2,4,刘又嘉2,惠华英1,谭周进3*
1(湖南中医药大学 药学院,湖南 长沙,410208) 2(湖南中医药大学 中医学院,湖南 长沙,410208)3(湖南中医药大学 医学院,湖南 长沙,410208) 4(湖南人文科技学院 数学与金融学院,湖南 娄底,417000)
乳糖酶是一种分解乳糖产生半乳糖和葡萄糖的双糖酶,在乳品生产、医药助消化、果菜成熟软化、环境保护等方面具有重大应用价值。微生物是产乳糖酶的主要来源,具有生长繁殖快、酶量丰富、生产成本低、适合工业化生产等特点。通过查阅国内外文献,对微生物乳糖酶研究从微生物乳糖酶特点、产乳糖酶主要微生物、基因工程技术在乳糖酶生产上的应用及微生物乳糖酶的应用等领域进行了综述,为产乳糖酶微生物的开发、乳糖酶基因工程技术的应用等提供参考。
微生物;乳糖酶;特点;基因工程
乳糖酶能水解乳糖生成葡萄糖和半乳糖,还可以通过半乳糖苷转移作用生成功能性低聚半乳糖,又称β-D-半乳糖苷酶(β-D-galactoside-galactohydrolase E.C.3.2.1.23)。乳糖酶在乳制品加工、医药、环境、食品等领域得到广泛应用,在医药上主要用来治疗乳糖不耐受症[1]。荷兰生物学家1889年首次报道乳糖酶能水解乳糖以来[2],乳糖酶的研究日渐完善。20世纪60年代,国外学者成功研制出一系列微生物乳糖酶商品并投放市场,国内在20世纪80年代以后开始微生物乳糖酶的研究,但主要集中在产酶菌株的筛选、产酶条件的优化、乳糖酶的分离纯化及酶学性质等的研究,取得了一些进展。
乳糖酶的来源非常丰富,包括植物来源、动物来源和微生物来源。植物来源如杏、李、桃、苹果和咖啡豆等,动物来源主要有肠、脑、消化器官和皮肤组织,微生物来源有细菌、放线菌、酵母菌和霉菌等,只有微生物乳糖酶具有工业应用价值[3]。本文主要归纳总结了微生物乳糖酶的生化特性、主要产酶菌株及高产菌株的优化方法和微生物乳糖酶的应用。
1 微生物乳糖酶的特点
微生物具有代谢高效、生长繁殖快的优点,其应用优势明显。微生物乳糖酶性质多样、来源广泛、酶活力高且容易制备。利用微生物发酵法制备乳糖酶具有周期短、生产成本低、产量高的特点,且不受地理位置、季节等的影响,能满足各种需求且便于工业化规模生产,是目前商用乳糖酶的主要生产方法[4]。乳糖酶分为胞外酶和胞内酶,细菌和酵母菌产生的乳糖酶一般为胞内酶,霉菌产生的乳糖酶为胞外酶。不同来源的微生物乳糖酶性质差异巨大(表1),细菌乳糖酶一般为常温乳糖酶,最适作用温度一般在40 ℃左右,如卷曲乳杆菌ATCC33820和大肠杆菌的乳糖酶的最适温度分别为45 ℃和40 ℃。有些细菌乳糖酶的作用温度可达90℃,也有些耐冷产乳糖酶菌株产生的乳糖酶在低温下仍保持较高酶活性,如拉恩氏茵属(Rahnellasp.)产生的乳糖酶在4 ℃仍保持最高酶活性的40%[5]。细菌乳糖酶的最适pH值近中性,一般为6.5~7.5,具有酶性质稳定、易于发酵等优势。酵母菌乳糖酶的最适作用温度一般在37 ℃左右,最适作用pH近中性,与牛乳的天然pH值接近,被广泛用于牛乳和乳清中乳糖的水解,但由于是胞内酶,不易提取[6]。霉菌产生的乳糖酶是胞外酶,提取方便,一般作用温度较高,在50 ℃以上,最适pH值偏酸性,分子量较小,主要用于酸性乳清和干酪的水解。微生物乳糖酶的用途广泛,但游离的乳糖酶存在价格昂贵、添加量大且不利于产品分离纯化等缺点,研究者们在固定化酶方面进行了研究与探索。研究表明,利用壳聚糖微球载体、苯乙烯马来酸酐共聚物纳米纤维载体和氨基化细菌纤维素载体固定β-半乳糖苷酶,能使乳糖酶具较好的储存和操作稳定性,并能提高酶的活性和回收利用率[7]。
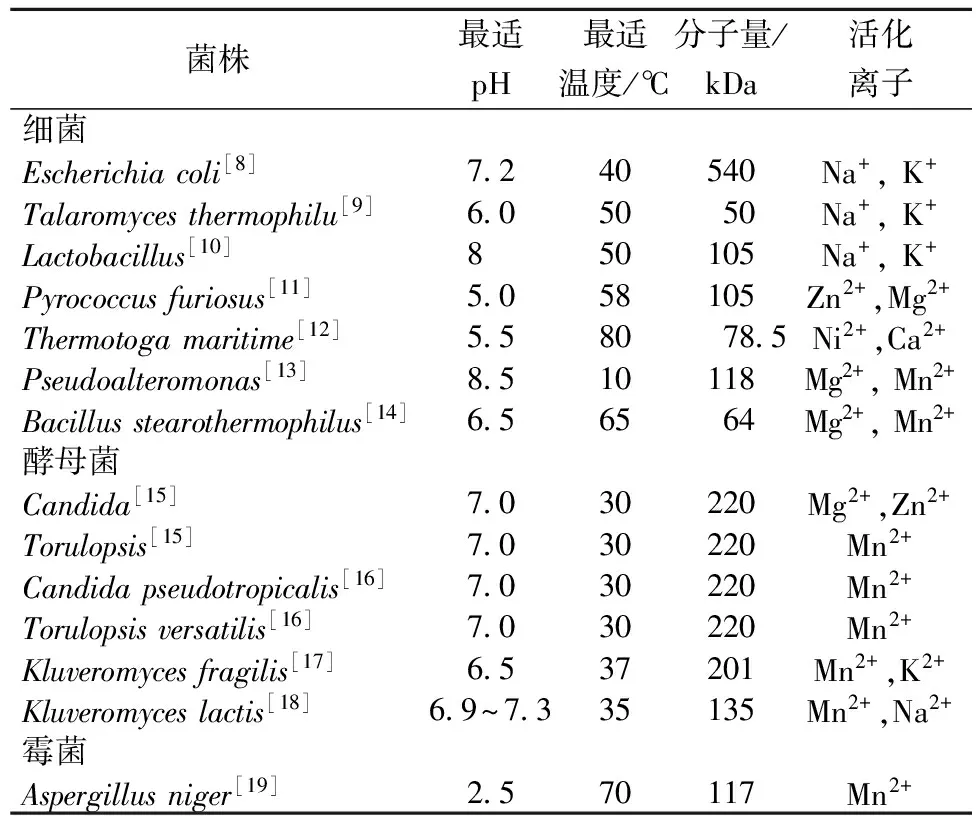
表1 一些微生物乳糖酶的性质
2 产乳糖酶的主要微生物
微生物种类多,特性不一。产乳糖酶的微生物有细菌、放线菌、酵母菌和霉菌,其中细菌占绝大多数,其次是霉菌,酵母菌和放线菌较少。大量细菌能产生乳糖酶,但仅有极少数的细菌可作为乳糖酶的安全来源,Streptococcusthermophilus是其中的一种,可用作酸奶酪和一些乳酪的发酵剂[16]。酵母菌可产生大量的乳糖酶,适用于牛奶和乳清的水解,主要包括Klugeveromycesmarxianus、Klugeveromyceslactis、Guchomycespullulans和Candidakefr[20]。目前常用的乳糖酶制剂来源菌中,乳酸克鲁维酵母、脆壁克鲁维酵母、米曲霉和黑曲霉等在食品工业中被认为是安全的[21],符合美国FDA(Food and Drug Administration)的GRAS (generally regarded as safe) 的要求。表2列举了一些主要的产乳糖酶微生物及商品化乳糖酶,例如荷兰帝斯曼公司的来源于乳酸克鲁维酵母的Maxilact系列、美国纽约酶发展公司生产的来源于黑曲霉的Fungal lactase,我国的哈尔滨美华生物技术股份有限公司生产的中性乳糖酶来源于脆壁克鲁维酵母,但乳糖酶产量依然偏低,在乳品工业中的应用仍受到限制。以后的研究中,应着力于研究如何提高微生物商品化乳糖酶的产量,使其能更好地应用于工业生产。

表2 产乳糖酶的微生物及其商品化乳糖酶
3 乳糖酶高产菌株的选育
乳糖酶在医药、乳品、环境保护、分析等方面应用广泛,然而产量低下限制了乳糖酶的应用及规模化生产。研究者们在乳糖酶高产菌株选育方面开展了大量的工作,主要技术集中在诱变育种和基因工程。乳糖酶高产菌株的诱变选育主要是通过60Co-γ射线照射、紫外线照射和亚硝基胍处理等进行诱变后,然后进行筛选。采用紫外线和60Co-γ射线协同诱变对出发菌株Uco-3的原生质体进行处理后,筛选突变株产生的乳糖酶活性由原来的16.27 u/mL可以提高到44.37 u/mL[44]。
随着基因工程技术的发展,乳糖酶高产菌株的选育取得了很好的成效。基因工程技术将性状优良的乳糖酶基因导入易于培养且生长迅速的微生物,获得重组乳糖酶基因工程菌,再进行发酵条件优化,提高乳糖酶生产含量,降低生产成本。乳糖酶基因的表达系统有三大类,分别是毕赤酵母表达系统、大肠杆菌表达系统和乳酸菌表达系统。大肠杆菌表达系统是目前应用最成熟、最广泛的原核表达系统,具有产量高、成本低、生长快及遗传背景清楚等优点,但真核基因在这种表达系统中没有翻译和修饰功能,所表达的目的蛋白常以不溶性包涵体形式存在,必须通过变性复性得到天然活性蛋白,表达的产物往往没有生物活性或生物活性很低。将嗜热脂肪芽孢杆菌的乳糖酶基因导入大肠杆菌后进行表达,结果发现重组蛋白的催化活性高出原来菌株约50倍,这是因为嗜热脂肪芽孢杆菌的乳糖酶基因是原核基因,在大肠杆菌表达系统中能直接表达[45]。毕赤酵母表达系统是目前发展最迅速、应用最广泛的外源蛋白质表达系统,在蛋白质生产中具有无比广阔的前景,主要特点是能利用甲醇作为能量来源和唯一碳源。这种表达系统具有蛋白修饰和翻译功能,稳定性高、表达能力强、遗传背景清楚、生长迅速,易于培养,生产成本低,适合高密度的发酵培养和商业化生产。把环状芽孢杆菌(Bacilluscirculans)的乳糖酶基因导入毕赤酵母中进行表达,目的蛋白表达量提高了2倍[46]。乳酸菌表达系统操作安全、简单、可诱导表达,也被广泛用于外源基因的表达。除此之外,还可以通过基因敲除的方法获得乳糖酶高产菌株。基因敲除技术是上世纪80年代末发展起来的,是指通过一定的途径使机体特定的基因失活或缺失的技术,主要包括同源重组技术、基因随机插入突变和RNAi基因敲除技术。将K.Marxianukm菌株的MIG1基因敲除后,乳糖酶基因的转录水平提高了2倍,酶生物合成量也明显提高[47]。随着新技术的发展,乳糖酶高产菌株的选育将有更大的进步。
利用基因工程技术得到的高产菌株固然能增大乳糖酶的产量,然而将其广泛应用于商业化生产还存在诸多问题。比如技术要求高导致生产成本升高;乳糖酶主要应用于食品医药方面,转基因菌株生产的酶可能存在潜在的危害。
4 微生物乳糖酶的应用
4.1 食品方面的应用
微生物来源的乳糖酶在食品工业中的一个重要应用是合成低聚半乳糖。低聚半乳糖是一种益生元,能够改善肠道菌群、增强免疫系统。低聚半乳糖难以被小肠吸收,还具有糖类的共有属性和较好的口感,被广泛用于制作高血脂、肥胖、糖尿病人的无热量食品。工业上低聚半乳糖主要采用酶法合成,尤其以微生物来源的β-半乳糖苷酶为主。β-半乳糖苷酶既能催化β-D-半乳糖苷键的水解,也可催化半乳糖基转移生成低聚半乳糖的转糖苷反应,因此能催化乳糖生成低聚半乳糖。利用β-半乳糖苷酶制作的酸乳风味和口感较好,保质期较一般乳制品长。
4.2 医药方面的应用
乳糖不耐受症是目前在全世界人群中较常出现的一种症状,医药领域将β-半乳糖苷酶做成酶制剂,以治疗乳糖不耐受症疾病以及多种儿童消化不良症[5]。
4.3 作为报告基因的应用
β-半乳糖苷酶可作为某些检测载体的报告基因或用于肠杆菌的鉴定。如利用β-半乳糖苷酶水解对硝基酚-β-D-半乳糖苷,生成对硝基酚(pNP)游离而呈现黄色的性质,采用酶标仪在405 nm波长下比色,依据光密度值确定肠杆菌中具有β-半乳糖苷酶的菌属的菌量[48]。李杰[49]等研究发现,利用β-半乳糖苷酶基因作为报告基因构建耐辐射异常球菌启动子的检测载体,能深入了解耐辐射异常球菌的抗逆基因在不同胁迫下的功能。
4.4 免疫和检测的应用
金国祥建立了以β-半乳糖苷酶为标志性抗原的小鼠黑色素瘤模型——galBl6肿瘤模型,以β-半乳糖苷酶表达载体作为DNA疫苗,在galBl6肿瘤模型上做了抗肿瘤免疫的实验,结果表明β-半乳糖苷酶基因疫苗具有抑制galBl6肿瘤生长的作用[50]。
4.5 环保方面的应用
乳清中含有乳糖、维生素、乳清蛋白和矿物质等营养成分,每年世界上约产乳清9×107T,其中50%当废水排放,不仅造成浪费,而且污染环境。用β-半乳糖苷酶水解乳清中的乳糖,可以提高含乳清饲料的营养价值,减少环境污染。
4.6 果蔬软化方面的应用
果蔬软化是在细胞壁多糖降解酶的作用下,细胞壁多糖发生降解,高聚物解离,细胞壁组织变软导致肉质软化。β-半乳糖苷酶可以让细胞壁的组分不稳定,并通过具支链的多聚醛酸的降解来溶解果胶,使果蔬软化。
5 结束语
乳糖酶缺乏或乳糖不耐受是全球面临的问题,影响了全世界近2/3的人群,对人类的健康造成了很大的威胁。微生物乳糖酶因微生物繁殖快、低生产成本、高酶活力等备受研究者的青睐。目前对微生物乳糖酶的研究主要在于筛选乳糖酶高产菌株,降低乳糖酶生产成本。常温乳糖酶水解速率慢、酶需要量大,且容易造成牛奶体系的杂菌污染等问题,并且我国乳品生产大多在低温环境下进行,因而也促使高产耐热和耐低温的乳糖酶生产菌株的开发,有望解决这些问题。
利用微生物育种技术和现代生物技术发展乳糖酶基因工程确实可以大大提高乳糖酶产量,但其安全性也有待于进一步提高。为了促进我国乳品工业的迅速发展,全面解决乳糖不耐受,开发高质量且安全的乳糖酶及对乳糖酶生物学特性的研究、探索其规律性、实现乳糖酶工业化低成本生产仍是巨大的挑战。此外,乳糖酶在食品行业之外的应用也有待进一步发掘。
[1] 王康,王璋,高阳,等.乳糖酶交联酶聚体的制备及性能[J].化学工程,2012,40(10):13-16.
[2] ROUWENHORST R J, PRONK J T, VAN DIJKEN J P. The discovery of beta-galactosidase [J].Trends in Biochemical Sciences,1989,14(10):416-418.
[3] 姜旭.乳糖酶在乳品工业中的应用[J].商品与质量·学术观察,2014(1):119.
[4] 林国秀,李珍,罗盛莲,等.产胞外乳糖酶耐冷菌株Comamonassp的筛选鉴定及酶学性质研究[J].工业微生物,2013,43(2):38-44.
[5] 沈莲莲,杨瑞金,华霄,等.产低温乳糖酶菌株的筛选、鉴定及酶学性质的研究[J].工业微生物,2013,43(3):12-17.
[6] 王敏,檀建新,张伟,等.微生物乳糖酶的特性和发展现状[J].河北农业大学学报,2003,26(Z1):167-169.
[7] 汤卫华,王立晖,殷海松,等.壳聚糖微球固定化β-半乳糖苷酶[J].食品与发酵工业,2015, 41(5):105-109.
[8] CRVAEN G R, STEERS E J, ANIFINSEN C B. Purification,composition and molecular weight of the β-galactosidase ofEscherichiacoliK12[J].The Journal of Biological Chemistry,1965,240(6):2 468-2 477.
[9] NAKKHARAT P, HALTRICH D. Lactose hydrolysis and formation of galactooligosaccharides by a novel immobilized beta-galactosidase from the thermophilic fungusTalaromycesthermophiles[J].Applied Biochemistry and Biotechnology,2006,129:215-225.
[10] NGUYEN T H, SPLENCHTNA B, STEINBOCK M, et a1. Purification and characterization of two novel β-galactosidases fromLactobacillusreuteri[J].J Agric FoodJournal of Agricultural & Food Chemistry,2006,54(14):4 989-4 998.
[11] PARRNJIT S P,REEBA P,RAM S S,et a1.Review Microbial production,immobilization and applications of β-D-galactosidase[J].Journal of Chemical Technology and Biotechnology,2006,81(4):530-543.
[12] LI Li-te, ZHANG Min, JIANG Zhengqiang, et a1. Characterisation of a thermostable family 42 β-galactosidase fromThermotogamaritime[J].Food Chemistry,2009, 112(4):844-850.
[13] 宋春丽.耐冷酵母Guehomycespullulans17-1菌株乳糖酶的研究[D].青岛:中国海洋大学,2010.
[14] 高兆建,侯进慧,孙会刚,等.耐高温β-半乳糖苷酶的分离纯化与酶学性质分析[J].食品科学,2010,23(31):151-156.
[15] 徐金利.产乳糖酶酵母菌株的遗传改良和乳糖酶的发酵生产[D].青岛:中国海洋大学,2012.
[16] 谭树华,高向东,吴梧桐.脆壁克鲁维酵母乳耱酶提取物性质研究[J].药物生物技术,2000,7(3):153-156.
[17] 钱卫东,洪奕梅.一株Kluyveromyceslactis酵母胞内乳糖酶性质的研究[J].中国酿造,2012,31(3):67-69.
[18] SHANE O, WALSH G. A novel acid-stable,acid-activeβ-galactosidase potentially suited to the alleviation of lactose intolerance[J].Applied Microbiology and Biotechnology,2010,86(2):517-524.
[19] 赵春萍.高产乳糖酶酵母菌筛、培养基优化及酶的分离提取[D].呼和浩特:内蒙古农业大学,2014.
[20] 李兴.酶法降解乳糖及低乳糖发酵酸乳的发酵工艺技术研究[D].石家庄:河北科技大学,2013.
[21] 王政,莫菁莲,黄冬爱,等.乳糖酶在大肠杆菌中的高效表达与纯化[J].中国热带医学,2010,10(5):527-528,564.
[22] LI Yu-mei, WANG Hong-mei, LU Li-li, et al. Purification and characterization of a novel β-galactosidase with transglycosylation activity fromBacillusmegaterium2-37-4-1[J]. Applied Biochemistry and Biotechnology,2009,158(1):192-199.
[23] RHIMI M, AGHAJARI N, JAOUADI B, et al. Exploring the acidotolerance of beta-galactosidase fromLactobacillusdelbrueckiisubsp. bulgaricus: an attractive enzyme for lactose bioconversion[J].Research in Microbiology,2009,160(10):775-784.
[24] CHEN W, CHEN H, XIA Y, et al. Production,purification,and characterization of a potential thermostable galactosidase for milk lactose hydrolysis fromBacillusstearothermophilus[J].Journal of Dairy Science,2008,91(5):1 751-1 758.
[25] YANG J, ZHANG H, JIANG L, et al.BifidobacteriumlongumBBMN68-specific modulated dendritic cells alleviate allergic responses to bovine β-lactoglobulin in mice[J].Journal of Applied Microbiology,2015,119(4):1 127-1 137.
[26] JUAJUN O, NGUYEN T H, MAISCHBERGER T, et al. Cloning,purification,and characterization of β-galactosidase fromBacilluslicheniformisDSM 13[J]. Applied Microbiology and Biotechnology,2011,89(3):645-654.
[27] 傅晓燕.耐热β-半乳糠苷酶基因在枯草芽孢秆茵的克隆和表达[J].中国酿造,2004(8):16-18.
[28] ISHIKAWA K, KATAOKA M,YANAMOTO T, et al.Crystal structure of β-galactosidase fromBacilluscirculansATCC 31382 (BgaD) and the construction of theThermophilicmutants[J].FEBS Journal,2015,282(13):2 540-2 552.
[29] SOLOMON H V, TABACHNIKOV O, LANSKY S, et al. Structure-function relationships in Gan42B,an intracellular GH42 β-galactosidase fromGeobacillusstearothermophilus[J]. Acta Crystallographica Section D Biological Crystallography,2015,71(12):2 433-2 448.
[30] HO H J, TOH C Y, ANG B, et al. Outbreak of New Delhi metallo-β-lactamase-1-producingEnterobactercloacaein an acute care hospital general ward in Singapore[J].American Journal of Infection Control,2015,23(6):118-123.
[31] PEI Xue,ZHAO Jun-qi,CAI Peng-li,et al.Heterologous expression of a GH3 β-glucosidase fromNeurosporacrassainPichiapastoriswith high purity and its application in the hydrolysis of soybean isoflavone glycosides[J]. Protein Expression and Purification,2015,119:75-84.
[32] TREEBUPACHATSAKUL T,SHIOYA K, NAKAZAWA H, et al. Utilization of recombinantTrichodermareeseiexpressingAspergillusaculeatusβ-glucosidase I (JN11) for a more economical production of ethanol from lignocellulosic biomass[J].Journal of Bioscience and Bioengineering, 2015,120(6):657-665.
[33] WU Ding-xin,WANG Lin-chun,LI Yu-wei,et al.Heterologous expression and characterization of a thermostable exo-beta-D-glucosaminidase fromAspergillusoryzae[J]. Journal of Microbiology and Biotechnology,2015,25(8):164-169.
[34] ZHENG Pu,YU Hong-feng,SUN Zhi-hao,et al.Production of galacto-oligosaccharides by immobilized recombinant beta-galactosidase fromAspergilluscandidus[J]. Biotechnology Journal,2006,1(12):1 464-1 470.
[35] RIZZATTI A C, JORGE J A,TERENZI H F, et al. Purification and properties of a thermostable extracellular beta-D-xylosidase produced by a thermotolerantAspergillusphoenicis[J]. Journal of Industrial Microbiology & Biotechnology,2001,26(3):156-160.
[36] ZHOU Ling-fang, LI Shu-hua, ZHANG Tao, et al. Properties of a novel polydatin-β-D-glucosidase fromAspergillusnigerSK34.002 and its application in enzymatic preparation of resveratrol[J].Journal of the Science of Food and Agriculture,2015,13(5):135-139.
[37] KIM Y S,YOO M H, LEE G W, et al. Ginsenoside F1 production from ginsenoside Rg1 by a purified β-glucosidase fromFusariummoniliformevar. subglutinans[J].Biotechnology Letters,2011,33(12):2 457-2 461.
[38] SRIVASTAYA A, MISHRA S, CHAND S. Transgalactosylation of lactose for synthesis of galacto-oligosaccharides usingKluyveromycesmarxianusNCIM 3551[J].New Biotechnology,2015,32(4):412-418.
[39] TRETIAK K A, ZAKALSKII A E, GUDZ S P. The cloning and expression of the gene for beta-galactosidase fromCandidapseudotropicalisyeasts inSaccharomycescerevisiaecells[J].Mikrobiolohichnyi Zhurnal,1998,60(4):57-66.
[40] WU Peng, ZHAO Xi-hong, PAN Si-yi. Intraspecific protoplast fusion ofBrettanomycesanomalusfor improved production of an extracellular β-glucosidase[J]. Biotechnology & Biotechnological Equipment, 2014,28(5):878-881.
[41] XU Jin-li,ZHAO Jun,WANG Ling-fei,et al.Enhanced β-galactosidase production from whey powder by a mutant of the psychrotolerant yeastGuehomycespullulans17-1 for hydrolysis of lactose[J].Applied Biochemistry and Biotechnology,2012,166(3):599-611.
[42] PARMJIT S P, REEBA P, RAM S S, et a1.Microbial production,immobilization and applications of β-D-galactosidase[J].Journal of Chemical Technology and Biotechnology,2006,81(4):530-543.
[43] 杜海英,于宏伟,韩军,等.原生质体诱变选育乳糖酶高产菌株[J].微生物学通报, 2006, 33(6):48-51.
[44] 聂春明.乳酸杆菌β-半乳糖苷酶重叠基因的克隆、表达及酶学性质的分析[D].呼和浩特:内蒙古农业大学,2012.
[45] 陈卫,张灏,葛佳佳,等.高温乳糖酶基因在大肠杆菌中的高效表达[J].生物技术,2002,12(5):8-11.
[46] 梁果义,伍宁丰,张伟,等.来源于芽孢杆菌(Bacilluscirculans)的乳糖酶在毕赤酵母中的高效表达[J].高技术通讯,2006,16(1):55-60.
[47] 李美玲,江波,张涛,等.β-半乳糖苷酶催化乳糖合成低聚半乳糖[J].食品与生物技术学报,2016,35(3):234-239.
[48] 刘鑫龙,王立晖,汤卫华,等.固定化半乳糖苷酶催化合成低聚半乳糖的研究[J].食品工程,2016(1):20-22,39.
[49] 李杰,张陈,张维,等.基于β-半乳糖苷酶为报告基因的耐辐射异常球菌启动子检测载体构建[J].生物技术进展,2016,6(4):265-270.
[50] 金国祥.表达β-半乳糖苷酶的galB16肿瘤模型的建立及其在抗肿瘤免疫研究中的初步应用[D].杭州:浙江大学,2004.
Research progress on microorganism lactase
HE Lu1, LONG Cheng-xing2,4, LIU You-jia2, HUI Hua-ying1, TAN Zhou-jin3*
1(College of Pharmacy,Hunan University of Chinese Medicine, Changsha 410208, China)2(College of Chinese Traditional Medicine, Hunan University of Chinese Medicine, Changsha 410208, China)3(Medical College, Hunan University of Chinese Medicine, Changsha 410208, China)4(College of Mathematics and Finance, Hunan University of Humanities Science and Technology, Loudi 417000, China)
As a kind of disaccharidase, lactase could decompose lactose into galactose and glucose, and thus applied into dairy production, medical aid digestion, fruit mature softening and environmental protection and so on. As the main source of lactase, microorganism had many characteristics such as fast growing speed, rich enzyme amount, low production cost, and thus was suitable for industrial production. The study of microorganism lactase was mainly focused on the development of lactase-producing microorganisms and application of lactase gene engineering. Herein the research on the characteristics of microorganism lactase, main lactase-producing microorganism, application of engineering to lactase production and the application of microorganism lactase were reviewed.
microorganism; lactase; characteristic; gene engineering
硕士研究生(谭周进教授为通讯作者,E-mail:tanzhjin@sohu.com)。
国家自然科学基金(81573951); 长沙市科技局项目(k1508025-21); 湖南省教育厅项目(16C1202)
2016-12-31,改回日期:2017-02-21
10.13995/j.cnki.11-1802/ts.201706046

