耳石锶标记在识别鳙(Aristich thys nobilis)放流个体的可行性∗
李秀启,丛旭日,师吉华,高云芳,姜 涛,杨 健
(1:山东省淡水渔业研究院,山东省淡水水产遗传育种重点实验室,济南250013)(2:中国水产科学研究院淡水渔业研究中心,中国水产科学研究院内陆渔业生态环境与资源重点开放实验室,无锡214081)
耳石锶标记在识别鳙(Aristich thys nobilis)放流个体的可行性∗
李秀启1,丛旭日1,师吉华1,高云芳1,姜 涛2,杨 健2
(1:山东省淡水渔业研究院,山东省淡水水产遗传育种重点实验室,济南250013)
(2:中国水产科学研究院淡水渔业研究中心,中国水产科学研究院内陆渔业生态环境与资源重点开放实验室,无锡214081)
为探讨耳石微化学分析的相关方法和技术在鳙(Aristichthys nobilis)放流群体识别中的应用,以鳙的1龄幼鱼为研究对象,设置1、2、4、8、16 mg/L 5个浓度梯度的SrCl2溶液标记,利用元素电子显微探针技术(EPMA)检测获得了良好的标记图谱.面分布分析结果显示,暂养28 d后外源Sr在耳石的边缘形成明显的标记环,与对照组的蓝色边缘相比,高锶环带从黄绿色过渡到橘红色,随着标记浓度增大有加深的趋势.定量线分析表明对照组的Sr/Ca比值处于稳定的2.14± 0.39,而不同浓度Sr的实验组Sr/Ca比值均出现一个较为明显的峰值范围(5.04~32.32),且外源Sr浓度与耳石边缘的Sr/Ca比值之间存在明显的线性关系,标记过程中对照组和标记浓度间的死亡率并没有显著差异.结果表明锶标记原理和方法在鳙的大规模放流群体标记是可靠和安全的,验证了耳石锶标记在识别鳙放流个体上的可行性.建议选择鳙放流前仔稚鱼和幼鱼,以4 mg/L设为外源Sr的最适标记浓度,标记持续时间为28 d以上为宜.
鳙;耳石;锶标记;电子探针;群体标记技术
自2008年我国开始设立专项资金实施增殖放流工作以来,每年数以亿万的苗种被放流自然水域,重大意义在于补充渔业资源和修复水域生态系统.当前放流工作迫切需要解决的是如何客观评价增殖放流效果,可靠的标记手段一直是科学评价放流鱼类增殖效果的技术瓶颈.目前,群体标记方法主要有体外标记、荧光标记、化学标记和分子标记[1-2],传统的体外标记会影响鱼类正常生长和存活,损失率很高,回捕个体记录少,统计往往依赖于渔业报告.先进的体内荧光和电子标签价格较高,标记过程复杂,需要昂贵的特殊设备和大量的专业人员来跟踪识别,不适宜大规模的群体标记放流工作,而且特定外源物质的荧光或化学标记往往涉及标记的有效保留时间和外源物质的安全性问题[3].
耳石微化学分析已成为研究鱼类生活史的重要方法之一.鱼类在生长发育过程中,水体中的碳酸钙在耳石上沉积的同时,其他微量元素也被沉积在耳石中,由于它的非细胞性和代谢惰性,一般不会发生分解或重吸收,这种元素的信息可以一直保存下来,成为记录鱼类生活史的元素指纹(elemental fingerprints).耳石元素指纹分析能有效表征鱼类特定生活阶段所特有的微化学组成,以此重新构建或反演鱼类的生活史和环境史中相关问题.利用电子显微探针技术(EPMA)分析鱼类耳石上Sr和Sr/Ca含量比值,成为获取鱼类生活履历的有效手段,特别在洄游性鱼类能够准确而且直观地“反演”鱼类过去生活环境“履历”[4-5],被广泛应用于鱼类生活史重建、鱼类资源时空动态监测、产卵场溯源和种群识别等研究[6-8].锶作为淡水鱼类和海洋鱼类特别是具有生殖洄游习性的鱼类一种生物标志物[9-10],或作为一种人工标记元素用来评估人工增殖放流的效果[11-12],在渔业生物学研究中具有重要应用价值.国内一些学者开展了锶标记的安全浓度和浸染时间一些探索,王臣等[13]利用外源Sr浸染大麻哈鱼(Oncorhynchus keta)发眼卵后期胚胎在耳石得到清晰的标记环,表明可以利用外源Sr对大麻哈鱼耳石进行标记.
鳙(Aristichthys nobilis)作为我国的“四大家鱼”之一,增殖放流不仅补充内陆水体渔业资源,而且在富营养化水体中放养滤食性的鲢、鳙被认为是控制蓝藻水华、净化水质的有效手段[14-15],在我国淡水增殖渔业中占有极其重要的地位.以山东省东平湖为例,自2005年来连续11年累计放流鱼蟹15862万尾(只),其中鲢鳙所占比例为51.46%,由于尚未开展规范的放流效果评估,大规模生产性放流在某种意义上带有很大的盲目性,放流群体对渔业资源的恢复效果和水域生态系统的影响还不能做出科学的回答.本研究采用SrCl2溶液标记鳙的幼鱼耳石,探索不同标记浓度和暂养时间下的标记效果,建立适用于大规模标记早期鱼苗的耳石微化学标记实验条件,通过鳙的耳石Sr/Ca比值分析以期准确识别放流个体和增殖放流效果评价提供技术手段.
1 材料与方法
1.1 实验鱼来源及标记实验
采集育苗场培育的放流鱼类鳙的1龄鱼(体长为10.78±1.48 cm,体重27.13±14.02 g)作为实验鱼.取水族箱(125 cm×52 cm×50 cm)18个,注入曝气2 d以上的室外养殖池塘用水,保持水温18℃,根据水的体积及放养密度,随机挑取饱满健壮、规格基本一致的幼鱼放入水族箱中,每箱30尾,放鱼时随机抽样测量鱼的体长和体重.
按剂量向相应箱中加入SrCl2母液,至浸染质量浓度分别达到1、2、4、8、16 mg/L,共5个梯度,每个浓度设置3个平行,3个空白对照,共计18个养殖实验组,对应鱼缸编号为CK、A、B、C、D、E组.实验于2015年5月12日开始,至6月11日结束,期间定时投喂人工颗粒饲料,每天早晨吸污,每3 d换水1次,换水量为箱内水量(182m3)的1/3,水温保持在19.5~24.0℃,及时清除死亡个体并计数,标记暂养实验28 d后全部结束.
1.2 耳石摘取与前处理
用剪刀和镊子解剖幼鱼的头骨,在听囊内取出微耳石,剔除有机质,用蒸馏水清洗后晾干,置于离心管中干燥备用.
将耳石用AB胶水黏于小块树脂上,待凝固后以横截面平行于底面的方向将带有耳石的树脂块黏贴于磨具底座进行环氧树脂(Epofix,丹麦Struers公司)包埋;树脂凝固后并取出,使用AB胶将其黏贴于载玻片上,使用500目砂轮和1200目砂纸打磨至核心即将暴露后,切下树脂块将其翻转后黏贴于另一块载玻片上并打磨至核心完全暴露;使用磨抛机(Roto Pol-35,丹麦Struers公司)装备机织布抛光盘配合抛光液抛光,至耳石表面无明显划痕;样品放入Millo-Q水中超声清洗5 min后,自然条件下晾干24 h;完全干燥后,使用真空镀膜机(JEE-420,日本电子株式会社)蒸镀碳膜(36 A,25 s).
1.3 耳石的EPMA分析
利用电子微探针分析仪(JXA-8100型EPMA,日本电子株式会社)进行线分析和面分析[16-17].以碳酸钙(CaCO3)和钛酸锶(SrTiO3)为标准样品,线分布分析的加速电压和电子束电流分别为15 kV和2.0×10-8A,束斑直径5μm,每点驻留15 s,以2μm为间隔,连续测定Sr和Ca元素含量.面分布分析的加速电压和电子束电流分别为15 kV和5.0×10-7A,束斑直径3μm,像素为3μm×3μm,每点驻留30ms,测定Sr元素含量的面分布状况.
1.4 数据处理
数据分析采用Excel 2010软件进行线分布分析中的平均值和倍数计算以及Sr/Ca比值变化作图,采用SPSS 17.0软件进行不同阶段及与对照组的Sr/Ca比值差异进行非参数检验(P<0.05,Mann-Whitney U-test),显著性水平设定为P<0.05.
由于耳石中Sr含量远小于Ca含量,将Sr/Ca比值标准化,即统一用Sr含量除以Ca含量并乘以103,简称Sr/Ca比值.耳石不同Sr/Ca比值水平以平均值±标准差表示[20].
2 结果与分析
2.1 不同锶标记浓度和暂养期间鳙的存活情况
耳石锶标记实验鳙的1龄鱼经暂养28 d后,体长增加为14.78±2.33 cm,体重为43.00±14.31 g.各标记组和对照组在暂养期间均出现不同程度的死亡情况,尤其在暂养第1周和第2周死亡率均较高,但标记组死亡的平均数和对照组经t-检验整体无显著差异(P>0.05),实验结束实验鱼的体长和体重增加,与对照组差异不显著(P>0.05)(图1).在本实验设计的剂量范围内,Sr对实验鱼未表现急性毒性,16mg/L浓度的SrCl2溶液对幼鱼没有致死作用.

图1 不同浸染浓度和暂养时间鳙的死亡数Fig.1 The death number of Aristichthys nobilis in differentmarking concentrations and breeding times
2.2 外源Sr在鳙耳石的面分布特征
电子微探针分析结果(图2)显示,所有个体耳石核心区及其周边均为Sr浓度较低的蓝色,不同Sr浓度标记的耳石边缘包围着黄绿色和红色区域.当SrCl2溶液浓度为1、2mg/L时,能在耳石边缘上检测到较为明显的黄绿色标记(图2A,2B);当SrCl2溶液浓度为4mg/L时,在耳石的边缘形成较为明显的橘红色高锶环带(图2C);当外源Sr的浸染浓度达到8、16 mg/L,图2中D-1、D-2、E-1和E-2耳石边缘的红色环带不断加深.与之相比,对照组(CK)外围无变化,其面分布显示较为均一的蓝色.
2.3 外源Sr在鳙耳石上Sr/Ca比值变化特征
对照组的Sr/Ca比值没有出现较大波动,而不同浓度的实验组在耳石边缘Sr/Ca比值均有1个明显的峰值出现(图3).低浓度组Sr/Ca比值差异不显著(P>0.05),相同浸染浓度的平行组之间Sr/Ca比值的平均值差异较为显著(P<0.05),高浓度间Sr/Ca峰值差异显著(P<0.01).

图2 鳙耳石锶沉积状况面分布(CK、A、B、C、D和E分别为0、1、2、4、8和16mg/L Sr标记)Fig.2 Concentrations ofmapping analysis of the Sr in otoliths of Aristichthys nobilis
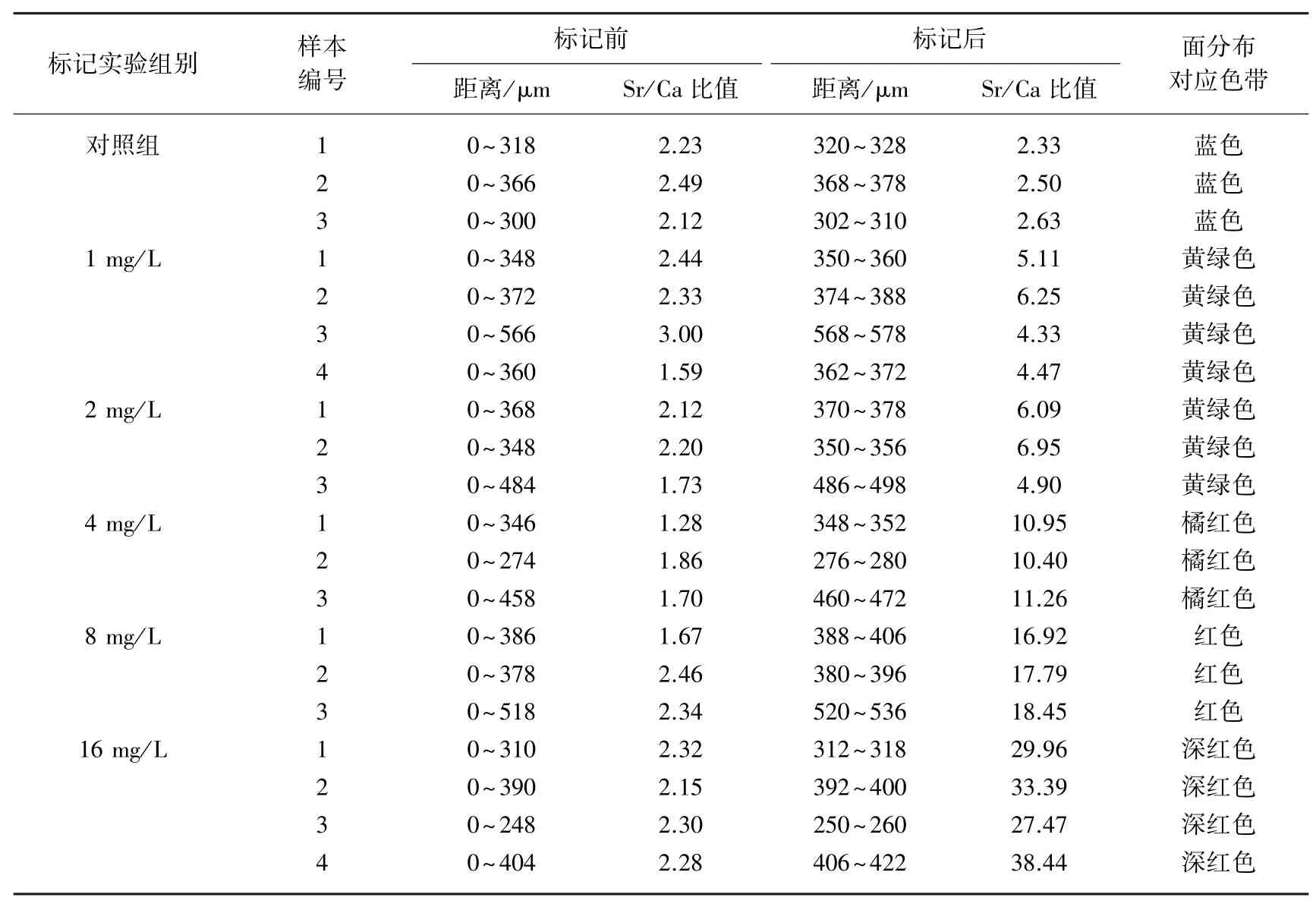
表1 鳙耳石Sr/Ca比值微化学变化Tab.1 Fluctuation of Sr/Camicrochemistry in the edge in otoliths of Aristichthys nobilis
鳙的耳石Sr/Ca比值分为2个阶段,分别是未经外源Sr标记前阶段和外源Sr标记后阶段(表1).其中,标记前阶段,对照组和实验组耳石从核心向边缘的不同径长(0~248μm,518μm)Sr/Ca比值变化比较稳定,Sr/Ca比值为2.14±0.39;且二者差异不显著(P>0.05);标记后阶段,实验组耳石边缘(280~520μm)均出现较为明显的峰值,不同标记浓度(1、2、4、8和16 mg/L)的耳石Sr/Ca比值对应为5.04±0.87、5.98±1.04、10.87± 0.44、17.72±0.77和32.32±4.75.

图3 鳙耳石锶沉积状况线分析Fig.3 Sr concentrations of line analysis of otoliths of Aristichthys nobilis
与面分析不同浓度标记效果的结果相印证,随着浸染浓度的增加,Sr/Ca比值峰值也越来越大.外源Sr浓度与耳石边缘的Sr/Ca比值之间有较为明显的线性关系:y=1.8617x+2.726(R2=0.9979).说明Sr在耳石上的沉积速率和沉积量不同,受外源Sr浓度的影响较为明显(图4).
3 讨论
3.1 鳙耳石锶标记可靠性分析
水体中Sr沉积在耳石上的过程与水环境条件(如Sr背景浓度、水温、盐度)和鱼类生理发育状态有关[18-19].Sr主要存在于水域中,由于地理差异和河流过程的不同,Sr在淡水、河口和海水中浓度差别很大.我国长江下游水体中元素浓度背景值Sr浓度为0.24 mg/L[20].河口表层水溶解Sr浓度水平表现为从长江(平均0.22 mg/L,范围:0.02~0.30 mg/L)向北至黄河(平均0.74mg/L,范围:0.05~0.95 mg/L)逐渐升高[21-23].海水中Sr浓度大致为8.5 mg/L,且在海洋中浓度基本不变[24].通常三类水体中Sr/Ca比值平均为淡水区(2.7±1.5)、河口区(5.6±1.1)和海水区(8.3±4.5)[25]. Brown等[26]统计分析美国淡水、河口及海水中Sr/Ca比值发现,海水的Sr/Ca比值(8.17~8.87)相对稳定,而河流(0.27~19.18)和淡水湖泊(0.20~5.02)则波动较大.

图4 耳石边缘Sr/Ca比值与外源Sr浓度的线性关系Fig.4 Linear relation between Sr/Ca ratio of otolith edge and exogenous Sr concentration
本实验元素定量线分析和面分布分析结果直观而鲜明地显示:1、2、4、8、16 mg/L共5个浓度梯度的SrCl2溶液在鳙的幼鱼耳石上均能产生明显的标记环,颜色由黄绿色逐渐变化为深红色.通过比较不同浓度的标记特征,外源Sr浓度在4 mg/L可以很明显地被电子微探针技术所检测.据王臣等[13]对大麻哈鱼发眼卵后期胚胎浸染实验的结果,经48 h外源Sr浸染(50、100、200、400mg/L)后暂养至12 d在耳石上形成了较为明显的“高锶环带”;再经100 d暂养后,实验鱼仍能正常生长,已形成的“高锶环带”没有减退现象,而且“高锶环带”后的耳石部分又逐渐恢复到正常的蓝绿色.同时,考虑到本研究中标记组与对照组间个体死亡率并没有显著差异,说明Sr浸染浓度对鳙鱼幼鱼影响较小.因此,对鳙而言较为合适的耳石标记浓度应在4mg/L以上.
3.2 鳙耳石Sr标记的最佳浸染时间
外源Sr沉积在耳石内浓度变化并非立即被响应,而是存在着一定时间的时滞.Milton等[27]在水体中添加Sr对120条澳洲肺鱼barramundi(Lates calcarifer)的幼鱼进行养殖实验,对1~2和7~11 d生长间隔的耳石轮纹进行原位元素检测,结果表明鱼体对水体元素变化的适应期为2周,在此期间元素浓度变化幅度较大,一旦鱼体与水体达到平衡后,耳石中与水体中的Sr/Ca比值亦具有正相关关系.
郭弘艺等[28]对日本鳗鲡(Anguilla japonica)幼体的耳石微化学分析表明:幼鳗自海洋至淡水的迁徙过程中,以Sr元素为代表的环境强响应元素存在明显的时滞效应,其含量从变态起始的2915.5±449.41μg/g,至变态完成的2244.7±383.73μg/g,最后降低至1053.9±450.90μg/g,前后降低了63.9%.研究表明Sr含量呈持续平缓的下降,并非立即响应了所栖息的水环境变化.长江口口门处九段沙采集的玻璃鳗平均日龄为141 d,与上游靖江段采集的日本鳗鲡幼体日龄相差12~19 d,即从九段沙迁徙至上游的靖江段可能需要15 d左右[29].在受控条件下养殖实验也显示,幼鳗耳石内Sr/Ca比值对水体盐度变化的适应期为10 d或者以上[30].王臣等[13]对大麻哈鱼胚胎标记研究结果表明:在大麻哈鱼耳石上从浸染开始到Sr在耳石上沉积有延时过程,浸染时间为48 h,而Sr峰值却持续12 d以上,表明锶元素在水体-鱼体-耳石迁移富集过程是渐进的.
上述研究结果表明,环境强响应元素(Sr)浓度需要机体较长时间的生理调节,才能达到平衡状态.本研究实验鱼为鳙的1龄幼鱼,暂养28 d后检测仅在耳石边缘部分发现较细弱的“高锶环带”,由于实验未能继续下去,其峰值持续天数无法确定.为保证有良好的标记效果,根据日轮沉积规律在对鳙群体的幼鱼耳石进行外源Sr标记时,可适当延长浸染的时间在28 d以上.
3.3 鳙耳石Sr标记的安全限量
Sr作为生物体的必须微量元素,不仅具有促进成骨细胞生长和抑制破骨细胞形成的作用[31-32],而且还有促进骨髓间质干细胞增殖并向成骨细胞分化、促进血管形成、改善骨质强度等作用[33].在一定范围内,体内高Sr高Ca对机体非常有益,若体内出现高Sr低Ca,则对机体生理代谢产生不利影响,甚至产生多种病理变化.已经证实在鱼的早期发育阶段,鱼体Sr能够明显地抑制Ca的吸收[34],过高的外源Sr浓度会使耳石Sr/Ca比值不稳定[13].Birge等[35]在28 d的实验观察到水体中的Sr对虹鳟(Oncorhynchusmykiss)从胚胎发育到孵化后第3 d早期生命阶段的影响,在Sr浓度49 mg/L的水平下可导致虹鳟仔稚鱼10%的畸形率和死亡率.Pyle等[36]证实了水中的Sr与卵孵化率降低具有显著相关性,但与幼苗的生长和死亡率没有相关性.
宋鸿建等[37]对大麻哈鱼的研究发现,Sr浓度为10mg/L时大麻哈鱼的各生长指标和存活率最高,说明此浓度对大麻哈鱼的生长有促进作用,但是随着Sr浓度的增加,大麻哈鱼稚鱼的存活率出现降低的现象,推测较高浓度的Sr抑制稚鱼的生长.建议在对大麻哈鱼稚鱼长期的暴露实验中Sr的安全质量浓度应控制在10 mg/L之内.王臣等在大麻哈鱼实验使用的Sr浓度为50 mg/L,耳石上形成50倍于正常值以上的Sr沉积高峰,产生极强的标记轮,实验鱼都能保持正常生长和摄食,浸染过程中也未产生明显的毒性反应,说明50~400 mg/L、48 h的浸染条件是安全的;同时发现高浓度的外源Sr可能影响了耳石元素的正常沉积[13].本研究所有被标记个体均未出现Sr、Ca沉积异常现象,并保持良好的正线性相关,同时养殖的结果也并未发现标记组的死亡率与对照组有显著差异.说明对于鳙的幼鱼而言,外源Sr浓度在16 mg/L以下并未产生任何影响.
Sr作为一种生物必须元素,急性毒性风险较小,利用Sr作为标记物其安全性是非常高的.国际上尚未颁布Sr的水质标准,美国和加拿大一些州省采用40(短期)和21 mg/L(长期)标准用于保护淡水生物[38-39].美国环境保护局(EPA)规定公共饮用水的稳定Sr的浓度上限为4 mg/L[40].我国国家标准规定:Sr浓度大于0.2 mg/L为锶矿泉水,其限量指标为小于5 mg/L.因此,综合考虑水质安全以及标记效果,对于鳙而言,4 mg/L的外源Sr标记浓度既能达到显著的标记效果,又能在安全的饮用水范围内,因此为最佳的标记浓度.
4 结论
本研究首次对淡水鱼类鳙的幼鱼进行了外源Sr标记的研究,探讨相关的标记浓度和浸染持续时间.从操作性角度考虑,鳙等鲤科鱼类微耳石较大易于摘取,Sr和Ca等元素以类质同象的方式沉淀在耳石晶格内部空位和晶格间隙中,且日轮轮纹较易观察,因此,首选以沉积率较大的微耳石进行元素微化学分析的材料.利用EPMA技术检测耳石中Sr元素的沉积虽具有一定的时滞效应,但由于浓度较高而稳定,日间变化趋势明显,Sr/Ca比值非常稳定,明显的标记效果可以较好地指示栖息地水环境状况.耳石Sr标记可在同一环境下的鱼类进行大批量标记,成本低,对鱼无伤害,安全性好,不存在标志丢失问题,而且还能确保鱼类成活率和水产品质量安全.上述分析表明外源Sr标记在淡水鱼类的放流群体识别上具有很高的可行性.
根据实验结果和Sr标记安全限量分析,建立鳙的幼鱼群体标记技术体系:对放流前育苗场幼鱼进行外源Sr标记,以4mg/L为外源Sr的最适浸染浓度,以28 d作为标记持续时间,利用电子显微探针技术(EPMA)分析随机取样个体耳石上的Sr和Sr/Ca比值,可以准确识别放流个体和开展后续的放流效果评价.
[1] Miller JA,Bellinger MR,Golden JT etal.Integration of natural and artificialmarkers in amixed stock analysisof Chinook salmon(Oncorhynchus tshawytscha).Fisheries Research,2010,102:152-159.
[2] Koljonen ML,Pella JJ,Mesuda M.Classical individual assignments versusmixturemodeling to estimate stock proportions in Atlantic salmon(Salmo salar)catches from DNA microsatellite data.Canadian Journal of Fisheires and Aquatic Sciences,2005,62(9):2143-2158.
[3] Liu Wei,Zhan Peirong,Wang Jilong etal.Stucture of otoliths daily growth ring of embryo chum salmon and environmental massmarking.Acta Hydrobiologica Sinica,2013,37(5):929-937.[刘伟,战培荣,王继隆等.大麻哈鱼胚胎耳石微结构及其群体环境标记.水生生物学报,2013,37(5):929-937.]
[4] Dou Shuozeng,Yokouchi Kazuki,Yu Xin et al.Reconstructingmigratory history of fish using otolith strontium:calciums ratios EMPA:A case study.Oceanologia et Limnologia Sinica,2011,42(4):512-520.[窦硕增,横内一樹,于鑫等.基于EPMA的耳石Sr:Ca比分析及其在鱼类生活履历反演中的应用实例研究.海洋与湖沼,2011,42(4):512-520.]
[5] Yang J,Arai T,Liu H et al.Environmental signature in the otolith elemental ingerprint of the tapertail anchovy,Coilia mystus,from the Changjiang estuary,China.Journal of Applied Ichthyology,2006,22(5):459-462.
[6] Dou Shuozeng.An introduction to fish otolith research techniques and applications.Studia Marina Sinica,2007,48:93-113.[窦硕增.鱼类的耳石信息分析及生活史重建——理论、方法与应用.海洋科学集刊,2007,48:93-113.]
[7] Townsend D,Radtke R,Morrison M et al.Recruitment implications of larval herring overwintering distribution in the gulf ofmaine,inferred using a new otolith technique.Marine Ecology Progress Series,1989,55:1-13.
[8] Secor D,Jay R,Rooker E etal.Identification of riverine,estuarine,and coastal contingents of Hudson River stripedbass based upon otolith elemental fingerprints.Marine Ecology Progress Series,2001,211:245-253.
[9] Melancon S,Fryer BJ,Markham JL.Chemical analysis of endolymph and the growing otolith:Fractionation ofmetals in freshwater fish species.Environ Toxicol Chem,2009,28(6):1279-1287.
[10] Collingsworth PD,Van Tassel JJ,Olesik JW et al.Effects of temperature and elemental concentration on the chemical composition of juvenile yellow perch(Perca flavescens)otoliths.Canadian Journal ofFisheiresand Aquatic Sciences,2010,67(7):1187-1196.
[11] Pollard MJ,Kingsford MJ,Battaglene SC.Chemicalmarking of juvenile snapper,Pagrusauratus(Sparidae),by incorporation of strontium into dorsal spines.Fishery Bulletin,1999,97(1):118-131.
[12] Schroder SL,Volk EC,Hagen P.Marking salmonidswith strontium chloride at various life history stages.NPAFC Technical Report,2001,(3):9-10.
[13] Wang Chen,Liu Wei,Zhan Peirong etal.Exogenous Sr2+sedimentation on otolith of chum salmon embryos.Chinese Journal ofApplied Ecology,2015,10:3189-3194.[王臣,刘伟,战培荣等.外源Sr2+在大麻哈鱼胚胎耳石上的沉积.应用生态学报,2015,10:3189-3194.]
[14] Liu Jiankang,Xie Ping.Direct control of Microcystis bloom through the use of Planktivorous Carp—Closure experiments and lake fishery practice.Ecologic Science,2003,22(3):193-198.[刘建康,谢平.用鲢鳙直接控制微囊藻水华的围隔试验和湖泊实践.生态科学,2003,22(3):193-198.]
[15] Ke Zhixin,Xie Ping,Guo Longgen et al.The growth characters of Hypophthalmichthysmolitrix and Aristichthys nobilis in large fish pens in the Meiliang Bay of Lake Taihu.Journal ofHydroecology,2011,(5):13-18.[柯志新,谢平,过龙根等.太湖梅梁湾大型生态控藻围栏内鲢鳙的生长特征.水生态学杂志,2011,(5):13-18.]
[16] Yang J,Arai T,Liu H etal.Reconstructing habitatuse of Coiliamystus and Coilia nasus of the Yangtza River estuary,and of Coilia nasus of Taihu Lake,based on otolith strontium and calcium.Journal ofFish Biology,2006,69(4):1120-1135.[17] Yang Jian,Liu Hongbo.Otolith microchemistry of greymullet Mugil cephalus from Chongming water in the Yangtze River estuary.Journal of Fisheries ofChina,2010,17:853-858.[杨健,刘洪波.长江口崇明水域鲻鱼耳石元素微化学分析.中国水产科学,2010,17:853-858.]
[18] Campana SE.Chemistry and composition of fish otoliths:Pathways,mechanisms and applications.Mar Ecol Prog Ser,1999,188:263-297.
[19] Miller JA.Effects ofwater temperature and barium concentration on otolith composition along a salinity gradient:Implications formigratory reconstructions.JExp Mar Biol Ecol,2011,405(1):42-52.
[20] Nagaya Y,Nakamura K,SaikiM.Strontium concentrations and strontium-chlorinity ratios in seawater of the North Pacific and the adjacent seas of Japan.Journal of the Oceanographical Society of Japan,1971,27(1):20-26.
[21] Shi Ben'an,Liang Xiaocong.Leveland distribution of strontium in thewater course of the Yellow River drainage.JEnviron Health,1996,13:63-64.[石本安,梁晓聪.黄河水系水体中锶的水平及分布.环境与健康杂志,1996,13:63-64.]
[22] Zhao Jichang,Geng Dongqing,Peng Jianhua etal.Origin ofmajor elements and Sr isotope for riverwater in Yangtze River source area.Hydrogeol Eng Geol,2003,30(2):89-93,98.[赵继昌,耿冬青,彭建华等.长江河源区的河水主要元素与Sr同位素来源.水文地质工程地质,2003,30(2):89-93,98.]
[23] Wang Bing,Li Xinqing,Yuan Honglin etal.Study on Sr geochemistry of surfacewaters inmid-eastern China.Earth Environ,2009,37(1):42-49.[王兵,李心清,袁洪林等.中国中东部地区地表水环境锶元素地球化学特征研究.地球与环境,2009,37(1):42-49.]
[24] DE Villiers S.Stephanie de seawater strontium and Sr/Ca variability in the Atlantic and Pacific oceans.Earth Planet Sci Lett,1999,171(4):623-634.
[25] Yang J,Jiang T,Liu H.Are there habitat salinitymarkersof the Sr:Ca ratio in the otolith ofwild diadromous fishes?A literature survey.Ichthyol Res,2011,58(3):291-294.
[26] Brown RJ,Severin KP.Otolith chemistry analyses indicate thatwater Sr:Ca is the primary factor influencing otolith Sr:Ca for freshwater and diadromous fish but not formarine fish.Canadian Journal of Fisheires and Aquatic Sciences,2009,66(10):1790-1808.
[27] Milton DA,Chenery SR.Sources and uptake of tracemetals in otoliths of juvenile barramundi(Lates calcarifer).Journal of Experimental Marine Biology and Ecology,2001,264(1):47-65.
[28] Guo Hongyi,Zhang Ya,TangWenqiao et al.Analysis of otolith microchemistry and screening of environmental indicator elements in early life history of Japanese eel.Journal of Fisheries ofChina,2015,39(10):1467-1478.[郭弘艺,张亚,唐文乔.日本鳗鲡幼体的耳石微化学分析及其环境指示元素筛选.水产学报,2015,39(10):1467-1478.]
[29] Zhang Ya.Study on pigmentation developmental stages andmorphological characteristics and otolithmicrochemistry of Japanese eels larvae,Anguilla japonica,collected in Yangtze River estuary[Dissertation].Shanghai:ShanghaiOcean University,2013.[张亚.长江口日本鳗鲡幼体的发育时相、形态特征和耳石化学研究[学位论文].上海:上海海洋大学,2013.]
[30] Yokouchi K,Fukuda N,Shirai K et al.Time lag of the response on the otolith strontium/calcium ratios of the Japanese eel,Anguilla japonica to changes instrontium/calcium ratios of ambientwater.Environmental Biology of Fishes,2011,92(4):469-478.
[31] Dahl SG,Allain P,Marie PJ et al.Incorporation and distribution of strontium in bone.Bone,2001,28(4):446-453.
[32] Buehler J,Chappuis P,Saffar JL et al.Strontium ranelate inhibits bone resorption while maintaining bone formation in alveolar bone in monkeys(Macaca fascicularis).Bone,2001,29(2):176-179.
[33] Caverzasio J.Strontium ranelate promotes osteoblastic cell replication through at least two differentmechanisms.Bone,2008,42(6):1131-1136.
[34] Chowdhury MJ,Blust R.Bioavailability ofwaterborne strontium to the common carp,Cyprinus carpio,in complexing environments.Aquatic Toxicology,2002,58(3/4):215-227.
[35] Birge WJ,Black JA,Ramey BA.The reproductive toxicology of aquatic contaminants.In:Saxena J,Fisher F eds.Hazard assessment of chemicals:Current developments.New York:Academic Press,1981:59-115.
[36] Pyle GG,Swanson SM,Lehmkuhl DM.Toxicity of uranium mine receiving waters to early life stage fathead minnows(Pimephales promelas)in the laborator.Environ Pollut,2002,116(2):243-255.
[37] Song Hongjian,Liu Wei,Wang Jilong et al.Effects of strontium ion on growth and ATPase activity in muscle of Chum Salmon(Oncorhynchus keta)Juvenile.Chinese Journal ofFisheries,2013,26(4):23-28.[宋洪建,刘伟,王继隆等.锶对大麻哈鱼稚鱼生长发育及肌肉ATP酶活性的影响.水产学杂志,2013,26(4):23-28.]
[38] MDEQ.Rule 57Water Quality Values.Surface Water Quality Assessment Section,Michigan Departmentof Environmental Quality,2008-12-10.
[39] OHIO EPA.Lake Erie Basin Aquatic Life and Human Health Tier ICriteria,Tier IIValues and Screening Values(SV). Chapter 3745-1 of the Ohio Administrative Code.Division of SurfaceWater,Ohio Environmental Protection Agency,2009.
[40] ATSDR.Toxicological Profile for Strontium.Atlanta:Agency for Toxic Substances and Disease Registry,USDepartment of Health and Human Services,2004.
Feasibility analysis of releasing individuals of Aristichthys nobilis identification based on otolith Srmarkers
LIXiuqi1,CONG Xuri1,SHIJihua1,GAO Yunfang1,JIANG Tao2&YANG Jian2
(1:Shandong Freshwater Fisheries Research Institute,Shandong Provincial Key Laboratory ofFreshwater Aquaculture Genetic Breeding,Jinan 250013,P.R.China)
(2:Key Laboratory ofEcological Environmentand Resources of Inland Fisheries,Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Wuxi 214081,P.R.China)
To explore the method of microchemistry marking on the otolith of Aristichthys nobilis,the 1-year-old juveniles were reared at five different concentrations(1,2,4,8,16mg/L)for 28 days,and the exogenous Sr sedimentation in otolithswere detected with electron probemicroanalyzer(EPMA).Themapping analysis showed thatobvious strontium signatures in the edge of otoliths of juvenileswere produced at different concentrations of Sr.The yellow-green strontium bandappeared in low level,the deep red zone shown as the concentration gradually increased.Line analysis indicated that the Sr/Ca ratio of control group was stable at 2.14±0.39,butwhich in the experimental groups of the different concentrations all appeared quite dramatically peak strontium value(5.04-32.32).Significant linear relationship was found between exogenous Sr and the Sr/Ca ratio in the edge of otoliths.There was also no significant difference in death rate between control and experimentalgroups.Allof these suggested that themethod of Sr marking confirmed the feasibility in recognizing the releasing individuals of A.nobilis.We suggest thatstock discrimination of A.nobilis weremarked in larval and juvenile and the concentration of exogenous Sr should be 4 mg/L,lasting formore than 28 days.
Aristichthys nobilis;otolith;strontium marking;electron probemicroanalyzer;stock mark
DOI 10.18307/2017.0415
©2017 by Journal of Lake Sciences
∗公益性行业(农业)科研专项经费(201303050)和山东省2016年度农业重大应用技术创新课题联合资助.2016-06-07收稿;2016-09-27收修改稿.李秀启(1968~),男,博士,副研究员;E-mail:xiuqili@sina.cn.

