工艺优化及化学组成分析
祖亿,赵茂臻,王鹏,王明霞,杨宗韫,谢凤英,徐速
(东北农业大学食品学院,黑龙江哈尔滨150030)
工艺优化及化学组成分析
祖亿,赵茂臻,王鹏,王明霞,杨宗韫,*谢凤英,徐速
(东北农业大学食品学院,黑龙江哈尔滨150030)
为了研究燕麦中多酚化合物的提取工艺及其化学组成,以超声波处理为辅助手段,以多酚提取量为试验指标,通过单因素试验和正交试验对提取温度、提取时间、料液比和乙醇体积分数进行优化,并利用高效液相-电喷雾质谱法对所获得的燕麦多酚化学组成进行分析。试验结果表明,超声辅助处理(超声功率180 W,超声时间20 min)燕麦多酚提取最佳工艺条件为乙醇体积分数70%,料液比1∶11,提取时间4.5 h,提取温度40℃;在此条件下,燕麦多酚提取量为183.12 mg/100 g。通过高效液相-电喷雾质谱法检测分析,确定燕麦中多酚化合物以结合态形式存在,主要为N-3',4'-二羟基肉桂酰-5-羟基邻氨基苯甲酸、燕麦蒽酰胺及其衍生物、二烯酸与二十六烷-1-醇、26-羟基二十六烷酸和28-羟基二十八烷酸组成的酚酸酯化物。
燕麦;多酚;提取;高效液相-电喷雾质谱法
The extraction technology and chemical composition of polyphenols from oats are studied.Ultrasonic treatments are supplementary means,polyphenol compounds are regarded as the index.The influences of extraction temperature,extraction time,ratio of rawmaterial and liquid,ethanol concentration on extraction efficiency are investigated by single factor experiment,and the extraction parameters of polyphenol are optimized by orthogonal experiment.The results showthat the optimum extraction conditions for ultrasonic assisted treatment(treatment power 180 W,treatment time 20 min)are:ethanol volumeter is 70%,the ratio of raw material and liquid is 1∶11,extraction time 4.5 h,extraction temperature 40℃,under this condition,the yield of polyphenol compounds from oats are 183.12 mg/100 g.The polyphenol compounds are separated and identified by high performance liquid chromatography-electrospray ionization mass spectrometry,determined the presence form of polyphenol compounds in oats is combined form,mainly for phenolic acids ester compounds composed by N-3',4'-two hydroxy cinnamoyl-5-hydroxy anthranilic acid,avenanthramides acid and its derivatives,two and twenty-six-1-alkyl alcohol,phenolic acid esterification of twenty-eight alkyl acid 26-twenty-six hydroxy alkanoic acids and 28-twenty-eight hydroxy alkanoic acids. Key words:oats;polyphenol;extraction;high performance liquid chromatography-electrospray ionization mass spectrometry
1 材料与方法
1.1 材料与仪器
燕麦,黑龙江牡丹江市深森山珍食品有限公司提供。
福林酚试剂,Sigma公司提供;甲醇和乙腈为色谱纯,德国Merck公司提供;没食子酸,天津市光复精细化工研究所提供;碳酸钠、无水乙醇、乙酸,均为国产分析纯。
FA2004型电子天平,上海衡平仪器仪表厂产品;DF-101S型集热式磁力加热搅拌器,金坛市医疗仪器厂产品;SC-3614型离心机,郑州明天仪器设备有限公司产品;UV-18型紫外可见分光光度计,天津市普瑞斯仪器有限公司产品;R-1005型旋转蒸发仪,郑州长城科工贸有限公司产品;Agilent1200型高效液相色谱-离子阱质谱仪,美国Agilent公司产品。
1.2 试验方法
1.2.1 燕麦多酚的提取
准确称取10.0 g燕麦超微粉于烧杯中,按试验设计加入100 mL乙醇溶液,密封条件下于超声清洗仪(超声功率180 W)中处理20 min后在指定的温度和时间下进行浸提、离心,取上清液,旋转蒸发浓缩至25 mL,即为燕麦多酚提取液。
1.2.2 多酚含量的测定
以没食子酸为标准品,采用Folin-ciocalteu法[9]进行燕麦多酚含量测定,其标准曲线为A=0.011 9X+ 0.005 6,相关系数R2=0.999 1。
1.2.3 燕麦多酚提取试验设计
(1)单因素试验。以多酚提取量为指标,考查提取温度、提取时间、料液比和乙醇体积分数对燕麦多酚提取效果的影响。
(2)正交试验。根据单因素试验结果,按L9(34)因素水平表排列顺序进行燕麦多酚提取正交试验。
燕麦多酚提取因素水平见表1。
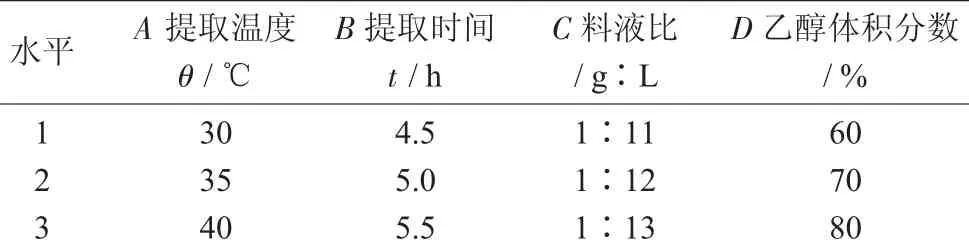
表1 燕麦多酚提取因素水平
1.2.4 液-质联用(HPLC-MS)测定方法
燕麦多酚组成采用HPLC-ESI-Q-TOF-MS进行分析。所用试剂过0.45 μm滤膜,岛津C18型色谱柱(250 mm×4.6 mm,5 μm),柱温30℃,检测波长280 nm;采用以下溶剂体系进行洗脱:流动相A为乙腈,B相为2%乙酸水溶液;所用的梯度洗脱程序为0~30 min 100%A,30~35 min 40%A,35~42 min 1%A;整个梯度中流速1 mL/min。质谱参数设定:毛细管电压3.0 kV,干燥气(N2)温度350℃,流速9.0 L/min,正离子模式,光谱测定范围100~2 000 m/z。
1.2.5 统计分析
每组试验都进行3次平行试验,并将试验数据进行误差分析;采用统计学软件Spass 18对试验数据进行显著性分析。
2 结果与分析
2.1 燕麦多酚提取工艺优化
2.1.1 提取温度对燕麦多酚提取量的影响
在提取时间5 h,料液比1∶10,乙醇体积分数70%时,研究提取温度25,35,45,55,65℃对燕麦多酚提取量的影响。
提取温度对燕麦多酚提取量的影响见图1。
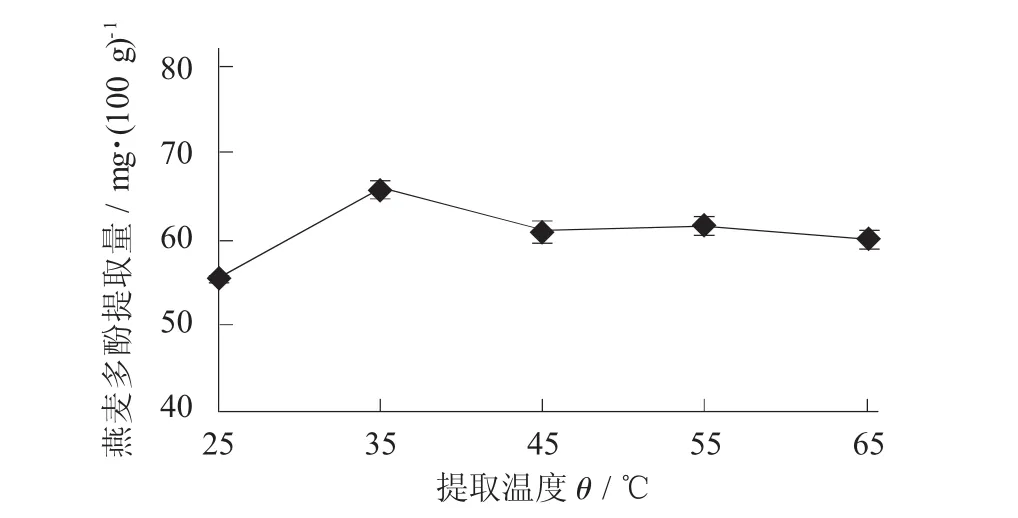
图1 提取温度对燕麦多酚提取量的影响
通常来说,当提取温度升高时植物组织会因吸水膨胀而增加可溶性物质溶解和扩散速度,促使有效成分溶出速度加快[10]。但是在图1中,当提取温度大于40℃时,提取温度对燕麦多酚提取量的影响却不显著(p>0.05);随着提取温度的升高,燕麦多酚提取量呈现先增加后逐渐趋于平稳的趋势。其原因可能与燕麦中多酚物质存在形式有关,当提取温度升高时,提取燕麦中自由酚会由于分子热运动溶出速度加快,但温度的改变对结合酚溶出率不会有太大影响。因此,选取35℃为燕麦多酚提取的提取温度。
2.1.2 提取时间对燕麦多酚提取量的影响
在提取温度35℃,料液比1∶10,乙醇体积分数70%时,研究提取时间3,4,5,6,7 h对燕麦多酚提取量的影响。
提取时间对燕麦多酚提取量的影响见图2。
多酚物质的抗氧化活性是提取条件选择必须考虑的因素之一。若提取条件导致多酚结构中羟基基团构型发生改变,其抗氧化活性也会随之降低[11-12]。因此,在兼顾增加多酚提取量的条件下,试验选择低温长时的提取方式。从图2可以看出,提取时间对燕麦多酚提取量具有极显著性影响(p<0.01)。提取时间的延长,燕麦多酚提取量由3 h时30.86 mg/100 g增加至最高值84.75 mg/100 g;其后,随着提取时间的延长,燕麦多酚提取量有所下降。因此,选取5 h为燕麦多酚提取的提取时间。
2.1.3 料液比对燕麦多酚提取量的影响
在提取温度35℃,提取时间5 h,乙醇体积分数70%时,研究料液比1∶5,1∶8,1∶10,1∶12,1∶15对燕麦多酚提取量的影响。
料液比对燕麦多酚提取量的影响见图3。
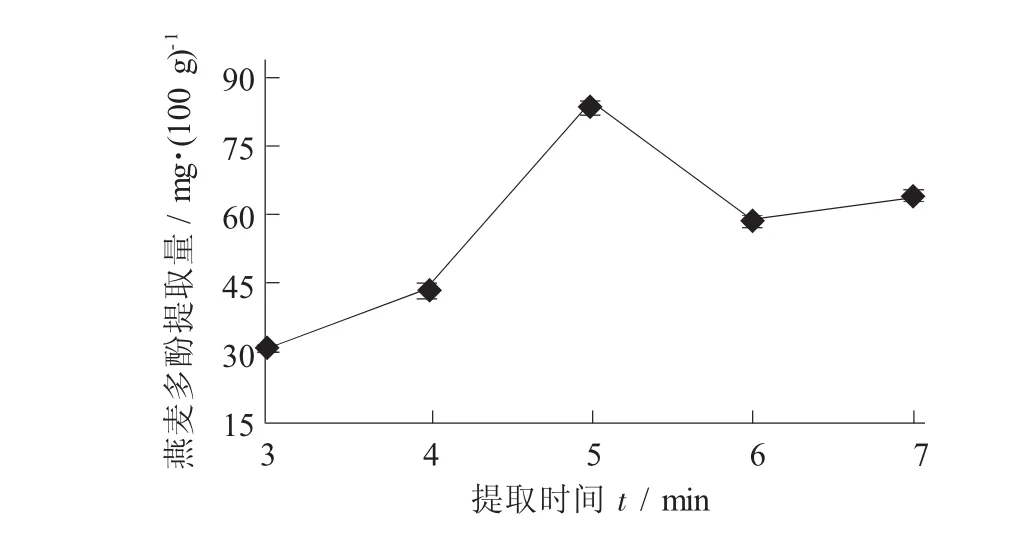
图2 提取时间对燕麦多酚提取量的影响
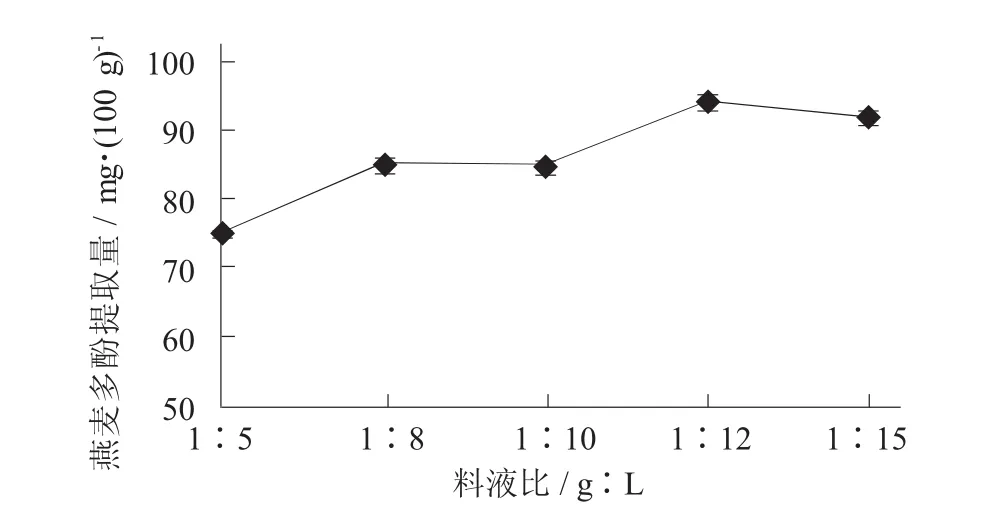
图3 料液比对燕麦多酚提取量的影响
由图3可知,随着料液比的增加,燕麦多酚提取量由74.9 mg/100 g(料液比1∶5)增加至94.20 mg/100 g(料液比1∶12),此后料液比对燕麦多酚提取量影响不显著(p>0.05),燕麦多酚提取量趋于平稳。因此,燕麦多酚提取的料液比选取1∶12为宜。
2.1.4 乙醇体积分数对燕麦多酚提取量的影响
在提取温度35℃,提取时间5 h,料液比1∶10时,研究乙醇体积分数10%,30%,50%,70%,90%对燕麦多酚提取量的影响。
乙醇体积分数对燕麦多酚提取量的影响见图4。
提取溶剂的极性会随着乙醇体积分数升高而有所降低,进而促使燕麦中极性相似物质溶出。在大多数学者的研究中,有机溶剂和水的复合体系最适合多酚化合物提取的有机溶剂含量范围50%~70%,图4中燕麦多酚溶出曲线也证明了这一点。由图4可以看出,乙醇体积分数对燕麦多酚提取量具有极显著性影响(p<0.01)。随着乙醇体积分数的升高,燕麦多酚在达到最高值117.73 mg/100 g后其提取量有所下降。因此,选取70%为燕麦多酚提取的乙醇体积分数。
2.1.5 正交试验
根据单因素试验结果,选取提取温度(A)、提取时间(B)、料液比(C)、乙醇体积分数(D)为试验因素,每个因素3个水平,以燕麦多酚提取量为指标,对燕麦多酚化合物提取进行条件优化。
燕麦多酚提取正交试验结果与分析见表2。
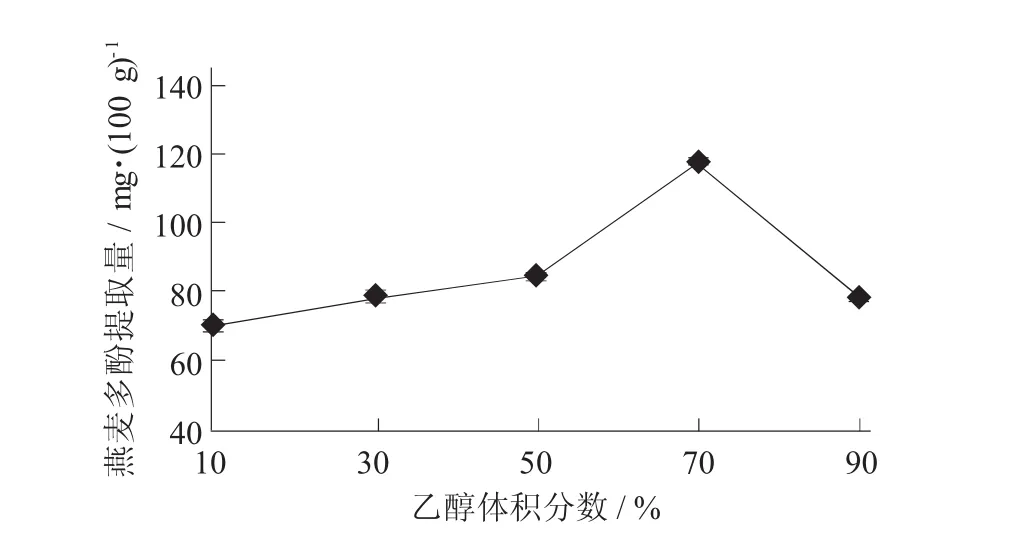
图4 乙醇体积分数对燕麦多酚提取量的影响
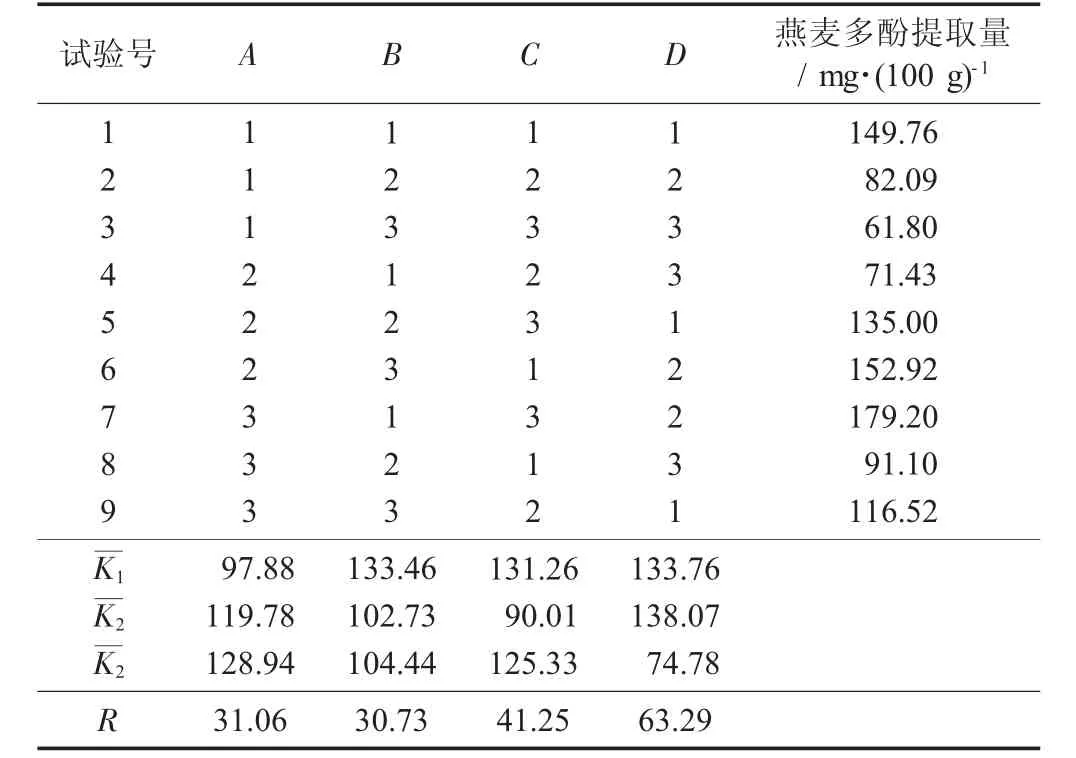
表2 燕麦多酚提取正交试验结果与分析
由表2中极差分析可知,各试验因素对燕麦多酚提取量的影响先后顺序为乙醇体积分数>料液比>提取时间>提取温度,最佳工艺条件组合为D2C1B1A3,即乙醇体积分数70%,料液比1∶11,提取时间4.5 h,提取温度40℃。在此工艺条件下进行验证试验,其燕麦多酚提取量为183.12 mg/100 g,表明超声波辅助燕麦多酚提取工艺可行。
2.2 燕麦多酚化合物组成分析
在正交试验最优条件下,对燕麦进行多酚提取后进行HPLC-EIS-MS分析。通过归一化法对色谱峰进行分析,可得到主要燕麦多酚组分相对含量的变化。
燕麦提取物的液相色谱分离见图5,燕麦粗粉和超声辅助处理粉主要多酚组分相对含量的变化见表3。
从表3中可以看出,超声辅助处理可以提高燕麦多酚的提取量,其提取量增幅为17.62%。将这一结果与Folin-ciocalteu法测定的燕麦多酚含量相比,其试验结果也是相符的。通过与相应文献[13-16]进行比较,确认了4种燕麦多酚化合物存在。
4种燕麦多酚化合物的质谱见图6。
由图6可知,组分1(保留时间为2.11min)色谱峰一级质谱中316.15 m/z碎片离子峰为N-3',4'-二羟基肉桂酰-5-羟基邻氨基苯甲酸特征峰,338.85 m/z和316.15 m/z 2个离子峰之间相差23,338.86 m/z应为316.82 m/z加钠形式,即338.86 m/z分子离子峰为N-3',4'-二羟基肉桂酰-5-羟基邻氨基苯甲酸钠盐;组分2(保留时间为2.53 min)色谱峰的一级质谱得到258.21 m/z分子离子峰应是分子式为C15H15NO3的燕麦蒽酰胺化合物;组分3(保留时间为2.74 min)色谱峰的一级质谱得到235.27 m/z和118.12 m/z 2个离子峰,其中碎片离子峰118.19 m/z为丁二酸,其分子式为HOOCCH2CH2COOH,当其与5-羟基邻氨基苯甲酸通过酰胺键连接环化脱去2个H2O后正好形成235.24 m/z这一分子峰。因此,235.24 m/z分子峰应为燕麦蒽酰胺的衍生物。
超声辅助处理粉中出现组分4,5,6,8由于未有相应文献报道,通过一级质谱图分子峰仅能判断其应为结合酚,但结构组成需进一步研究。组分7(保留时间为17.73 min)色谱峰的一级质谱得到792.94,679.86,114.01 m/z 3个离子峰。792.94 m/z与679.86 m/z离子峰之间相差113.08,而在碎片离子峰中确有114.01 m/z这一碎片离子峰存在,说明792.90 m/z这一分子峰是由二者组合而成。114.01 m/z这一碎片离子峰应是分子式为C6H9O2的二烯酸;参考相应相关资料,792.90 m/z分子离子峰应为二烯酸与二十六烷-1-醇、26-羟基二十六烷酸和28-羟基二十八烷酸组成酚酸酯化物。由此可见,超声辅助处理削弱了燕麦多酚与细胞壁结合作用力,促进了燕麦多酚溶出,进而增强了燕麦多酚的提取量。
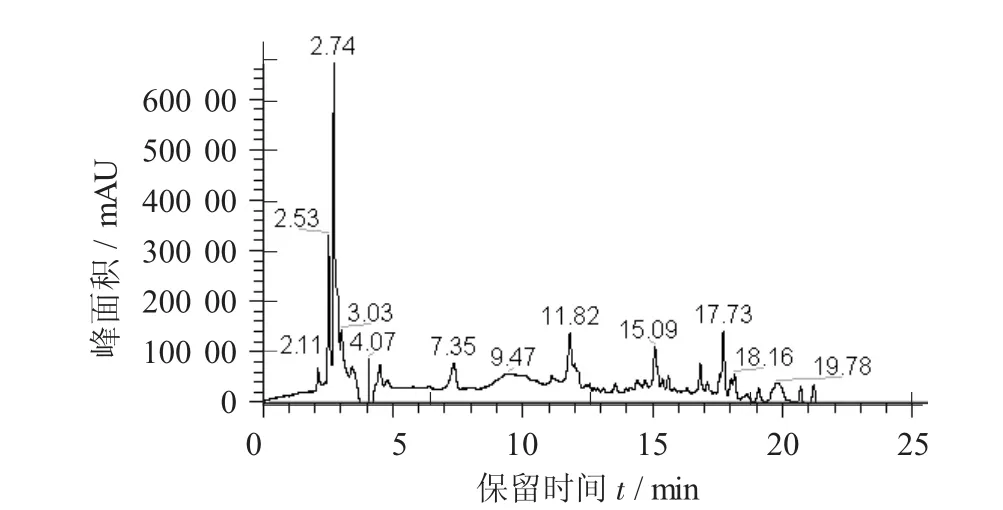
图5 燕麦提取物的液相色谱分离
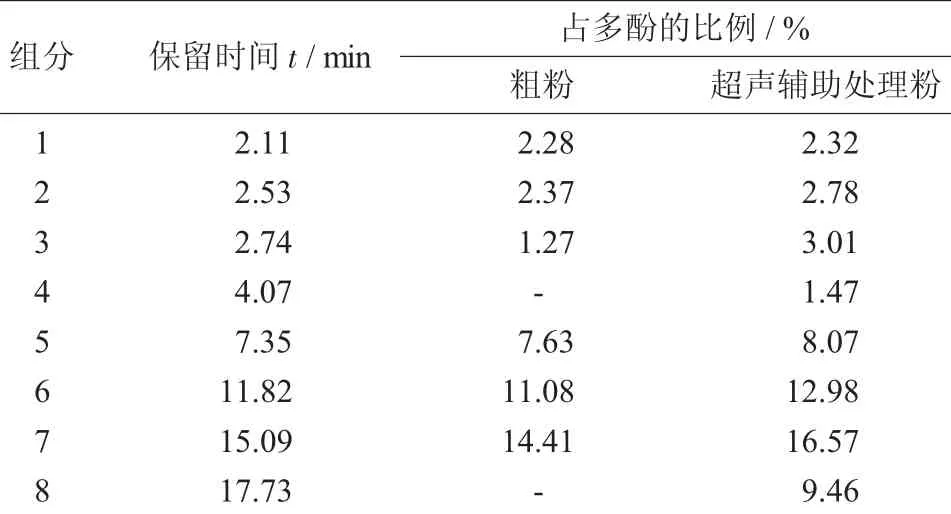
表3 燕麦粗粉和超声辅助处理粉主要多酚组分相对含量的变化
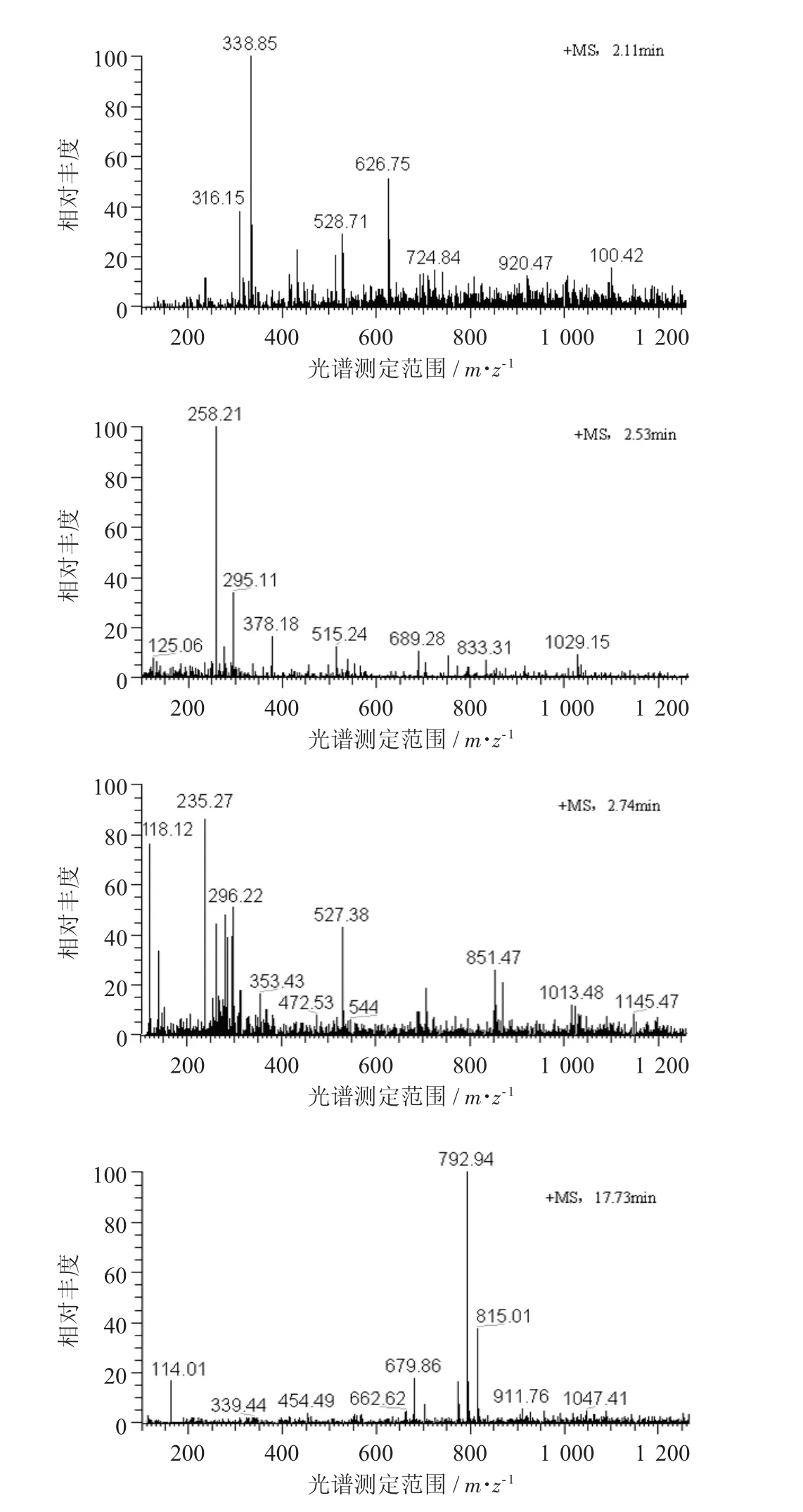
图64 种燕麦多酚化合物的质谱
3 结论
(1)超声辅助低温提取燕麦多酚的工艺条件为乙醇体积分数70%,料液比1∶11,提取时间4.5 h,提取温度40℃。在此工艺条件下,燕麦多酚提取量为183.12 mg/100 g。
(2)对燕麦粗粉和超声辅助处理粉多酚提取物进行HPLC-EIS-MS分析发现,超声辅助处理可提高燕麦多酚的提取量,其增量值为17.62%;并对燕麦多酚结构进行鉴定,确定N-3',4'-二羟基肉桂酰-5-羟基邻氨基苯甲酸、燕麦蒽酰胺及其衍生物、二烯酸与二十六烷-1-醇、26-羟基二十六烷酸和28-羟基二十八烷酸单酯等多酚物质的存在。
[1]Laura F,Xavier R,Marie-Hélène M,et al.Effects of laccase and xylanase on the chemical and rheological properties of oat and wheat doughs.[J].Journal of Agricultural &Food Chemistry,2008,56:5 732-5 742.
[2]Gujral H S,Sharma P,Rachna S.Effect of sand roasting on beta glucan extractability,physicochemical and antioxidant properties of oats[J].Lebensmittel Wissenschaftund Technologie,2011,44(10):2 223-2 230.
[3]Chu Y F,Wise M L,Gulvady A A,et al.In vitro,antioxidant capacity and anti-inflammatory activity of seven common oats[J].Food Chemistry,2013(S1-4):426-431.
[4]王燕,钟葵,林伟静,等.响应面法优化微波辅助提取燕麦多酚[J].中国食品学报,2012,12(11):69-76.
[5]任祎,任贵兴,马挺军,等.燕麦生物碱的提取及其抗氧化活性研究[J].农业工程学报,2008,24(5):265-269.
[6]Alrahmany R,Tsopmo A.Role of carbohydrases on the release of reducing sugar,total phenolics and on antioxidant properties of oat bran[J].Food Chemistry,2012(1):413-418.
[7]Cai S,Chen H,Ji B,et al.In vitro antioxidant activity and inhibitory effect,on oleic acid-induced hepatic steatosis,of fractions and subfractions from oat(Avena sativa L). ethanol extract[J].Food Chemistry,2011(3):900-905.
[8]徐元元,国旭丹,贺丽霞,等.常见6种杂粮与2种主粮的抗氧化活性比较研究[J].食品科学,2012,33(7):20-25.
[9]Walter M,Marchesan E,Massoni P F S,et al.Antioxidant properties of rice grains with light brown,red and black pericarp colors and the effect of processing[J].Food Research International,2013,50(2):698-703.
[10]李巨秀,李利霞,曾王旻,等.燕麦多酚化合物提取工艺及抗氧化活性的研究[J].中国食品学报,2010,10(5):14-21.
[11]付晓燕,吴茜,李书艺,等.燕麦发芽前后酚类物质的组成变化及结构鉴定[J].中国农业科学,2013,46(17):3 669-3 679.
[12]付晓燕,隋勇,谢笔钧,等.不同方法提取发芽燕麦酚类物质的含量、组成和抗氧化活性比较[J].食品工业科技,2014,35(15):54-57.
[13]Stefano V D,Avellone G,Bongiorno D,et al.Applications of liquid chromatography-mass spectrometry for food analysis[J].Journal of Chromatography A,2012(4):74-85.
[14]Dimberg L H.Isolation and identification of three possible avenanthramide from oats that increase during germination[D].Uppsala:Swedish University of Agricultural Sciences,2006.
[15]Daniels D G H,Martin H F.Antioxidants in oats:Monoesters of caffeic and ferulic acids[J].Journal of the Science of Food&Agriculture,1967(18):589-595.
[16]R Hitayezu,M M Baakdah,J Kinnin,et al.Antioxidant activity,avenanthramide and phenolic acid contents of oat milling fractions[J].Journal of Cereal Science,2015(7):35-40.◇
TQ914.1
A
10.16693/j.cnki.1671-9646(X).2017.06.009
2017-05-12
黑龙江省科技攻关项目(GC13B409)。
祖亿(1996—),女,在读本科,研究方向为粮食工程。
*通讯作者:谢凤英(1975—),女,博士,讲师,研究方向为粮食、油脂及植物蛋白质工程。采用HPLC-EIS-MS对燕麦多酚物质组成进行分析,以期为燕麦抗氧化成分的深入研究和安全、可靠的燕麦功能性食品开发提供理论依据。
Technique Optimization of Ultrasonic-assisted Extraction of Oat Polyphenols and Chemical Composition Analysis
ZU Yi,ZHAO Maozhen,WANG Peng,WANG Mingxia,YANG Zongyun,*XIE Fengying,XU Su
(College of Food,Northeast Agricultural University,Harbin,Heilongjiang 150030,China)
燕麦作为禾本科粮食作物之一,其不仅含有碳水化合物、蛋白质等营养成分,还含有木聚糖、β-葡聚糖、生育酚、多酚等生物活性物质[1-3]。燕麦中多酚物质主要以燕麦生物碱、黄酮类化合物和酚酸形式存在[4],其中燕麦生物碱为燕麦所特有的一类多酚化合物,主要存在于麸皮和糊粉层中,是由羟基肉桂酸及其衍生物通过酰胺键(-HNCO-)与邻氨基苯甲酸及其衍生物连接而形成燕麦蒽酰胺类化合物。燕麦中黄酮类化合物较少,但阿魏酸、香草酸等酚酸类物质含量较高。由于酚酸类物质多以可溶性酯或与蛋白质、糖等大分子结合所形成的复合物形式存在,因此常规的热水和有机溶剂提取,燕麦多酚提取量均较低[5-7]。虽采用酸或碱试剂处理能增加多酚物质溶出,但提取条件若控制不当,会由于多酚结构改变而使燕麦多酚抗氧化能力有所下降[8]。因此,试验以黑龙江省产的燕麦为研究对象,首次尝试利用超声波产生的空穴作用,促使与细胞壁相连的酚酸类物质溶出,以提高燕麦多酚提取量。同时,

