磺胺氯吡嗪钠复方对小鼠体内抗弓形虫疗效的观察
程军霞,蒋 蔚,陈永军,薛俊欣,韩阳瑞,王 权
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海200241)
·研究论文·
磺胺氯吡嗪钠复方对小鼠体内抗弓形虫疗效的观察
程军霞,蒋 蔚,陈永军,薛俊欣,韩阳瑞,王 权
(中国农业科学院上海兽医研究所 农业部动物寄生虫学重点开放实验室,上海200241)
为进一步挖掘磺胺氯吡嗪钠的抗弓形虫疗效,本研究以磺胺嘧啶钠作为对照,观察磺胺氯吡嗪钠(sulfachloropyrazine sodium,SPZ)、黄芩苷、乳酸TMP、乙胺嘧啶和甘草单独使用时的体内外抗弓形虫效果,然后以SPZ-甘草-黄芩苷3种药物的复方制剂作为复方对照组,用叶酸合成双抑制的SPZ-乳酸TMP/乙胺嘧啶复方制剂对人工感染弓形虫RH株的KM小鼠进行体内治疗试验。体外试验表明,这6种药物均可较好地抑制弓形虫增殖;小鼠体内试验表明,单独使用SPZ(250 mg/kg、200 mg/kg)可保护部分小鼠存活(存活率分别为50%和25%),其他5种药物可不同程度地延长小鼠存活时间,但均不能避免小鼠死亡。在复方给药组(SPZ浓度为200 mg/kg),使用SPZ-乳酸TMP/乙胺嘧啶无明显的协同作用,使用SPZ-甘草-黄芩苷时疗效得到明显提高(小鼠存活率达到40%)。结果启示SPZ特别的治疗效果除了与其具有的通过干扰虫体叶酸代谢来抑制虫体繁殖的作用有关外,可能还与其他机制(如药物作用影响弓形虫调节宿主的免疫功能)有关。
弓形虫病;磺胺氯吡嗪钠;体内试验;体外试验;协同作用
弓形虫是一种呈世界性分布的专性细胞内寄生原虫[1],在人畜和野生动物之间广泛传播,对人类健康和畜牧业生产构成严重威胁。目前治疗弓形虫病的药物主要有磺胺嘧啶、磺胺二甲嘧啶、磺胺二甲氧嘧啶和磺胺间六甲氧嘧啶等[2],它们的毒副反应发生率相对较高,并且只能抑制增殖状态的速殖子,不能根治弓形虫病,停药后复发率较高,不能治愈严重的弓形虫病[3]。因此寻求高效低毒的抗弓形虫药物已成为当前临床与防治工作的迫切需要[4]。
本实验室前期研究发现,在甲氧苄氨嘧啶、磺胺氯吡嗪钠(sulfachloropyrazine sodium,SPZ)、硝唑尼特、巴龙霉素、磺胺嘧啶钠(sulfadiazine sodium,SDZ)、AC3和盐酸氯苯胍等[5]几十种广泛用于治疗畜禽寄生虫病的药物和一些中药里,SPZ抗弓形虫疗效最佳,最高能保护60%感染小鼠免于发病死亡,并能长期存活。联合用药既可以减少单一药物用量从而减少毒副作用,又可以通过药物的协同作用提高对弓形虫病的治疗效果,因此本研究选取磺胺氯吡嗪钠-乳酸TMP/乙胺嘧啶的复方药剂对人工感染弓形虫的小鼠进行体内治疗试验,并与SPZ单独使用、SPZ-黄芩苷-甘草复配使用的药效进行比较,以期进一步探明提高SPZ抗弓形虫疗效的可能性途径。
1 材料和方法
1.1 药物和试剂 磺胺氯吡嗪钠(含量99.97%)和磺胺嘧啶钠(99.53%)购自上海宝山振宗生物工程厂;黄芩苷(baicalin,含量98%)和甘草(glycyrrhizae,含量98%)购自南京替斯艾么中药研究所;乙胺嘧啶(pyrimethamine,含量99%)购自上海将来实业有限公司;乳酸TMP(lactate TMP,含量99%)购自武汉大华伟业医药化工有限公司;四甲基偶氮唑盐(methylthiazolyl tetrazoliam,MTT)购自Sigma公司;二甲基亚砜(DMSO)购自国药集团化学试剂有限公司;胎牛血清(FBS)和DMEM购自Gibco公司。5 mg/ mL MTT溶液配制:称取50 mg MTT,溶于10 mL DMEM溶液中。黄芩苷使用前用含1%DMSO和10% FBS的DMEM培养基溶解,其他药物使用前用少量生理盐水溶解,再用10%FBS的DMEM培养基稀释至适当浓度,用0.22 μm微孔滤膜过滤除菌后分装,4℃保存备用。
1.2 小鼠 KM系雌性小白鼠购自上海斯莱克实验动物有限公司,体重19~25 g,清洁级。
1.3 弓形虫虫株的复苏和增殖 弓形虫RH株由上海兽医研究所寄生虫实验室保存,试验前经小鼠腹腔传代2~3次,取腹水中虫体用生理盐水重悬并稀释至5×105个/mL,用于药物体内外抗弓形虫试验。
1.4 Vero细胞 Vero细胞由上海兽医研究所人畜共患病研究室保存。细胞培养于含有10%FBS的DMEM培养基,于37℃、5%CO2培养箱中培养。试验前用胰酶消化后用吸管吹打使之脱瓶壁,离心收集后,将细胞数量调整为5×104~1×105个/mL,待用。
1.5 细胞毒性试验 采用MTT法,设立空白对照组(不加Vero细胞和药物)、试验对照组(只加Vero细胞)和试验组(加Vero细胞和药物)。取96孔板,按2×104个/孔加Vero细胞悬液100 μL,37℃、5% CO2培养箱中培养24 h;弃上清,SPZ、SDZ、乙胺嘧啶、乳酸TMP、黄芩苷和甘草各设8个浓度梯度:3.2、1.6、0.8、0.4、0.2、0.1、0.05、0.025 mg/mL,每孔分别加入不同浓度的药物100 μL,每个浓度设3个平行;培养20 h后,每孔加5 mg/mLMTT工作液20 μL,继续培养4 h;取出培养板,吸弃培养上清,每孔加入200 μL二甲基亚砜,振荡混匀,0.5 h后,用酶标仪在波长490 nm测出各孔的OD值;计算重复孔的平均值以及增殖率:增殖率=(OD试验组-OD空白对照组)÷(OD试验对照组-OD空白对照组)×100%。以Vero细胞增殖率大于或等于90%的药物浓度为安全浓度。
1.6 体外抗弓形虫试验 取24孔细胞培养板,每孔加含5×104个Vero细胞的培养基悬液400 μL,37℃、5%CO2培养24 h后,每孔加含弓形虫速殖子4×105个的DMEM完全培养基100 μL,继续培养24 h,然后加入含药物的DMEM完全培养基500 μL,每种药物在最大安全浓度以内设置4个梯度浓度,每个浓度设3个平行孔,同时将不加药物孔设为对照孔。观察加药后4、8、12、24、36、48 h细胞生长状态,确定最佳观察时间并初步判定药物效果。在最佳观察时间内判定各组药物抑制弓形虫增值的效果。用显微镜观察每孔10个视野,每个视野观察200个细胞,计数感染细胞数并取平均值,计算相对抑制率:相对抑制率=(对照孔平均感染数-试验孔平均感染数)÷对照孔平均感染数×100%。
1.7 体内抗弓形虫试验
1.7.1 药物小鼠体内安全性检测 在初步了解药物的安全性基础上设计各组用药剂量,每组10只小鼠,定量灌胃给药,每天1次,连续用药5 d。试验开始和结束时每组小鼠分别称重,试验期为20 d,观察并记录小鼠的体重变化及死亡情况。
1.7.2 小鼠体内药物治疗试验 设14个药物试验组,同时设立感染对照组和空白对照组(具体见表6)。SPZ单一给药组和复方给药组每组24只小鼠,随机分装2笼。其余单一药物给药组及对照组,每组12只小鼠。用葡萄糖生理盐水稀释弓形虫速殖子至2.5×103个/mL,每只小鼠腹腔接种0.4 mL。接种24 h后将药物溶于生理盐水或混悬于羧甲基纤维素中,按小鼠体重配制成给药剂量,使用16号灌胃针按设定剂量灌服给药,每只小鼠每天灌药1次,每次0.5 mL,连续用药5 d,其中感染不用药对照组每天灌等量生理盐水。开始观察各组药物的治疗效果,至40 d结束试验。每天记录小鼠发病、饮食、活动等情况,并记录小鼠死亡时间和死亡数。接种弓形虫速殖子后d 5每组/笼随机选取2只小鼠颈部脱臼处死,在小鼠腹腔中注射生理盐水,抽取腹腔液在显微镜下检查有无弓形虫速殖子,在血球计数板上计数速殖子数量,如果小鼠死亡且腹腔冲洗液中检查到大量滋养体,则认为是弓形虫致死的。给药期间或给药后立即死亡的小鼠不作试验统计用。
1.7.3 治疗效果指标 计算各组小鼠的平均存活时间和存活率。小鼠存活率=(试验结束时小鼠存活数÷试验小鼠数)×100%。平均死亡时间:试验小鼠从接种到死亡的时间计为死亡时间,平均死亡时间=小鼠的死亡时间总和÷死亡小鼠数。腹腔速殖子计数:腹腔注入2 mL生理盐水后抽取腹腔液,通过血球计数板计数,速殖子浓度过大时稀释后计数。
1.8 试验数据分析 所有数据按x ±s表示,采用GraphPad Prism统计学软件包分析试验数据。
2 结果
2.1 细胞毒性试验 图1所示黄芩苷、乳酸TMP、乙胺嘧啶、SPZ、SDZ和甘草6种药物在不同药物浓度时Vero细胞的增殖率,以Vero细胞增殖率大于或等于90%的浓度为安全浓度,其中浓度最大的为最大安全浓度。黄芩苷、乳酸TMP、乙胺嘧啶、SPZ、SDZ和甘草的最大安全浓度分别为50、200、800、800、1600、3200 μg/mL。结果显示甘草对Vero细胞的毒性较低,黄芩苷的毒性较高。
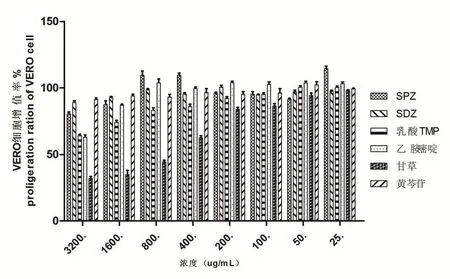
图1 磺胺氯吡嗪钠、磺胺嘧啶钠、乳酸TMP、乙胺嘧啶、甘草和黄芩苷对Vero细胞的毒性Fig.1 The toxicity of SPZ, SDZ, lactate TMP, pyrimethamine, baicalin and glycyrrhiza to Vero cells in vitro
2.2 药物体外抗弓形虫效果
2.2.1 药物体外抗弓形虫情况的观察 感染不治疗对照组,弓形虫速殖子感染Vero细胞4 h后,大部分虫体贴近细胞开始侵染。感染24 h后速殖子完全侵入细胞内,并在细胞内增殖,随着时间延长,细胞内弓形虫数量增加,呈菊花样排列。36 h后细胞完整无破裂,细胞内呈“菊花样”排列的弓形虫的“假包囊”较多且清晰可见,为最佳观察时间,此时易于区分感染细胞和非感染细胞并对感染细胞计数。感染48 h后Vero细胞已有部分破裂,胞外释放出大量的弓形虫速殖子。黄芩苷、乳酸TMP、乙胺嘧啶、SPZ、SDZ和甘草6个药物组的Vero细胞在加药12 h内大小无明显变化,细胞完整无破裂,细胞外有部分弓形虫变细。加药24 h后细胞肿胀,细胞间只有少量弓形虫速殖子,弓形虫在细胞内增殖,随着时间延长,胞内弓形虫数量增加,呈菊花样排列。加药36 h后明显观察到药物浓度与弓形虫“假包囊”有负相关性(图2),48 h后,低浓度药物孔中,Vero细胞脱落聚集,有的细胞形态模糊,细胞肿胀,有少量细胞破裂,释放出较多的弓形虫速殖子。随着药物浓度的增高,具有完整形态的Vero细胞增多,部分细胞肿胀,细胞间只有少量的弓形虫。高浓度的药物组,弓形虫速殖子变为针状,无侵染能力,Vero细胞保持完整形态。结果表明弓形虫感染细胞36 h左右,形成的“假包囊”清晰可见,此时易于观察药物浓度与细胞间虫体数的关系。

图2 磺胺氯吡嗪钠试验组细胞形态观察(400×)Fig.2 Morphology of Vero cells after SPZ treatment(400×)注: 箭头所指为弓形虫速殖子侵入细胞后形成的假包囊. A: 未加药物的空白对照组; B:低浓度药物组; C: 中等浓度药物组; D: 高浓度药物组Note: The arrows indicated the pseudocyst. A: Blank control group; B. Low concentration group; C: Middle concentration group; D: High concentration group.
2.2.2 药物体外对弓形虫抑制效果 在药物安全浓度下,进行药物体外抗弓形虫试验,36 h观察效果。结果显示药物对虫体的抑制作用随着药物浓度的增加而增强。SPZ和SDZ在药物浓度分别大于500 μg/mL和800 μg/mL时对弓形虫速殖子的抑制作用大于50%,相同药物浓度下SPZ抑制效果优于SDZ,SPZ最大抑制率可达80%,SDZ最大抑制率可达65%。乙胺嘧啶在其最大安全药物浓度800 μg/ mL时,对弓形虫速殖子的抑制作用为80%;黄芩苷、乳酸TMP两者在药物浓度6.25 μg/mL时,对弓形虫速殖子的抑制作用均大于90%;甘草在3200 μg/mL时对弓形虫的抑制率达到50%。可见,这6种药物在体外对弓形虫速殖子均有较好的抑制效果,作用从大到小依次为乳酸TMP、黄芩苷、乙胺嘧啶、SPZ、SDZ和甘草(图3、4)。
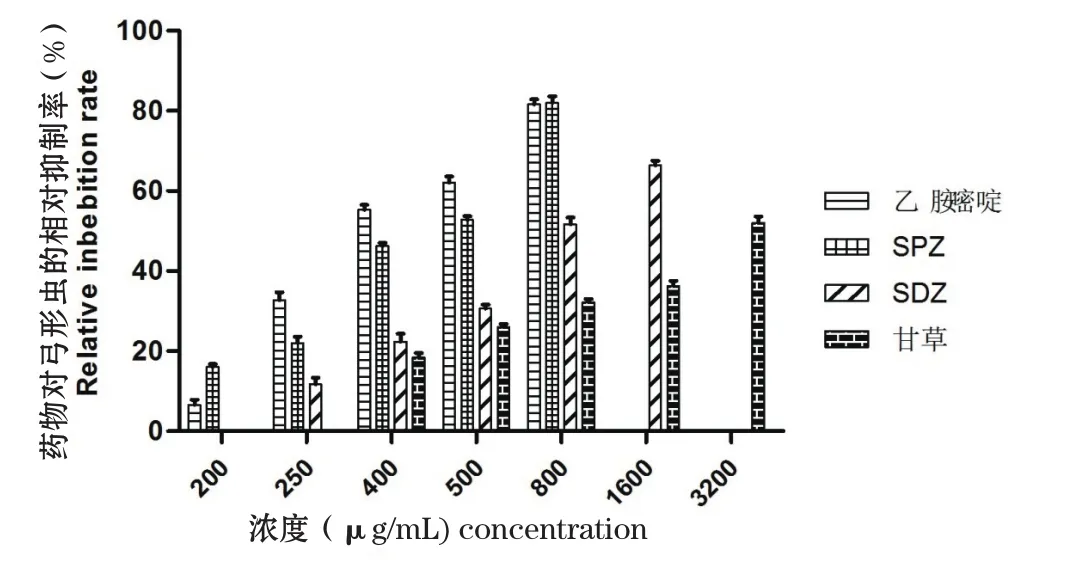
图3 乙胺嘧啶、磺胺氯吡嗪钠(SPZ)、磺胺嘧啶钠(SDZ)和甘草体外对弓形虫速殖子的相对抑制效果Fig.3 The relative inhibition rate pyrimethamine, SPZ, SDZ and glycyrrhiza on tachyzolites of Toxoplasma gondii in vitro
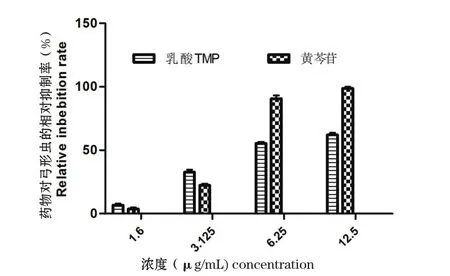
图4 乳酸TMP和黄芩苷体外对弓形虫速殖子的相对抑制效果Fig.4 The relative inhibition rate of lactate TMP and baicalinon tachyzolites of Toxoplasma gondii in vitro
2.3 药物体内抗弓形虫效果
2.3.1 小鼠体内药物安全性试验结果 根据小鼠给药前后体重增加情况可知(表5),毒性最低的为乳酸TMP,毒副作用相对最大的为250 mg/kg的SDZ。同等剂量下,SPZ的毒副作用低于SDZ,但与对照组相比,差异也具有极显著统计学意义(P<0.05)。
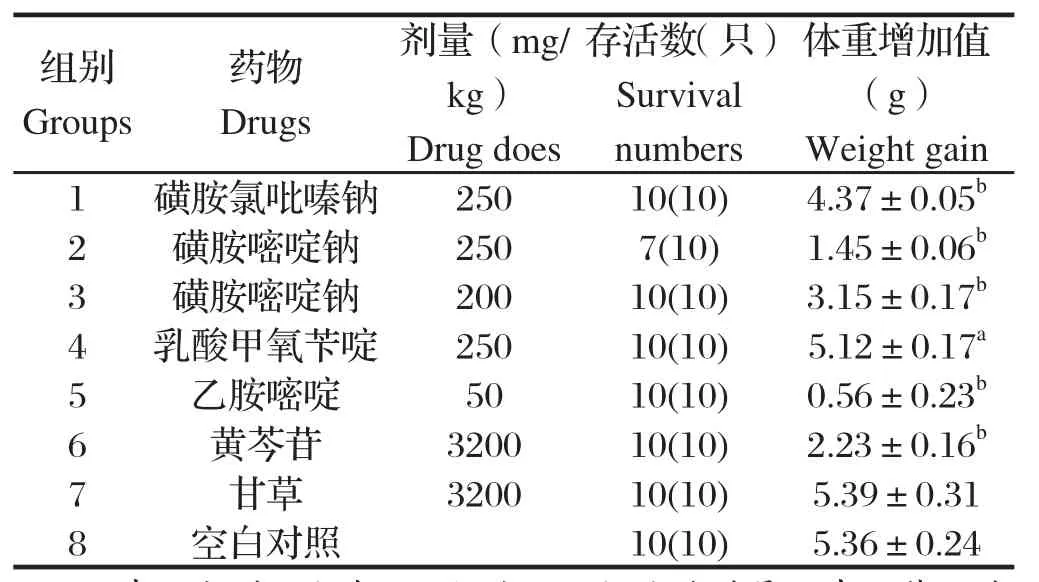
表5 药物体内安全性试验结果Table 5 Detection results of drug security in vivo
2.3.2 药物小鼠体内抗弓形虫作用的结果 通过镜检观察可知,与感染对照组相比,给药组的小鼠腹腔液中,弓形虫速殖子量均明显降低,其中SPZ试验组效果最明显(P<0.05)。由小鼠存活率结果可知,相比于感染对照组,单独使用高剂量的SDZ、乳酸TMP、乙胺嘧啶、黄芩和甘草时虽能延长小鼠平均死亡时间,但均不能使小鼠避免死亡,存活率均为0%。
SPZ单剂量组及其复方合剂组按每组两笼小鼠进行体内抗虫药物试验,以平均存活率比较疗效:SPZ剂量为200 mg/kg和250 mg/kg能使部分小鼠存活,平均存活率分别为25%和50%,而且在试验期结束后,存活的小鼠仍可长期存活(超过1年以上)。在药物复方组中,SPZ用量降为200 mg/kg,与不同用量的乳酸TMP配伍时,小鼠的平均存活率为20%~25%;与不同用量的乙胺嘧啶配伍时,小鼠的平均存活率也为20%~25%,与单独给予200 mg/kg的SPZ试验组的小鼠存活率相同或略低。结果表明复方中SPZ与乳酸TMP/乙胺嘧啶在小鼠体内抗弓形虫感染方面无明显的协同作用。但由于与黄芩和甘草两种中药配伍时小鼠的存活率提升至40%,仅次于250mg/kg的SPZ试验组的小鼠存活率,而且小鼠腹腔中检测不到弓形虫速殖子,提示中西药复方制剂在保持较高疗效的同时,不仅能够减少西药用量从而减少其副作用,还能提高药物治疗效果。
3 讨论
磺胺药(如SDZ、磺胺甲恶唑等)是一类广谱的抗微生物药物,其化学结构式与对氨基苯甲酸类似,可以竞争性结合二氢叶酸合成酶[6],通过抑制二氢叶酸合成酶的活性阻断二氢叶酸的合成,使叶酸代谢异常,从而抑制细菌或弓形虫增殖。磺胺增效剂[7]TMP,抑制二氢叶酸还原酶,使二氢叶酸不能还原为四氢叶酸,从而阻止细菌的核酸合成,与磺胺药合用,可使细菌的叶酸代谢受到双重阻断,使磺胺药的抑菌作用增强数倍至数十倍,同时可减少耐药菌株的出现。乙胺嘧啶[8]的作用机理也为抑制二氢叶酸还原酶[9]的活性,主要用于疟疾的预防,也可用于治疗弓形虫病。前期体内药物筛选试验中发现SPZ对弓形虫RH株抑制效果最佳,对易感动物小鼠保护率高达60%(SPZ剂量为250 mg/kg时用不同饮水给药方式),且小鼠可长期存活,而其他药物,如SDZ,对感染鼠的保护率为零。SPZ属于磺胺药,推测其主要通过对二氢叶酸还原酶的抑制作用来阻断弓形虫叶酸合成代谢,从而抑制抗弓形虫的生长发育,因此可与二氢叶酸还原酶抑制剂甲氧苄啶或乙胺嘧啶复配提高抗虫疗效。基于这种设想,我们采用SPZ-乳酸TMP/乙胺嘧啶的复方药剂进行体内、外抗弓形虫试验。
体外试验中发现,在药物安全浓度下,SPZ、SDZ、乙胺嘧啶、黄芩苷和乳酸TMP单独使用时对弓形虫速殖子增殖的抑制率均超过80%,其中黄芩苷和乳酸TMP在低浓度12.5 μg/mL时能够完全抑制弓形虫增殖。然后采用临床常用的SDZ作为抗弓形虫药物的阳性对照,进行了单一药物的体内抗弓形虫试验,发现在同等药物剂量下,单独使用SDZ虽然能够延长感染弓形虫的小鼠的死亡时间,但是小鼠存活率为0,而单独使用SPZ可使50%的小鼠存活,并且腹腔液中未发现弓形虫速殖子,说明SPZ具有显著的抗弓形虫作用,治疗效果明显优于SDZ,这与之前蒋蔚等[10]、黄兵等[11]和王帅等[12]的研究结果相似。小鼠体内药物安全性试验发现,在同等剂量下,SPZ的毒副作用低于磺SDZ。综观以上结果,SPZ有望作为抗弓形虫药物的良好选择。
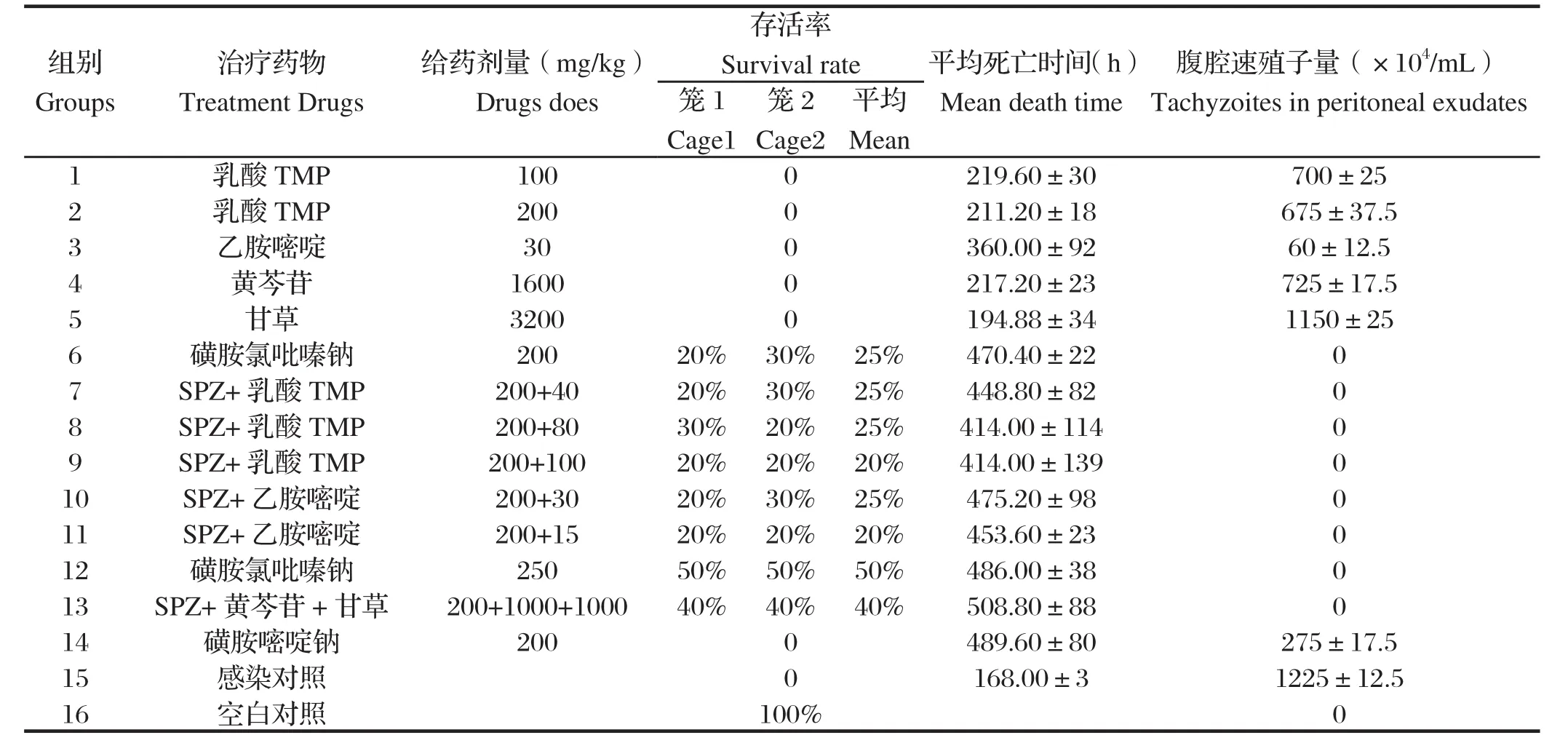
表6 不同药物小鼠体内抗弓形虫初步效果Table 6 Preliminary eff cacy of drugs on infections of T.gondii RH strain in mice
为了进一步挖掘SPZ的抗弓形虫疗效,我们尝试将SPZ用量降为200 mg/kg,探究其分别与40 mg/ kg乳酸TMP、80 mg/kg乳酸TMP、100 mg/kg乳酸TMP、15 mg/kg乙胺嘧啶和30 mg/kg乙胺嘧啶组成复配方剂时的抗弓形虫效果。结果显示,这些治疗组小鼠的存活率与单独给予200 mg/kg SPZ组相当,无明显提高,表明与二氢叶酸还原酶抑制剂联合用药不能降低SPZ的用药剂量,也不能提高对弓形虫感染小鼠的保护率。研究表明TMP单独使用时无抗弓形虫活性,但与磺胺甲恶唑复配使用能提高其抗弓形虫效果,有效防止弓形虫脑炎的发生[13]。表明SPZ与磺胺甲恶唑尽管同属磺胺药,但在抗弓形虫效果和机理上不能仅仅用叶酸合成受阻来解释其差异,特别是SPZ能保护部分急性感染小鼠免于死亡。SPZ虽有较好的抗弓形虫效果,但控制弓形虫病发展需要依靠机体免疫力,可尝试配伍免疫调节剂,如甘草;弓形虫病可使动物发热,可适当配伍退热中药,如黄芩苷,因此本试验尝试用SPZ-甘草-黄芩苷组成抗弓形虫复方制剂,并作为复方对照组。在复方制剂中SPZ用量降为200 mg/kg,与单独给予SPZ200 mg/kg相比,对感染鼠的保护率显著提高,说明甘草和黄芩与SPZ配伍使用后明显增加了SPZ抗虫效果,提高了小鼠的存活率。SPZ-乳酸TMP/乙胺嘧啶复方药剂和SPZ-黄芩苷-甘草复配使用时的药效不同,启示我们SPZ的特别治疗效果除了缘于磺胺类药物均具有的干扰虫体的叶酸代谢而抑制虫体繁殖的作用外,可能还与其他机制有关。另外,我们研究发现,感染弓形虫后用SPZ治疗组的小鼠产生的IL-12要高于其它对照组(另文发表),而表达高水平的IL-12和IFN-γ是天然免疫的特征[14],推测SPZ抗虫机制异于磺胺类药具有的独特抗虫机制——即干扰虫体的叶酸代谢,从而抑制虫体繁殖,可能与SPZ作用于虫体影响其调节宿主的免疫功能相关,但需要进一步的研究证实。
SDZ、黄芩苷、甘草、乙胺嘧啶和乳酸TMP在体外试验均显示出一定的抑制弓形虫速殖子增殖的效果,但体内试验中发现单独使用均不能使小鼠避免死亡。另外在细胞毒性试验中发现,黄芩苷毒性较大,但通过小鼠体内安全性试验发现,其毒性低于SPZ和SDZ,说明体外和体内试验存在着一定的差别[15],体外试验并不能完全代替体内试验结果,只有将体内、体外试验相结合才能既做到简单、快速,增加结果的可信度。
[1] 张瑞岩, 刘全, 商立民, 等. 抗弓形虫药物研究进展[J]. 动物医学进展, 2010, 31(1): 95-100.
[2] 王旗, 杨雯, 杨小迪, 等. 抗弓形虫药物的研究进展[J]. 中国病原生物学杂志, 2014(5): 478-480.
[3] 聂福旭, 贾志江, 刘娣琴, 等. 抗弓形虫药物的作用机制和效果的研究进展[J]. 中国动物检疫, 2013(4): 75-77.
[4] 龚国华, 侯加法, 蒋蔚, 等. 7种药物体内外抗弓形虫效果分析[J]. 畜牧与兽医, 2011, 43(7): 58-61.
[5] Franco P S, Gomes A O, Barbosa B F, et al. Azithromycin and spiramycin induce anti-inflammatory response in human trophoblastic (BeWo) cells infected by Toxoplasma gondii but are able to control infection[J]. Placenta, 2011, 32(11): 838-844.
[6] 吕惠序. 猪场如何正确使用磺胺类药物及抗菌增效剂[J].养猪, 2010(2): 73-75.
[7] 白明水. 磺胺类药物及其增效剂的临床使用价值[J]. 中国社区医师: 医学专业, 2008(24): 10.
[8] Montazeri M, Daryani A, Ebrahimzadeh M, et al. Effect of propranolol alone and in combination with pyrimethamine on acute murine toxoplasmosis.[J]. Jundishapur J Microbiol, 2015, 8(9): e22572.
[9] 曾艳波.急性弓形虫小鼠感染模型的建立与抗动物弓形虫病药物的初步筛选[D]. 北京: 中国农业科学院, 2011.
[10] 蒋蔚, 陈永军, 张花景, 等. 磺胺氯吡嗪钠中药复方对小鼠体内抗弓形虫疗效的观察[J]. 畜牧兽医学报, 2013, 44(12): 2022-2028.
[11] 黄兵, 朱顺海, 曾艳波, 等. 几种药物抗小鼠弓形虫感染的初步效果[J]. 中国动物传染病学报, 2010, 18(3): 45-50.
[12] 王帅, 赵光伟, 谢青, 等. 鸡源弓形虫治疗药物的筛选[J].中国兽医科学, 2012(11): 1190-1194.
[13] 赵自屹. 艾滋病合并弓形虫脑病患者的临床治疗分析[J].深圳中西医结合杂志, 2015, 25(2): 132-133.
[14] Li L, Jiang Y, Lao S. Mycobacterium tuberculosis-Specific IL-21+IFN-γ+CD4+ T Cells Are Regulated by IL-12[J]. Plos One, 2016, 11(1): e0147356.
[15] Barbosa B F, Gomes A O, Ferro E A, et al. Enrofloxacin is able to control Toxoplasma gondii, infection in both in vitro, and in vivo, experimental models[J]. Vet Parasitol, 2012, 187(1-2): 44-52.
TREATMENT EFFECT OF COMPOUND SULFACHLOROPYRAZINE SODIUM ON ACUTE TOXOPLASMOSIS IN MICE
CHENG Jun-xia, JIANG Wei, CHEN Yong-jun, XUE Jun-xin, HAN Yang-rui, WANG Quan
(Key Laboratory of Animal Parasitology of Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
To further explore the curative effect of sulfachloropyrazine sodium (SPZ) on Toxoplasma gondii, we tested single use of SPZ, baicalin, lactate TMP, pyrimethamine and glycyrrhiza against T.gondii both in vitro and in vivo and used sulfadiazine sodium(SDZ) as control. Then we used SPZ-glycyrrhiza-baicalin as control to test the combination effect of SPZ with lactate TMP or pyrimethamine, which blocked the synthesis of folic acid in double ways in KM mice artif cially infected with T.gondii RH strain. The results showed that all 6 drugs showed inhibitory effect on the proliferation of T.gondii in vitro. The single dosages of SPZ (250 mg/kg or 200 mg/kg) protected some mice from death in acute toxoplasmosis as the survival rates were 50% and 25% in vivo. Other 5 drugs delayed the death but did not protect them from death. Combined administration use of SPZ (200 mg/kg) and lactate TMP or pyrimethamine had no obvious synergistic effect while compound SPZ-glycyrrhiza-baicalin signif cantly improved the survival rate up to 40%. The results suggested that the special therapeutic effect of SPZ not only inhibited the proliferation of T.gondii by by interfering the metabolism of folic acid, but also possibly had interaction with the host immunity.
Toxoplasmosis; sulfachloropyrazine sodium; in vitro; in vivo; synergistic effect
S852.723
A
1674-6422(2017)03-0054-07
2017-02-28
公益性行业(农业)科研专项(20130303045)
程军霞,女,硕士研究生,预防兽医学专业
王权,E-mail:wangquan@shvri.ac.cn

