野雉尾金粉蕨微繁殖技术
管 菊,万 劲,陈嘉裔
(1.西南林业大学 园林学院,云南 昆明 650224; 2.三江学院,江苏 南京 210012; 3.昆明绿岛园艺有限公司,云南 昆明 650224)
野雉尾金粉蕨微繁殖技术
管 菊1,万 劲2,陈嘉裔3*
(1.西南林业大学 园林学院,云南 昆明 650224; 2.三江学院,江苏 南京 210012; 3.昆明绿岛园艺有限公司,云南 昆明 650224)
以野雉尾金粉蕨的孢子为外植体,建立快繁体系。结果表明,野雉尾金粉蕨孢子HgCl2最佳处理时间为3 min,孢子最适萌发培养基为1/2MS+2%蔗糖。增殖期间,降低糖浓度更有利于配子体的快速增殖,最适增殖培养基为1/2MS+1%蔗糖。1/2MS+2%蔗糖为最适孢子体诱导培养基,待幼孢子体长至3~5 cm时,即可出瓶炼苗,炼苗最优基质为草炭+蛭石(1∶1)。
野雉尾金粉蕨; 孢子; 微繁殖
野雉尾金粉蕨(Onychiumjaponicum),又名中华金粉蕨、柏香莲,为中国蕨科金粉蕨属植物,常生于海拔50~2 200 m的林下沟边或灌丛阴处,主要分布于秦岭以南、广东以北地区,云南产绥江、大关、宣威等地[1]。野雉尾金粉蕨生长旺盛,叶密呈丛状,似鸡尾形,造型别致,优雅飘逸,极适宜于盆栽或垂吊栽培观赏。
试验采用微繁殖技术建立其快繁体系,将对保护野雉尾金粉蕨野生资源不受破坏、合理进行开发利用有着重要意义,同时也对促进可持续发展、保持生物多样性及维护生态平衡具有一定意义。
1 材料与方法
1.1 材料
野雉尾金粉蕨孢子采自云南省昆明市金殿蕨类植物园,采集日期2015年10月,采集后放置于4 ℃冰箱保存。
1.2 方法
1.2.1 培养条件
本试验培养基以MS、1/2MS为基本成分,分别附加0.4%的1 500 g·cm-2强度卡拉胶以及不同浓度的蔗糖,调整pH值在5.8~6.0,于121 ℃高压灭菌锅中灭菌15 min。使用日本三洋MLR-351H型人工可控气候箱进行培养,光照强度设定为3 000 lx,每日光照时长18 h,培养温度恒定25 ℃,培养湿度恒定80%。
1.2.2 孢子预处理
为使孢子灭菌取得更好效果,首先对孢子进行预处理,使孢子被水充分浸润,并进一步去杂。
称取1 mg供试孢子,置于5 mL离心管内,滴入无菌水,充分振荡后以3 000 r·min-1离心1 min,弃去上清液,重复2次,至上清液无肉眼可见杂质后,再次充分振荡,得到的即纯度较高的孢子悬浊液,备用。
1.2.3 孢子灭菌
使用一次性无菌滴管吸取1 mL孢子悬浊液,滴入滤纸叠成的纸包内,置于75%的酒精中浸泡约15 s,无菌蒸馏水清洗2次,再用0.1%的HgCl2(使用前添加1~2滴吐温-80)浸泡灭菌,设置30 s及1、3、5 min不同时长的灭菌处理组。浸泡灭菌后,用无菌水清洗5~6次,清洗总时长不少于5 min,然后用滴管吸取滤纸袋内的孢子悬浊液,滴于1/2MS+1%蔗糖培养基中,轻轻摇晃,使悬浮液均匀分布于培养基上。试验每个处理接种6瓶,重复4次。接种后每日取样,使用显微镜对孢子萌发进行镜检,使用Nikon ECLIPSE Ti倒置显微镜进行拍照记录,5 d后对污染率进行调查,20 d后统计孢子萌发率。
孢子萌发率检测方法为随机镜检,随机抽取处理组中4瓶,以100倍的放大倍数,在每瓶内随机选择4个视野进行观察,对视野内孢子进行萌发率统计,以出现绿色配子体细胞作为萌发标准。
1.2.4 孢子萌发培养
将孢子悬浊液按先前得出的最适灭菌方法进行处理,处理后分别接种于不同成分的培养基中,培养条件同上,每处理20瓶,重复3次。接种7 d后,每隔2 d观察和记录配子体的生长发育状况,30 d后结束调查。
1.2.5 增殖培养
将原叶体充分分散成单个个体,挑选出其中长势良好、大小相近的原叶体个体,分别接种于不同培养基中进行增殖培养。使用不同培养基成分(A)、不同蔗糖含量(B)、不同pH值(C)的组合对原叶体进行增殖培养,试验采用L9(34)的正交试验设计,1~3水平因素A分别为MS、1/2MS和1/4MS,B分别为1%、2%和3%,C分别为5.8、6.0和6.2。处理组合为A1B1C1、A1B2C2、A1B3C3、A2B1C2、A2B2C3、A2B3C1、A3B1C3、A3B2C1和A3B3C2。
每瓶培养基接原叶体10棵,每种培养基接20瓶,重复3次,为方便数据统计,在接种时原叶体个体之间均需保留一定距离,均匀分布于培养基上。接种7 d后开始观察并记录生长状况,观察记录原叶体长势、增殖状况,60 d后对原叶体长势、增殖倍数进行统计分析。
1.2.6 幼孢子体诱导
将长势良好、大小相近的原叶体个体分别接入以下孢子体诱导培养基中。①1/2MS;②1/2MS+1%蔗糖;③1/2MS+2%蔗糖;④1/2MS+3%蔗糖。试验每组接种15瓶,重复3次。7 d后,每隔2 d观察并记录生长状况,不再转接,60 d后对诱导率进行统计。
1.2.7 炼苗与移栽
当幼孢子体长至3~5 cm时进行驯化移栽。首先在培养室半开瓶盖放置3 d,然后用镊子从瓶内取出植株,用自来水冲洗净附着在根部的培养基,移栽到不同基质的穴盘中。1号草炭,2号蛭石,3号草炭+蛭石(1∶1)。置于光照培养箱中培养,设定培养温度25 ℃,光照12 h,湿度90%。45 d后,对根长、苗高、状态等进行统计。
2 结果与分析
2.1 不同灭菌时间对外植体成活率的影响
由表1可知,随着HgCl2灭菌时间的增加,污染率大幅降低,说明HgCl2对于孢子表面所携带的污染物具有较好的灭杀效果。但随着灭菌时间的延长,孢子的萌发活性也会受到影响。结果表明,75%的酒精处理15 s后,再用0.1% HgCl2处理3 min,为野雉尾金粉蕨孢子的最佳灭菌方法。
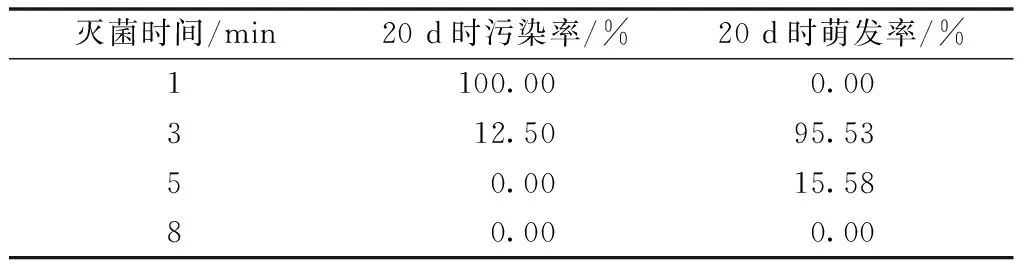
表1 不同灭菌处理对野雉尾金粉蕨孢子 成活率的影响
2.2 不同浓度无机盐及糖对孢子萌发及原叶体形成的影响
接种4 d后于显微镜下即可观察到孢子大量萌发,萌发后逐渐形成丝状体和片状体,30 d后可形成直径0.2 cm左右的绿色原叶体。经相关性分析可得,萌发率与MS盐浓度相关系数为-0.998,萌发率与蔗糖浓度的相关系数为-0.016,萌发率与MS盐浓度在0.01水平上极显著相关,说明在本试验梯度下,野雉尾金粉蕨孢子萌发情况主要只与无机盐浓度高低有关,而与糖浓度基本无关,较低的无机盐水平有利于孢子的萌发,1/2MS培养基为孢子萌发最适培养基。由表2可知,野雉尾金粉蕨孢子萌发后,糖浓度与无机盐浓度均对其生长均有一定影响,萌发后的孢子在不加糖的培养基上生长速度极为缓慢,绿色绒状体最小,较低的无机盐水平以及一定的糖浓度更有利于孢子萌发后的生长,6号1/2MS+2%蔗糖培养基最适于孢子萌发生长。
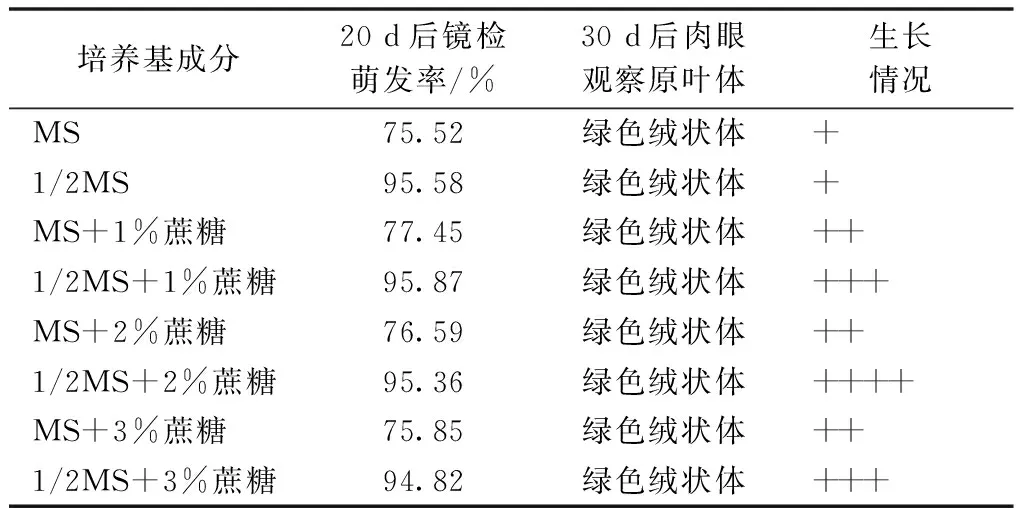
表2 不同培养基下野雉尾金粉蕨孢子萌发情况
注:+号代表配子体生长量,数量越多表示生长量越大。
2.3 不同浓度无机盐、糖及pH对原叶体增殖的影响
在原叶体增殖阶段,低盐分、低浓度蔗糖更加适宜原叶体的增殖生长。原叶体在高糖环境下,虽然增殖倍数也较高,但自身体积变小,且出现团块状生长、相互之间无法分离,这对于今后原叶体的转接扩增、幼孢子体的形成都极为不利。
由表3可知,1/2MS+1%蔗糖的4号培养基为原叶体增殖最适培养基,在该配方下,原叶体无性增殖数量多,且原叶体个体形态较大、相互间质地疏松可分开,有利于原叶体的转接扩增以及幼孢子体的诱导。培养基MS盐浓度与增殖倍数呈显著相关(F=726.500,P=0.001),说明主要影响增殖情况的仍为培养基MS盐浓度,而当pH值处于5.8~6.2时,对增殖培养几乎没有影响。

表3 不同成分培养基处理组合下野雉尾金粉蕨原叶体增殖生长情况
2.4 孢子体诱导
不同糖浓度下孢子体诱导的具体情况见表4。原叶体停止转接后,不加糖配方的培养基没有诱导出孢子体,且原叶体生长极为缓慢,出现了部分死亡的现象。高糖浓度配方的培养基上,原叶体不断增殖继续团块状生长,同样没有诱导出孢子体。1%、2%糖浓度培养基在停止转接后约40 d即有孢子体产生,60 d后统计孢子体生长情况,1%蔗糖浓度培养基相比2%蔗糖浓度培养基孢子体产生数量少、长势弱、叶片发黄。由此可见,1/2MS+2%蔗糖培养基为孢子体诱导适宜培养基。
2.5 炼苗与移栽
45 d后炼苗及移栽情况见表5、图1。由于蕨类在炼苗时孢子体已有根系长出,植株具备完整的根、茎、叶结构,炼苗成活率很高,期间注意喷水、遮荫和保温即可。在以蛭石为基质的炼苗盘中,由于蛭石养分含量较少,故几乎没有生长量,新生叶萌发数量少、植株细长瘦弱。在泥炭基质中的苗新叶数量、根系数量、苗高、长势等均没有在草炭+蛭石(1∶1)的混合栽培介质中的好,这可能是由于添加蛭石后,介质的透气性得到改善,从而更有利于植株根系的生长,促进了植物的营养吸收。
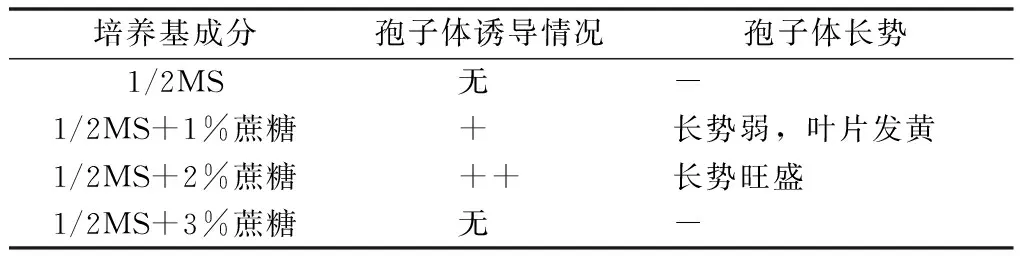
表4 60 d后不同糖浓度下孢子体诱导情况
注:+数量代表诱导数量多少。

表5 野雉尾金粉蕨的炼苗与移栽
注:表中数值为平均值±标准差;不同小写字母表示在0.05水平差异显著;+代表植株长势情况。

图1 野雉尾金粉蕨配子体增殖、孢子体诱导、炼苗移栽情况
3 讨论
本试验以野雉尾金粉蕨的孢子作为外植体,经灭菌处理后建立其无菌繁殖体系,理论上可以无限数量增殖生长,避免常规孢子繁殖中孢子材料有限[2]的问题;在配子体增殖阶段,于适宜的培养配方、培养环境下,其增殖量每60 d可达20.27倍,与常规孢子繁殖研究相比,大大提高了繁殖效率;炼苗移栽环节中,炼苗方法简单、栽培基质配方易于调配,45 d左右即可正常养护,以上这些都使得短时间内获得标准化野雉尾金粉蕨种苗成为可能,这对于开发利用野雉尾金粉蕨资源具有重要意义。
在试验过程中还发现,野雉尾金粉蕨微繁殖各阶段中,1/2MS培养基培养效果较MS培养基效果均更好,这说明野雉尾金粉蕨适合于较低无机盐浓度的培养基上生长,这一现象与吴芹等[3-4]研究观点基本一致,说明蕨类的微繁殖可能都需要较低的无机盐水平。在孢子体诱导阶段,据文献报道及前期试验发现,不同蕨类在离体培养微繁殖过程中,幼孢子体的产生的状况差异很大。如本试验中的野雉尾金粉蕨,即属于配子体可增殖、孢子体可瓶内诱导的蕨类,由于其配子体增殖倍率已经很高,故试验过程中没有再诱导愈伤的必要,快繁可直接通过增殖配子体产生孢子体来实现。而对于部分配子体难以快速增殖[5]、孢子体难以瓶内发生[6]及无法获得孢子材料[7]的这类蕨类,为提高增殖倍数,就需通过调整培养基配方来进行,如通过诱导愈伤、诱导GGB、诱导产生丛生芽等途径来实现植株的高速增殖。
本试验只针对糖浓度以及培养基成分对于生长的影响进行了初步研究,而韦景枫等[8]在研究凤丫蕨微繁殖时发现,通过添加NAA、BA等外源激素于培养基内可以有效提高增殖倍数,野雉尾金粉蕨微繁殖过程中是否也存在这一现象,在添加不同浓度激素、不同激素组合下是否还可以继续提高配子体增殖倍数、孢子体诱导率等,这些有待做进一步深入研究。
[1] 中国科学院昆明植物研究所. 云南植物志第20卷:蕨类植物[M]. 北京:科学出版社,2006.
[2] 孙起梦,刘兴剑. 几种蕨类植物的孢子繁殖试验研究[J]. 安徽农业科学,2010,38(25):13571-13572.
[3] 吴芹. 几种观赏蕨类植物的繁殖技术研究 [D]. 南京:南京林业大学,2007.
[4] 潘晓韵,沈晓岚,朱开元,等. 鸟巢蕨的组培快繁技术[J]. 浙江农业科学,2014(7):1049-1050.
[5] 袁玲. 两种观赏蕨类植物离体快繁体系的建立[D]. 武汉:华中农业大学,2007.
[6] 郭红娟. 几种药用蕨类植物孢子繁殖和配子体发育及叶表皮研究[D]. 桂林:广西师范大学,2010.
[7] 叶晓青,李红,佘建明,等. 凤尾蕨离体培养微繁殖技术[J]. 江苏农业学报,2010,26(6):1445-1446.
[8] 韦景枫,匡世秀,陶文丞,等. 凤丫蕨组培快繁技术初报[J]. 贵州林业科技,2004,32(3):32-34.
(责任编辑:张瑞麟)
2017-01-17
西南林业大学科技创新项目(C16051)
管 菊(1991—),女,云南宣威人,硕士研究生,研究方向为观赏植物繁殖与栽培,E-mail:710029000@qq.com。
陈嘉裔,从事观赏植物育种与繁殖工作,E-mail:wansju@foxmail.com。
10.16178/j.issn.0528-9017.20170628
S68
B
0528-9017(2017)06-0996-04
文献著录格式:管菊,万劲,陈嘉裔. 野雉尾金粉蕨微繁殖技术[J].浙江农业科学,2017,58(6):996-999.

