广西壮族自治区HIV与MTB双重感染患者的临床特征分析
梁大斌 林玫 蓝如束 崔哲哲 覃慧芳 林定文 谢志满 蒋权 韦柏才
·论著·
广西壮族自治区HIV与MTB双重感染患者的临床特征分析
梁大斌 林玫 蓝如束 崔哲哲 覃慧芳 林定文 谢志满 蒋权 韦柏才
目的 探索广西壮族自治区HIV与MTB双重感染患者的临床特征,为进一步研究双重感染的控制、诊疗提供科学依据。方法 连续纳入2013年9月至2015年8月广西壮族自治区南宁市、来宾市和贵港市可随访的HIV感染者或AIDS患者,且发现HIV感染后无结核病诊断史及抗结核药物使用史;同时纳入性别、年龄(±3岁)相近的单纯结核病患者,均采用统一设计的调查表调查。通过临床特征分析及相关实验室检查对双重感染患者、单纯HIV感染者或AIDS患者、单纯结核病患者进行比较分析。结果 共纳入HIV感染者或AIDS 患者1024例,确诊或临床诊断并发MTB感染者160例(15.62%)(简称“双重感染组”);单纯HIV感染者或AIDS患者505例(49.32%)。纳入单纯结核病患者489例。双重感染组在咳嗽咯痰[76.88%(123/160)]、符合结核病的胸部影像学改变[80.00%(128/160)]、痰涂片阳性率[7.32%(9/123)]均低于单纯结核病组[93.46%(457/489)、98.98%(484/489)、34.97%(171/489)](χ2分别为34.88,80.76,36.20,P值均<0.01),而低热[41.25%(66/160)]、体质量下降[34.38%(55/160)]、盗汗[8.75%(14/160)]、肺外结核[22.50%(36/160)]的发生率均高于单纯结核病组[8.79%(43/489)、6.34%(31/489)、3.89%(19/489)、0.41%(2/489)](χ2=90.88,P<0.01;χ2=82.43,P<0.01;χ2=5.91,P=0.015;χ2=106.73,P<0.01)。双重感染组患者体质量下降[34.38%(55/160)]、气促和(或)呼吸困难[21.88%(35/160)]、胸痛[10.00%(16/160)]、腹泻数天不止[9.38%(15/160)]、舌表面鹅口疮或口腔黏膜奶酪样白斑[27.50%(44/160)]等临床表现发生率均高于单纯HIV感染者或AIDS患者[6.14%(31/505)、3.17%(16/505)、0.59%(3/505)、2.18%(11/505)、5.35%(27/505)](χ2分别为86.04,60.05,Fisher精确检验,16.75,62.53,P值均<0.01)。CD4+T淋巴细胞计数(74.00个/mm3)明显低于单纯HIV感染者和(或)AIDS 患者(282.00个/mm3)(Z=-9.43,P<0.01)。双重感染组未接受艾滋病抗病毒药物治疗(HAART)者咳嗽咯痰[81.36%(96/118)]、低热[50.00%(59/118)]、体质量减轻[41.53%(49/118)]的发生率明显高于接受治疗者[64.29%(27/42)、16.67%(7/42)、9.52%(4/42)](χ2=5.08,P=0.024;χ2=14.20,P<0.01;χ2=14.32,P<0.01);而有无卡介苗接种史[62.86%(22/35)、84.80%(106/125)]的差异仅在与结核病相符的影像学改变方面有统计学意义(χ2=8.23,P<0.01)。结论 双重感染患者临床特征复杂,诊断难度大,需对其加强监测和随访,并探索和推广新快速诊断方法,以及早发现、进行治疗。
HIV感染; 获得性免疫缺陷综合征; 分枝杆菌, 结核; 重叠感染; 疾病特征
HIV与MTB双重感染是全球重要的公共卫生问题,疾病负担沉重[1]。文献报道,对多个国家的研究表明,对HIV感染或AIDS的死亡患者进行尸检,发现可能有30%~60%的患者死于未进行结核病诊断[2]。广西壮族自治区是AIDS的高发区[3],同样面临着双重感染防控的挑战。本研究通过对广西壮族自治区HIV与MTB双重感染患者临床特征的分析,为进一步研究双重感染的控制、诊断及治疗提供科学依据。
资料和方法
一、患者基本情况
连续纳入2013年9月至2015年8月于广西壮族自治区南宁市、来宾市、贵港市的艾滋病防治机构登记的可随访到的HIV感染者或AIDS患者(包括双重感染者和单纯HIV感染者或AIDS患者),且发现HIV感染后无结核病诊断史及抗结核药物使用史。同时,在上述调查点纳入性别、年龄相近(±3岁)的结核病防治机构登记的初治结核病(包括肺结核和肺外结核)患者。本研究的方案、调查表、知情同意书等均获得广西伦理委员会批准(IRB 0001594,FWA 00001359)。所有参加调查的对象均在调查之前签署知情同意书。
本研究共纳入符合条件的HIV感染者或AIDS患者1024例(简称“所有纳入者”),其中男715例(69.82%),女309例(30.18%);年龄5~85岁,平均(48.79±14.64)岁。经过病史收集、实验室检测、临床症状等情况将研究患者纳入以下1~3组。
1.双重感染组:所有纳入者中并发MTB感染者160例,检出率为15.62%(160/1024),其中男130例(81.25%),女30例(18.75%);年龄12~83岁,平均(48.83±15.61)岁;包括确诊患者75例(7.32%),但其中有24例未检出与肺结核相符的胸部影像学改变,临床诊断患者85例(8.30%)。
2.单纯HIV感染者或AIDS患者组:所有纳入者中505例为单纯HIV感染者或AIDS患者,其中男321例(63.56%),女性184例(36.44%);年龄14~85岁,平均年龄(47.90±14.50)岁。
3. 单纯结核病组:同时在本项目研究点纳入489例初治单纯结核病患者,其中男352例(71.98%),女137例(28.02%)。年龄11~82岁,平均年龄(47.20±14.93)岁。
4.其他诊断者:其中结核潜伏感染156例,疑似结核病但达不到临床诊断标准148例,非结核分枝杆菌感染55例,均未能达到肺结核诊断标准,为了避免混淆,也未纳入单纯HIV组。
双重感染组与单纯HIV感染者或AIDS患者组、单纯结核病组比较,性别分布差异均有统计学意义(χ2=17.41,P<0.01;χ2=5.42,P=0.020),年龄分布差异均无统计学意义(t=0.69,P=0.490;t=1.19,P=0.236)。
二、研究方法
1.病史及标本采集:由受过统一培训的临床医生对HIV感染者或AIDS患者,以及单纯结核病患者进行询问和体格检查,并收集患者的各项检查结果,使用项目统一设计的调查表(参考了国家和WHO相关指南和调查表,并经过专家讨论)进行记录,包括患者基本信息、HIV感染情况、结核病临床特征、艾滋病抗病毒治疗(highly active antiroviral therapy,HAART)史、卡介苗接种史等。收集HIV感染者或AIDS患者(包括双重感染者和单纯HIV感染者或AIDS患者)及单纯结核病患者各3份痰标本(夜间痰、晨痰和即时痰)、HIV感染者或AIDS患者2份血液标本、肺外结核患者病灶部位组织标本。
2.实验室检查:及时对HIV感染者或AIDS患者的合格痰标本行痰涂片抗酸染色、MTB培养(MGIT 960液体培养和改良固体培养基培养)、菌种鉴定和GeneXpert MTB/RIF (简称Xpert MTB/RIF)检测,以及血标本γ-干扰素释放试验(inter-feron-gamma release assays,IGRAs)、CD4+T淋巴细胞计数;对单纯结核病患者行痰涂片抗酸染色,由于经费和试剂短缺未进行痰培养和Xpert MTB/RIF检测。肺外结核行病灶部位标本组织病理学检查。操作步骤均严格按《中国结核病防治规划实施工作指南(2008版)》(简称“《指南》”)[4]和《结核病实验室标准化操作与网络建设》[5]要求进行检测。对血标本严格按试剂说明书要求。
3.质量控制:制定统一的研究方法和技术路线,对项目相关人员开展调查前培训及考核。指定专人进行调查、数据复核、标本采集、运送、验收及检验;定期对调查地区进行调查质量及实验室质量控制。
4. 观察指标:选择肺结核常见症状体征(咳嗽咯痰、低热、体质量下降、盗汗、符合结核病的胸部影像学改变),以及双重感染患者常见的肺外结核、AIDS患者常见的机会感染症状体征(体质量下降、气促和(或)呼吸困难、胸痛、腹泻数天不止、舌表面鹅口疮或黏膜奶酪样白斑、视力障碍)作为观察指标。
三、诊断标准
1.HIV感染者或AIDS患者并发MTB感染的诊断标准:根据患者的结核病症状体征、影像学检查、实验室检查结果,按照《指南》标准,将符合以下条件的均作为HIV感染者或AIDS患者并发MTB感染患者(即双重感染组):(1) HIV感染者或AIDS患者临床诊断符合下列条件之一者,①3次痰涂片阴性,胸部影像学检查显示与活动性肺结核相符的病变,且伴有咳嗽、咯痰、咯血等肺结核可疑症状;②3次痰涂片阴性,胸部影像学检查显示与活动性肺结核相符的病变,且结核菌素皮肤试验强阳性;③3次痰涂片阴性,胸部影像学检查显示与活动性肺结核相符的病变,且抗结核抗体检查阳性;④3次痰涂片阴性,胸部影像学检查显示与活动性肺结核相符的病变,且肺外组织病理检查证实为结核病变者;⑤3次痰涂片阴性的疑似肺结核患者,经诊断性治疗或随访观察可排除其他肺部疾病者。 (2)凡符合下列条件之一者为确诊患者。①2份痰涂片抗酸染色镜检阳性或痰培养阳性,且伴肺结核可疑症状;②1份痰涂片抗酸染色镜检阳性或痰培养阳性,且胸部影像学检查显示活动性肺结核相符的病变和(或)伴肺结核可疑症状;③1份痰标本Xpert MTB/RIF试验阳性,且伴肺结核可疑症状和(或)胸部影像学检查显示与活动性肺结核相符的病变;④有肺部以外结核病临床症状、体征,且组织病理学检查提示结核者可确诊肺外结核。
2.单纯HIV感染者或AIDS患者的诊断标准:参照《艾滋病和艾滋病病毒感染诊断标准》(WS293-2008)对单纯HIV感染者或AIDS患者进行诊断[6]。
3.单纯结核病的诊断标准:根据患者的结核病症状体征、影像学检查、实验室检查结果,按照《指南》标准进行诊断[4]。
四、统计学分析
采用统一设计的EpiData数据库进行数据录入,将数据导出Excel表,进行描述性分析。采用SPSS 17.0对数据进行统计学分析,计数资料“率”的比较采用卡方检验或Fisher精确检验;计量资料的比较采用t检验,如方差不齐(CD4+计数)则用Mann-WhitneyU秩和检验计算Z值。以P<0.05为差异有统计学意义。
结 果
一、双重感染组患者与单纯结核病组临床特征比较
160例双重感染组患者与489例单纯结核病组患者比较,前者咳嗽咯痰、符合结核病的胸部影像学改变发生率均较低,而低热、体质量下降、肺外结核、盗汗的发生率均较高,差异均有统计学意义(P值均<0.05)(表1)。
二、双重感染患者组与单纯HIV感染者及AIDS患者组并发其他机会性感染的临床特征
160例双重感染患者与505例单纯HIV感染者及AIDS患者比较,前者体质量下降、气促和(或)呼吸困难、胸痛、腹泻数天不止,以及舌表面鹅口疮或口腔黏膜奶酪样白斑等临床表现发生率均较后者高(P值均<0.05)(表2)。
三、实验室检测结果
1.HIV感染者及AIDS患者的IGRAs检测结果:由于试剂短缺,仅对连续纳入的860例HIV感染者及AIDS患者进行了IGRAs检测。208例(24.19%)阳性患者中,45例(21.63%)是双重感染患者,其余163例(78.37%)为潜伏性结核感染;结果不确定者占11.16%(96/860)。
2.HIV感染者及AIDS患者的结核病病原学检测结果:对能采集到合格痰标本的HIV感染者及AIDS患者的痰标本进行分枝杆菌病原学检测,其中对974例患者进行固体培养和液体培养,阳性率分别为5.13%(50/974)和6.37%(62/974),差异无统计学意义(χ2=1.36,P=0.243)。因试剂短缺,仅对连续纳入的301例行Xpert MTB/RIF试验,阳性率为8.31%(25/301)。对301例进行Xpert MTB/RIF检测的患者同时进行固体培养和液体培养,阳性率分别为5.65%(17例)和7.31% (22例),与Xpert MTB/RIF检测阳性率相比,差异均无统计学意义(χ2=1.64,P=0.201;χ2=0.21,P=0.649)。
3.双重感染患者与单纯结核病患者的痰涂片阳性情况:对采集到合格痰标本的123例双重感染患者和489例单纯结核病患者进行了痰涂片检查,阳性检出者分别为9例(7.32%)和171例(34.97%),两组差别有统计学意义(χ2=36.20,P<0.01)。
4.双重感染患者与单纯HIV感染者及AIDS患者的CD4+T淋巴细胞计数:采集到合格标本的159例双重感染患者(1例死亡,未能检测)及505例单纯HIV感染者及AIDS患者的CD4+T淋巴细胞计数分别为74.00个/mm3和282.00个/mm3,两组患者差异有统计学意义(Z=-9.43,P<0.01)。
四、是否接受治疗及卡介苗注射对双重感染患者临床特征的影响
在160例双重感染患者中,接受与未接受艾滋病抗病毒药物治疗(HAART)者在咳嗽咯痰(64.29%、81.36%)、低热(16.67%、50.00%)及体质量下降(16.67%、41.64%)等症状体征的发生率差异均有统计学意义(P值均<0.05)。而有否卡介苗接种史的差异仅在与结核病相符的影像学改变方面有统计学意义(χ2=8.23,P=0.004)。详见表3。
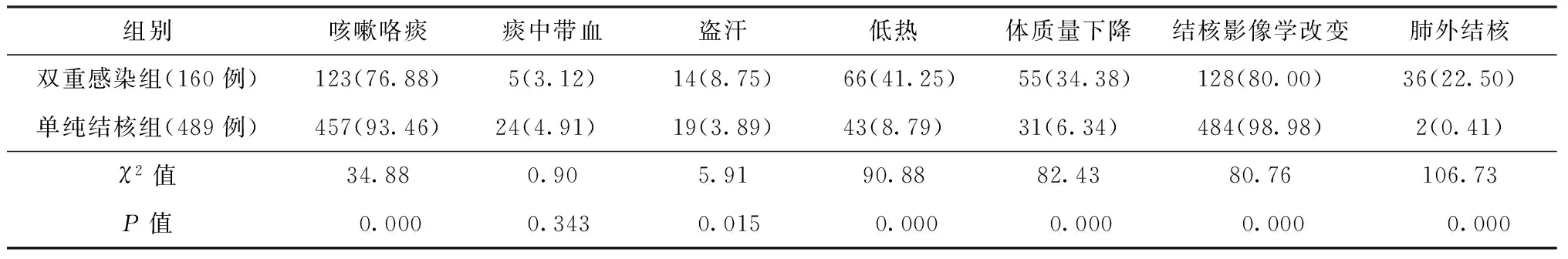
表1 双重感染患者与单纯结核病患者相关临床特征比较
注 括号外数值为“患者例数”,括号内数值为“发生率(%)”
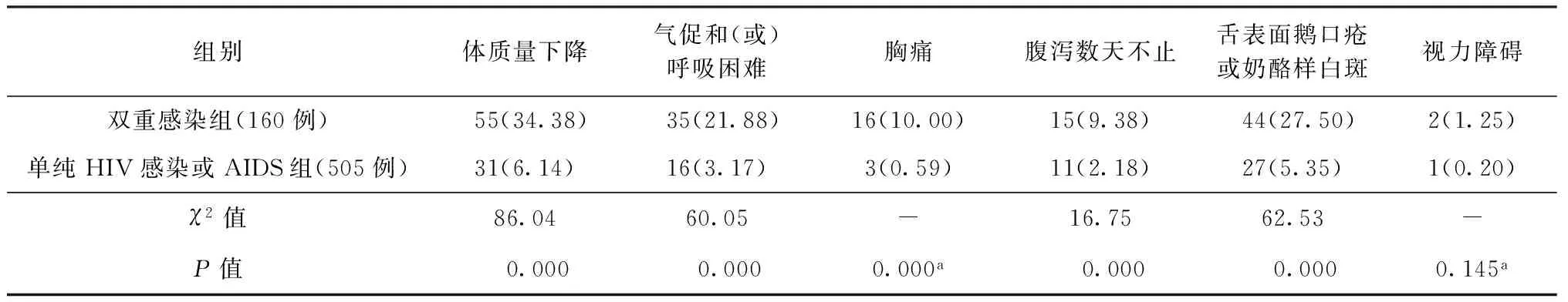
表2 双重感染组患者与单纯HIV感染或AIDS组患者临床特征比较
注 括号外数值为“患者例数”,括号内数值为“发生率(%)”;a:Fisher精确检验
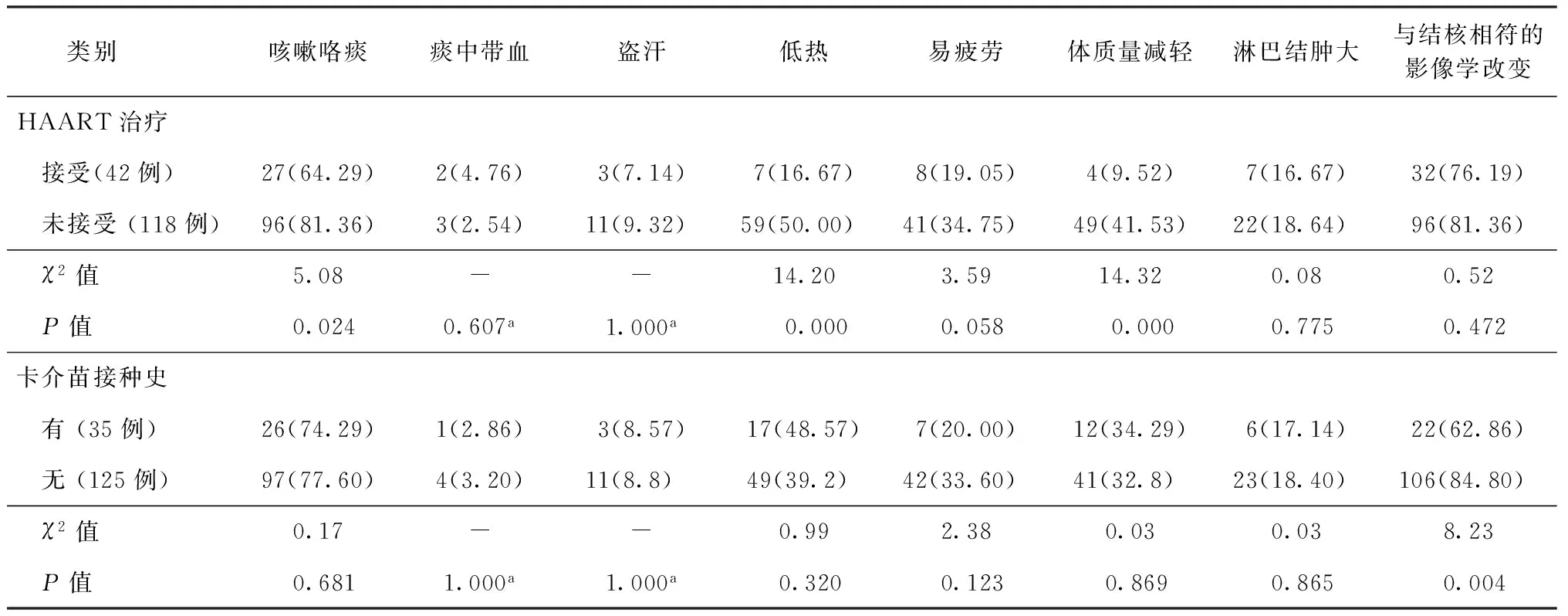
表3 是否接受HAART治疗及卡介苗接种对双重感染患者临床特征的影响
注 括号外数值为“患者例数”,括号内数值为“发生率(%)”;a:Fisher精确检验
讨 论
AIDS患者由于自身免疫机能受损,容易并发MTB感染,且死亡率远远高于普通结核病患者[7]。广西壮族自治区是AIDS的高发区,因此也会出现大量的HIV与MTB双重感染者[8],给结核病防控带来严峻的挑战。
由于HIV感染者与AIDS患者的免疫系统受损,并发结核病时的症状体征不典型[9],致诊断困难。目前,胸部影像学检查和痰涂片抗酸染色作为《指南》中最重要的肺结核的诊断手段之一,在本研究双重感染患者中,与结核病相符的胸部影像学改变的发生率及痰涂片阳性患者的比率均较单纯结核病患者低,导致对HIV感染者与AIDS患者进行肺结核诊断难度的加大,与国内[10]、国外[11]报道相符;而双重感染患者发生率较高的低热、体质量下降等是AIDS患者和结核病患者均可能出现的非特异性的症状与体征,更增加了HIV感染者与AIDS患者MTB感染诊断的复杂性。因此,要定期对HIV感染者与AIDS患者进行随访和结核病相关检查,同时开发、推广新的敏感度和特异度更高的检测手段,如Xpert MTB/RIF等快速诊断方法[12],以及时发现双重感染患者并进行抗结核药物治疗。
本研究中双重感染患者的CD4+T细胞水平较单纯HIV感染者与AIDS患者低,提示患者免疫水平下降容易导致结核病发病。同时,还发现双重感染患者的肺外结核发生率远高于单纯结核病患者,国外的研究也发现,患者免疫功能受损程度越严重,罹患肺外结核的可能性更高[13]。此外,本研究中双重感染患者与单纯HIV感染者及AIDS患者比较,更容易有其他系统的机会性感染症状体征,如鹅口疮或黏膜奶酪样白斑、腹泻不止等。早诊断、早治疗可减轻AIDS患者机会性感染的症状、体征及降低死亡率[14],提高患者的生存质量和生存率。
IGRAs检测在美国已经被批准为结核感染的辅助诊断工具[15]。本研究将IGRAs检测用于HIV阳性者,阳性率为24.19%,高于巴西报道的HIV阳性者的阳性率(15.00%)[16]。提示相对于结核菌素皮肤试验而言,IGRAs检测在HIV阳性者MTB感染的诊断方面有更好的效果,且操作简单、检测快速、可区分因卡介苗注射或MTB自然感染所致的结核菌素皮肤试验阳性结果,并且有高敏感度和特异度等优点[17]。本研究HIV感染者与AIDS患者中,除21.63%的IGRAs阳性者诊断为双重感染患者外,绝大部分为结核分枝杆菌潜伏性感染者,对于这些潜伏感染者,需及时进行预防性治疗,以降低结核病的发生[18],有利于控制结核病的传播。
本研究中采用Xpert MTB/RIF、固体培养和液体培养对HIV感染者及AIDS患者进行MTB的检测。Xpert MTB/RIF检测方法操作简单、方便,敏感度比较高[19],与培养相比,获得结果的时间大大缩短(2.5 h内可得结果),因而也是WHO所推荐的、用于包括HIV感染者及AIDS患者在内的结核病快速诊断工具[20],值得在有条件的地区推广使用。但在HIV感染者中非结核分枝杆菌感染率比普通人群高[21],Xpert MTB/RIF不能检测非结核分枝杆菌感染情况。而培养的方法除可检测MTB感染外,还可检测非结核分枝杆菌感染[22]。因而在实际工作中多种方法综合利用,可更全面地了解HIV感染者的MTB和非结核分枝杆菌的感染情况,从而及早开展针对性的治疗。
双重感染患者在接受了HAART治疗的情况下,咳嗽咯痰、低热及体质量下降等症状体征发生率低于未接受治疗者,其他国家也有类似的报道[23]。说明经过治疗后,双重感染患者的临床症状有所减轻。但同时也要警惕部分患者在接受HAART治疗后发生免疫重建疾病,其症状与体征往往不典型而不易被发现,结核病即是其中重要的一种免疫重建疾病[24],需要加强筛查和诊断,及早发现患者的MTB感染和结核病发病情况。
本研究发现,除与肺结核相符的影像学改变在有、无卡介苗接种史的双重感染患者(成年患者为主)中的差异有统计学意义。目前的研究普遍认为,卡介苗对预防儿童发生严重结核病最有效,但对于成年人肺结核的保护力差异极大[25]。对于卡介苗与肺结核临床症状、体征的关系目前的报道少见,对于本研究发现的差异有统计学意义的结果,有待进一步进行大样本的流行病学研究。
本研究由于经费和试剂短缺等原因,未能对单纯结核病进行培养和Xpert MTB/RIF等检测。今后在条件允许的情况下可进行进一步的深入研究。另外,本研究各组年龄均衡,未进行年龄分层分析。
综上所述,双重感染患者的临床症状与体征复杂,结核病临床特征不典型,容易发生肺外其他部位的结核病及其他机会性感染,增加了临床诊断的困难;需对患者加强监测和随访,并需探索和推广新的快速诊断方法,以便及早发现、治疗双重感染患者,提高患者的生存质量及生存率。
[1] World Health Organization.Global Tuberculosis Report.Geneva:World Health Organization, 2013.
[2] Boehme CC, Nicol MP, Nabeta P, et al. Feasibility, diagnostic accuracy, and effectiveness of decentralised use of the Xpert MTB/RIF test for diagnosis of tuberculosis and multidrug resistance: a multicentre implementation study. Lancet,2011, 377(9776): 1495-1505.
[3] Liang S, Shen Z, Yan J,et al. Low virologic failure and drug resistance among HIV-infected patients receiving hospital-based ART while care and outreach through community in Guangxi, China.Front Public Health,2015,3: 244.
[4] 中华人民共和国卫生部疾病预防控制局,中华人民共和国卫生部医政司,中国疾病预防控制中心.中国结核病防治规划实施工作指南(2008年).北京:中国协和医科大学出版社,2009.
[5] 赵雁林,刘志敏.结核病实验室标准化操作与网络建设.北京:人民卫生出版社,2013.
[6] 中华人民共和国卫生部. 中华人民共和国卫生行业标准:艾滋病和艾滋病病毒感染诊断标准(WS293-2008). 北京:人民卫生出版社,2008.
[7] Geleto A, Abate D, Egata G.Intensified tuberculosis case finding, implementation of isoniazid preventive therapy and associated factors among people living with human immunodeficiency virus at public health facilities of Harari Region, Eas-tern Ethiopia: a cross-sectional study. Int J Health Sci (Qassim), 2017,11(1):1-8.
[8] 杨芳,朱兴莲,王世萍,等.2006—2013 年西昌市 TB/HIV 双重感染流行特征及抗结核治疗情况分析.预防医学情报杂志,2016,32(2):142-144.
[9] Kouassi B, N’Gom A, Horo K,et al. Correlation of the manifestations of tuberculosis and the degree of immunosuppression in patients with HIV. Rev Mal Respir, 2013, 30(7):549-554.
[10] 沈佳胤,卢洪洲. 艾滋病合并结核病的防治研究进展. 中国艾滋病性病, 2015,21(6):543-546.
[11] Gomerep SS, Eze UA, Chiegboka LO,et al. Sputum smear pattern among patients diagnosed with pulmonary tuberculosis in makurdi, north central nigeria. Niger J Med, 2015,24(3):201-206.
[12] World Health Organization. Implementing tuberculosis diagnostics: a policy framework. Geneva:World Health Organization,2015.
[13] Manjareeka M,Nanda S.Prevalence of HIV infection among tuberculosis patients in Eastern India. J Infect Public Health,2013, 6(5):358-362.
[14] Balcha TT, Skogmar S, Sturegård E, et al. Outcome of tuberculosis treatment in HIV-positive adults diagnosed through active versus passive case-finding. Glob Health Action, 2015, 8: 27048.
[15] Mazurek GH, Jereb J, Vernon A, et al. Updated guidelines for using Interferon Gamma Release Assays to detectMycobacteriumtuberculosisinfection-United States, 2010.MMWR Recomm Rep,2010,59(RR-5):1-25.
[16] Kussen GM, Dalla-Costa LM,Rossoni A,et al. Interferon-gamma release assay versus tuberculin skin test for latent tuberculosis infection among HIV patients in Brazil.Braz J Infect Dis,2016,20(1):69-75.
[17] Yu Y, Zhao X, Wang W, et al. Diagnostic performance of interferon-gamma releasing assay in HIV-infected patients in China. PLoS One,2013,8(8): e70957.
[18] Ayele HT, Mourik MS, Debray TP, et al. Isoniazid prophylactic therapy for the prevention of tuberculosis in HIV infected adults: a systematic review and Meta-analysis of rando-mized trials. PLoS One,2015,10(11):e0142290.
[19] 路丽萍,陆斌,刘梅,等.GeneXpert MTB/RIF技术在结核病早期诊断中的应用.中国防痨杂志,2017,39(1):71-75.
[20] Scott C, Walusimbi S, Kirenga B, et al.Evaluation of automated molecular testing rollout for tuberculosis diagnosis using routinely collected surveillance Data-uganda, 2012—2015. MMWR Morb Mortal Wkly Rep,2017,66(12):339-342.
[21] 刘修武,范厚翠,葛成群,等.艾滋病患者非结核分枝杆菌感染的临床分析.中华医院感染学杂志, 2016,26(10):2239-2241.
[22] 杨翰,党丽云,崔晓利,等.BACTEC MGIT 960培养管内浑浊生长抗酸杆菌的分析.中国防痨杂志,2017,39(1):104-106.
[23] Dhungana GP, Sharma S, Khadga P, et al. Surveillance of tuberculosis among HIV infected persons in three different regions of Nepal. Nepal Med Coll J,2013,15(2):113-116.
[24] Affandi JS,Kumar M,Agarwal U,et al. The search for a genetic factor associating with immune restoration disease in HIV patients co-infected withMycobacteriumtuberculosis. Dis Mar-kers,2013,34(6):445-449.
[25] Orme IM.Tuberculosis vaccine types and timings.Clin Vaccine Immunol,2015,22(3):249-257.
(本文编辑:孟莉 薛爱华)
Analysis of clinical features of HIV/MTB co-infected patients in Guangxi Zhuang Autonomous Region
LIANG Da-bin*, LIN Mei, LAN Ru-shu, CUI Zhe-zhe, QIN Hui-fang, LIN Ding-wen, XIE Zhi-man, JIANG Quan, WEI Bo-cai.
*Institute of Tuberculosis Control, Guangxi Zhuang Autonomous Region Center for Disease Prevention and Control, Nanning 530028, China
LIN Mei, Email: gxlinmei@126.com
Objective To explore the clinical features of HIV/MTB co-infected patients in Guangxi Zhuang Autonomous Region (or Guangxi), and to provide scientific basis for further researches on the control, diagnosis and treatment of HIV/MTB co-infection. Methods HIV/AIDS patients who were followed up without previous diagnosis and treatment of TB were continuously enrolled in Nanning, Laibin and Guigang of Guangxi from September, 2013 to August, 2015. Simultaneously, TB patients were enrolled with same genders and similar ages (±3 years).Standardized questionnaire was designed and used to collect the information. The clinical features and laboratory exam results were compared among HIV/MTB cases, HIV/AIDS cases and TB cases. Results Among 1024 enrolled cases infected with HIV, 160 (15.62%) were confirmed/clinical diagnosed HIV/MTB cases, 505 (49.32%) were HIV infection/AIDS patients. And 489 TB cases were enrolled. Less HIV/MTB cases had cough/expectoration (76.88% (123/160)), suggestive radiological findings (80.00% (128/160)) and sputum smear positivity (7.32% (9/123)), when compared with cases of TB (93.46% (457/489), 98.98% (484/489), 34.97% (171/489)) (χ2=34.88, 80.76, 36.20, allP<0.01), while the incidences of fever (41.25% (66/160)), weight loss (34.38% (55/160)), night sweat (8.75% (14/160)) and extrapulmonary TB (22.50% (36/160)) were more than TB cases (8.79% (43/489), 6.34% (31/489), 3.89% (19/489), 0.41% (2/489)), which were significantly different (χ2=90.88,P<0.01;χ2=82.43,P<0.01;χ2=5.91,P=0.015;χ2=106.73,P<0.01). In HIV/MTB cases group, weight loss (34.38% (55/160)), anhelation (21.88% (35/160)), pectoralgia (10.00% (16/160)), lasting diarrhea (9.38% (15/160)), oral thrush or mucous leukoplakia (27.50% (44/160)) were more common when comparing with the HIV/AIDS cases (6.14% (31/505), 3.17% (16/505), 0.59% (3/505), 2.18% (11/505), 5.35% (27/505)) (χ2=86.04, 60.05, Fisher’s exact test, 16.75, 62.53, allP<0.01). The median count of CD4+T cell in HIV/MTB cases (74.00/mm3) was lower than HIV/AIDS cases (282.00/mm3) (Z=-9.43,P<0.01). When comparing the HIV/MTB cases who had not undergone HAART with those had undergone HAART, the former manifested more frequency of cough/expectoration (81.36% (96/118) vs. 64.29% (27/42)), fever (50.00% (59/118) vs. 16.67% (7/42)) and weight loss ((41.53% (49/118) vs. 9.52% (4/42)) (χ2=5.08,P=0.024;χ2=14.20,P<0.01;χ2=14.32,P<0.01). Patients vaccinated BCG or not had significant difference only in suggestive radiological findings (62.86% (22/35) vs. 84.80% (106/125)) (χ2=8.23,P<0.01). Conclusion HIV/MTB cases have more complex clinical features, resulting in more difficulty in diagnosis. Monitoring and follow-up should be strengthened, and new rapid diagnostic tests are needed to be explored and promoted for early identification and treatment of HIV/MTB patients.
HIV infections; Acquired immunodeficiency syndrome;Mycobacteriumtuberculosis; Superinfection; Disease attributes
10.3969/j.issn.1000-6621.2017.07.010
广西医疗卫生适宜技术研究与开发课题(S201310-04)
530028 南宁,广西壮族自治区疾病预防控制中心结核病防制所(梁大斌、蓝如束、崔哲哲、覃慧芳、林定文);广西壮族自治区疾病预防控制中心(林玫);广西壮族自治区南宁市第四人民医院(谢志满);广西壮族自治区来宾市疾病预防控制中心结核病防制科(蒋权);广西壮族自治区贵港市疾病预防控制中心结核病防治科(韦柏才)
林玫,Email: gxlinmei@126.com
2017-01-17)

