胸腺肽α1辅助治疗初治肺结核的临床效果观察
李奎 范传奇 江自成 杨才勇 刘胜昔 方坚
·论著·
胸腺肽α1辅助治疗初治肺结核的临床效果观察
李奎 范传奇 江自成 杨才勇 刘胜昔 方坚
目的 探讨初治肺结核患者早期应用胸腺肽α1辅助治疗的临床治疗效果。方法 收集2009年6月至2014年12月陕西省安康市中心医院感染性疾病科收治的初治肺结核患者,根据随机数字表法进行随机分组:106例进入胸腺肽α1组(化疗加胸腺肽α1,简称“α1组”),109例进入对照组(单纯化疗)。观察治疗前及治疗后第1个月末、3个月末和6个月末的临床疗效、免疫功能变化及复发情况。 结果 两组患者均进行临床治疗,其中治疗6个月时,两组患者均有2例失访。治疗前α1组和对照组CD4+T淋巴细胞计数[分别为450(318~535)个/μl、420(326~508)个/μl]差异无统计学意义(U=5599.00,P=0.696),化疗1个月后两组CD4+T淋巴细胞计数均上升,α1组上升的幅度[262(163~376)个/μl]高于对照组[189(100~282)个/μl],差异有统计学意义(U=4019.50,P<0.01)。治疗第3、6个月末时,α1组患者的痰菌阴转率分别为69.8%(74/106)、99.0%(103/104),均高于对照组同期的痰菌阴转率[分别为55.0%(60/109)、91.6%(98/107)],差异均有统计学意义(χ2=4.99,P=0.025;χ2=6.48,P=0.011)。治疗第3、6个月末时,α1组胸部影像学表现有效率分别为77.4%(82/106)、87.5%(91/104),明显高于对照组[分别为65.1%(71/109)、73.8%(79/107)],差异均有统计学意义(χ2=3.91,P=0.048;χ2=5.18,P=0.023);α1组空洞缩小率分别为76.1%(35/46)、89.1%(41/46),均优于对照组同期的空洞缩小率[分别为53.5%(23/43)、69.8%(30/43)],差异均有统计学意义(χ2=5.00,P=0.025;χ2=5.17,P=0.023);6个月疗程结束时,α1组患者的空洞闭合率(69.6%,32/46)明显高于对照组(48.8%,21/43),差异有统计学意义(χ2=3.96,P=0.046)。6个月疗程结束时,α1组治疗成功率为97.1%(101/104),失败率为2.9%(3/104);对照组治疗成功率为89.7%(96/107),失败率为10.3%(11/107),两组患者的治疗转归情况差异无统计学意义(U=5272.00,P=0.435)。 结论 初治肺结核患者早期抗结核治疗的同时辅助应用胸腺肽α1有助于痰菌阴转、肺内病变的吸收好转和免疫功能的改善。
结核,肺; 胸腺生成素类; 抗生素类, 抗结核; 药物疗法, 联合; 疗效比较研究
结核病免疫学干预手段的研究是目前研究的热点领域之一。结核分枝杆菌(Mycobacteriumtuberculosis,MTB)感染后辅助性T细胞(Th)1反应下降和Th2反应增加,导致Th1/Th2失衡,CD4+T淋巴细胞下降、CD8+T淋巴细胞增多,导致CD4+/CD8+比值下降甚至倒置,是结核病免疫变化的最主要表现[1],调节这种失衡的免疫反应是结核病免疫治疗的一个重要研究方向。一些临床实验显示,胸腺激素在老年、耐药、复治和并发糖尿病的结核病患者中有积极的治疗价值[2-3],但对初治肺结核的研究并不多,为了最大限度发挥其效能,免疫治疗需要继续改进。本研究采用前瞻性研究,通过对初治痰菌阳性肺结核患者进行化疗联合胸腺肽α1免疫调节辅助治疗,与单纯化疗的患者进行比较,分析两组患者的治疗效果、转归及复发情况的差异,以期为临床治疗提供参考。
资料和方法
一、研究对象
为陕西省安康市中心医院感染性疾病科收治的2009年6月至2014年12月符合纳入和排除标准,具有完整临床资料的全部患者。
1.入选标准:(1)痰抗酸染色涂片或培养阳性;(2)胸部影像学检查证实有活动性病变;(3)符合初治条件,包括尚未开始抗结核药物治疗及化疗未满1个月的新发患者;(4)年龄在18~65岁;(5)丙型肝炎病毒、人类获得性免疫缺陷病毒抗体阴性;(6)无严重并发症(如矽肺、癫痫、肾病等)、无严重血液系统异常;(7)本研究已通过医院医学伦理学委员会批准,符合伦理学要求,患者自愿接受药物治疗方案,并签署知情同意书。
2.排除标准:(1)复治患者;(2)粟粒性肺结核、结核性脑膜炎及糖尿病并发结核病患者;(3)孕妇及哺乳期女性;(4)存在肝功能异常者;(5)正在或需要使用免疫抑制剂者;(6)因依从性差或药物不良反应重而退组,或不能坚持治疗、临床资料不全、对结果判定有影响者。
二、分组及治疗方案
1.分组:本研究入选患者均按随机数字表法分为两组,分别为单纯化疗组(对照组)和化疗加胸腺肽α1组(α1组)。对照组109例,男69例,女40例,中位年龄46.0(32~55)岁;α1组107例,男62例,女45例,中位年龄47.0(31~53)岁,治疗1个月后α1组1例女性患者因黄疸退出治疗。纳入治疗的两组患者年龄、性别、体质量指数、空洞率及基础免疫状态等基本特征差异无统计学意义,具有可比性(表1)。
2.治疗方案:对照组采用2H-R-Z-E/4H-R-E化疗方案(H:异烟肼;R:利福平;Z:吡嗪酰胺;E:乙胺丁醇),其中H 0.3 g/d,天津力生制药股份有限公司生产;Z 1.5 g/d,上海上药信谊药厂有限公司生产;E 0.75 g/d,杭州民生药业有限公司生产;R在体质量<50 kg者0.45 g/d,≥50 kg者0.6 g/d,杭州民生药业有限公司生产;所有药物均为口服,1次/d。α1组在以上化疗方案的基础上在第1个月加用注射用胸腺肽α1(海南双成药业股份有限公司生产),1.6 mg/次,皮下注射,隔日1次。两组患者均住院治疗至少1个月。
三、观察指标
1.免疫学检测:治疗前与治疗后1个月分别进行CD4+T淋巴细胞计数检查。
2.细菌学检查:每例患者在化疗前查痰涂片3次(即时痰、晨痰和夜间痰)、培养1次;分别在治疗后第1、3、6个月末给予痰抗酸杆菌涂片检查,每次间隔30 d(即第2、4、7个月末)再次进行痰抗酸杆菌涂片复查。
3.胸部CT检查:治疗前均行胸部CT检查,并且在治疗后第1、3、6个月末进行复查。
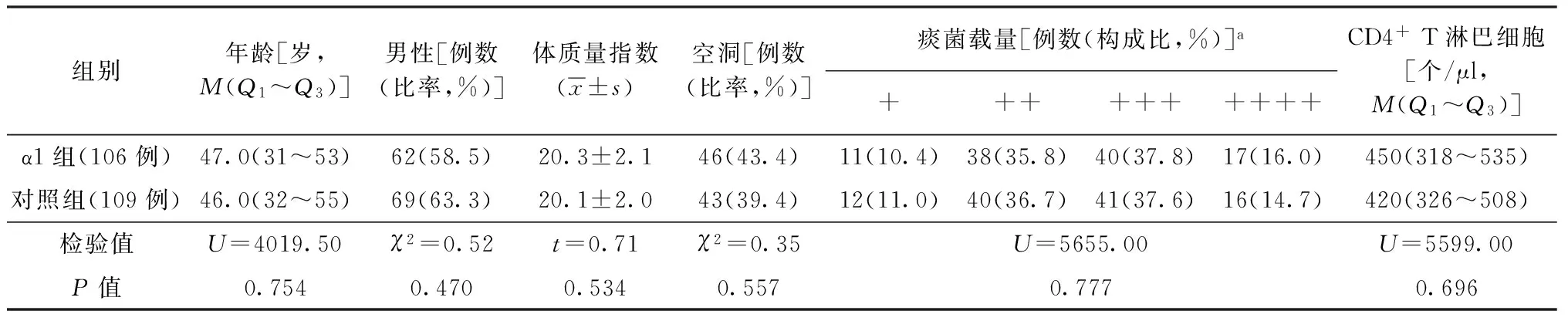
表1 两组患者基本情况比较
注a:痰菌载量由低到高,分别用 “+”~“++++”表示
四、疗效分析
1.痰菌阴转及复发定义:(1)痰菌阴转:连续2次痰涂片或培养阴性,间隔至少30 d,首次得到涂片和培养阴性结果的标本收集时间作为痰菌阴转的时间[4-5]。(2)复发:最近的治疗结果为“治愈”或“完成疗程”,随后进入随访,患者有临床症状则进行胸部X线摄影、痰涂片检查,出现下列情况之一者:①痰涂片或痰培养阳性;②虽痰菌阴性,但胸片上阴影扩大或出现新病灶,并排除类赫反应、炎症、肿瘤及其他非结核病变者[6]。
2.影像学判断标准:以胸部CT扫描观察病灶吸收情况为依据进行判断。(1)病灶吸收情况:“明显吸收”为病灶吸收≥1/2原病灶,“吸收”为病灶吸收<1/2 原病灶。治疗有效率=(明显吸收例数+吸收例数)/总患者例数×100%;(2)空洞改变情况:“闭合”为空洞闭合消失,“缩小”为空洞缩小≥原空洞直径的1/2。
3.治疗转归判断标准:按《耐药结核病化学治疗指南(2015)》[5]的分类进行分析。
4.随访复发率:化疗结束后2年内的复发情况。随访时让患者了解停药后需要立即复查的临床症状,停药后6个月内每3个月、6个月后每6个月进行随访,2年内共随访5次,如患者未及时复查,则通过电话联系的方式对患者进行复查。
五、统计学分析
应用SPSS 16.0软件对数据进行统计分析,两组间痰菌阴转率、胸部影像学表现好转率、空洞缩小及闭合率、药物不良反应发生率和复发率的比较采用χ2检验;体质量指数及CD4+T淋巴细胞计数采用t检验;年龄、痰菌载量及治疗转归采用秩和(Mann-WhitneyU)检验;以P<0.05为差异有统计学意义。
结 果
一、免疫学指标
治疗前两组CD4+T淋巴细胞计数差异无统计学意义(表1),化疗1个月后两组CD4+T淋巴细胞计数均上升,α1组上升的幅度高于对照组,差异有统计学意义(表2)。
二、痰菌阴转情况
α1组患者第1个月末的痰菌阴转率为43.4%,对照组为40.4%,差异无统计学意义;α1组患者第3个月末和第6个月末的痰菌阴转率分别为69.8%、99.0%,均高于对照组同期的痰菌阴转率(分别为55.0%、91.6%),差异均有统计学意义(表2)。
三、病灶变化情况
1. 病灶吸收情况:α1组和对照组第1个月末胸部CT表现总有效率分别为47.2%、39.4%,两组患者总有效率差异无统计学意义;第3、6个月末α1组的总有效率分别为77.4%、87.5%,明显优于对照组同期的总有效率(分别为65.1%、73.8%),差异均有统计学意义(表3)。
2. 空洞改变情况:α1组第3、6个月末的空洞缩小率分别为76.1%、89.1%,均优于对照组同期的空洞缩小率(分别为53.5%、69.8%),差异均有统计学意义;α1组6个月末空洞闭合率为69.9%,优于对照组的48.4%(表4)。
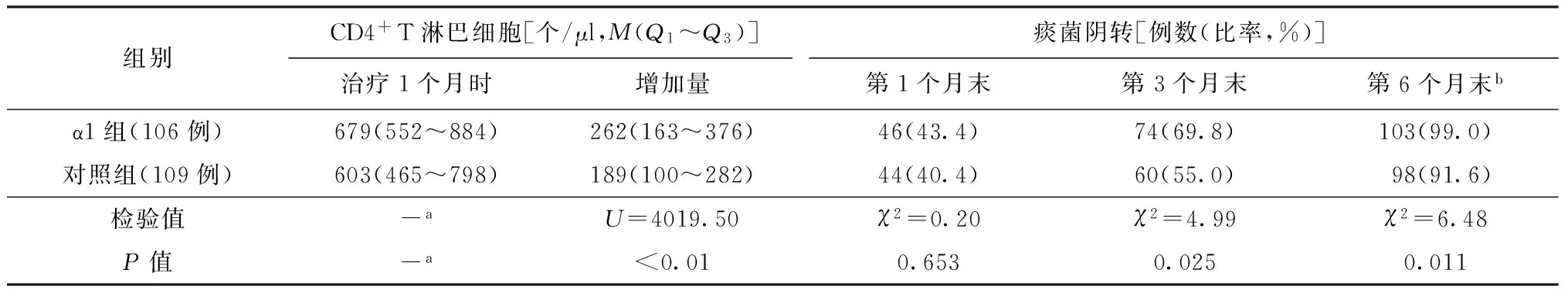
表2 两组患者免疫状态及痰菌阴转情况
注a:无需进行统计学比较;b:治疗第6个月时,α1组和对照组分别失访2例,两组例数分别为104例和107例
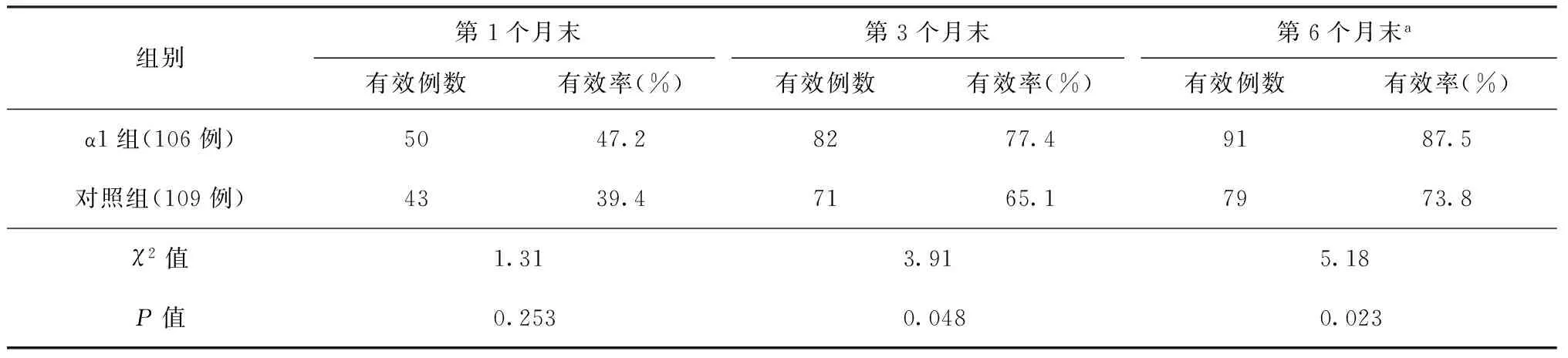
表3 两组患者胸部CT表现吸收情况
注a:治疗第6个月时,α1组和对照组分别失访2例,两组例数分别为104例和107例
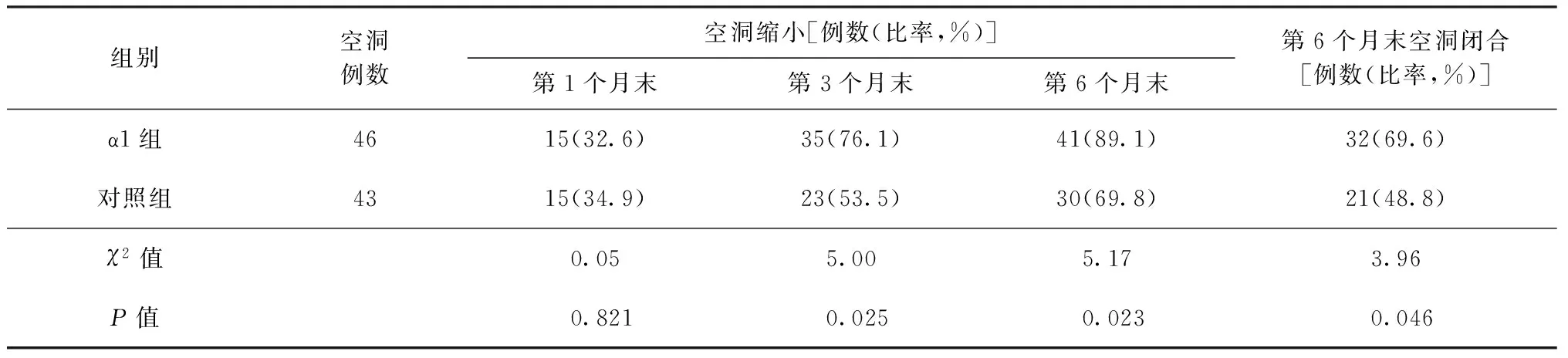
表4 两组患者胸部空洞改变情况
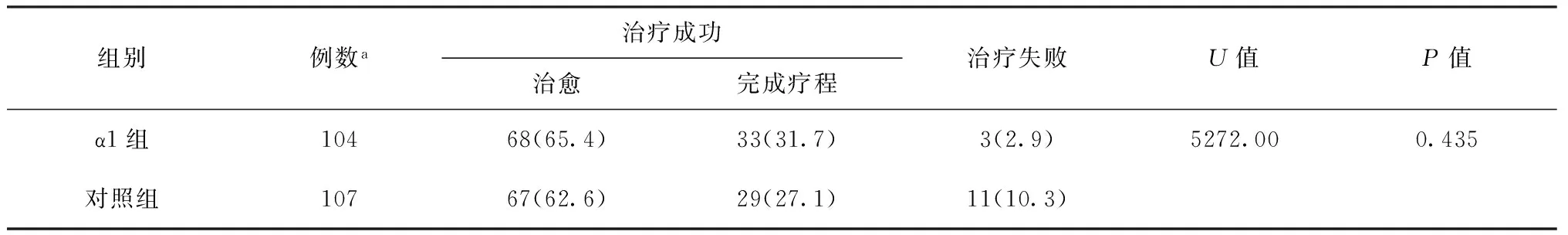
表5 两组患者治疗转归情况[例数(构成比,%)]
注a:治疗第6个月时,α1组和对照组分别失访2例
四、治疗转归
6个月治疗结束时,两组均有2例患者失访;α1组治疗成功率为97.1%,失败率为2.9%,对照组治疗成功率为89.7%,失败率为10.3%,两组患者的治疗转归情况差异无统计学意义(表5)。
五、药物不良反应
α1组的106例患者中,发生肝功能异常5例次,尿酸升高28例次,皮疹4例次,白细胞降低2例次,共出现不良反应39例次。对照组109例中,出现肝功能异常7例次,尿酸升高31例次,皮疹6例次,白细胞降低3例次,共出现不良反应47例次。α1组1例出现黄疸的患者因化疗暂停,未纳入分析,其余出现不良反应的患者经保肝、降尿酸、抗过敏及升白细胞等治疗后好转,未中断治疗。
六、复发情况
治疗结束后随访的2年内,α1组4例复发,复发率为3.8%,对照组12例复发,复发率为11.2%,α1组的复发率低于对照组,差异有统计学意义(χ2=4.09,P=0.043)。
讨 论
结核病是由MTB感染引起的一种慢性传染病,在感染控制和细菌清除方面,机体免疫反应的平衡至关重要,尤其是以CD4+T淋巴细胞介导的Th1型免疫应答起主要作用。结核病致免疫功能失衡的可能机理如下:(1)在活动性结核感染中,MTB可能直接持续下调Th1细胞,导致Th1分泌白细胞介素(IL)-2、γ-干扰素(IFN-γ)和肿瘤坏死因子(TNF)-α等的功能下降[7],这些细胞因子水平的上升与MTB生长抑制[8]及保护性反应相关[9],下降则活化巨噬细胞和CD8+细胞毒性T淋巴细胞吞噬和杀灭MTB的能力明显降低,从而使胞内的MTB免于被机体及时清除;(2)Th2细胞分泌IL-4、IL-10 和TNF-β等细胞因子上升,表达了过度的炎性反应致免疫损伤;(3)由MTB抗原激活的调节性T细胞(Treg)和程序性死亡受体(PD)-1/程序性死亡配体(PD-L)1等具有负性免疫调节作用[10]。IFN-γ可抑制Th2细胞和促进PD-1/PD-L1表达,IL-4和IL-10可抑制Th1细胞表达,Treg可抑制IL-2和IFN-γ等细胞因子的分泌[10],从而构成一个彼此对抗对方的相互调控系统,并在生理状况下保持相对平衡。这种细胞因子网络平衡的倾斜可造成所需要的化疗时间延长、耐药性出现和内源性复燃等一系列问题,常规化疗并不能直接纠正这种异常的免疫反应。结核病免疫治疗旨在改变T淋巴细胞数量及调节细胞因子失衡的状态,达到促进疗效的目的。
目前,结核病免疫治疗的制剂选择仍较局限,拮抗Th2分泌细胞因子的药物仅为短期的动物实验报告、还没用于临床病例研究[11],重组IL-2[12]、IFN-γ等单细胞因子及母牛分枝杆菌菌苗可能有积极作用,但仍缺乏严格的论证基础,治疗性疫苗仍有待于再评估,V5前景看好[13]。胸腺肽α1作为一种双向免疫调节剂,其作用机制包括,刺激外周血液淋巴细胞丝裂原,来促进T淋巴细胞的成熟并分泌IFN-γ、IL-2及IL-3等淋巴因子,纠正Th1/Th2失衡,同时可通过对CD4+T淋巴细胞的激活,增强机体的混合淋巴细胞反应,并增加前NK细胞的聚集及杀伤能力,加强巨噬细胞的吞噬功能,促进CD4+T淋巴细胞及CD4+/CD8+明显上升,尤其是促进处于免疫调节中心地位IL-2的分泌作用不容忽视,从而具有调节和增强细胞免疫功能,维持细胞免疫相对平衡与稳定状态,起到协同增强杀灭MTB的能力[14],为现阶段免疫活性较强并可被大众所获得的免疫制剂。
本研究入选的患者治疗前CD4+T淋巴细胞计数较国内王隽等[15]报道的肺结核患者CD4+T淋巴细胞计数的结果更低,其原因可能系本研究入选患者处于西部地区,与较高的确诊延迟率[16]及较低的及时就诊率有关。本研究的患者辅以胸腺肽α1治疗1个月后外周血CD4+T淋巴细胞数提高,差异有统计学意义。表示经胸腺肽α1治疗后能提升T淋巴细胞亚群CD4+T淋巴细胞绝对值水平,且上升幅度明显,进而使低下的免疫功能得到提高。从痰菌阴转率及胸部CT表现的改善情况看,在1个月时两组差异无统计学意义,而在3个月及6个月时均高于对照组,这种早期无明显差异,后期明显改变,原因可能有3个方面:一是机体受刺激后T淋巴细胞活化分泌细胞因子,使之杀死MTB的能力增强,此过程大约持续3~12周,在此之前细菌学及影像学上不足以显示出区别;二是短期疗效观察受胞外菌的影响,而胸腺肽α1对胞内持留菌的影响在强化阶段强大的化疗作用下显得微不足道;三是痰菌阴转及影像变化滞后于免疫功能改善,随着免疫功能的恢复,有助于促进痰菌阴转、肺部病灶的吸收,达到提高治疗效果的目的,这与国内有关研究结果一致[17]。在疗程结束时α1组的治疗成功率略高于对照组,失访率相当,而治疗失败率较对照组降低,但两组差异无统计学意义,与杜雨华等[18]研究结果一致,提示是否加用免疫增强剂不是影响治疗转归的主要危险因素。
复发率的高低是衡量细胞内MTB杀灭程度的标志,也是化疗效果的考核指标。复发的主要原因是休眠菌、L型菌与宿主防御力之间失去平衡。若宿主免疫力完善,既使有少数休眠菌、L型菌,机体也可抑制其增殖与“返祖”,至少可以保持临床治愈,即休眠菌和宿主防御力维持平衡状态。胸腺肽α1为这种平衡的维持提供了有力支撑,为达到进一步降低肺结核复发率奠定了理论依据。本研究随访中α1组复发率明显低于对照组,可能提示在初治菌阳肺结核患者中,早期胸腺肽α1的应用有助于降低结核复发率,免疫治疗与否与复发事件呈负相关,这与最近Chauhan等[19]研究提示DNA疫苗有减少化疗所需时间等免疫治疗的作用相一致。
治疗过程中,两组患者不良反应多为尿酸升高及肝功能异常等,均为与抗结核药物治疗相关的较为轻微、可逆的症状,在α1组仅部分患者出现注射部位不适,未见其他与胸腺肽α1治疗相关的不良反应。Javadi等[20]对204例肺结核患者的研究中,不良反应的发生率为45.1%。李剑波等[21]研究显示,抗结核药物不良反应总发生率为30.0%。本研究结果与上述报道的发生率不尽相同,原因可能是医生对反应症状的标准判断不同,导致纳入不良反应的情况有差异。
本研究中,在巩固期未首选国家推荐的4H-R标准治疗方案,而是在患者治疗方案中增加了乙胺丁醇,由于入选患者位于贫困和结核病高发区域,且痰菌阳性,医生主要顾虑继发性耐药MTB的产生,其他原因包括既往本区域痰菌阴转情况、增加药物的协同作用及延缓耐药等,在保证方案调整符合基本原则的前提下,经过集体讨论认可采用略强于推荐标准的化疗方案。
总之,机体的免疫能力、MTB的毒力和(或)病变性质等均与结核病预后相关。胸腺肽α1通过提高肺结核患者的细胞免疫功能,有效提高了抗结核治疗效果及降低了复发率。
本研究的局限性:仅以T淋巴细胞亚群数量评价免疫功能仍是有限的,今后应寻找更有价值的指标。入选患者没有考虑初治耐药肺结核及非结核分枝杆菌的影响,胸腺肽α1的临床疗效可能被低估,仍需开展多中心、前瞻性、大样本、随机对照的临床研究对其进行严格评估。
[1] 何娅,潘洪秋,范琳.免疫辅助治疗初治肺结核的研究.中国防痨杂志,2017,39(2):134-139.
[2] 陈雁,乔旭霞.胸腺五肽辅助治疗老年空洞性耐药肺结核临床效果分析.安徽医学,2014,35(3):353-355.
[3] 王钧,任瑞华,李香兰,等.肺结核合并糖尿病患者应用胸腺五肽辅助治疗效果观察.河北医药,2016,38(15):2283-2285.
[4] World Health Organization.Guidelines for the programmatic management of drug-resistant tuberculosis:emergency update 2008.Geneva:World Health Organization,2008.
[5] 中国防痨协会.耐药结核病化学治疗指南(2015).中国防痨杂志,2015,37(5):421-469.
[6] Falzon D, Jaramillo E, Schünemann HJ, et al.WHO guidelines for the programmatic management of drug-resistant tuberculosis: 2011 update. Eur Respir J,2011,38(3):516-528.
[7] Khan N,Vidyarthi A,Amir M,et al.T-cell exhaustion in tuberculosis: pitfalls and prospects. Crit Rev Microbiol,2017,43(2):133-141.
[8] Smith SG,Zelmer A,Blitz R,et al. Polyfunctional CD4 T-cells correlate with in vitro mycobacterial growth inhibition followingMycobacteriumbovisBCG-vaccination of infants.Vaccine,2016,34(44):5298-5305.
[9] Maggioli MF,Palmer MV,Thacker TC,et al.Increased TNF-α/IFN-γ/IL-2 and decreased TNF-α/IFN-γ production by central memory T cells are associated with protective responses against bovinetuberculosis following BCG vaccination. Front Immunol,2016,7:421.
[10] 潘雪,施敏骅.程序性死亡受体-1/程序性死亡配体-1信号途径与结核病免疫机制的研究进展.中华传染病杂志,2015,33(6):374-377.
[11] Buccheri S, Reljic R, Caccamo N, et al.IL-4 depletion enhances host resistance and passive IgA protection against tuberculosis infection in BALB/c mice.Eur J Immunol,2007,37(3):729-737.
[12] 李湘武.白细胞介素-2辅助治疗对结核性胸膜炎患者免疫功能影响的临床.结核病与肺部健康杂志,2016,5(2):144-147.
[13] Butov DA,Efremenko YV,Prihoda ND,et al.Adjunct immune therapy of first-diagnosed TB, relapsed TB, treatment-failed TB, multidrug-resistant TB and TB/HIV.Immunotherapy,2012,4(7):687-695.
[14] Prezzemolo T,Guggino G,La Manna MP,et al.Functional signatures of human CD4 and CD8 T cell responses toMycobacteriumtuberculosis.Front Immunol,2014,5:180.
[15] 王隽,郭茹,王敬,等.芪甲利肺胶囊治疗复治肺结核患者的疗效观察.中国防痨杂志,2016,38(2):139-143.
[16] 王倪,周林,成诗明.不同地区新发涂阳肺结核患者延误水平的变化趋势分析.中国防痨杂志,2011,33(9):562-565.
[17] 周颖,朱建民,周志英,等.中医辅助治疗对耐多药肺结核患者细胞免疫状态改善的影响.中国防痨杂志,2016,38(1):32-37.
[18] 杜雨华,苏汝钊,周惠贤,等.116例耐多药肺结核治疗转归情况影响因素分析.中国防痨杂志,2012,34(1):19-22.
[19] Chauhan P,Jain R,Dey B,et al.Adjunctive immunotherapy with α-crystallin based DNA vaccination reduces tuberculosis chemotherapy period in chronically infected mice.Sci Rep,2013,3:1821.
[20] Javadi MR,Shalviri G,Gholami K,et al. Adverse reactions of anti-tuberculosis drugs in hospitalized patients: incidence, severity and risk factors.Pharmacoepidemiol Drug Saf,2007,16(10):1104-1110.
[21] 李剑波,张丽祥,陆华.肺结核患者不同年龄组发生药物不良反应的对比研究.中国防痨杂志,2016,38(12):1109-1114.
(本文编辑:郭萌)
Clinical efficacy observation of thymosin alpha 1 in the treatment of primary pulmonary tuberculosis
LI Kui,FAN Chuan-qi,JIANG Zi-cheng,YANG Cai-yong,LIU Sheng-xi,FANG Jian.
Department of Infectious Diseases,Ankang City Central Hospital of Shaanxi Province,Ankang 725000,China
LI Kui,Email:42131642@qq.com
Objective To evaluate clinical efficacy of thymosin alpha 1 in the early treatment of primary pulmonary tuberculosis. Methods Two hundred and fifteen cases with primary pulmonary tuberculosis were enrolled in the Department of Infectious Disease of Ankang City Central Hospital during Jun. 2009 to Dec. 2014. According to random number table method, all cases were randomly divided into two groups. That was 106 cases in thymosin alpha 1 group (chemotherapy combined with thymosin alpha 1, alpha 1 group), and 109 cases in the control group (chemotherapy). Clinical effect, immune function and recurrence were observed before treatment and in 1, 3 and 6 months after treatment. Results Clinical efficacy was demonstrated in the two groups. There were each 2 lost cases in alpha 1 group and control group in the 6 months after treatment. The CD4+T lymphocyte count in the α1 group (450(318-535)/μl) and control group (420(326-508)/μl) before treatment were no difference statistically (U=5599.00,P=0.696). The CD4+T lymphocyte counts were increased in two group in the 1 month after treatment. The increase of CD4+T lymphocyte count in the α1 group (262(163-376)/μl) was higher than that (189(100-282)/μl) in the control group with significant difference statistically (U=4019.50,P<0.01). The rates of sputum negative conversion in the 3 and 6 months after treatment in the α1 group (69.8%(74/106) vs. 99.0% (103/104)) were higher than those (55.0%(60/109) vs. 91.6%(98/107)) in the control group with significant difference statistically (χ2=4.99,P=0.025;χ2=6.48,P=0.011). The rates of chest imaging effect in the 3 and 6 months after treatment in the α1 group (77.4%(82/106) vs. 87.5%(91/104)) were higher than those (65.1%(71/109) vs. 73.8%(79/107)) in the control group with significant difference statistically (χ2=3.91,P=0.048;χ2=5.18,P=0.023). The cavity reducing rates in the 3 and 6 months after treatment in the α1 group (76.1%(35/46) vs. 89.1%(41/46)) were better than those (53.5%(23/43) vs. 69.8%(30/43)) in the control group with significant difference statistically (χ2=5.00,P=0.025;χ2=5.17,P=0.023). The cavity closure rates in the 6 months after treatment in the α1 group (69.6%(32/46) were higher than that (48.8%(21/43)) in the control group with significant difference statistically (χ2=3.96,P=0.046). After 6 months of treatment, the rates of success and failure were 97.1% (101/104) vs. 2.9% (3/104) in the α1 group, 89.7% (96/107) vs. 10.3% (11/107) in the control group without significant difference statistically (U=5272.00,P=0.435). Conclusion Chemotherapy combined with adjunctive therapy with thymosin alpha 1 earlier is helpful to sputum negative conversion, lung lesion absorption and immune function improvement in primary pulmonary tuberculosis.
Tuberculosis,pulmonary; Thymopoietins; Antibiotics, antitubercular; Drug therapy, combination; Comparative effectiveness research
10.3969/j.issn.1000-6621.2017.07.014
725000 陕西省安康市中心医院感染性疾病科
李奎,Email:42131642@qq.com
2017-02-16)

