对铝和氯化铜反应的异常现象解释的补充与商榷
吴朝辉
摘要:对铝和氯化铜溶液反应的异常现象解释作了某些补充和更正。通过实验探究和理论分析发现:因受Al3+和Cu(OH)2反应以及Cu2+被Al置换反应的共同影响,铝和氯化铜溶液反应过程中不会出现蓝色沉淀。因为生成的Cu与Al会在体系中形成原电池,使Al能持续反应,所以固体表面会不断产生气泡。由于Al和CuCl2反应生成CuCl的趋势更大,反应更易发生,所以CuCl主要来自Al和CuCl2的反应。
关键词:铝与氯化铜;异常现象;实验探究;教学研讨
文章编号:1005–6629(2016)12–0090–03 中图分类号:G633.8 文献标识码:B
铝片与CuSO4溶液反应,虽然用砂纸擦去了铝片表面氧化膜,但两者的反应速率仍然不太理想,于是笔者改用CuCl2溶液,因为Cl-可穿过氧化膜,取代膜中的氧原子,使具有保护作用的氧化膜成为可溶性氯化物,从而活化金属表面,促进反应进行[1]。但在实验时发现Al与CuCl2溶液的反应现象很出人意料,而且溶液浓度不同,现象也不同。通过检索发现,已有多位老师就这个实验的反应现象进行了深入研究。仔细比对已有文献和反应现象,发现有些现象被忽视了,而对有些现象的解释并不科学。于是结合文献和实验观察,对部分现象进行补充解释,并对某些错误解释提出商榷,以期对Al与CuCl2溶液的反应形成更真实、更全面的认识。本文涉及实验均在21℃下进行。
1 实验现象概述
向烧杯中加入20mL 0.5 mol·L-1 CuCl2浓溶液,加入铝片(未除去氧化膜),可看到:铝片表面析出少量紫红色固体,产生无色无味气体;溶液由绿色变成深褐色;反应变得很剧烈呈沸腾状,烧杯外壁发烫;溶液中出现白色沉淀;如加Al至过量,白色固体最终完全变成紫红色固体,反应结束后得到无色溶液。
如果用0.1 mol·L-1 CuCl2稀溶液,则反应现象为:铝片表面析出疏松的紫红色固体,产生无色无味气体;烧杯发热;溶液最终变为无色;如果Al过量,则固体中持续有少量气体产生。
2 对实验异常现象的已有研究与解释
范艳花等[2]在“铝与氯化铜溶液反应异常现象的探究”(以下简称文1)一文中,对异常现象进行了系统分析,证实:无色无味气体是H2;白色固体是CuCl;深褐色是[CuCl2]-(褐色)与CuCl2(绿色)的混合色;紫红色固体是Cu。
袁鸿志[3]用缠有铜丝的铝片与CuCl2溶液反应,证实是原电池效应造成析出的铜结构疏松。因为H+也在铜丝表面得到电子生成H2,使析出的铜无法形成致密结构。
朱华英[4]在“Al与CuSO4溶液和CuCl2溶液反应有何不同”(以下简称文2)一文中,通过稀释实验证明溶液呈深褐色是因为存在[CuCl2]-、[CuCl3]2-、[CuCl4]3-等配合离子:用大量水稀释溶液,上述配合离子解离,析出白色沉淀。
3 对异常现象的补充解释与商榷
3.1 为什么没有蓝色的Cu(OH)2沉淀
但是,在实验各环节中并没有看到蓝色沉淀(CuCl2没有,CuSO4也没有),文1、文2也未提及有蓝色沉淀现象。为什么不出现蓝色沉淀?经分析,至少存在以下三种可能的原因。
实验1 取少量蓝色沉淀,加5mL蒸馏水,加铝片(未除氧化膜),无明显现象。再加入1滴管0.5 mol·L-1 CuCl2溶液,观察现象。
实验2 取少量蓝色沉淀,加5mL蒸馏水,加热使固体完全变黑,加铝片(未除氧化膜),无明显现象。再加入1滴管0.5 mol·L-1 CuCl2溶液,观察现象。
实验3 取少量蓝色沉淀,加5mL蒸馏水,再加少量AlCl3固体,振荡,固体立即溶解,溶液呈浅绿色且无浑浊。
实验1、实验2中加入CuCl2溶液是为了让反应体系更接近Al与CuCl2溶液的反应。结果看到:铝片表面缓慢产生气泡,10min后固体变成紫红色,最终溶液无色。实验3也证实了原因三是成立的。


4 小结与疑问
Al和CuCl2溶液反应是多个反应同时进行的复杂体系,既有相互竞争,又有相互促进;既有一步到位,又有分步进行。CuCl2溶液浓度不同,不仅反应剧烈程度有差异,各个反应进行程度也有差异。我们可用图1来归纳Al与CuCl2溶液的反应。
Al与CuCl2浓溶液反应,以①②区的变化为主,③区变化为副。Al与CuCl2稀溶液反应,以①③区变化为主,②区变化为副。至于Cu+CuCl2、Cu(OH)2+Al、CuO+H2O+Al的变化,可能存在,但程度很弱。所以,如果要用CuCl2代替CuSO4,应选用CuCl2稀溶液,以避免异常现象冲击课堂教学。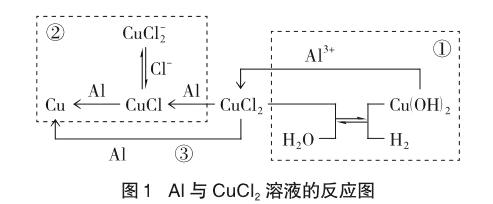
笔者发现实验4还有其他用途:可用CuCl2代替Hg(NO3)2,实现铝和水在常温下反应。析出的Cu和Hg都可阻止铝片表面形成氧化膜,都可利用原电池效应加快铝和水的反应,但用CuCl2溶液替代,可避免使用毒性較大的汞盐,使实验更绿色化。
对于Al与CuCl2溶液的反应,还有一点疑惑:根据H2的现象,可知生成了不少Al(OH)3,可奇怪的是并没有看到白色沉淀(将该试管放置一个星期也未见到)。在实验1~3中,根据原理分析应生成Al(OH)3,为什么也看不见沉淀?笔者推测Al(OH)3可能是以胶体的形式分散到了水中,便采用了丁达尔效应进行验证,结果成功地看到了光亮的通路。但是,因为Al3+也能通过水解形成Al(OH)3胶体,使丁达尔效应这一证明方式失去了惟一性,显得说服力不足。我们有理由质疑:生成的Al(OH)3真的形成胶体了吗?有没有可能生成其他某种可溶性的含铝化合物?虽经多方努力,笔者仍未能找到确切、可靠的实验方法,有待继续思考和探究。
参考文献:
[1]王程杰.关注氯离子效应在实验中的应用[J].化学教学,2015,(12):53~56.
[2]范艳花,赵俊伟,孙丹儿.铝与氯化铜溶液反应异常现象的探究[J].化学教学,2010,(2):9~11.
[3]袁鸿志. Al和CuCl2溶液反应机理的实验探究[J].化学教育,2008,(4):71.
[4]朱华英. Al与CuSO4溶液和CuCl2溶液反应有何不同[J].中学化学教学参考,2011,(7):46.
[5]唐敏.镁和氯化铁反应的实验和讨论[J].化学教学,2009,(12):9~10.
[6][7][9][10]武汉大学、吉林大学等校编.无机化学(第三版)[M].北京:高等教育出版社,1994:505~507,883,663,441.
[8]杨德壬.中学教学全书·化学卷[M].上海:上海教育出版社,1996:898~899.

