甜菜树贝壳杉烯合酶基因的克隆与原核表达
刘洪伟, 王 帅, 王 强, 王 伟, 杨艳芳, 刘锡葵, 邱德有
(1.林木遗传育种国家重点实验室 中国林业科学研究院林业研究所,北京100091;2.四川农业大学 农学院,成都611130;3.中国医学科学院/中国协和医科大学药物研究所,北京100050;4.中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,云南 昆明650204)
甜菜树贝壳杉烯合酶基因的克隆与原核表达
刘洪伟1, 王 帅1, 王 强2, 王 伟3, 杨艳芳1, 刘锡葵*4, 邱德有1
(1.林木遗传育种国家重点实验室 中国林业科学研究院林业研究所,北京100091;2.四川农业大学 农学院,成都611130;3.中国医学科学院/中国协和医科大学药物研究所,北京100050;4.中国科学院昆明植物研究所 植物化学与西部植物资源持续利用国家重点实验室,云南 昆明650204)
本文作者研究了赤霉素合成途径中的关键酶-贝壳杉烯合酶,对其功能的研究可以为以后优化品种提供基因层面的基础。首先通过RACE-PCR技术,从甜菜树叶片中克隆得到贝壳杉烯合酶基因(Ent-kaurene synthase gene,YlKS)的全长cDNA,共2 512 bp(GenBank登录号为KP872698),其ORF长度为2 232 bp,共编码743个氨基酸,预测蛋白质相对分子质量大小为84 987,蛋白质等电点为5.264,表明该蛋白质呈酸性。将该基因构建到表达载体pET32a中,得到重组质粒pET-32a-YlKS。通过将pGG/An2、p IRS和重组质粒pET-32a-YlKS 3个质粒共转入菌株BL21(DE3)中,得到重组菌株,并进行发酵。通过SDS-PAGE分析发现,重组蛋白成功得到了表达。最后通过对发酵产物进行萃取,并使用GC-MS进行检测,确定了该基因所编码的酶确实是贝壳杉烯合酶。
甜菜树;贝壳杉烯合酶;原核表达;气质联用
甜菜树 (Yunnanopilia longistaminata(W.Z.Li)C.Y.Wu et D.Z.Li(Opiliaceae))是我国特有的野生食用木本蔬菜植物[1-2],为山柚子科甜菜树属的乔木植物,主要分布在我国云南红河流域海拔在900~1 500m的亚热带森林中[3]。作为一种有待开发的野生食用植物资源,吴志霜等[4]对它的营养成分进行了报道,发现其氨基酸和维生素C等营养物质的含量都比其他植物丰富。柳建军等对它的脂溶性化学成分进行了分析[5],分离得到了10个化合物,并发现甜菜树提取物具有一定抗氧化活性[6]。刘锡葵等从甜菜树中分离鉴定出两种紫杉烷类物质[3],可能成为一种新的紫杉烷类物质的来源植物,并证明其主要甜味功能因子成分为艾杜醇(iditol)[7]。
作为以嫩茎叶为食用部位的甜菜树,研究其营养生长的基因调控能够为良株筛选提供基因层面上基础及参考。许多研究指出,赤霉素能促进芹菜、苜蓿、茼蒿、苋菜、白菜、菠菜等多种植物茎叶的生长和产量的增加[8]。在植物赤霉素的合成途径中,首先由古巴焦磷酸合酶 (Copalyl pyrophosphate synthase,CPS)催化GGPP形成中间产物内根-古巴焦磷酸(Ent-copalyl diphosphate,CDP),CDP再由内根-贝壳杉烯合酶(Ent-kaurene synthase,KS)催化合成内根-贝壳杉烯(Ent-kaurene),所以KS是赤霉素合成途径中的第2个关键酶[9]。在水稻中内根-贝壳杉烯合酶OsKS1催化赤霉素生物合成的第二步反应,且其只在水稻叶片和茎中表达,而萌发中的种子和根中不表达,说明OsKS1仅与水稻地上部分生长发育相关,不参与种子的萌发和根的生长[10]。但到目前为止,编码KS的基因在多种植物中都被相继克隆得到[11],但在甜菜树上尚未见报道。
本研究中利用RACE-PCR技术首次从甜菜树中克隆得到了KS基因的cDNA全长,并将其构建到原核表达载体pET32a中得到重组质粒,并和质粒pGG/An2(含有一个玉米的ent-CPS基因An2[12])、p ISR[13]共转到表达菌株BL21(DE3)进行发酵,通过GC-MS对发酵产物进行了研究,现将有关方法和结果报道如下。
1 材料与方法
1.1 试验材料
长蕊甜菜树幼苗由中科院昆明植物研究所刘锡葵副研究员实验室培育,在温室种植20 d到生长状态良好,取幼嫩叶片1 g,迅速用液氮冷冻,存于-80℃备用。细菌蛋白质提取试剂盒、克隆载体pUC-19、大肠杆菌DH5α和BL21(DE3):购自北京康为世纪生物科技有限公司;表达载体pET32a由中国医学科学院药物研究所王伟副研究员提供。质粒pGG/An2、p ISR及pET-28-OsKS(含有一个水稻的KS基因OsKS1[14])由四川农业大学的王强教授构建。
1.2 甜菜树叶片RNA的提取
使用北京天恩泽基因科技有限公司的柱式植物RNAout2.0试剂盒,按照其说明书步骤提取冻存的甜菜树叶总RNA,并在样品上柱后纯化之前,加TAKARA公司的DNaseⅠ进行处理,去除DNA。cDNA的合成使用 Clontech公司的 SMARTerTMRACE cDNA Amplification Kit,按照说明书的步骤合成5’和3’RACE Ready cDNA。
1.3 基因RACE、全长克隆与序列分析
通过分析本课题组的甜菜树转录组数据(尚未发表),得到KS基因的片段,并设计RACE-PCR引物YLKS5-1:CCAGATAATCCAGACAGTTAGCGTT T;YLKS3-1:ATGGGCAAAGAATGGCGTGTT。PCR扩增条件为94℃预变性5 min;94℃变性1 min,65℃退火1 min,72℃延伸1 min,共35个循环;72℃延伸10min。
然后通过RACE-PCR扩增得到甜菜树KS基因的两端序列,利用MegAlign拼接出全长,并命名该基因为 YloKS。设计 ORF扩增引物 YLKS1:ATGTTTAAAGCAGATGAGCTCTCCGTT;YLKS2:TT AATTTTGCAGCAAATTTTGCGAT。使用KAPA公司的HIFI热启动高保真酶进行扩增,PCR条件如下:95℃预变性3min;98℃变性20 s,62℃退火15 s,72℃延伸1min,共32个循环;72℃延伸10min。将PCR得到的片段进行胶回收,然后连接到pUC-19克隆载体上送到中美泰和公司进行测序验证。
1.4 表达引物的设计和载体构建
使用软件Primer 5分析克隆到的KS基因序列的以及原核表达载体pET32a的酶切位点,分别选用Bam H I和Not I两个酶切位点(下划线处标出),并设计引物,上游引物为YLKS-PET-1-1:CGGGAT CCATGTTTAAAGCAGATGAGCTCTCCGTT,下游引物为 YLKS-PET-2-1:TTGCGGCCGCTTAATTTT GCAGCAAATTTTGCGAT。以含有YlKS的pUC-19质粒为模板,使用KAPA公司的HIFI热启动高保真酶进行PCR扩增,PCR条件如下:95℃预变性3 min;98℃变性20 s,60℃退火15 s,72℃延伸1min,共3个循环;98℃变性20 s,62℃退火15 s,72℃延伸1min,共28个循环;72℃延伸10min。
将得到的PCR产物使用Axygen公司的PCR产物回收试剂盒进行回收,和表达载体分别使用Kpn I和Not I(NEB公司)进行双酶切。酶切2 h后再次进行纯化,并用的T4 DNA连接酶(NEB公司)16℃连接6 h。转化大肠杆菌DH5α,倒置37℃过夜培养,菌落PCR筛选阳性菌株。将阳性菌株送北京中美泰和公司测序验证。
1.5 重组蛋白的原核表达
将3种质粒pGG/An2、p ISR和重组质粒pET-32a-YlKS(或pET-32a或pET-32a-OsKS)共转化到大肠杆菌BL21(DE3)菌株,涂到含有氯霉素(Chlor,34μg/mL)、壮观霉素(Spec,50μg/mL)和氨苄霉素(Amp,50μg/mL)的平板上,37℃倒置培养过夜。以pGG/An2、pISR和空载体pET-32a(+)3个质粒共转入菌株BL21(DE3)中,得到的菌株作为阴性对照;以pGG/An2、p ISR和pET-28-OsKS 3个质粒共转入菌株BL21(DE3)中,得到的菌株作为阳性对照;以pGG/An2、p ISR和重组质粒pET-32a-YlKS 3个质粒共转入菌株BL21(DE3)中,得到的菌株进行实验。挑取5个单克隆到2 mL含有3种抗生素的液体LB培养基中,活化12 h。
21世纪初中国推出文化“走出去”战略以来,成绩斐然,“译介在其中发挥了十分关键的作用”[1]。谢天振教授提出的“译介”致力于“揭示译语文化系统中的政治、意识形态、文学观念、经济因素等对文学翻译的操纵和影响”[2]。由此,“译介”的概念不再局限于自身框架中,它突破传统意义上的翻译研究,从其他学科汲取养分丰盈自己,获得更为长久的生命力。传播学不仅是一门探讨传播现象与规律的学科,其交叉学科的属性也使得它成为一种研究方法。从传播学的角度来审视文学作品的译介,不仅完善了传播学的知识体系,推动传播学理论建设,也为译介研究提供新思路、新方法、新收获。
取600μL活化的菌液加入到装有60 mL TB培养基的玻璃三角瓶中,37℃培养2.5 h。然后,加入660μL 50%的无菌甘油和6mL的10×磷酸缓冲液。在18℃预培养1 h后,取出三角瓶,加入100μL 5mg/mL的IPTG,在18℃下表达72 h。
取出10mL表达得到的菌液,8 000 r/min下离心8min,去上清液。加入2 mL细菌蛋白质溶解液,充分混匀后37℃孵育3 h,离心取上清液,得到总蛋白质并进行SDS-PAGE电泳,检测YlKS基因的重组蛋白是否表达。
1.6 发酵产物的萃取及GC-MS分析
在50 mL发酵菌液中加入50 mL的正己烷萃取8 h,每隔2 h左右摇晃一下。然后,500W超声5min,使萃取更充分。4℃过夜。取35mL正己烷氮吹,最后定容到1mL,待GC-MS检测。
样品的GC-MS分析采用Agilent 7890A/5975C完成,所用的柱子为HP-5MS(30 m×250μm ID× 0.25μm)。采取不分流方式进样,每次进样1μL。分离程序为:80℃,2 min;10℃/min的速度升温到210℃;以3℃/min的速度升温至240℃;240℃保持3min。进样口温度为250℃,质谱四级杆检测器温度为150℃。质谱条件为仪器默认条件。
2 结果与分析
2.1 YlKS基因的克隆和序列分析
对YlKS的ORF序列进行分析发现其编码743个氨基酸,使用DNASTAR中的EditSeq预测得出其编码的蛋白质相对分子质量约为84 987,蛋白质等电点为5.264,表明该蛋白质呈酸性。
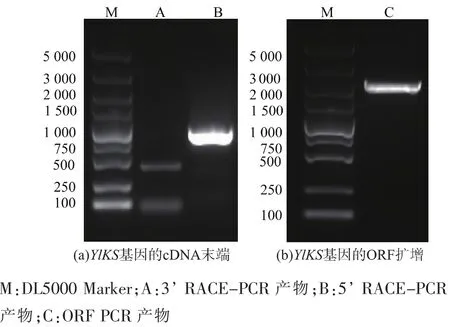
图1 YlKS基因的cDNA末端及ORF扩增Fig.1 Cloning of the cDNA ends and ORF of YlKS
2.2 表达载体pET-32a-YlKS的构建及原核表达
将转化pET-32a-YlKS表达载体的菌株进行PCR鉴定,鉴定结果为阳性。比对测序结果表明,YlKS基因片段已成功连接到表达载体中。
以转入pET-32a载体的菌株作为对照,来分析pET-32a-YlKS载体中YlKS基因的表达情况。两种重组菌株表达后收集菌体并裂解,上清液进行SDS-PAGE电泳验证,结果发现表达的重组蛋白约在103 000位置(见图2),与预测的融合蛋白一致。
2.3 产物GC-MS分析
将对照和样品发酵得到的菌液用正己烷抽提,将抽提溶剂氮吹,定容至1 mL,用GC-MS进行检测。结果显示:阳性对照中贝壳杉烯在GC中保留时间(RT)为20.32min(图3(a)),样品在20.31min处也存在特征峰(图3(b)),而转入空载质粒的阴性对照则在此时间没有相应的特征峰(图3(c))。图4(a)显示为水稻的贝壳杉烯合酶产物的GC-MS图谱,图4(b)显示为甜菜树的贝壳杉烯合酶产物的GCMS图谱,两者质谱图基本一致。通过色谱的保留时间和质谱数据可以判断,本实验中得到的基因确实为贝壳杉烯合酶基因。
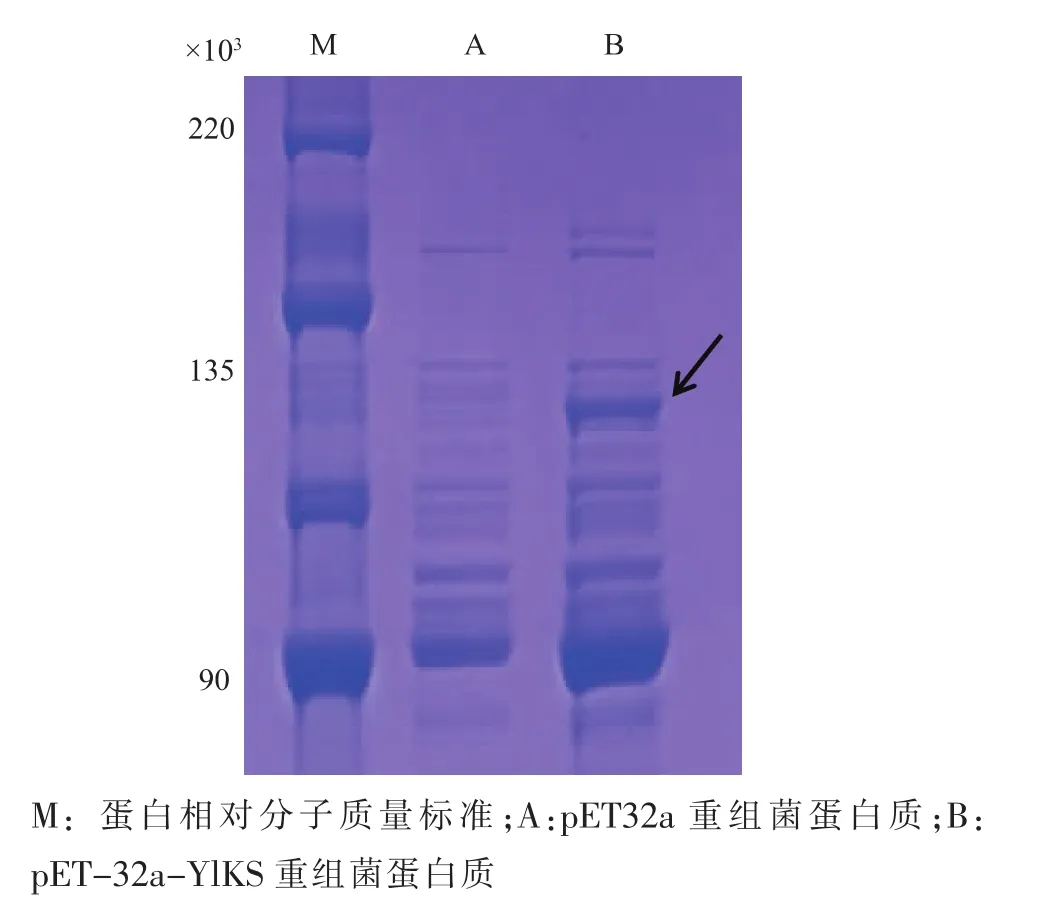
图2 YlKS重组蛋白PAGE电泳Fig.2 PAGE analysis of the Y lKS recombinant protein

图3 大肠杆菌中发酵产物的GC结果分析Fig.3 GC analysis of the fermentation product in E.coli

图4 发酵产物贝壳杉烯的GC-MS结果分析Fig.4 GC-MS analysis of the fermentation product ent-kaurene
3 结语
甜菜树在我国云南地区,作为一种甜味野生蔬菜,深受当地民众的喜爱,近年发现其具有紫杉烷类化合物[6],使人关注它的萜类化合物代谢途径。我们从代谢的角度入手,研究了此植物赤霉素合成途径中的关键酶--贝壳杉烯合酶。本文中借助大肠杆菌系统进行反应,在大肠杆菌中,虽然有甲基-D-赤藓糖醇-4-磷酸 (The methyl erythritol phosphate,MEP)途径,但是异戊烯基焦磷酸(Isopentenyl diphosphate,IPP) 和 二 甲 基 丙 烯 基 焦 磷 酸(Dimethylallyl diphosphate,DMPP)的合成很少,Cyr等[13]将MEP途径中的两个限速酶基因脱氧木酮糖-5-磷酸合成酶基因 (1-deoxy-D-xylulose-5-phosphatesynthase gene,DXS)和脱氧木酮糖磷酸还原异构酶基因 (1-deoxy-D-xylulose-5-phosphate reductase gene,DXR),以及异戊烯基焦磷酸异构酶基因(Isopentenyl diphosphateisomerase gene,IDI)基因剪切信号肽后,重组到pCDFDuet载体中,得到的p IRS重组质粒转入大肠杆菌能够增加 IPP和DMPP的产量,同时将GGPPS基因和CPS基因重组到pACYCDuet质粒中得到pGG/An2重组质粒,可以用来在大肠杆菌中合成GGPP。本文中将pGG/ An2、p ISR和重组质粒pET-32a-YlKS 3个质粒共转入菌株BL21(DE3)中,得到重组菌株,进行发酵,通过对发酵产物进行萃取,应用GC-MS进行检测,确定了YlKS基因表达的酶具有贝壳杉烯合酶的功能。通常情况下,需要对二萜合酶功能验证时,需要先将蛋白质进行表达并得到可溶性的蛋白质,再在体外反应体系中加入底物GGPP进行测试,本文中使用合成生物学技术,使大肠杆菌能够合成底物GGPP,这种验证二萜合酶的方法更省时省力,方便经济,在二萜合酶的研究中具有很大的优势。
赤霉素能促进蔬菜的细胞分裂、细胞伸长、叶片扩大和茎伸长生长,促进侧枝生长、抽苔等[15]。甜菜树的食用部位是嫩茎叶,所以研究赤霉素对甜菜树茎叶的生长是非常重要的。作为赤霉素合成途径中的关键酶之一的KS在苹果[11]、梨[16]中都有研究。在水稻中,如果KS基因缺失突变体表现为严重矮化、不能开花[10],这种现象可以用在对矮化苗的选育中,尤其在矮化的果树砧木研究中有突出作用[11,16]。目前,编码KS的基因在其他多种植物上相继得到克隆[17-20],我们首次报道从甜菜树中克隆得到KS基因,并通过原核表达验证其功能。甜菜树作为中国云南红河流域的一种野生食用木本蔬菜植物,深受当地居民的喜爱,现在也逐渐开始了人工种植,但价格依然昂贵,对该基因的研究可以为以后对甜菜树不同株高的选育提供一定基础。
[1]LIWenzheng.A new species of Melientha(A new recorded genus of opiliaceae from china)[J].Acta Botanica Yunnanica,1989,11(4):407-408.(in Chinese)
[2]WU Zhengyi,LIDezhu.Yunnanopilia-a primitive new genus of opiloaceae from yunnan plateau,China and its biogeographic significance[J].Acta Botanica Yunnanica,2000,22(3):248-250.(in Chinese)
[3]LIU X K,LIU JJ.New source for L-iditoland taxanes[J/OL].Nature Precedings,2008[2017-04-22].http://hdl.handle.net/10101/ npre.2008.1502.1.
[4]WU Zhishuang,WANG Yuehua.Analysis of nutritional components in tender leaves and stems of w ild plant Yunnanopilialongistaminea[J].Journal of Plant Resources and Environment,2005,14(1):60-61.(in Chinese)
[5]LIU Jianjun,LIU Xikui.Chem ical constituents from Yunnanopilia longistaminea[J].Natural Product Research and Development,2008,20(suppl):8-10,13.(in Chinese)
[6]LIU Jianjun,XU Lisong,LIU Xikui.Antioxidantactivity ofwild edible vegetable Yunnanopilia longistaminata[J].Food Science,2008,29(8):125-127.(in Chinese)
[7]LIU Xikui,XIAO Jianqing.Isolation and identification of a sweet function factor from the endem ic w ild vegetable of Yunnanopilia longistaminata[J].Food Science and Technology,2009,34(5):207-209.(in Chinese)
[8]LIU Zhenqi.Prelim inary studies of gibberellin physiological function[J].Plant Physiology Communications,1965,5:29-31.(in Chinese)
[9]SAKAMOTO T,M IURA K,ITOH H,etal.An overview ofgibberellinmetabolism enzymegenesand their relatedmutants in rice [J].Plant Physiology,2004,134(4):1642-1653.
[10]MARGISPM,ZHOU X R,ZHU Q H,etal.Isolation and characterization of a Ds-tagged rice(Oryza sativa L.)GA-responsive dwarfmutantdefective in an early step of the gibberellin biosynthesispathway[J].Plant Cell Reports,2005,23(12):819-833.
[11]DENG Xiaoyun,DAIHongyi,LIANG Meixia.Cloning and expression analysis of ent-kaurene synthase gene MdKS in apple(Malus domestica Borkh)[J].Acta Agriculture Boreali-Sinica,2013,28(2):46-51.(in Chinese)
[12]HARRISL J,SAPARNO A,JOHNSTON A,etal.The maize An2 gene is induced by Fusarium attack and encodesan ent-copalyl diphosphate synthase[J].Plant M olecular Biology,2005,59(6):881-894.
[13]CYR A,WILDERMAN PR,DETEMAN M,etal.A modular approach for facile biosynthesis of labdane-related diterpenes[J]. Journal of the American Chem ical Society,2007,129(21):6684-6685.
[14]XU M,W ILDERMAN PR,MORRONE D,et al.Functional characterization of the rice kaurene synthase-like gene fam ily[J]. Phytochem istry,2007,68(3):312-326.
[15]YE Zixin.The application of gibberellic acid in vegetable production[J].Agriculture and Technology,1997,33(6):486-487.(in Chinese)
[16]CHENG Feifei,OU Chunqing,JIANG Shuling,et al.Cloning and expression analysis of ent-kaurene synthase gene in pear[J]. Journal of Shenyang Agricultural University,2011(6):677-682.(in Chinese)
[17]YAMAGUCHI S,SAITO T,ABE H,et al.Molecular cloning and characterization of a cDNA encoding the gibberellin biosynthetic enzyme ent-kaurene synthase B from pumpkin (Cucurbita maxima L.)[J].The Plant Journal,1996,10(2):203-213.
[18]YAMAGUCHI S,SUN T,KAWAIDE H,et al.The GA2 locus of Arabidopsis thaliana encodes ent-kaurene synthase of gibberellin biosynthesis[J].Plant Physiology,1998,116(4):1271-1278.
[19]RICHMAN A S,GIJZEN M,STARRATT A N,etal.Diterpene synthesis in Stevia rebaudiana:recruitmentand up-regulation of key enzymes from thegibberellin biosynthetic pathway[J].The Plant Journal,1999,19(4):411-421.
[20]SAWADA Y,KATSUMATA T,KITAMURA J,et al.Germination of photoblastic lettuce seeds is regulated via the control of endogenous physiologically active gibberellin content,rather than of gibberellin responsiveness[J].Journal of Experimental Botany,2008,59(12):3383-3393.
Cloning and Expression of the Ent-Kaurene Synthase Gene from Yunnanopilia longistam inata(W.Z.Li,C.Y.W u et D.Z.Li)(Opiliaceae)
LIU Hongwei1, WANG Shuai1, WANG Qiang2, WANGWei3,YANG Yanfang1, LIU Xikui*4, QIU Deyou1
(1.State Key Laboratory of Tree Genetics and Breeding,The Research Institute of Forestry,Chinese Academy of Forestry,Beijing 100091,China;2.College of Agronomy,Sichuan Agricultural University,Chengdu 611130,China;3.Institute of Materia Medica,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100050,China;4.State Key Laboratory of Phytochemistry and Plant Resourses in West China,Kunm ing Institute of Botany,Chinese Academy of Sciences,Kunm ing 650204,China)
Yunnanopilia longistaminata isaw ild woody vegetable in China,and its tender stems and leaves are edible.So far,studies of Y.longistaminata havemostly been focused on tissue culture,physiology and biochem istry,while less concentrated on the gene level.Gibberellin (GA)can enhance vegetative grow th,such as the bolting,and the grow th of stems and leaves.Usingmolecular biology methods,we studied the ent-kaurene synthase,a key enzyme in the synthesis pathway of gibberellins.Ent-kaurene synthase gene(YlKS)was cloned from the leaf of Y.longistaminata through RACE-PCR.The full gene length was 2 512 bp(GenBank accession number KP872698). Results showed that the ORF length of YlKS was 2 232 bp and themolecularweightof its encoded protein(YlKS)was84 987.The theoretical isoelectric pointof YlKSwas5.264,which suggested that YlKS protein was acidic.The gene was cloned into the vector pET32a to get the plasm id pET-32a-YlKS.Plasm ids p IRS,pGG/An2 and pET-32a-YlKSwere co-transformed into BL21(DE3)strain to obtain a new recombinantstrain,and then the recombinantstrainwasused for fermentation. The SDS-PAGE analysis showed that the recombinant protein was expressed successfully.Finally,we used n-hexane to extract the fermentation products and the GC-MS analysis confirmed that the gene in this studywas Ent-kaurene synthase encoding gene.
Yunnanopilia longistaminata,ent-kaurene synthase,prokaryotic expression,GC-MS
Q 943.2
A
1673—1689(2017)05—0479—07
2015-05-06
中国林业科学研究院林业研究所中央级公益性科研院所基本科研业务费专项(RIF2014-01);中国林业科学研究院中央级公益性科研院所基本科研业务费专项(CAFYBB2012042)。
刘洪伟(1987—),男,山东莒县人,农学博士,助理研究员,主要从事紫杉醇相关分子生物学方向的研究。
E-mail:lhwei1987@126.com
*通信作者:刘锡葵(1967—),男,湖南湘潭人,副研究员,主要从事野生食用蔬菜和药用植物资源化学与持续利用方面的研究。
E-mail:liuxikui@mail.kib.ac.cn
刘洪伟,王帅,王强,等.甜菜树贝壳杉烯合酶基因的克隆与原核表达[J].食品与生物技术学报,2017,36(05):479-485.

