多酶偶联催化制备手性化合物(S)-环氧苯乙烷
朱利娟,胡 蝶, 储亚琴,臧 嘉, 余 涛, 邬敏辰*
(1.江南大学 药学院,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122;3.江南大学 无锡医学院,江苏 无锡214122)
多酶偶联催化制备手性化合物(S)-环氧苯乙烷
朱利娟1,胡 蝶2, 储亚琴3,臧 嘉2, 余 涛1, 邬敏辰*3
(1.江南大学 药学院,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122;3.江南大学 无锡医学院,江苏 无锡214122)
在水/有机两相中将羰基还原酶SyS1、葡萄糖1-脱氢酶SyGDH和卤代醇脱卤酶C SyHheC偶联催化α-溴代苯乙酮以高效制备(S)-环氧苯乙烷(SO)。第1步反应催化α-溴代苯乙酮不对称还原为(S)-2-溴-1-苯基乙醇((S)-BPE)及NADPH的原位再生,其优化的反应条件:100mmol/L磷酸钾缓冲液 (pH 8.0)/正己烷 (V∶V=4∶6)、40mmol/Lα-溴代苯乙酮、80mmol/ LD-葡萄糖、0.2mmol/L NADP+和70mg/mL E.coli/Sygdh-Sys1湿菌体(共表达SyGDH和SyS1),终体积1.0 mL,35℃反应8 h。第2步反应催化(S)-BPE脱卤闭环为(S)-SO,其反应条件:在上述反应体系中加入磷酸钾缓冲液(pH 8.0)和0.3 U SyHheC,终体积2.0 mL,35℃反应30 min。通过连续2步酶催化反应,终产物(S)-SO的摩尔产率为99%、对映体过量值>99%。
多酶偶联;(S)-环氧苯乙烷;水/有机两相;不对称还原;脱卤闭环
对映纯环氧化物是一类高附加值的手性合成子或砌块,被广泛应用于药物、精细化学品、农药和功能性材料等的合成[1]。如(S)-环氧苯乙烷(styrene oxide,SO)可用于合成α1-、β2-和β3-肾上腺素能受体激动剂[2]、抗癌药物左咪唑[3]、抗艾滋病药物(-)-hyperolactone C和杀虫剂硫磷嗪等[4-5]。(R)-或(S)-SO的制备有化学法和生物法,每种方法又分为合成法和拆分法。化学合成或拆分法需使用较昂贵的金属催化剂,且存在摩尔产率和对映体过量(enantiomeric excess,e.e.)值低以及环境污染大等缺陷,从而限制了其工业化应用[2,6]。迄今为止,已有较多采用生物拆分法制备(S)-SO的报道,但从外消旋体(R,S)-SO中获得某种对映异构体的最大或理论摩尔产率仅为50%[5]。近年来,采用生物合成法制备手性环氧化物已成为研究热点。Schrittwieser等[7]将短乳杆菌 (Lactobacillus brevis)醇脱氢酶LBADH偶联分支杆菌 (Mycobacterium sp.GP1)卤代醇脱卤酶HheB催化α-氯代苯乙酮制备(S)-SO,其产率为84%、e.e.值>99%。在现有报道中多以α-氯代苯乙酮为底物制备(S)-SO[8-9],而以α-溴代苯乙酮为底物的报道极少,其原因主要是后者在水中易分解[10]。另外,α-溴代与α-氯代苯乙醇相比,溴基团比氯基团更易被氨基或其它亲核试剂取代,也更易形成环氧化物[11]。故采用α-溴代苯乙酮为底物更具挑战性和应用价值。本研究中拟采用水/有机两相取代纯水相,探讨多酶偶联催化α-溴代苯乙酮制备(S)-SO的可行性。
作者所在实验室分别人工合成了SyS1、SyGDH和SyHheC基因Sys1、Sygdh和SyhheC,并将它们在大肠杆菌中进行了表达[12-13]。为了高效制备(S)-SO,本研究中设计一种在水/有机两相体系中多酶偶联催化的方案(见图1)。在第1步反应中,SyS1催化α-溴代苯乙酮不对称还原为 (S)-BPE,并借助SyGDH实现NADPH的原位再生。在第2步反应中,SyHheC催化(S)-BPE脱卤闭环为(S)-SO。同时,对影响(S)-BPE和(S)-SO摩尔产率的主要因素(如温度、有机溶剂、pH值、底物浓度和湿菌体剂量等)进行优化。

图1 多酶偶联催化α-溴代苯乙酮制备(S)-SO流程Fig.1 Flow chart of multi-enzyme cascade catalysis for the preparation of (S) -SO from α -bromoacetophenone
1 材料与方法
1.1 菌株和培养基
共表达SyGDH和SyS1(SyGDH/SyS1)的E.coli/ Sygdh-Sys1菌株及单表达SyHheC的E.coli/SyhheC菌株,由作者所在实验室构建和保藏。LB培养基(w/ v):10 g/L胰蛋白胨、5 g/L酵母提取物和 10 g/L NaCl(固体培养基添加18 g/L琼脂粉),pH 7.2。
1.2 主要试剂和仪器
NADPH和NADP+,购自上海源叶公司;4-氯乙酰乙酸乙酯(COBE),购自北京百灵威公司;α-溴代苯乙酮、(R)-和 (S)-BPE,购自上海安耐吉公司;(R,S)-和(S)-SO,购自上海萨恩公司;其它试剂均为国产或进口分析纯。GC-2010气相色谱仪,日本Shimadzu公司产品;手性气相色谱柱(CP-Chirasil-DEX CB,25 m×0.25 mm×0.25μm),美国Agilent公司产品。
1.3 SyGDH/SyS1和SyHheC的表达
将E.coli/Sygdh-Sys1和E.coli/SyhheC菌株分别接种于含终质量浓度为100μg/mL氨苄青霉素和卡那霉素的2 mL LB培养基中,37℃、220 r/min培养过夜;再分别以2mL/dL转接入30mL LB培养基中,培养至OD600约为0.8时,加入IPTG至终摩尔浓度0.6mmol/L,26℃诱导表达12 h。离心收集菌体,用6mL磷酸钾缓冲液 (20mmol/L,pH 7.5)悬浮,冰浴超声波破细胞,上清液作为SyGDH/SyS1和SyHheC酶液。
1.4 分析方法
1.4.1 酶活性的测定 SyS1活性测定参照文献[13]并略作修改。酶催化反应体系:100mmol/L磷酸钾缓冲液 (pH 7.0)、2 mmol/L COBE、0.2 mmol/L NADPH及适量SyGDH/SyS1酶液,终体积220μL,35℃反应10 min,用酶标仪测定OD340降低值。SyGDH活性测定参照文献[12]。在上述反应条件下,每分钟氧化1μmol NADPH(SyS1)或还原1μmol NADP+(SyGDH)所需的酶量定义为1个酶活性单位(U)。
SyHheC活性测定参照文献[15]并略作修改。在1.5 mL EP管A和B中各加入20μL 200 mmol/L(R,S)-SO溶液、330μL 100mmol/L磷酸钾缓冲液(pH 8.0)和50μL 600 mmol/L NaNO2,35℃预热5min;在A和B管中分别加入100μL SyHheC酶液和磷酸钾缓冲液,35℃反应10min;立即各加入50μL 50 mmol/L对硝基苄基吡啶,80℃保温10 min;迅速冷却至室温,各加入500μL体积分数50%三乙胺显色,用酶标仪测定OD595值。在上述反应条件下,每分钟水解1μmol(R,S)-SO所需的酶量定义为1个酶活性单位(U)。
1.4.2 温度对SyS1催化效率的影响 在20~50℃下,按1.4.1方法测定SyS1活性,最高反应速率以相对酶活性100%计。将SyGDH/SyS1酶液置于25、35℃和40℃下处理6 h,每隔1 h取样,按1.4.1方法测定SyS1残余活性,未处理酶液的酶活性以100%计。当残余酶活性大于80%,即定义为热稳定。
1.4.3 酶对有机溶剂的耐受性 将SyGDH/SyS1和SyHheC酶液分别与各种有机溶剂按等体积混合,35℃、150 r/min处理1 h,离心取下层水相,按1.4.1方法测定残余酶活性,未处理酶液的酶活性以100%计。当残余酶活性在80%以上,表明有机溶剂对酶活性影响不显著。
1.4.4 气相色谱分析 酶催化反应液加入等体积乙酸丁酯(含1 mL/L正己醇作内标),混匀,8 000 r/ min离心,吸取600μL上层有机相,无水硫酸镁干燥,过0.22μm有机膜。样品分析采用GC-2010气相色谱仪、CP-Chirasil-DEX CB手性气相色谱柱和氢火焰离子检测器(FID)。参数设置:进样口和检测器温度均为220℃;色谱柱温度自100℃以10℃/ min升温至200℃;载气为氮气,流量3.0 mL/min,分流比1∶39。(R)-和(S)-SO、α-溴代苯乙酮、(S)-和(R)-BPE的保留时间分别为3.536、3.631、7.415、8.608min和8.728min。
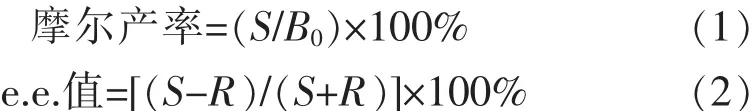
其中,S和R分别代表(S)-和(R)-BPE或(S)-和(R)-SO的最终摩尔浓度,B0代表α-溴代苯乙酮的初始摩尔浓度。
1.5 多酶偶联催化制备(S)-环氧苯乙烷
1.5.1 不对称还原反应的初始条件 100 mmol/L磷酸钾缓冲液(pH 7.0)/正己烷(v/v=4∶6)、20mmol/L α-溴代苯乙酮、80 mmol/LD-葡萄糖、0.2 mmol/L NADP+和60mg/mL E.coli/Sygdh-Sys1湿菌体(共表达SyGDH和SyS1),终体积1.0mL,35℃、150 r/min反应10 h。
1.5.2 不对称还原反应条件的优化 基于α-溴代苯乙酮不对称还原反应的初始条件,采用单因素试验拟对主要因素 (pH值、底物浓度、E.coli/Sygdh-Sys1湿菌体剂量和反应时间)进行优化。酶催化反应液按1.4.4方法分析,以(S)-BPE摩尔产率为指标。
1.5.3 脱卤闭环反应的条件 在上述优化的反应体系中添加磷酸钾缓冲液 (pH 8.0)和0.3 U SyHheC,终体积2.0 mL,35℃反应40min。酶催化反应液按1.4.4方法分析,以(S)-SO摩尔产率为指标。
2 结果与分析
2.1 温度对多酶偶联催化效率的影响
温度对酶催化反应具有双重作用,温度升高可加快酶催化反应速率,但温度过高又会引起酶蛋白变性失活。因此,在某一温度下多酶偶联催化效率的高低取决于各种酶在该温度下催化反应速率和热稳定性的综合平衡因素。按1.4.2方法分析了温度对SyS1催化效率的影响(见图2)。由图2(a)可见,SyS1在35~45℃范围内具有较高的催化反应速率。由图2(b)可见,SyS1在35℃及其以下较稳定(残余酶活性>80%)。另据报道,SyGDH和SyHheC的催化反应速率分别在30~50℃和35~50℃范围内较高,且两种酶均在55℃及其以下(热处理1 h)稳定[12-13]。综合考虑SyS1、SyGDH和SyHheC的催化反应速率和热稳定性,选择在35℃进行多酶偶联催化,包括α-溴代苯乙酮不对称还原及(S)-BPE脱卤闭环。
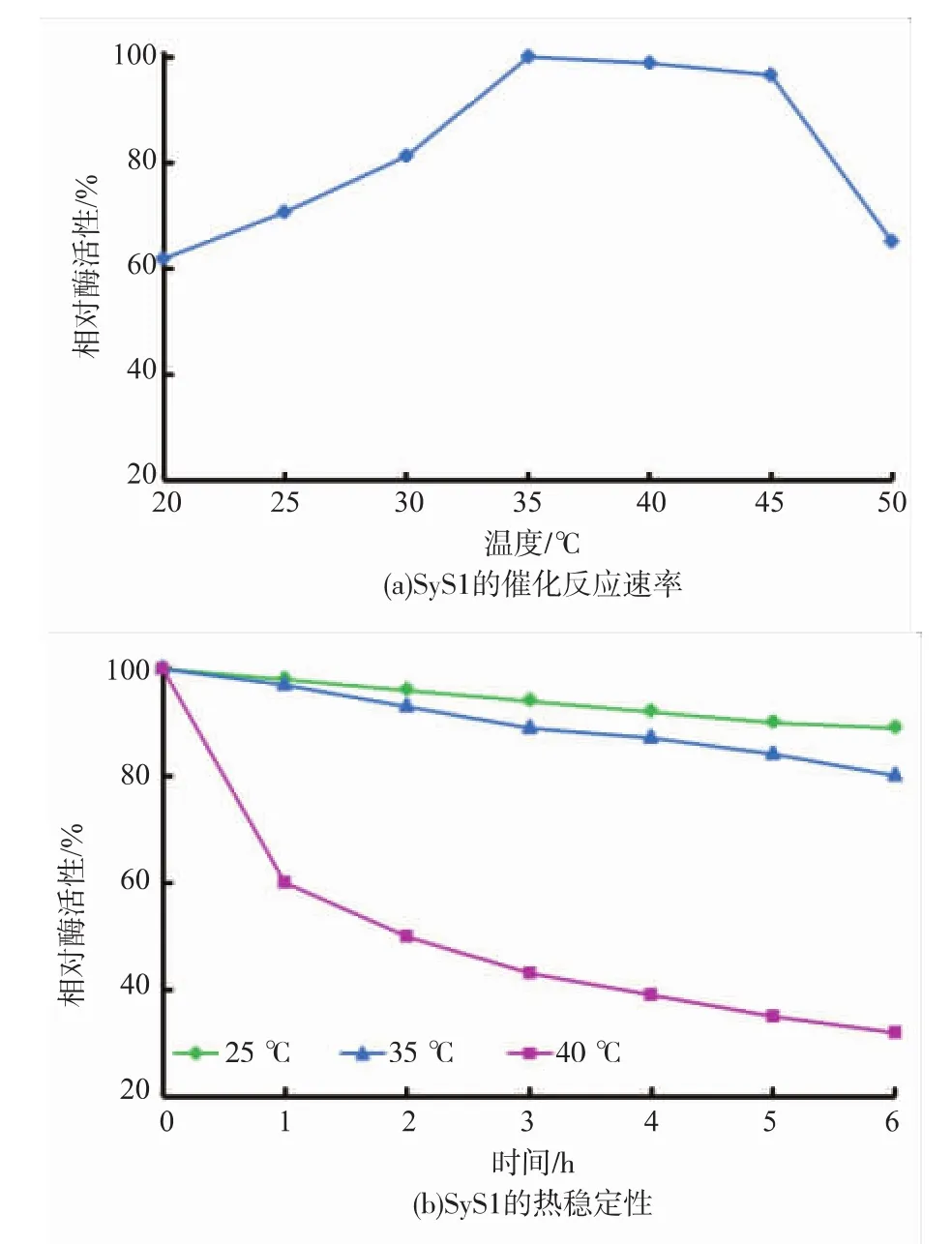
图2 温度对SyS1催化效率的影响Fig.2 Effect of temperatures on the catalytic efficiencyofSyS1
2.2 水/有机两相中有机溶剂的选择
据文献报道,与α-氯代苯乙酮不同,α-溴代苯乙酮在纯水相中不稳定,能自发产生1-苯基-1,2-二醇和苯基乙醇等副产物[10],故在纯水相中催化α-溴代苯乙酮不对称还原所获产物的纯度低。因此,选择合适的有机溶剂组成水/有机两相,是提高底物稳定性和产物纯度的关键。本研究中选取乙酸乙酯等6种常见的非极性有机溶剂与SyGDH/SyS1或SyHheC酶液等体积混合,分析有机溶剂对酶活性的影响(见图3)。由图3可见:乙酸乙酯、乙酸丁酯和甲基叔丁醚显著能使SyS1变性失活 (残余酶活性<20%);正辛烷使SyHheC的残余酶活性<30%;正已烷和环己烷对SyS1和SyHheC活性的影响较小;SyGDH对6种有机溶剂均有较强的耐受性 (残余酶活性>70%)。综合考虑不同有机溶剂对3种酶的影响程度,选择正己烷组成水/有机两相(酶活性>80%)作为多酶偶联催化反应的有机相。
不同配比的水/有机两相对产物的回收率和酶的催化效率都有一定的影响。提高有机溶剂的比例,可以提高底物的稳定性和产物的回收率,但高浓度的有机溶剂对细胞有毒害作用,影响酶活性从而导致产率下降[12]。实验结果表明当缓冲液/正己烷体积比在4∶6以下,产物的摩尔产率均>95%。综合考虑产物的回收率和酶的催化效率(为第2步脱卤闭环反应奠定基础),因而选择缓冲液/正己烷的体积配比为4∶6。

图3 各种有机溶剂对酶稳定性的影响Fig.3 Effect of organic solvents on the enzyme stabilities
2.3 不对称还原反应条件的优化
2.3.1 底物浓度的影响 在35℃、缓冲液/正己烷体积比为4∶6的条件下,考察了不同初始摩尔浓度(10~60mmol/L)的底物α-溴代苯乙酮对不对称还原反应的影响(见图4),结果表明,当底物浓度在40 mmol/L以下,(S)-BPE摩尔产率均能达到95%以上(e.e.值>99%);当底物浓度大于40 mmol/L时,摩尔产率下降较快,一方面可能是底物对酶的抑制作用,另一方面也可能是酶的催化中心达到饱和状态。最终催化反应底物的初始浓度定为40mmol/L。
2.3.2 pH值的影响 反应体系的pH值通过影响酶活性中心氨基酸的解离状态,从而影响酶活性及催化效率。在上述条件(底物浓度40mmol/L,35℃,缓冲液/正己烷体积比为4∶6)下,考察了不同pH(100 mmol/L,4.0~12.0)对反应的影响(见图5)。结果表明,在pH<6.0和>9.0时,(S)-BPE摩尔产率降低较快;在pH 6.0~9.0,摩尔产率>95%,e.e.值>99%且保持不变。同时根据文献[13]研究,SyHheC参与的第二步脱卤闭环反应的最适pH范围是8.0~10.0,最终选定催化反应的pH为8.0。

图4 底物摩尔浓度对不对称还原反应的影响Fig. 4 Effect of substrate concentrationson the asymmetric reduction reaction
2.3.3 湿菌体剂量的影响 在上述优化的条件(底物浓度40mmol/L,35℃,缓冲液/正己烷体积比为4∶6,pH 8.0)下,考察不同质量浓度(50~100 mg/mL)的E.coli/Sygdh-Sys1湿菌体对反应的影响 (见图6),结果表明,菌体质量浓度在50~70 mg/mL时,(S)-BPE摩尔产率随菌体质量浓度的增大而增大;在70mg/mL时,摩尔产率达到最大值99.1%。当菌体质量浓度大于70mg/mL时,产率反而下降,原因可能是在一定范围内,催化体系中结合底物的酶分子活性位点随菌体浓度的增大而增大,但菌体浓度过多增大了反应体系的传质阻力使得底物分子与酶分子不能充分接触而降低催化效率,综合考虑选定湿菌体剂量为70mg/mL。
2.4 多酶偶联催化体系的反应进程
在底物α-溴代苯乙酮摩尔浓度40 mmol/L、35℃、缓冲液/正己烷体积比为4∶6、pH 8.0、E.coli/ Sygdh-Sys1湿菌体质量浓度为70mg/mL的条件下,第1步不对称还原反应的进程如图7(a)所示,中间产物(S)-BPE在反应2 h内生成的速度较快;2~8 h内放缓,可能是随着反应的进行酶活性不断下降,且产物的积累对酶活性也有一定的抑制作用。8 h时摩尔产率达到99.1%,e.e.值>99%。随后,SyHheC催化中间产物 (S)-BPE进行脱卤闭环合成终产物(S)-SO,第2步脱卤闭环反应进程如图7(b)所示,在20min内(S)-SO迅速积累,30min时(S)-SO的摩尔产率可达99%且e.e.值一直保持在99%以上。
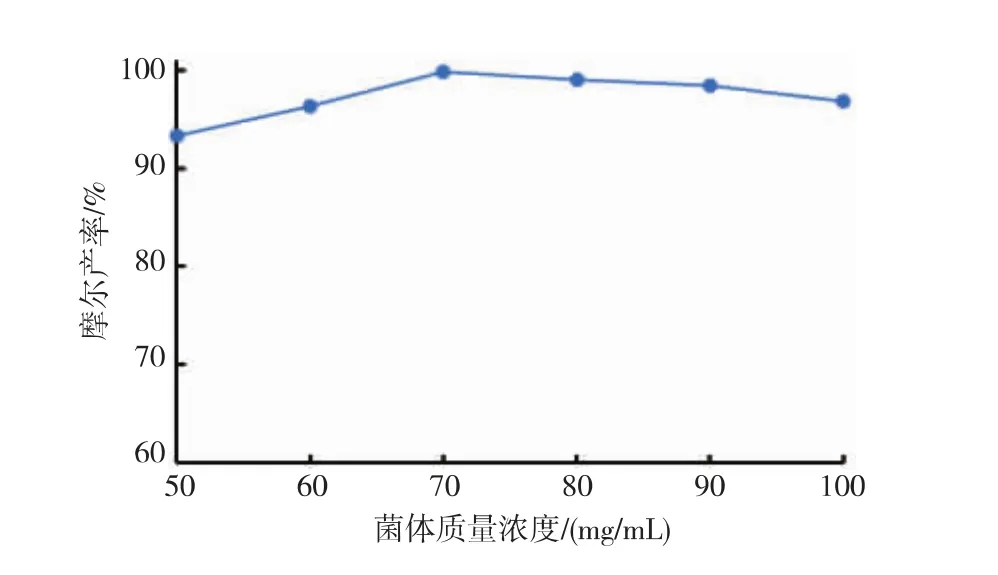
图6 菌体质量浓度对不对称还原反应的影响Fig.6 Effect of cell concentrations on the asymmetric reduction reaction

图7 多酶偶联催化体系的反应进程Fig.7 Reactioncourses of the multi-enzyme cascade catalysis
3 结语
本文作者在SyGDH催化葡萄糖提供辅酶循环的基础上,于水/有机两相中将SyS1和SyHheC偶联催化α-溴代苯乙酮合成重要的手性药物中间体(S)-SO,并对其第1步不对称还原反应的条件进行了优化,较Ren等[11]报道的底物浓度提高2.4倍、时间缩短6 h。研究表明在优化的催化反应条件下反应8 h后,添加0.3 U SyHheC,35℃反应30min后可得到终产物(S)-SO的摩尔产率达99%且e.e.值>99%。实验结果说明所设计的水/有机两相中多酶偶联催化的体系可以将前手性酮转化为光学纯的药物中间体,具有原料经济,过程方便易行,产物摩尔产率大、高e.e.值等优点,具有很大的应用价值,本研究也为多酶偶联催化反应体系合成手性药物中间体奠定了良好的基础。另外,多酶偶联催化反应体系中第1步不对称还原反应的催化时间(8 h)是第2步脱卤闭环反应(30 min)的16倍,下一步可以考虑通过理性改造SyS1以解除第1步限速反应,达到提高(S)-SO生产效率的目的。
[1]CHOIW J.Biotechnologicalproduction of enantiopureepoxidesby enzymatic kinetic resolution[J].Applied M icrobiology and Biotechnology,2009,84(2):239-247.
[2]HAMADA T,TORIIT,IZAWA K,et al.Practical synthesis of optically active styrene oxides via reductive transformation of 2-chloroacetophenonesw ith chiral rhodium catalysts[J].Organic Letters,2002,4(24):4373-4376.
[3]MOERTELC G,FLEM ING TR,MACDONALD JS,etal.Levamisole and fluorouracil for adjuvant therapy of resected colon carcinoma[J].The New England Journal of M edicine,1990,322(6):352-358.
[4]HODGSON DM,MAN S.Synthesisof the anti-HIV agent(-)-hyperolactone C by using oxonium ylide formation rearrangement [J].Chem istry:A European Journal,2011,17(35):9731-9737.
[5]WU S,LIA,CHIN Y S,et al.Enantioselective hydrolysis of racemic and meso-epoxides w ith recombinant Escherichia coli expressing epoxide hydrolase from Sphingomonas sp.HXN-200:preparation of epoxides and vicinal diols in high ee and high concentration[J].ACSCatalysis,2013,3(4):752-759.
[6]KLUNDER J M,KO S Y,SHARPLESS K B.Asymmetric epoxidation of allyl alcohol:efficient routes to homochiral β-adrenergic blocking agents[J].Journal of Organic Chem istry,1986,51(19):3710-3712.
[7]SCHRITTWIESER J H,LAVANDERA I,SEISSER B,et al.Shifting the equilibrium of a biocatalytic cascade synthesis to enantiopureepoxidesusing anion exchangers[J].Tetrahedron:Asymmetry,2009,20(4):483-488.
[8]SEISSER B,LAVANDERA I,FABER K,etal.Stereo-complementary two-step cascades using a two-enzyme system leading to enantiopure epoxides[J].Advanced Synthesis&Catalysis,2007,349(8/9):1399-1404.
[9]CHEN S Y,YANG C X,WU JP,et al.Multi-enzymatic biosynthesis of chiralβ-hydroxy nitriles through co-expression of oxidoreductase and halohydrin dehalogenase[J].Advanced Synthesis&Catalysis,2013,355(16):3179-3190.
[10]ROCHA L C,FERREIRA H V,PIMENTA E F,et al.Biotransformation ofα-bromoacetophenones by the marine fungus Aspergillus sydowii[J].M arine Biotechnology,2010,12(5):552-557.
[11]REN J,DONG W Y,YU B Q,et al.Synthesis of optically activeα-bromohydrins via reduction ofα-bromoacetophenone analogues catalyzed by an isolated carbonyl reductase[J].Tetrahedron:Asymmetry,2012,23(6):497-500.
[12]YU Tao,HU Die,WU M inchen,et al.Enzymatic characterization and coenzyme regeneration of a recombinant glucose 1-dehydrogenase[J].Journal of Food Science and Biotechnology,2014,33(9):910-916.(in Chinese)
[13]冯峰.卤代醇脱卤酶SyHheC的基因克隆、表达及应用研究[D].无锡:江南大学,2014.
[14]宿宇宁.双酶共表达重组菌不对称还原制备光学纯(R)-2-羟基-4-苯基丁酸乙酯[D].无锡:江南大学,2013.
[15]TANG Yanfa,XU Jianhe,YEQin.A spectrophotometric assay for determination ofepoxide concentration and epoxide hydrolase activity[J].Journal of Analytical Science,2002,18(2):142-144.(in Chinese)
M ulti-Enzyme Cascade Catalysis for the Preparation of Chiral Com pound(S)-Styrene Oxide
ZHU Lijuan1, HU Die2, CHU Yaqin3, ZANG Jia2, YU Tao1, WUMinchen*3
(1.School of Pharmaceutical Science,Jiangnan University,Wuxi 214122,China;2.School of Biotechnology,Jiangnan University,Wuxi214122,China;3.WuxiMedical School,Jiangnan University,Wuxi214122,China)
In an aqueous/organic two-phase,cascade catalysis was carried out for the efficient preparation of(S)-styrene oxide(SO)by a combination of carbonyl reductase(SyS1),glucose 1-dehydrogenase (SyGDH)and halohydrin dehalogenase C (SyHheC).The firststep was to asymmetrically reduceα-bromoacetophenone into(S)-2-bromo-1-phenylethanol((S)-BPE)and to regenerate NADPH in situ.The optim ized conditionswere 100mmol/L potassium phosphate buffer(pH 8.0)/n-hexane(v∶v=4∶6),40mmol/Lα-bromoacetophenone,80mmol/LD-glucose,0.2mmol/L NADP+and 70mg/m L wet E.coli/Sygdh-Sys1 cells(co-expressing both SyGDH and SyS1)in a volume of1.0m L at35℃for8 h.The second step was dehalogenation ring-closure of(S)-BPE into(S)-SO by adding potassium phosphate buffer(pH 8.0)and 0.3 U SyHheC into the above reactionsystem,in a volume of2.0m L,at35℃for 30m in.Through two stepsof enzyme catalysis,the final product(S)-SO was obtained w ith amolar yield of 99%and an enantiomeric excess valuemore than 99%.
multi-enzyme cascade,(S)-styrene oxide,aqueous/organic two-phase,asymmetric reduction,dehalogenation ring-closure
Q 814.9
A
1673—1689(2017)05—0473—06
2015-06-03
国家自然科学基金项目(31271811);江苏省普通高校研究生科研创新计划项目(SJLX-0529)。
*通信作者:邬敏辰(1962—),男,江苏无锡人,理学博士,教授,博士研究生导师,主要从事酶工程与基因工程研究。
E-mail:bioch@163.com
朱利娟,胡蝶,储亚琴,等.多酶偶联催化制备手性化合物(S)-环氧苯乙烷[J].食品与生物技术学报,2017,36(05):473-478.

