复方鳖甲软肝片辅助治疗慢性丙型肝炎纤维化疗效观察
马小勇,席蓉蓉,房 荣*
(延安市人民医院感染科,陕西 延安 716000)
复方鳖甲软肝片辅助治疗慢性丙型肝炎纤维化疗效观察
马小勇,席蓉蓉,房 荣*
(延安市人民医院感染科,陕西 延安 716000)
目的 观察复方鳖甲软肝片辅助治疗慢性丙型肝炎纤维化的疗效。方法 将56例慢性丙肝患者随机分为观察组与对照组各28例,观察组采用复方鳖甲软肝片联合聚乙二醇干扰素ɑ-2b(PegIFNɑ-2b)及利巴韦林治疗,对照组采用PegIFNɑ-2b及利巴韦林进行治疗,疗程24周,持续2个疗程。观察比较2组患者的病毒学应答、肝脏瞬时弹性成像,检查测定肝脏硬度值(LSM)、治疗前后血清丙氨酸氨基转氨酶(ALT)及透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PC-Ⅲ)、Ⅳ型胶原(Ⅳ-C)、血清肿瘤坏死因子 α(TNF-α)、转化生长因子-β1(TGF-β1)、白介素 6(IL-6)的变化。 结果 观察组患者获得持续病毒应答(SVR)20例,对照组18例,组间比较差异无统计学意义(P>0.05);两组LSM较治疗前均降低,观察组LSM显著低于对照组(P<0.05);治疗后观察组 ALT、HA、LN、PC-III、IV-C、TNF-α、TGF-β1、IL-6 较治疗前显著降低,差异有统计学意义(P<0.05),观察组治疗效果优于对照组,差异有统计学意义(P<0.05)。结论 复方鳖甲软肝片可显著改善慢性丙型肝炎肝纤维化程度,起到辅助治疗的作用。
慢性丙型肝炎;复方鳖甲软肝片;肝纤维化;利巴韦林;肝脏瞬时弹性;病毒学应答
丙型肝炎(hepatitis C)是一种全球性流行传染病,据世界卫生组织统计全球丙型肝炎(hepatitis C virus,HCV)感染人数约1.85亿,感染率约为2.8%,每年新发病例约35万例。丙型肝炎的危害之一是容易慢性化,感染者中有70%左右会演变为慢性丙型肝炎(chronic hepatitis C,CHC),而慢性感染可导致肝脏慢性炎症坏死及纤维化,逐渐演变为肝硬化及肝癌[1]。临床采用聚乙二醇干扰素α-2b(PegIFNα-2b)联合利巴韦林为治疗CHC的标准方案,对抑制HCV-DNA的复制有良好效果。复方鳖甲软肝片有软坚散结、化瘀解毒、益气养血的功效,治疗肝炎纤维化、肝硬化的效果显著[2-3]。本研究在采用PegIFNɑ-2b及利巴韦林治疗丙型肝炎的基础上联合复方鳖甲软肝片辅助治疗,观察其对患者肝纤维化的改善作用,现报道如下。
1 资料与方法
1.1 一般资料
选取2013年1月至2016年1月本院住院及门诊患者56例。按随机数字表法将患者分为西药组(对照组)、中药+西药组(观察组)各28例。观察组男 19 例,女 9 例,年龄 20~67 岁,平均(38.1±11.7)岁,平均病程(5.7±0.6)年;对照组男 21 例,女 7 例,年龄 21~69 岁,平均(19.2±12.3)岁,平均病程(6.3±0.8)年。所有患者均未接受过干扰素治疗,2组患者的一般资料比较差异无统计学意义(P>0.05)。
1.2 病例选择标准
1.2.1 诊断标准 根据中华医学会肝病学分会指定的《丙型肝炎防治指南(2015年更新版)》[4]标准:(1)HCV 感染 6 个月以上,血清抗-HCV 阳性;(2)血清 HCV RNA 阳性;(3)HCV 基因属于 2/3 型;(4)瞬时弹性成像(transient elastography,TE)测定肝硬度≥7.3 kPa。
1.2.2 纳入标准 患者需满足以下标准:(1) 符合上述丙型肝炎诊断标准;(2)HCV基因类型为2型或3型;(3)血清学检查透明质酸(haluronic acid,HA)、层粘连蛋白(laminin,LN)、Ⅲ型前胶原(PC-Ⅲ)、Ⅳ型胶原(Ⅳ-C)、天门冬氨酸氨基转移酶(AST)/丙氨酸氨基转氨酶(ALT)比值、谷氨酰转肽酶(GGT)和碱性磷酸酶(ALP)升高;(4)血清肿瘤坏死因子 α(TNF-α)、转化生长因子-β1(TGF-β1)、白介素 6(IL-6)水平异常。
1.2.3 排除标准 (1)失代偿期硬化患者(如患有肝性脑病、腹水、出血性静脉曲张等疾病患者);(2)合并乙型肝炎、HIV感染或其他自身免疫性疾病患者;(3)妊娠期或哺乳患者;(4)严重感染,心功能不全、慢性阻塞性肺炎、酒精性肝病患者。
1.3 治疗方法
对照组28例患者应用PegINFα-2b(佩乐能,爱尔兰先灵葆雅公司,S20110083,80 μg/支),80 μg/周,同时每天口服利巴韦林(华北制药股份有限公司,批号 130221,20 mg/片)3 次/d,15 片/次。 观察组在对照组用药基础上服用复方鳖甲软肝片(内蒙古福瑞医疗科技股份有限公司,0.5 g/片), 一次 4片,3次/d,一个疗程24周,共治疗2个疗程。
1.4 观察指标
治疗前后分别检测血清抗-HCV水平、肝脏硬度值(LSM)、肝纤维化指标 HA、LN、PC-III、IV-C 及血清 TNF-ɑ、TGF-β1、IL-6 及肝功能指标 ALT。 其中肝瞬时弹性成像检查(TE)采用法国Echosens公司生产的肝纤维化扫描仪,肝功能相关检测由迈瑞BS-390完成,酶联免疫吸附试验(ELISA)法检测TNF-ɑ、TGF-β1、IL-6,试剂盒购自上海远慕生物科技有限公司。每四周进行一次门诊随访,检测血常规,肝/肾功能、血糖、甲状腺功能,并记录不良反应。
1.5 疗效评定标准
根据《丙型肝炎防治指南(2015年更新版)》[4],HCV治疗应答判定标准包括早期病毒学应答(early viral response,EVR):治疗12周时血清HCV RNA为阴性或载量<2log10 IU/mL;治疗结束时病毒学应答(end-of-treatment viral response,ETVR):治疗结束后血清HCV RNA载量<2log10 IU/mL;持续病毒学应答(sustained viral response,SVR):治疗结束后24周,血清HCV RNA载量<2log10 IU/mL;非持续病毒学应答(non-sustained viral response,NSVR):治疗24周后血清HCV RNA为阳性。
1.6 统计分析
采用SPSS 18.0统计软件进行数据分析,计量资料用“±s”表示,组间比较采用 t检验,计数资料用百分数(%)表示,采用 χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
两组患者的病毒学应答比较相当,差异无统计学意义(P>0.05)。 见表 1。
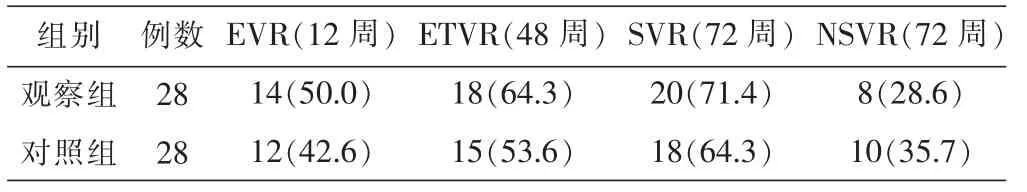
表1两组患者临床疗效比较 [例(%)]
2.2 两组患者治疗前后肝功能指标及血清肝纤维化指标比较
两组患者治疗后肝功能指标ALT及肝纤维化指标HA、LN、PC-III、IV-C较治疗前均有显著改善,差异有统计学意义(P<0.05);观察组在治疗后的ALT、HA、LN、PC-III、IV-C 水平较对照组下降幅度更大,改善更为明显,差异有统计学意义(P<0.05)。见表2。
2.3 两组患者治疗前后肝脏硬度值(LSM)比较
治疗后2组患者LSM较治疗前均显著降低(P<0.05);治疗后观察组LSM值低于对照组,两组间差异有统计学意义(P<0.05)。 见表3。
表 2 两组患者治疗前后 ALT、HA、LN、PC-III和 IV-C 的变化 (±s,n=28)
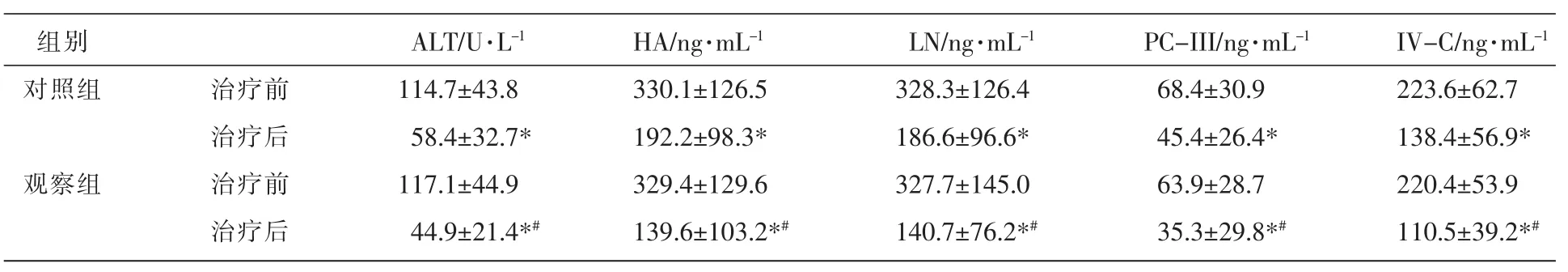
表 2 两组患者治疗前后 ALT、HA、LN、PC-III和 IV-C 的变化 (±s,n=28)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
组别对照组观察组治疗前治疗后治疗前治疗后ALT/U·L-1114.7±43.8 58.4±32.7*117.1±44.9 44.9±21.4*#HA/ng·mL-1330.1±126.5 192.2±98.3*329.4±129.6 139.6±103.2*#LN/ng·mL-1328.3±126.4 186.6±96.6*327.7±145.0 140.7±76.2*#PC-III/ng·mL-168.4±30.9 45.4±26.4*63.9±28.7 35.3±29.8*#IV-C/ng·mL-1223.6±62.7 138.4±56.9*220.4±53.9 110.5±39.2*#
表3两组患者治疗前后肝脏硬度值(LSM)比较 (kPa,±s)

表3两组患者治疗前后肝脏硬度值(LSM)比较 (kPa,±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
组别对照组观察组n 28 28治疗前9.32±1.71 9.47±1.74治疗后6.27±0.75*3.47±0.85*#
2.4 两组患者治疗前后血清相关细胞因子变化比较
治疗 24 周后,患者的 TNF-α、TGF-β1、IL-6 水平均低于治疗前,差异有统计学意义(P<0.05);观察组治疗后 TNF-α、TGF-β1、IL-6 水平均低于对照组,差异有统计学意义(P<0.05)。 见表4。
表 4 两组患者治疗前后 TNF-α、TGF-β1、IL-6 的变化 (±s,n=28)

表 4 两组患者治疗前后 TNF-α、TGF-β1、IL-6 的变化 (±s,n=28)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
组别对照组观察组时间治疗前治疗后治疗前治疗后TNF-α/μg·L-1146.3±42.8 66.4±32.7*142.1±44.9 54.9±21.4*#TGF-β1/μg·L-1172.1±66.5 47.2±18.3*169.4±59.6 43.6±10.2*#IL-6/μg·L-14.56±0.32 3.82±0.21*4.64±0.24 3.26±0.30*#
2.5 不良反应
治疗过程中时有患者发生不同程度的不良反应,主要是由于PegINFα-2b与利巴韦林联用带来的副作用,大部分采取对症治疗后均能缓解,部分患者采取减少用药量措施,从不良反应发生率来看观察组与对照组之间差异无统计学意义(P>0.05)。见表5。
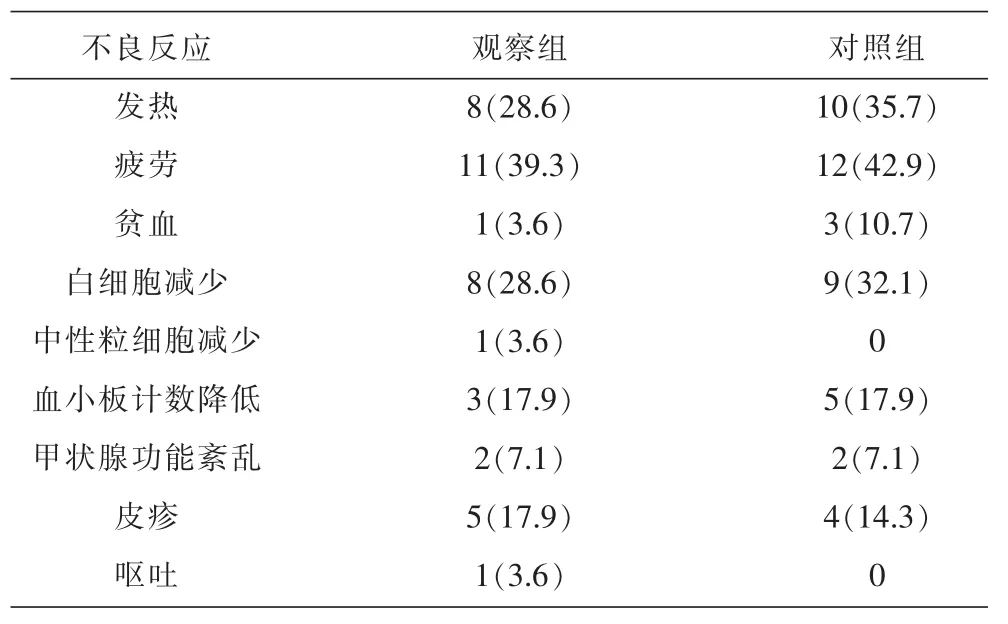
表5两组患者不良反应发生情况 [n=28,例(%)]
3 讨论
HCV是导致慢性肝脏疾病、肝硬化、肝癌的首要诱因,已成为影响公共健康的因素之一,引起了社会的广泛关注。该病起病隐匿,感染HCV后症状不明显,患者往往未能意识受到病毒感染而错过治疗时机,而又容易发展为慢性肝病,严重者将导致肝硬化、肝细胞性肝癌等。CHC一旦确诊一般都先进行抗病毒治疗,经过多年摸索,PegIFNα-2b联合利巴韦林治疗CHC的方案的疗效最为显著,已被许多国家采纳为标准治疗方案[5]。干扰素主要起到调节免疫应答的作用,利巴韦林是一种口服核苷类抗病毒药。不管是何种治疗方案,不同的HCV基因型对其应答也各不相同。研究表明PegIFNα-2b联合利巴韦林治疗方案对基因2/3型患者的效果较为明显,根据我国《慢性丙型肝炎抗病毒治疗专家共识》的指导建议[6],该方案的推荐疗程为24周,为突出药物治疗效果,本研究的研究重点对象为HCV2/3型基因患者。但是该治疗方案也存在缺点,首先是研究界对其持续病毒学应答(sustained virological response,SVR)率仍存在争议,即该方案能否逆转肝纤维化仍缺乏定论;该方案的另一个局限性是明显的副作用,尤其是对外周血细胞数量的影响可导致用药减量甚至终止治疗,影响治疗效果[7]。由于HCV是影响肝纤维化发展的因素,因此在对HCV进行病因治疗的同时选择合适的药物进行抗纤维化治疗显得十分必要。
阐明肝纤维化的机制对预防终末期肝病具有相当重要的意义。肝纤维化的形成主要是由于细胞外基质(extracellular matrix,ECM)的过度堆积造成的。ECM主要包括如胶原蛋白、层粘连蛋白、弹性蛋白、纤连蛋白等,这些物质是慢性肝炎损伤修复的产物。HCV感染后病毒蛋白一方面可直接调控相关信号与代谢通路,另一方面也可间接诱导免疫应答机制导致慢性炎症发生,两方面因素的合力造成了肝纤维化的发生。肝星状细胞(hepatic stellate cell,HSC)是一种在窦周隙的静止型维生素A的储存细胞。大量研究表明HSC是肝纤维化的关键因素,HSC一般处于静止状态,当肝损伤时便会被激活,分泌大量可伸缩性肌成纤维细胞,同时打破了ECM的降解与堆积平衡导致ECM堆积,造成纤维瘢痕,最终导致肝硬化[8-9]。TNF-α及IL-6均是由单核-巨噬细胞合成的内源性细胞因子,可直接参与HCV炎症反应,不仅介导肝纤维化形成,而且通过促进ECM的合成造成ECM合成平衡失调,进一步促进纤维化发生发展。研究表明TNF-α与IL-6与肝纤维化指标呈正相关的关系,不仅可反映宿主自身免疫应答情况,也可作为肝纤维化程度的参考指标之一[10]。TGF-β1是肝纤维化发生发展过程中重要的细胞因子,研究表明 ECM的合成和降解受到TGF-β1的控制,在TGF-β1作用下可激活储脂细胞转化为纤维母细胞,又可促进ECM的生成,通过抑制相关水解酶抑制ECM降解,还可抑制肝细胞的再生及诱导肝细胞凋亡,可见TGF-β1是重要的致纤维化因子,在肝纤维化形成和治疗中有重要的参考价值,目前也有研究将其作为靶标分子通过抑制其产生达到抗纤维化的目的[11]。
肝纤维化属于中医学中“胁痛”“积聚”的范畴,经过半个世纪的摸索,中医药治疗慢性肝病纤维化取得了长足的进展,彰显传统医学的优势,目前已有多个CFDA批准的抗肝纤维化的中成药上市。复方鳖甲软肝片是抗肝纤维化中成药的代表药物之一,由鳖甲、冬虫夏草、板蓝根、三七、黄芪等11味中药组成,目前研究主要集中于慢性乙肝肝纤维化的治疗。赵文莉等[2]用复方鳖甲软肝片联合恩替卡韦治疗乙型肝炎纤维化,48周治疗后患者的肝功能恢复, 肝纤维指标 HA、PC-III、LN、IV-C均有明显改善;柴梅等[12]在对124例乙型肝炎患者的治疗中,发现复方鳖甲软肝片可显著降低血清IL-6、IL-8、TNF-ɑ水平,起到肝脏保护作用;大量文献报道复方鳖甲软肝片与抗病毒药物联用,均可有效降低肝纤维化指标,缩小门脉宽度和脾脏厚度,有效阻止肝纤维化,逆转早期肝硬化发生[3]。
本实验研究结果显示,复方鳖甲软肝片联合PegIFNɑ-2b和利巴韦林治疗CHC,经48周治疗后患者获得SVR例数组间无统计学差异,复方鳖甲软肝片对抗病毒治疗效果不明显;肝脏瞬时弹性检查可直观反映患者肝硬化程度,治疗后患者LSM值有所改善,观察组LSM值显著低于对照组(P<0.05),证明复方鳖甲软肝片具有改善肝纤维化与肝硬化效果;治疗后患者血清ALT及肝纤维化4项指标均显著优于对照组(P<0.05),患者血清 TNF-ɑ、TGF-β1、IL-6水平显著下降(P<0.05),提示炎症受到控制,肝损伤受到遏制。证明复方鳖甲软肝片对干扰素-利巴韦林治疗方案起到了很好的辅助作用,副作用少,安全性好,值得在临床应用中推广[13]。
[1]刘志荣.α-干扰素联合利巴韦林对慢性丙型肝炎肝组织纤维化影响的研究[D].济南:山东大学,2005.
[2]赵文莉,王保春,贺新祥.复方鳖甲软肝片联合恩替卡韦片治疗肝纤维化疗效观察[J].现代中西医结合杂志,2016,25(3):263-265.
[3]张旭东,董占军.复方鳖甲软肝片治疗乙肝肝纤维化临床研究概况[J].河北中医药学报,2016,31(2):62-64.
[4]中华医学会肝病学分会,中华医学会感染病学分会.丙型肝炎防治指南(2015年版)[J].中国肝脏病杂志(电子版),2015,7(3):19-35.
[5]胡 烨,张 国.肝纤维化的药物治疗研究进展[J].实用肝脏病杂志,2016,19(1):8-11.
[6]慢性丙型肝炎抗病毒治疗专家委员会.慢性丙型肝炎抗病毒治疗专家共识[J].中华实验和临床感染病杂志(电子版),2009,3(3):343-352.
[7]陈 倩.干扰素α-2b联合利巴韦林治疗慢性丙型肝炎对外周血细胞的影响[D].长春:吉林大学,2014.
[8]张素梅,刘媗婷,李子文,等.复方甘草酸苷联合苦参素治疗慢性肝炎患者对血清肝纤维化指标的影响[J].实用肝脏病杂志,2014,17(3):309-310.
[9]Sebastiani G,Gkouvatsos K,Pantopoulos K.Chronic hepatitis C and liver fibrosis[J].World J.Gastroenterol,2014,20(32):11033-11053.
[10]陈晓红,朱思和,马英骥,等.肿瘤坏死因子-α和白介素-6与病毒性肝炎肝纤维化的关系[J].黑龙江医学,2001,25(1):11-13.
[11]吕 品,程凤凤,陈惠华.TGF-β1与肝纤维化[J].科学技术与工程,2004,4(4):307-311.
[12]柴 梅,李同进,曹玉娟,等.恩替卡韦联合复方鳖甲软肝片对乙型肝炎患者血清IL-6、IL-8、TNF-α水平影响及肝损伤保护作用研究[J].辽宁中医药大学学报,2016,18(3):114-116.
[13]Janczewska E,Flisiak R,Zarebska-Michaluk D,et al.Effect of Peginterferon or Ribavirin Dosing on Efficacy of Therapy With Telaprevir in Treatment-Experienced Patients With Chronic Hepatitis C and Advanced Liver Fibrosis:A Multicenter Cohort Study[J].Medicine(Philadelphia,PA,U.S.),2015,94(38):e1411.
(本文编辑 李 杰)
Effect of Fufang Biejia Ruangan Tablet on Liver Fibrosis in Chronic Hepatitis C
MA Xiaoyong,XI Rongrong,FANG Rong*
(Infectious Department,Yan'an City People's Hospital,Yan'an,Shangxi 716000,China)
ObjectiveTo observe the curative effect of Fufang Biejia Ruangan tablet on adjuvant therapy of liver fibrosis in chronic hepatitis C.MethodsTotally 56 selected CHC patients were randomly divided into the observation group and control group,28 cases in each group.Control group was given PegIFNα-2b subcutaneous injection and ribavirin orally each time.Observation group was treated wih Fufang Biejia Ruangan tablet on the basis of control group.The treatment course was for24 weeks,which lasted fortwocourses.The virologicalresponse and livertransientelastography in two groups were determined.The liver stiffness values examination (LSM),serum alanine aminotransferase (ALT),hyaluronic acid(HA),laminin(LN),procollagen III(PC-III),type IV collagen(IV-C),serum tumor necrosis factor alpha(TNF-α)and transforming growth factor beta 1 (TGF-β1)and interleukin 6 (IL-6)were tested.Results20 patients in observation group and 18 cases in control group
SVR,there is no significant difference between two groups (P>0.05).LSM of the two groups were lower than before treatment,LSM in observation group was significantly lower than the control group (P<0.05).After treatment,ALT,HA,LN,PC-III,IV-C,TNF-α,TGF-β1,IL-6 in observation group were significantly lower than that before treatment,the difference was statistically significant (P<0.05),the effect of the observation group was better than the control group,the difference was statistically significant(P<0.05).Conclusion Fufang Biejia Ruangan tablet could significantly improve the degree of liver fibrosis in chronic hepatitis C,it play the role of adjuvant therapy.
chronic hepatitis C;Fufang Biejia Ruangan tablet;liver fibrosis;ribavirin;hepatic transient elasticity;virological response
R575.1;R289.5
B
doi:10.3969/j.issn.1674-070X.2017.08.018
2016-08-08
陕西省科技计划项目(2015K13-1-071-63)。
马小勇,男,学士,主治医师,研究方向:病毒性肝炎及肺结核等。
*房 荣,男,副主任医师,E-mail:859428059@qq.com。
本文引用:马小勇,席蓉蓉,房 荣.复方鳖甲软肝片辅助治疗慢性丙型肝炎纤维化疗效观察[J].湖南中医药大学学报,2017,37(8):887-890.

