CuInS2三元量子点荧光探针测定新霉素
毛永强,胡美娜,李 娜*
(1.辽宁工程技术大学理学院,阜新123000; 2.辽宁工程技术大学安全科学与工程学院,矿山热动力灾害与防治教育部重点实验室,阜新123000)
CuInS2三元量子点荧光探针测定新霉素
毛永强1,2,胡美娜1,李 娜1*
(1.辽宁工程技术大学理学院,阜新123000; 2.辽宁工程技术大学安全科学与工程学院,矿山热动力灾害与防治教育部重点实验室,阜新123000)
采用水热法制备了巯基乙酸修饰的CuInS2三元量子点,基于CuInS2量子点荧光强度能够被新霉素显著猝灭的特性,建立了CuInS2三元量子点荧光探针测定新霉素的方法。优化的试验条件如下:①pH 8.0的三羟甲基氨基甲烷-盐酸缓冲溶液的用量为0.5 mL;②CuInS2量子点的浓度为2.0×10-7mol·L-1;③反应时间为5 min。新霉素的浓度在1.0×10-8~2.0×10-7mol·L-1内与其对应的荧光猝灭强度呈线性关系,检出限(3s/k)为2.0×10-10mol·L-1。以空白样品为基体进行加标回收试验,所得回收率在98.4%~106%之间,测定值的相对标准偏差(n=5)在1.9%~2.4%之间。
CuInS2量子点;新霉素;荧光探针
新霉素(NEO)是一种易溶于水、性质稳定的氨基糖甙类抗生素,对很多植物病原菌具有较好的抑制作用,可有效防治大白菜软腐病、姜瘟病、柑桔溃疡病等果蔬病害[1]。但是果蔬中残留超限量的新霉素会对人体的肾、耳等器官造成严重损害,因此许多国家对其残留限量有严格规定[2]。目前新霉素的测定主要有酶联免疫吸附法、液相色谱法和液相色谱-串联质谱法等[3-5]。酶联免疫吸附法操作简单易行,但可能发生假阳性;液相色谱法和液相色谱-串联质谱法灵敏度高,但操作繁杂费时、检测成本高。因此,建立一种操作简便、成本低廉、灵敏度高的检测方法具有重要的现实意义。
量子点(QDs)具有激发光谱宽、发射光谱窄、量子产率高及光稳定性好等优点,已作为荧光探针成功用于多种金属离子、蛋白质、生物大分子和农兽药残留的分析检测[6-11]。然而,大部分量子点因其含有镉、碲、铅等有毒元素,限制了实际应用的可能性。近年来,CuInS2等Ⅰ-Ⅲ-Ⅵ族三元量子点引起研究者的广泛关注,它们具有带隙窄、低毒、吸光系数高、斯托克位移大和稳定性好等优点,在太阳能电池、光催化和化学传感器等领域均有良好的应用前景[12-14]。
本工作采用水热法制备了巯基乙酸修饰的CuInS2量子点[15],研究了新霉素对量子点的荧光猝灭效应,发现荧光猝灭强度与新霉素的浓度在一定范围内呈线性关系,据此建立了一种测定新霉素含量荧光猝灭法,并将其用于市售小白菜中新霉素含量的测定,结果满意。
1 试验部分
1.1 仪器与试剂
日立F-4500型荧光分光光度计,日立UV-3010型紫外-可见分光光度计,PB-10型精密酸度计,SZCL-2型智能控温磁力搅拌器,WG 9020A型卧式电热鼓风干燥箱,H1650R型台式高速冷冻离心机,50 mL聚四氟乙烯反应釜。
新霉素标准储备溶液:1.0×10-5mol·L-1,称取新霉素0.007 12 g于250 mL烧杯中,加少量水溶解后,移至1 L容量瓶中,用水定容,置于冰箱中冷藏保存。
氯化铜、三氯化铟、硫脲、氢氧化钠、巯基乙酸、新霉素均为分析纯;试验用水为二次蒸馏水。
1.2 试验方法
1.2.1 CuInS2量子点制备
将氯化铜0.409 g和三氯化铟0.531 g溶于水中,然后加入巯基乙酸2.5 mL,磁力搅拌20 min。用1.0 mol·L-1氢氧化钠溶液调节pH至11.0,加入硫脲0.365 g,磁力搅拌至完全溶解后转入反应釜中,在150℃干燥箱中反应21 h,待冷却至室温后取出。加入乙醇使CuInS2量子点沉降,离心后将沉淀溶于水中,置于4℃冰箱中保存备用。
1.2.2 样品前处理
将在市场购买的新鲜小白菜用捣碎机捣碎,混合均匀后,置于冰柜中保存备用。
称取小白菜试样5.000 g置于100 mL锥形瓶中,加入甲醇50 mL,超声提取10 min,以12 000 r· min-1转速离心10 min,取上清液于50 mL鸡心瓶中,减压浓缩至10 mL,转入50 mL容量瓶中,加水定容,置于冰箱中冷藏备用。
1.2.3 新霉素测定
在一系列5 mL比色管中,依次加入CuInS2量子点0.5 mL、pH 8.0的三羟甲基氨基甲烷-盐酸(Tris-HCl)缓冲溶液0.5 mL和一定量的新霉素标准溶液,用水稀释至刻度,摇匀。室温下静置5 min后,以激发波长350 nm测定体系的荧光强度(If)和空白溶液(未加入新霉素标准溶液)的荧光强度(I0),计算体系荧光猝灭强度(ΔI=I0-If)。
2 结果与讨论
2.1 CuInS2量子点的形貌表征
巯基乙酸修饰CuInS2量子点的透射电子显微镜(TEM)图见图1。
由图1可知:所制备CuInS2量子点近球形,分散性较好,平均粒径约为3.8 nm。
2.2 CuInS2量子点和新霉素作用的荧光光谱
巯基乙酸修饰CuInS2量子点的紫外-可见吸收光谱和荧光发射光谱见图2。
由图2可知:CuInS2量子点的紫外-可见吸收峰位于波长600 nm处;当激发波长为350 nm时,CuInS2量子点的荧光发射峰位于540 nm处,荧光发射峰窄而对称,表明CuInS2量子点具有较好的荧光性能。

图1 CuInS2量子点的TEM图Fig.1 TEM image of CuInS2quantum dots
在CuInS2量子点中加入系列新霉素标准溶液,量子点荧光强度发生了显著的降低,且随着新霉素加入量的增加,荧光发射峰也略有红移(见图3),据此建立了一种测定新霉素含量的荧光猝灭法。

图2 CuInS2量子点的紫外-可见吸收光谱和荧光发射光谱Fig.2 UV-Vis absorption spectrum and fluorescence emission spectrum of CuInS2quantum dots
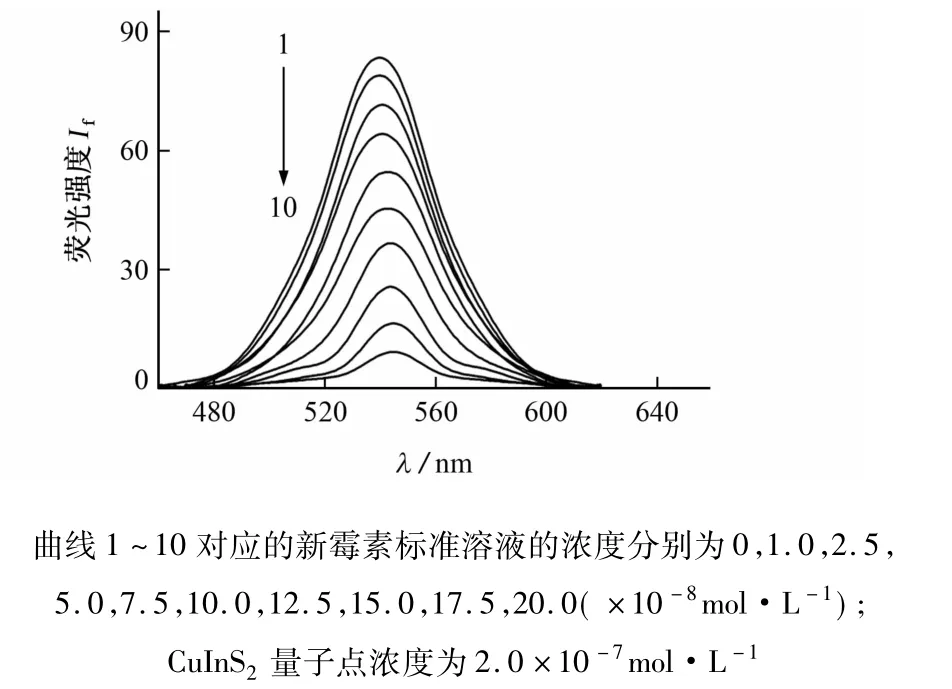
图3 不同浓度新霉素标准溶液下CuInS2量子点的荧光发射光谱Fig.3 Fluorescence emission spectra of CuInS2quantum dots in the presence of neomycin standard solution with various concentrations
2.3 反应条件的选择
2.3.1 缓冲溶液的酸度及用量
试验考察了Tris-HCl、BR、乙酸-乙酸钠等缓冲溶液对体系荧光猝灭强度ΔI的影响。结果表明:在Tris-HCl缓冲溶液中ΔI最大且稳定。同时,考察了Tris-HCl缓冲溶液的酸度对ΔI的影响。结果表明:随pH的增加,ΔI逐渐增强;当pH为8.0时,ΔI达到最大值;此后随pH增加,ΔI逐渐降低。试验进一步考察了Tris-HCl缓冲溶液用量对ΔI的影响。结果表明:随Tris-HCl缓冲溶液用量的增加,ΔI逐渐增大;当缓冲溶液用量为0.5 mL时,ΔI达到最大值;继续增加缓冲溶液用量,ΔI反而减小。试验选择加入pH 8.0的Tris-HCl缓冲溶液0.5 mL。
2.3.2 量子点的浓度
试验考察了CuInS2量子点浓度对体系荧光猝灭强度的影响,其结果见图4。

图4 CuInS2量子点浓度对体系荧光猝灭强度的影响Fig.4 Effect of CuInS2quantum dots concentration on fluorescence quenching intensity of the system
由图4可知:ΔI随着量子点浓度的增加先增后减;当量子点浓度为2.0×10-7mol·L-1时,ΔI达到最大值。其原因在于量子点浓度过低时,体系荧光强度较弱,加入少量新霉素就引起ΔI显著变化,检测灵敏度高,但线性范围较窄;而量子点浓度过高时,体系荧光强度较强,加入少量新霉素引起ΔI的变化很小,导致检测灵敏度较低。综合考虑体系的灵敏度和线性范围,试验选取CuInS2量子点的浓度为2.0×10-7mol·L-1。
2.3.3 反应时间
在室温条件下,试验考察了反应时间对ΔI的影响。结果表明:当体系各组分混合5 min后,ΔI达到最大值,且在60 min内保持不变。试验选择反应5 min后测定体系荧光强度。
2.4 共存物质的干扰
试验考察了小白菜中常见共存物质对1.0× 10-7mol·L-1新霉素标准溶液测定的影响。结果表明:当相对误差在±5%时,100倍的维生素A、维生素B2、维生素C、维生素E、烟酸、K+、Na+,50倍的Mg2+、Ca2+、Zn2+、Cu2+、Mn2+对测定结果无明显影响。
2.5 标准曲线与检出限
按试验方法对新霉素标准溶液系列进行测定,并绘制标准曲线。结果表明:新霉素的浓度在1.0× 10-8~2.0×10-7mol·L-1内与其对应的ΔI呈线性关系,其线性回归方程为y=3.747 x+0.513 3,相关系数为0.999 3。以空白的3倍标准偏差除以标准曲线的斜率计算方法的检出限(3s/k)为2.0× 10-10mol·L-1。
2.6 样品分析
按试验方法处理并测定小白菜,样品中未检出新霉素,表明样品中无新霉素或其含量低于检出限。在样品提取液中加入不同浓度水平的新霉素标准溶液,进行加标回收试验,精密度和回收试验结果见表1。

表1 精密度和回收试验结果(n=5)Tab.1 Results of tests for precision and recovery(n=5)
由表1可知:加标回收率在98.4%~106%之间,相对标准偏差(RSD)在1.9%~2.4%之间。
本工作建立了测定新霉素含量的荧光猝灭法。该方法操作简单、线性范围宽、灵敏度高、检测成本低,可用于果蔬中新霉素残留量的快速分析检测。
[1]贺燕,陶科,黄晓,等.新霉素对植物病原细菌的防效及其急性毒性[J].农药,2008,47(4):297-299.
[2]赵进辉,袁海超,刘木华,等.导数同步荧光光谱-小波-SGA-LSSVR联用快速测定鸭蛋蛋清中新霉素残留含量[J].分析化学,2013,41(4):546-552.
[3]WANG S,XU B,ZHANG Y,et al.Development of enzyme-linked immunosorbent assay(ELISA)for the detection of neomycin residues in pig muscle,chicken muscle,egg,fish,milk and kidney[J].Meat Science,2009,82 (1):53-58.
[4]CLAROT I,REGAZZETI A,AUZEIL N,et al.Analysis of neomycin sulfate and framycetin sulfate by high-perfrmance liquid chromatography using evaporative light scattering detection[J].Journalof Chromatography A,2005,1087(1/2):236-244.
[5]MASCHER D G,UNGER C P,MASCHER H J.Determination of neomycin and bacitracin in human or rabbit serum by HPLC-MS/MS[J].Journal of Pharmaceutical and Biomedical Analysis,2007,43(2):691-700.
[6]ROSENTHAL S J.Bar-coding biomolecules with fluorescent nanocrystals[J].Nature Biotechnology,2001,19 (7):621-622.
[7]WANG J,LIANG J G,SHENG Z G,et al.A novel strategy for selective detection of Ag+based on the red shift of emission wavelength of quantum dots[J].Microchimica Acta,2009,167(3/4):281-287.
[8]LI L,ZHANG F F,DING Y P,et al.Synthesis of functionalized ZnSe nanoparticles and their applications in the determination of bovine serum albumin[J].Journal of Fluorescence,2009,19(3):437-441.
[9]QU F,LIH.Selective molecular recognition of polycyclic aromatic hydrocarbons using CdTe quantum dots with cyclodextrin as supramolecular nano-sensitizers in water[J].Sensors and Actuators B,2009,135(2):499-505.
[10]LIANG J G,HUANG S,ZENG D Y,et al.CdSe quantum dots as luminescent probes for spironolactone determination[J].Talanta,2006,69(1):126-130.
[11]LI D,YAN Z Y,CHENG W Q.Determination of ciprofloxacin with functionalized cadmium sulfide nanoparticles as a fluorescence probe[J].Spectrochimica Acta Part A,2008,71(4):1204-1211.
[12]XING H,ZHANG Q X,HUANG X M,et al.Aqueous colloidal CuInS2for quantum dot sensitized solar cells[J].Journal of Materials Chemistry,2011,21(40): 15903-15905.
[13]SHEN F,QUE W X,LIAO Y L,et al.Photocatalytic activity of TiO2nanoparticles sensitized by CuInS2quantum dots[J].Industrial and Engineering Chemistry Research,2011,50(15):9131-9137.
[14]LIU S Y,SHI F P,CHEN L,et al.Tyrosine-functionalized CuInS2quantum dots as a fluorescence probe for the determination of biothiols,histidine and threonine[J].Analyst,2013,138(19):5819-5825.
[15]LIU S Y,ZHANG H,YU Q,et al.One-pot synthesis of ternary CuInS2quantum dots with near-infrared fluorescence in aqueous solution[J].RSC Advances,2012,3(2):819-825.
Determination of Neomycin with Ternary CuInS2Quantum Dots as Fluorescent Probe
MAO Yongqiang1,2,HU Meina1,LI Na1*
(1.College of Science,Liaoning Technical University,Fuxin 123000,China; 2.Key Laboratory of Mine Thermodynamic Disasters and Control of Ministry of Education,College of Safety Science and Engineering,Liaoning Technical University,Fuxin 123000,China)
The ternary CuInS2quantum dots were prepared using thioglycolic acid as modifiers by hydrothermal synthesis method.Based on the fact of the fluorescence intensity of CuInS2quantum dots could be quenched remarkably by neomycin,a method for determination of neomycin with ternary CuInS2quantum dots as fluorescent probe was established.The optimized conditions found were as follows:①amount of Tris-HCl buffer solution of pH 8.0:0.5 mL;②concentration of CuInS2quantum dots:2.0×10-7mol·L-1;③time of reaction:5 min.Linear relationship between values of the fluorescence quenching intensity and concentration of neomycin was obtained in the range of1.0×10-8-2.0 ×10-7mol·L-1,with detection limit(3s/k)of 2.0×10-10mol·L-1.On the base of blank sample,test for recovery was made by standard addition method;values ofrecovery found were in the range of98.4%-106%,with RSD's(n=5) in the range of 1.9%-2.4%.
CuInS2quantum dots;neomycin;fluorescent probe
O657.3
A
1001-4020(2017)05-0538-04
10.11973/lhjy-hx201705009
2016-04-20
辽宁省教育厅科学研究项目(L2013138);辽宁省大学生创新创业训练项目(201410147014)
毛永强(1974-),男,辽宁昌图人,副教授,博士,主要从事食品安全检测与分析研究
*通信联系人。linamaoyongqiang@126.com

