树鼩形觉剥夺性近视模型的建立及观察
杨冬梅, 朱 勤, 李 娜, 郭立云, 张晓帆, 张洁莹, 胡 敏, 代解杰
(1. 云南省第二人民医院眼科中心 昆明医科大学第四附属医院眼科, 昆明 650021; 2. 中国医学科学院/北京协和医学院医学生物学研究所, 昆明 650118)
·论 著·
树鼩形觉剥夺性近视模型的建立及观察
杨冬梅1, 朱 勤1, 李 娜2, 郭立云1, 张晓帆1, 张洁莹1, 胡 敏1, 代解杰2
(1. 云南省第二人民医院眼科中心 昆明医科大学第四附属医院眼科, 昆明 650021; 2. 中国医学科学院/北京协和医学院医学生物学研究所, 昆明 650118)
目的 建立树鼩性成熟期及成年早期形觉剥夺性近视(FDM)模型,探讨年龄在近视发生发展中的作用及以视网膜形态变化为主的局部视网膜机制与近视的关系。方法 4月龄和5月龄树鼩各30只,随机分为空白对照组、遮盖组。遮盖组右眼遮盖作为实验眼,左眼开放作为自身对照眼。用自制半透明眼罩建立形觉剥夺近视模型,然后撤出干预因素,分别于遮盖3周、6周测量各组屈光度及眼轴长度; 于遮盖6周观察视网膜厚度及视网膜各层细胞数目变化情况。结果 4月龄和5月龄树鼩遮盖右眼3周后,遮盖眼远视度数均有所降低,但与自身对照眼相比差异无统计学意义(P>0.05); 而遮盖6周后: 两组的屈光度和眼轴与对照眼比较均有明显差异 (P<0.05); 在遮盖期间,形觉剥夺眼眼轴不断增长,近视度数也逐渐增加,二者有很好的直线负相关关系; 并且4月龄组所诱导出的近视程度高于5月龄组 (P<0.05)。形觉剥夺可引起各层视网膜普遍变薄,有核细胞层、感光细胞层、内核层、神经节细胞层中胞核数减少,排列稀疏紊乱。结论 形觉剥夺可以诱导性成熟期及成年早期树鼩的近视形成及视网膜形态发生变化。
树鼩; 形觉剥夺性近视(FDM); 视网膜形态学
世界各地的青少年近视患病率明显增高,且绝大部分为病理性近视[1-5]。我国学龄期青少年近视眼患病率高达70%~80%, 位居世界第二位,且发病率呈上升趋势[6-8]。因此,阐明青少年近视的发生机制并有效干预近视的发生发展具有重要意义。本实验通过选择与人类视觉系统高度相似的4月龄和5月龄树鼩作为实验动物[9-12],采用改良的自制半透明眼罩遮盖实验眼,造成形觉剥夺成像障碍,建立并诱导出树鼩性成熟期及成年早期形觉剥夺性近视(FDM)模型,探讨年龄在近视发展中的作用;并从形态学方面,初步探索局部视网膜机制在近视形成中的作用。
1 材料与方法
1.1 实验动物及模型建立和分组
排除先天性近视及其他眼部疾患的4月龄及5月龄雄性健康实验用树鼩各3 0只,体质量120~200 g,由昆明医科大学实验动物中心提供[SCXK(滇)K2013-0002]。将4月龄、5月龄树鼩各随机分为空白对照组和遮盖组,每组15只。A0组: 4月龄空白对照组;A组(4月龄遮盖组): 右眼遮盖作为实验眼,左眼开放作为自身对照眼,于遮盖3周(A3)和6周(A6)时测量眼轴及屈光度; B0组: 5月龄空白对照组; B组(5月龄单纯遮盖组): 右眼遮盖,左眼开放作为自身对照眼,于遮盖3周(B3)和6周(B6)时测量眼轴及屈光度。将自制半透明眼罩(外径1.428 mm,内径1.314 mm),用1-0黑丝线缝于实验组树鼩右眼内外眦皮肤处,深达骨膜,打活结固定(以备定期进行眼罩消毒),并在眼罩上打孔供透气用(图1)。室内人工饲养,自然昼夜节律,自由进食饮水, 室温22~28 ℃。遮盖过程中,隔日观察遮盖情况,缝线松动或脱落立即重新缝合。

图1 半透明眼罩遮盖右眼建立形觉剥夺模型
1.2 主要仪器设备和试剂
复方托吡咔胺滴眼液,规格: 10 mL/支,批号: M584571,盐酸奥布卡因滴眼液,规格: 20 mL: 80 mg/支,批号: J20100128, 均为日本Santen参天制药(中国)有限公司; 戊巴比妥钠, 规格: 50 mg/瓶,美国Sigma公司,批号: P3761; 外径千分尺,中国LINKS/哈量,型号: 300; A超增益矫正仪器,天津迈达公司,型号: ODM-2100S; 带状检影镜,苏州六六公司,型号: YZ24。
1.3 眼球生物学参数测量
1.3.1 屈光度测量 动物在安静状态时,于结膜囊点质量分数为1%复方托吡咔胺滴眼液共3次(间隔10 min),充分散瞳0.5 h后于暗室内行视网膜检影。动物头部位置固定,工作距离为0.50 m,以0.25D间隔在水平及垂直子午线上带状光检影,散光以半量计入球镜,每眼重复测量3次取平均值。1.3.2 眼轴测量 盐酸奥布卡因滴眼液共3次(间隔3 min),调整A超增益矫正仪器后,自动模式下测量眼轴长度(取角膜顶点到眼球后极部玻璃体视网膜界面的距离) 6次,精确到0.01 mm,取平均值。各时间段生物测量结束后,于各组随机取1只树鼩用质量分数3%戊巴比妥(0.1 mL/kg)深度麻醉后迅速摘除眼球后,用外径千分尺测量树鼩眼球前后径(图2)。
本实验设计采用单盲法,检影验光及眼轴测量均由同一位专业人员操作,实验过程中具体的分组方法及干预措施,操作人员均不知情。
1.4 视网膜形态学观察
于遮盖6周时, 腹腔内注射过量质量分数3%戊巴比妥钠深度麻醉树鼩,在树鼩上方、鼻侧巩膜缝线标记后立即摘出眼球,放入新鲜配制的混合固定液(体积分数40%甲醛、冰醋酸、蒸馏水、体积分数95%乙醇,按2∶1∶7∶10的比例配制)中,4 ℃固定24 h,同时显微镜下用1 mL注射器刺破角膜,向玻璃体腔内注射少量固定液,以便充分固定和防止视网膜脱离,待组织变硬后在显微镜下去除眼前节,将眼球壁全层完整分离。所取标本以流水冲洗24 h,然后常规梯度乙醇脱水,二甲苯透明, 石蜡包埋, 连续切片5张, 每张切片厚度4 mm, 1张用于HE染色, 2张用于TUNEL染色, 其余备用。用三乙氧基硅烷(APES)处理过的玻片收取组织切片, 恒温箱60 ℃烤片3~4 h。光镜下观察HE切片中的视网膜厚度及各层细胞形态学变化。

图2 眼球前后径及眼轴的测量
1.5 统计学分析
本实验所有数据均采用表示,应用统计软件SPSS17.0进行数据检验。同一时间点双眼比较采用配对t检验,不同时间点的数据比较采用单因素方差分析(ANOVA),组间两两比较比较采用LSD法,不同年龄组同一时间点数据比较用配对t检验,眼轴与屈光度关系采用Person相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 眼球生物参数测量
A0组、B0组双眼及其他各组左眼随生长发育屈光度呈生理性远视化发展,眼轴逐渐延长; A3组右眼远视度数有所降低, 眼轴较左眼延长约0.05 mm; A6组右眼屈光度与左眼的差值为3.49D,呈明显近视漂移,眼轴较左眼延长0.33 mm; B3组右眼屈光度及眼轴与左眼无明显差异; B6组右眼诱导出的相对近视程度约为2.56 D,眼轴比左眼增长0.23 mm。将各组右眼的屈光度及眼轴长度差值进行单因素方差分析,除A0组与A3组、B0组与B3组外,其他各组间比较均有差异(表1,表2)。
将A6组双眼屈光度差值(d1)及眼轴的差值(d2)与B6组进行比较,A6组诱导出的屈光度及眼轴数值明显高于B6组 (表3)。并且在遮盖期间,随着形觉剥夺眼眼轴不断增长,近视度数也逐渐增加,二者有很好的直线负相关关系(A6组r=-0.926,P<0.01; B6组r=-0.922,P<0.01)。

表1 4月龄树鼩各组屈光度、眼轴长度比较Table 1 Four months tree shrews at the age of diopter and axial length contrast

表2 5月龄树鼩各组屈光度、眼轴长度比较Table 1 Five months tree shrews at the age of diopter and axial length contrast

表3 4月龄和5月龄树鼩形觉剥夺6周后双眼屈光度与眼轴差值比较Table 3 Form deprivation after six weeks of age in four and five months at the age of tree shrew binoculus diopter difference and axial length difference
2.2 视网膜形态变化观察
光学显微镜下可见, A0组和B0组双眼视网膜厚度及各层细胞核数无明显差别(图3, 图4); A6组和B6组实验眼与对照眼相比视网膜各层普遍变薄,尤以神经纤维层、内丛状层、内核层最为明显(图5,图6); 而有核细胞层胞核数减少、排列紊乱,尤以感光细胞层、内核层最为明显; 感光细胞层胞核明显减少、内外节排列紊乱,内核层胞核层数明显减少、排列稀疏(图7,图8)。
3 讨论
人类正视化过程中眼球发育经历了两个阶段,婴儿期:此期眼轴发育较快, 2~3年增加约5 mm,远视度数明显降低; 青少年期:此期约持续10年甚至更长的时间,眼球生长速度变缓,眼轴仅增加1 mm,屈光状态向正视眼方向继续发展[13,14]。但是异常的视觉环境可以改变这种眼球正视化的既定模式以适应新的视觉刺激,使眼球生长失去调控,眼轴过度延长导致屈光不正。在经典的动物实验性近视模型中,FDM可以通过眼睑缝合或戴弥散镜片等方式,使物像无法在视网膜上聚焦,视觉系统缺乏相应的反馈信号,眼球生长失去调控,过度延长而发生[15-18]。国内外目前比较成熟的FDM动物模型包括: 鸡、豚鼠、树鼩、猕猴、松鼠猴和啮齿类动物等[19-23]。

图3 A0组树鼩视网膜(HE×400)Figure 3 A0group of retina in tree shrew (HE×400)

图4 B0组树鼩视网膜(HE×400)Figure 4 B0group of retina in tree shrew (HE×400)

图5 A6组树鼩视网膜(HE×400)Figure 5 A6group of retina in tree shrew (HE×400)

图6 B6组树鼩视网膜 (HE×400)Figure 6 B6group of retina in tree shrew (HE×400)

图7 A6组树鼩视网膜的感光细胞层(红色→)、内核层(→) (HE×400)Figure 7 Photoreceptor cell layer (红色→) and inner nuclear layer (→) of retina of A6 group in tree shrew (HE×400)
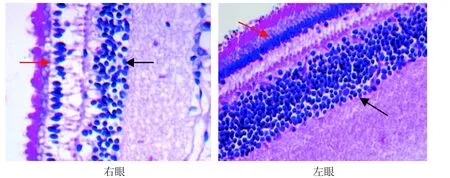
图8 B6组树鼩视网膜的感光细胞层(红色→)、内核层(→) (HE×400)Figure 8 Photoreceptor cell layer (红色→) and inner nuclear layer (→) of retina of B6 group in tree shrew (HE×400)
尽管对FDM进行了大量实验研究,然而多数经典的实验动物模型几乎都采用眼球发育敏感期的婴幼儿模型,那么进入青春期后以及成年早期,正视化机制是否依然发挥作用;在正视化的末期或结束后,异常视觉的输入能否破坏眼球原有生长模式,从而产生近视。大量的流行病学统计[24-26]及相关研究表明[18,27-28],人类的近视绝大部分是从正视化的末期(大约7~9 岁左右)开始出现,且高发于眼球发育的第二阶段(青少年期),即人类FDM形成的最敏感时期为8~16岁; 并且成年后正视化机制仍在发挥作用, 只是表现方式发生了变化[18,29]。研究表明[30],暗光下鸡可以形成近视眼,暗光环境中主要是视锥细胞受影响; 以视锥细胞为主的动物(如松鼠)对形觉剥夺极为敏感[31],而以视杆细胞为主的猫对形觉剥夺不敏感[32]; 用甲酞缩肌胺选择性损伤视锥细胞后,鸡对形觉剥夺的反应明显减轻[33];说明以视锥细胞为主的局部视网膜作用机制在FDM的形成中有重要作用。用外源性甲状腺素抑制剂喂养性成熟期的大鼠和小鼠,造成与甲状腺激素受体β缺陷时相同的表现: 中波长视蛋白表达减少,短波长视蛋白普遍表达增多[34]。说明青春期(性成熟后)视锥细胞的视蛋白表达,仍具有一定的可塑性,但是鼠的视网膜以视杆细胞为主,且其视觉系统与人类相差甚大。因此,选择与人类正视化机制存在共性及视锥细胞为主的动物为研究对象,建立青少年期动物的FDM模型,研究结果才更具有比较医学意义。
树鼩具有发达的视觉系统和一些灵长类动物的视觉特征,双眼视觉和色觉都很发达, 它的光感受器以视锥细胞为主(视杆细胞少于4%),为二色视、昼行性动物, 是国内外较成熟的近视眼动物模型。据文献报道,树鼩在正视化过程中眼球发育的两个阶段与人类接近,与人类的正视化机制存在共性[9,11,12,35,36]。根据眼部各屈光成分及眼轴发育曲线可知: 15~18周龄(4月龄左右)的树鼩相当于人类的青少年时期(10~15岁), 此时正是人类近视的高发期; 20周龄(近5月龄)相当于成年早期(18~20岁)[12]。因此,本实验选择与人类视觉系统发育较接近的青春期(4月龄)和成年早期(5月龄)树鼩作为实验动物,采用改良的自制半透明眼罩遮盖实验眼,造成形觉剥夺成像障碍,结果表明诱导并建立了青春期及成年早期树鼩单眼FDM动物模型。
树鼩出生15 d左右睁眼时屈光状态为+25D,然后迅速下降,30 d后基本稳定在+5D左右,眼轴长约7.8 mm[37]。本实验中,出生4月龄的树鼩屈光度约为7.00 D,眼轴为7.80 mm,出生5月龄时屈光度下降约0.75 D,眼轴增加0.02 mm,与Siegwart等[37]和Norton等[10]的研究结果一致,即树鼩性发育成熟后眼球处于缓慢发育阶段,眼轴缓慢变长,趋于正视。4月龄和5月龄树鼩在遮盖3周后屈光度和眼轴变化不明显,仍然呈高度远视状态;而遮盖6周后,4月龄和5月龄树鼩则分别诱导出的相对近视程度为3.49 D和2.56 D,眼轴相对增长约0. 33 mm和0.23 mm,均明显形成了近视; 4月龄树鼩所形成的近视程度远高于5月龄,这与Siegwart等[37]提出的在树鼩青春期和成年早期可以成功诱导出近视模型的观点相一致。此外,遮盖眼的屈光度和眼轴长度之间存在负性线性相关关系;证实了形觉剥夺主要造成树鼩遮盖眼眼轴的延长,形成的近视属轴性近视,且剥夺发生越早、持续时间越长,其近视程度越重。
尽管树鼩的视网膜厚度与人类相比较薄, 但其视网膜结构及主要组成细胞与人类极为相似[38,39]。本实验结果显示: 随形觉剥夺时间延长至6周时,近视形成, 树鼩视网膜全层普遍变薄, 尤以内核层、内丛状层、神经纤维层最为明显,而有核细胞层感光细胞层、内核层、神经节细胞层中不仅胞核数减少, 而且排列稀疏紊乱,与一些研究者[40-43]对豚鼠FDM视网膜形态学的研究结果一致。
综上所述, 本实验研究表明, 在性成熟期以及成年早期树鼩的眼球发育过程中,正视化机制仍然发挥作用,形觉剥夺仍然可以对此年龄段树鼩的屈光状态及视网膜形态造成明显影响,初步证实了建立与人类视觉发育比较接近的形觉剥夺性动物近视模型的可行性。从实验结果推测, 以感光细胞为主的视网膜细胞减少可能是高度近视眼患者永久性视网膜变薄、视功能障碍的重要原因之一。如果能从视锥细胞发育分化调控及其可塑性研究的途径入手并予以有效地干预,将会为病理性近视的药物治疗提供新的思路, 这也是本课题下一步研究的重点。
[1] Chow YC, Dhillon B, Chew PT, et al. Refractive errors in Singapore medical students[J]. Singapore Med J, 1990, 31 (5):472-473.
[2] Wong TY, Foster PJ, Hee J, et al. Prevalence and risk factors for refractive errors in adult Chinese population in Singapore [J]. Invest Ophthalmol Vis Sci, 2000, 41(9):2486-2494.
[3] Mohan M, Pakrasi S, Zutshi R. Myopia in India[J]. Acta Ophthalmol Suppl, 1988, 185:19-23.
[4] Fledelius HC. Myopia prevalence in Scandinavia.A survey, with emphasis on factors of relevance for epidemiological refraction studies in general[J]. Acta Ophthalmol Suppl, 1988, 185:44-50.
[5] Sperduto RD, Seigel D, Roberts J, et al. Prevalence of myopia in the United states[J]. Arch Ophthalmol, 1983, 101(3):405-407.
[6] Saw SM, Shih-Yen EC, Koh A, et a1. Interventions to retard myopia progression in children:an evidence-based update [J].Ophthalmology, 2002, 109(3):415-421.
[7] Lin LL, Chen CJ, Hung PT, et al. Nation-wide survey of myopia among school children in Taiwan, 1986[J]. Acta Ophthalmol Suppl, 1988, 185:29-33.
[8] Wilson A, Woo G.A review of the prevalence and causes of myopia[J]. Singapore Med J, 1989, 30(5):479-484.
[9] Norton TT, McBrien NA. Normal development of refractive state and ocular component dimensions in the tree shrew (Tupaia belangeri )[J]. Vision Res, 1992, 32(5):833- 842.
[10] Siegwart JT Jr, Norton TT. The susceptible period for deprivation induced myopia in tree shrew[J]. Vision Res, 1998, 38(22):3505-3515.
[11] JiangBC, Woessner WM. Vitreous chamber elongation is responsible for myopia development in a young adult [J]. Optom Vis Sci, 1996, 73(4):231-234.
[12] McBrien NA, Adams DW. A longitudinal investigation of adult-onset and adult-progression of myopia in an occupational group.Refractive and biometric findings[J]. Invest Ophthalmol Vis Sci, 1997, 38(2):321-333.
[13] Larsen JS. The sagittal growth of the eye. 3. Ultrasonic measurement of the posterior segment ( axial length of the vitreous) from birth to puberty[J]. Acta Ophthalmol(Copenh), 1971, 49(3):441- 453.
[14] Wiesel TN,Raviola E.Myopia and eye enlargement after neonatal lid fusion in monkeys[J]. Nature, 1977, 266(5597): 66-68.
[15] Marsh-Tootle WL, Norton TT. Refractive and structural measures of lid-suture myopia in tree shrew[J]. Invest Ophthalmol Vis Sci, 1989, 30(10):2245-2257.
[16] Qiao-Grider Y, Hung LF, Kee CS, et al. Recovery from formdeprivation myopia in rhesus monkeys[J]. Invest Ophthalmol Vis Sci, 2004, 45(10):3361-3372.
[17] Lu F, Zhou X, Zhao H, et al. Axial myopia induced by a monocularly-deprived facemask in guinea pigs: A non-invasive and effective model[J]. Exp Eye Res, 2006, 82(4):628-636.
[18] Grosvenor T. Reduction in axial length with age: an emmetropizing mechanism for the adult eye? [J]. Am J Optom Physiol Opt, 1987, 64 (9):657-663.
[19] Wildsoet C, Wallman J. Choroidal and scleral mechanisms of compensation for spcetacle lenses in chicks[J]. Vision Res, 1995, 35(9):1175-1194.
[20] Wallman J, Gottlieb MD, Rajaram V, et al. Local retinal regions control local eye growth and myopia[J]. Science, 1987, 237 (4810):73-77.
[21] Raviola E,Wiesel TN. Effect of dark-rearing on experimental myopia in monkeys[J]. Invest Ophthalmol Vis Sci, 1978, 17 (6):485-488.
[22] Schaeffel F, Howland HC. Properties of feedback loops controlling eye growth and refractive state in the chicken[J]. Vision Res, 1991, 31(4):717-734.
[23] Hu M, Hu Z, Xue L, et al. Guinea pigs reared in a monochromatic environment exhibit changes in cone density and opsin expression[J]. Exp Eye Res, 2011, 93(6):804-809.
[24] Zhao J, Pan X, Sui R, et al. Refractive error study in children: results from Shunyi District, China[J]. Am J Ophthalmol, 2000,129(4):427-435.
[25] He M, Huang W, Zheng Y, et al. Refractive error and visual impairment in school children in rural southern China[J]. Ophthalmology, 2007, 114(2):374-382.
[26] He M, Zeng J, Liu Y, et al. Refractive error and visual mipairment in urban children in southern china[J]. Invest Ophthalmol Vis Sci, 2004, 45(3):793-799.
[27] Rada JA, Nickla DL, Troilo D, et al. Decreased proteoglycan synthesis associated with form deprivation myopia in mature primate eyes[J].Invest Ophthalmol Vis Sci, 2000, 41 (8): 2050-2058.
[28] O’Leary DJ, Millodot M.Eyelid closure causes myopia in humans[J]. Experientia, 1979, 35(11):1478-1479.
[29] Lee KE, Klein BE, Klein R. Changes in refractive error over a 5-year interval in the Beaver Dam Eye Study[J]. Invest Ophthalmol Vis Sci , 1999, 40(8):1645-1649.
[30] Lauber JK, Kinnear A. Eye enlargement in birds induced by dim light[J]. Can J Ophthalmol, 1979, 14(4):265-269.
[31] MeBrien NA, Moghaddam HO, New R, et al. Experimental myopia in a diurnal mammal(Sciurus carolinensis) with no accommodative ability[J]. J Physiol, 1993, 469:427-441.
[32] Nathan J, Crewther SG, Grewther DP, et al. Effects of retinal image degradation on ocular growth in cats[J]. InvestOphthalmol Vis Sci, 1984, 25(11):1300-1306.
[33] Westbrook AM, Crewther SG, Liang H, et al.Formoguanamineinduced inhibition of deprivation myopia in chick is accompanied by choroidal thinning While retinal function is retained. Vision Res, 1995, 35(14):2075-2088.
[34] Lind GJ, Chew SJ, Marzani D, et al. Muscarinic acetylcholine receptor antagonists inhibit chick scleral chondrocytes[J]. Invest Ophthalmol Vis Sci, 1998, 39(12):2217-2231.
[35] McBrien NA, Norton TT. The development of experimental myopia and ocular component dimensions in monocularly lid-sutured tree shrews (Tupaia belangeri) [J]. Vision Res, 1992, 32(5):843-852.
[36] Jacobs GH, Neitz J. Spectral mechanisms and color vision in the tree shrew (Tupaia belangeri) [J]. Vision Res, 1986, 26(2): 291-298.
[37] Norton TT, McBrien NA. Normal development of refractive state and ocular component dimensions in the tree shrew (Tupaia belangeri) [J]. 1992, 32(5):833-842.
[38] Samorajski T, Ordy JM, Keefe JR. Structural organization of the retina in the tree shrew (Tupaia glis) [J]. J Cell Biol, 1966, 28(3):489-504.
[39] Foelix RF, Kretz R, Rager G.Structure and postnatal develpoment of photoreceptors and their synapses the retina of the tree shrew (Tupaia belangeri)[J]. Cell Tissue Res, 1987, 247(2):287-297.
[40] 文丹, 刘双珍, 毛俊峰, 等. 豚鼠形觉剥夺性近视视网膜形态学研究[J]. 国际眼科杂志, 2006(5):1045-1048.
[41] Ehrlich D, Sattayasai J, Zappia J, et al. Effects of selective neurotoxins on eye growth in the young chick[J]. Ciba Found Symp, 1990, 155:63-84.
[42] Pruett RC. Complications associated with posterior staphyloma[J]. Curr Opin Ophthalmol, 1998, 9(3):16-22.
[43]徐格致, 李维英, 曹安民. 病理性近视视网膜变性中感光细胞的凋亡[J]. 中华眼底病杂志, 1996(3):68-70.
Preliminary Establishment and Research on Form Deprivation Myopia Model in Tree Shrew
YANG Dong-mei1, ZHU Qin1, LI Na2, GUO Li-yun1, ZHANG Xiao-fan1, ZHANG Jie-ying1, HU Min1, DAI Jie-jie2
(
1. Department of Ophthalmology, the Second People’s Hospital of Yunnan Province & the Fourth Affiliated Hospital of Kunming Medical University, Kunming 650021, China;
2. Institute of Medical Biology, Chinese Academy of Medical Sciences & Peking Union Medical College, Tree Shrew Germplasm Resource Center, Kunming 650018, China)
ObjectiveTo establish the adolescence and early adulthood form deprivation myopia (FDM) model in tree shrew and to observe the retinal morphology, in order to explore the role of age in the development of myopia and the effection of local retinal mechanism for FDM. Method Thirty tree shrews at age of 4 months and 5 months without congenital myopia and other eye diseases were respectively selected. All tree shrews were randomly divided into: control group, and cover group. In the cover group, right eyes served as the experimental eye, left eye as control eyes. Experimental eye were covered with handmade semi-translucent film. then measure the diopter and ?axial?length of tree shrews after being covered for 3 weeks and 6 weeks. The retinal thickness and the number of cells in each layer of retina were observed by electron microscopy after being covered for 6 weeks .ResultsThe tree shrews were born 4 months and 5 months form deprivation after 3 weeks, hyperopia was alleviated but not statistically significant compared with control eyes, and two groups of tree shrews cover eye diopter and eye axis are different obviously compared with control eyes after 6 weeks. At deprivation period, axial continue to extend and gradually increase to myopia, and they have a good negative linear relationship. Form deprivation can lead to thinning of the retina of the tree shrew, can also lead to number decrease on photoreceptor cell layer, inner nuclear layer, and ganglion cell layer cells .ConclusionForm deprivation can induce myopia formation and retinal morphological change in adolescence and early adulthood tree shrews.
Tree shrew; Form deprivation myopia (FDM); Retinal morphology.
Q95-33
A
1674-5817(2017)03-0171-08
10.3969/j.issn.1674-5817.2017.03.001
2016-12-12
国家自然科学基金(81560168), 国家科技支撑计划项目 (2014BAI01B01), 云南省联合支持国家计划项目(2015GA009), 云南省自然科学基金(2013FZ191), 昆明医科大学重点联合专项(2014FA017), 云南省卫生科技计划项目(2014NS043)
杨冬梅(1985-), 女, 硕士研究生, 住院医师, 研究方向: 斜视弱视小儿眼病。E-mail:12326703@qq.com
胡 敏。E-mail: fudanhumin@sina.com代解杰。E-mail: 278206145@qq.com

