无机磷溶解菌对扁穗雀麦生长及品质的影响
李小冬,王普昶,李显刚,王小利,舒健虹
(1.贵州省草业研究所,贵州 贵阳 550006; 2.黔南州饲草饲料工作站,贵州 都匀 558000)
无机磷溶解菌对扁穗雀麦生长及品质的影响
李小冬1,王普昶1,李显刚2,王小利1,舒健虹1
(1.贵州省草业研究所,贵州 贵阳 550006; 2.黔南州饲草饲料工作站,贵州 都匀 558000)
对扁穗雀麦(Bromuscartharticus)根际溶磷菌进行分离,得到6株溶磷菌株。采用盆栽试验,比较接种6种不同溶磷菌株对扁穗雀麦的株高、分蘖数、根长、地上与地下部分生物产量等的影响,同时也进行了营养品质(粗蛋白、粗脂肪、中性洗涤纤维、酸性洗涤纤维、全磷和全钙)的测定。结果发现:溶磷菌肥能促进扁穗雀麦根系生物量的增加,Br24,Br7和Br17的效果最明显;溶磷菌对株高和产量的促进作用在植物生长早期要优于后期,Br24与Br7效果最好。施加溶磷菌肥能够显著提高了植物总磷含量,降低了总钙与中性洗涤纤维含量(除Br8与Br17),促生效果较好的菌株粗蛋白含量略有下降(P>0.05),而促生效果不显著的菌株粗蛋白含量显著增加。综合分析,生产应用潜力最大的2个菌株为Br24与Br7。
溶磷菌;扁穗雀麦;产量性状;品质
磷是继氮之后影响植物生长的第二大量元素。磷在植物中占干重总量的0.05%~0.50%,是植物体内许多重要有机化合物的组成成分,在结构和生理上起着重要作用,同时又以多种方式参与植物体内的各种生理代谢,对促进植物的生长发育和新陈代谢,以及作物的早熟、高产、优质都起着重要的作用,磷素不足是限制植物生长和农业生产的重要因素[1]。土壤中磷含量在400~1 200 mg/kg,但能直接被植物吸收利用的磷只有1 mg/kg[2]。传统农业生产中大量施用磷肥不仅会导致环境污染,而且肥料中的速效磷很容易与土壤中的铁、铝生成难溶的化合物,加之磷在土壤中的运动速度很慢,植物体难以吸收利用。因此,最有效最环保的方法是筛选土壤根际中的溶磷菌为植物生长提供磷源。
溶磷菌是影响植物生长发育最重要的土壤微生物之一,它能够通过分泌自身代谢物降解土壤中难溶性磷。有研究报道,溶磷菌能够通过不同的途径促进植物生长,分泌甲酸、乳酸、丁二酸等多种有机酸是其主要溶磷机理[3-5],为植物提供可利用的磷源。此外,溶磷菌还能够与其他土壤有益微生物相互作用,促进土壤中铁细菌的产生[6-7]。除了直接促进植物生长外,溶磷菌还可以通过改善植物生长环境间接促进植物生长,通过分泌氢氰酸和抗菌素类药物抑制有害病菌的生长[8-9],以及降低乙烯含量,延缓植物衰老等作用[10-11]。
扁穗雀麦因其品质好、生长快,是贵州喀斯特地区适应性较好的牧草品种之一,但其在发芽与苗期都面临低磷胁迫危害,溶磷菌还具有一定的底物特异性与物种专一性[12-13]。以扁穗雀麦根系土壤中分离获得的溶磷菌为材料,通过盆栽试验研究其对扁穗雀麦生长的影响,旨在筛选出可以促进植物生长的溶磷菌株,同时探讨溶磷微生物对植物生长促进作用的机理。
1 材料和方法
1.1 供试菌株及培养土壤
试验地土壤全氮1.85 g/kg,全磷2.86 g/kg(P2O5),全钾15.66 g/kg(K2O),有机质47.08 g/kg,碱解氮111 mg/kg,有效磷35.5 mg/kg,速效钾317 mg/kg,pH为7.04。选用PKO无机培养基(含磷酸钙)分离菌株,保存用LB培养基,组成及配方参考文献[14]方法进行,溶磷菌从扁穗雀麦根际土壤中分离获得,其特性分析参考文献[15]方法(表1)。
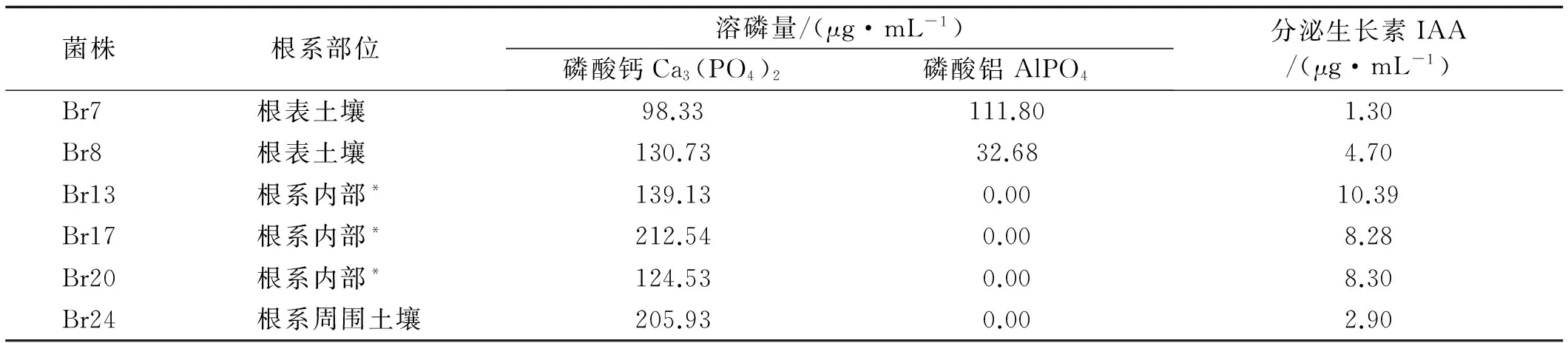
表1 供试菌株溶磷量和分泌生长素能力Table 1 Phosphorus dissolving and auxin segregation abilities of different strains
注:*将根洗净,用研钵磨碎后,离心取上清液分离培养
1.2 播种与栽培管理
取田间耕作层土壤0~20 cm,除去砾石及杂草枯枝后,混匀过2 mm筛,高温高压蒸汽灭菌2 h后装于栽培盆中,每盆装1.5 kg。扁穗雀麦种子用50℃温水浸泡过夜,用75%酒精浸种5 min,无菌水冲洗2~3次,1%的氯化汞消毒10 min,用无菌水冲洗5~6次后浸泡于溶磷菌悬液2~3 h,取出按常规方法播种于直径20 cm盆中,每盆播种25粒,每菌株3个重复,以不接种菌株为对照,置于生长室,22℃,16 h光照,8 h黑暗,光照强度为12 000 Lx。种子发芽后每盆保存10株进行观察。每次刈割后每钵追施尿素0.5 g,整个试验周期为6个月,在试验过程中未见明显元素缺乏表型。
1.3 农艺性状测定
播种后每生长1个月测量30个单株的株高,植株高度为地面到旗叶的高度。刈割后每材料随机选5株为一个整体测定地上部分干重,每组测6个重复。分蘖数为最后1次刈割植株的分蘖数,测量30个单株。根长与根重为最后1次测产时将根系全部取出进行根长、鲜重、干重的测定值,测15个生物学重复。用每组样品5次测产的地上部分混合均匀后进行营养成份分析。植株营养分析参照文献[16-17]方法测定。粗蛋白(凯氏定氮法);全磷(H2SO4-H2O2,消煮-钒钼黄比色法);全钙(干灰化-原子吸收分光光度法);粗脂肪(重量法);中性洗涤纤维(NDF)与酸性洗涤纤维(ADF)含量以范氏(Van Soest)洗涤法测定。
1.4 数据分析
数据用Excel 2010与SPSS 22.0统计软件进行分析,根据t检验进行差异显著分析(P<0.05水平)。
2 结果与分析
2.1 溶磷菌浸种对扁穗雀麦根系特性的影响
相对于各溶磷菌对株高的显著促生作用,其对根系的促进效果较弱。接种不同溶磷菌菌液的扁穗雀麦的根系长度与对照差异不显著(表2)。但植物根系的重量均比对照有增加趋势,除Br13与Br20外,其他处理均显著高于对照(P<0.05),其中,Br24,Br7和Br17促生效果最好(P<0.01)。干重的变化趋势与鲜重相同,Br3与Br20与对照差异不显著(P>0.05), Br24、Br7、Br17与Br8均显著高于对照(P<0.05)。
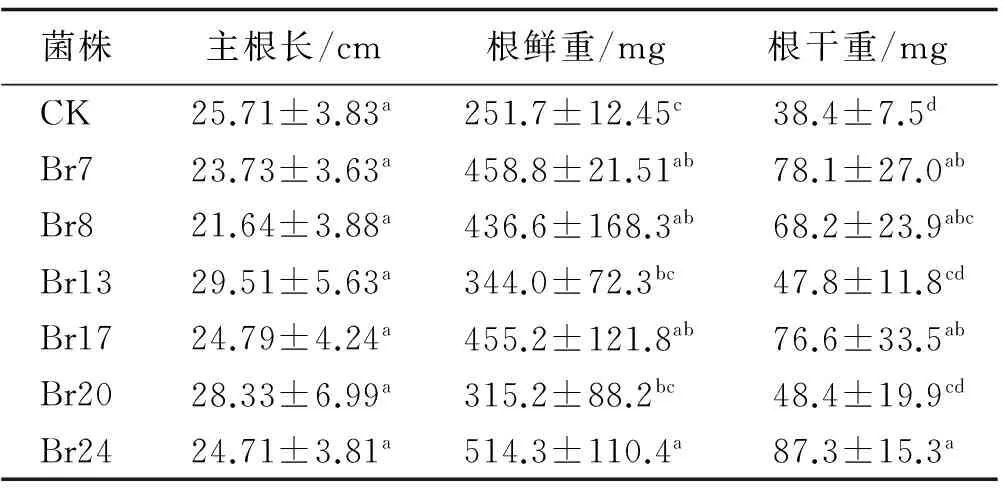
表2 不同溶磷菌处理下扁穗雀麦根系特性Table 2 Effect of different strains on root growth of Bromus cartharticus
注:同列不同小写字母表示差异显著(P<0.05)
2.2 不同溶磷菌对扁穗雀麦株高的影响
不同溶磷菌对植物的促生效果不同,在试验早期(第1茬),6种溶磷菌都能显著促进扁穗雀麦生长,其株高增加54.7%~120.7%(P<0.05)。第二茬与第三茬试验中,施用溶磷菌液的扁穗雀麦整体比对照要高,但相互之间差异不显著(P>0.05)。而对第4茬与第5茬产量测定表明,除了Br13,施用其余溶磷菌液的扁穗雀麦的株高与对照没有显著差异(P>0.05),Br13在第5茬中显著高于对照组(P<0.05)。从总体分析,筛选的溶磷菌属于快生型溶磷菌种,对植物早期生长的促生效果更明显,其中Br24,Br13和Br73种溶磷菌的促生效果最好(表3)。
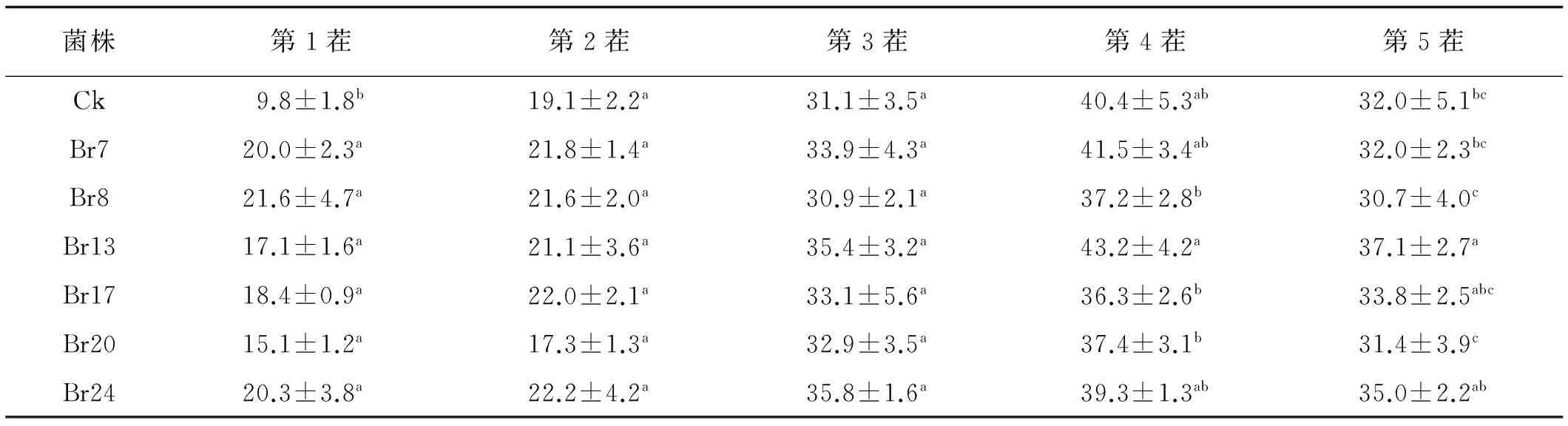
表3 不同溶磷菌处理下的扁穗雀麦株高Table 3 Effect of different strains on plant height of Bromus cartharticus cm
2.3 不同菌株对扁穗雀麦植株分蘖的影响
株高与分蘖数是禾本科牧草产量的两个决定性因素,试验中施加不同菌液对扁穗雀麦分蘖数发现,菌液能不同程度促进植株的分蘖,其中施用Br7与Br24菌液的植株分蘖数比CK增加69%~73%(P<0.05),Br8、Br13、Br17与Br20对植株分蘖的促进效果相对较弱,施用后尽管分蘖数增加,但与对照差异不显著(P>0.05,图1)。

图1 不同菌株处理下的扁穗雀麦植株分蘖数Fig.1 Effect of different strains on tillering number of Bromus cartharticus 注:*表示差异显著(P<0.05)
2.4 不同溶磷菌对扁穗雀麦产量的影响
测定不同菌液对扁穗雀麦产量的促生效果发现菌液的促生效应主要表现在植物生长早期,尽管每个菌株都有促生效果,但增加幅度与持续时间差异较大。第1茬与第2茬测产时,除Br13与Br20外,所有的菌液都对产量有显著促进作用(P<0.05),第3茬测产时发现只有施用Br7,Br17与Br24的植株产量显著高于对照(P<0.05),Br8,Br13与Br20差异不显著。第4茬与第5茬产量测定表明只有Br7与Br24两种菌液对植物促生达显著水平(P<0.05),然而其促生的增产幅度也比前3茬降低,其余菌液对植物促生效果与对照差异不显著。5茬草总产量比较发现,Br24与Br7对产量促进效果最好,Br13和Br17次之,而Br8与Br20对产量促进作用不明显(表4)。
2.5 溶磷菌液对扁穗雀麦品质的影响
根据施用菌液的差异将每个处理下5次刈割的扁穗雀麦牧草混合均匀,测定其营养品质的变化。粗蛋白是决定牧草营养品质的重要指标之一,不同溶磷菌液对扁穗雀麦粗蛋白含量影响较大,其中Br13与Br20显著高于对照(P<0.05),Br8与Br17与对照相当,Br7与Br24略低于CK,但他们与对照间均没有达到差异显著水平(P>0.05)。施用溶磷菌液使扁穗雀麦粗脂肪的含量有下降的趋势,Br7、Br8、Br17与Br20与对照相比,粗脂肪含量下降16%(P<0.05),Br13与Br20没有显著变化(P>0.05)。中性洗涤纤维与酸性洗涤纤维是衡量牧草营养价值的重要指标,并与动物采食量以及消化率显著相关。除Br8与Br17菌株外,施用其余菌液均能显著降低扁穗雀麦的中性洗涤含量(P<0.05),但有增加酸性洗涤纤维含量的趋势,除了施用Br13菌液比对照略低外,其余各菌液都不同程度提高了扁穗雀麦酸性洗涤纤维的含量,但都未达到差异显著(P>0.05)。使用溶磷菌液以后,扁穗雀麦的含磷量比对照高9.52%~19.05%(P<0.05)。然而施用溶磷菌液显著降低了扁穗雀麦植株钙含量,除Br8以外,其余各菌液降低值>70%(表5)。
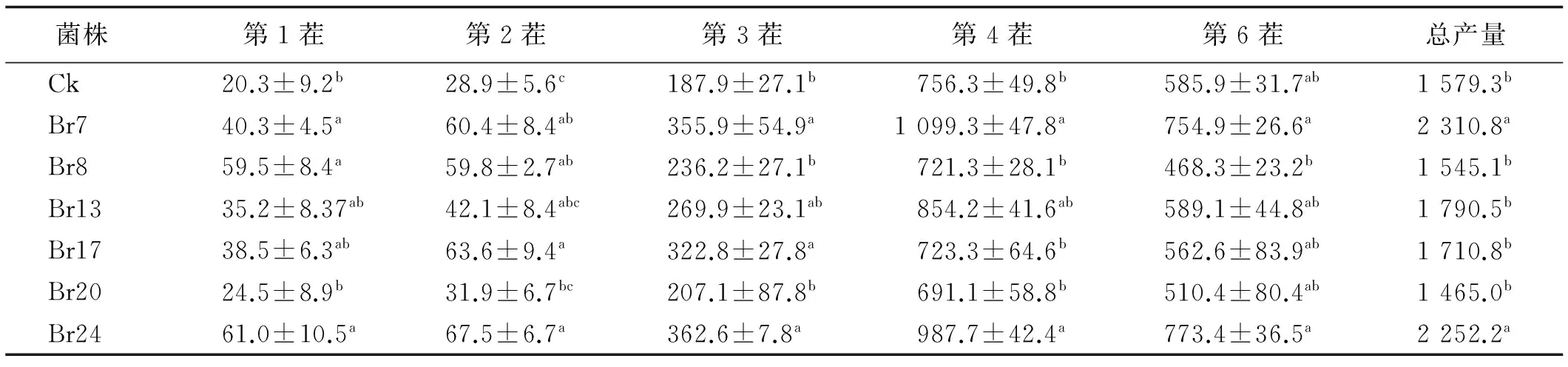
表4 不同溶磷菌处理下扁穗雀麦生物产量(干重)Table 4 Effect of different strains on yield (dry weight) of Bromus catharticus mg/(5株)
注:同列不同字母表示差异显著(P<0.05)
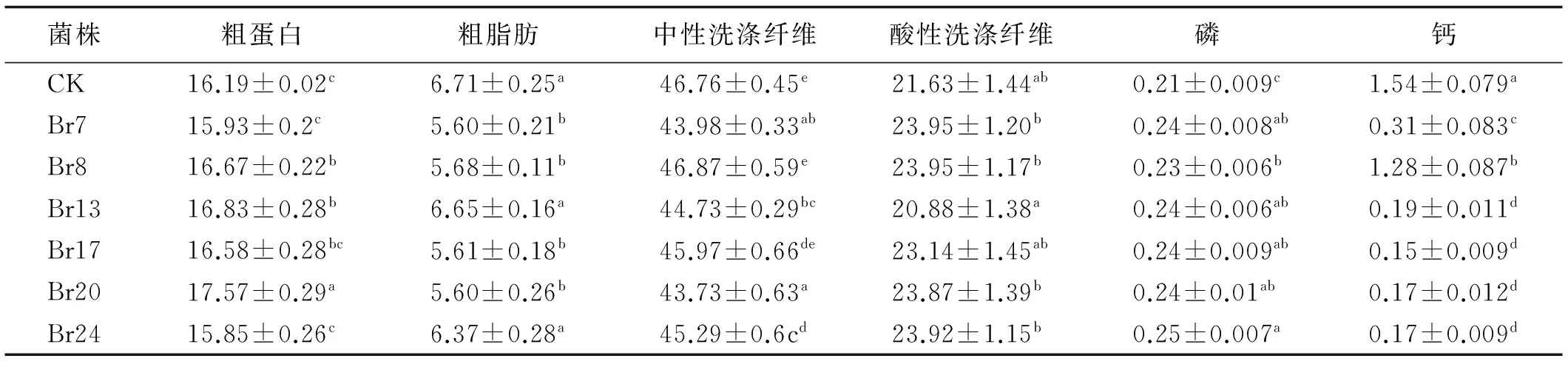
表5 不同菌种处理下扁穗雀麦的品质Table 5 Effect of different strains on forage quality of Bromus catharticus %
3 讨论
根系是作物的地下营养器官,起支持和固定植物体,吸收水分和养分等作用。最近的研究发现植物根系还可以合成并分泌部分氨基酸、生物碱以及植物激素,如生长素和细胞分裂素等,这些植物激素对作物的生长发育起调控作用[5]。根系发育直接影响作物产量,根质量与千粒质量、穗数以及根数与穗质量、穗数、穗粒质量、千粒质量显著正相关[18]。研究表明,主根长在处理组与对照组之间差异不显著,可能是因为盆栽试验条件限制造成,因为在5次产量测定完成后,所有植株的根系都已经生长到花钵的底部。然而对根系称重发现,除Br13与Br20外,其余菌株都显著提高了根系干重,反应了施用菌液对根粗以及侧根数的促进作用,分蘖数的增加也从侧面反应溶磷菌能够促进分蘖(分枝)。许多研究表明,在缺磷逆境中,植物通过促进根系发育来提高对磷的吸收能力[19]。植物为了寻求磷源,根系发育增强,根系伸长,侧根的长度和密度都增加,以加强对磷的吸收[20-21]。
溶磷菌对扁穗雀麦的株高与地上生物量的影响在试验早期的效果比较显著,可能是有限的生长条件造成的,花钵中可被溶解的无机磷数量有限,随着溶磷菌的分解以及植物生长消耗,试验后期土壤可利用的磷元素减少,因此,试验前期相对效果要优于后期。还有由于前期气温低,植株分蘖少,生长缓慢,溶磷菌解磷速率能够满足植物生长发育需要,而试验后期气温回升,扁穗雀麦迅速生长,溶磷菌解磷速率不能满足植物快速生长的需要,而造成植物相对缺磷。但有可能是菌活性影响造成,有研究表明植物益生菌活性在其贮存基质中存在波动性变化[22]。
植物根际微生物可生产大量的有机酸以溶解土壤中难溶性磷[23],前人的研究结果表明,氮元素含量增加能够促进磷元素的吸收[24],但磷元素含量的增加对氮元素的吸收具有一定拮抗作用[25]。试验中,施用对植物促生效果较好的Br7,Br17和Br24菌液的扁穗雀麦粗蛋白含量显著略低于对照(P>0.05),而促生效果不显著的Br8,Br13和Br20菌液对应的植物的粗蛋白都显著提高(P<0.05),虽然没有直接测定植株中氮元素的含量,但从侧面反映出高浓度的磷元素可能会抑制氮元素的吸收。因此,在制作生物菌液时需要根据植物对营养需求的特性对多种营养元素进行合理搭配。溶磷菌对植物纤维素含量影响的报道比较少,试验发现施用溶磷菌液后,扁穗雀麦的中性洗涤纤维的含量显著下降,酸性洗涤纤维的含量差异不显著,其原因还需下一步深入研究。
高钙影响植物的光合作用、生长速率及磷代谢,在拟南芥中研究发现植物代谢、防御、信号传导、转运等多个生理过程都受高钙的诱导表达[26-27],赵雪莱[28]研究报道,随着土壤钙磷比的增加,油蒿的株高及地上部分生物量的相对生长率均显著降低。喀斯特地区土壤的显著特点是钙离子含量高,施加溶磷菌液以后,所有处理组的扁穗雀麦植株磷离子含量增高,而钙离子含量降低,可能溶磷菌能够有效减少喀斯特地区高浓度钙离子对植物生长的副作用。钙元素含量也是影响牧草品质的一个重要指标,施加溶磷菌液后减低了钙离子含量的机制还不清楚,其是否会影响扁穗雀麦的营养品质还有待下一步研究。
4 结论
溶磷菌对扁穗雀麦根系具有一定促进作用,主要表现在根系生物量的增加,其中Br24,Br7和Br17的效果最明显。
溶磷菌对株高以及产量的促进作用在植物生长早期的促进效果要优于后期,其中Br24与Br7效果最好。施加溶磷菌液显著提高了植物总磷含量,降低了总钙与中性洗涤纤维含量(除Br8和Br17),促生效果较好的菌株粗蛋白含量略有下降(P>0.05),而促生效果不显著的菌株粗蛋白含量显著增加。
综合分析,应用生产潜力最大的两个菌株为Br24与Br7。
[1] Armada E,Probanza A,Roldán A,etal.Native plant growth promoting bacteria Bacillus thuringiensis and mixed or individual mycorrhizal species improved drought tolerance and oxidative metabolism in Lavandula dentata plants[J].Journal of Plant Physiology,2015,192:1-12.
[2] Ahemad M.Phosphate-solubilizing bacteria-assisted phytoremediation of metalliferous soils:a review[J].Biotechonology,2015,5(2):111-121.
[3] Rodr guez H,Fraga R,Gonzalez T,etal.Genetics of phosphate solubilization and its potential applications for improving plant growth-promoting bacteria[J].International Journal of Cultural Studies,2006,9(5):329-329.
[4] Misra N,Gupta G,Jha P N.Assessment of mineral phosphate-solubilizing properties and molecular characterization of zinc-tolerant bacteria[J].Journal of Basic Microbiology,2012,52(5):549-558.
[5] Oves M,Khan MS,Zaidi A.Chromium reducing and plant growth promoting novel strain Pseudomonas aeruginosa OSG41 enhance chickpea growth in chromium amended soils[J].European Journal of Soil Biology,2013,56(2):72-83.
[6] Ahemad M,Khan MS.Biotoxic impact of fungicides on plant growth promoting activities of phosphate-solubilizingKlebsiellasp.isolated from mustard(Brassicacampestris) rhizosphere[J].Journal of Pest Science,2012,85(1):29-36.
[7] Ahemad M,Khan M S.Effect of fungicides on plant growth promoting activities of phosphate solubilizingPseudomonasputidaisolated from mustard(Brassicacompestris) rhizosphere[J].Chemosphere,2012,86(9):945-950.
[8] Upadhyay A,Srivastava S.Evaluation of multiple plant growth promoting traits of an isolate ofPseudomonasfluorescensstrainPsd[J].Indian Journal of Experimental Biology,2010,48(6):601-609.
[9] Singh Y,Ramteke P,Shukla P K.Isolation and characterization of heavy metal resistant Pseudomonas spp.and their plant growth promoting activities[J].Appl Biochem Biotechnol,2013,170:1038-1056.
[10] Jiang C Y,Sheng X F,Qian M,etal.Isolation and characterization of a heavy metal-resistantBurkholderiasp.from heavy metal-contaminated paddy field soil and its potential in promoting plant growth and heavy metal accumulation in metal-polluted soil[J].Chemosphere,2008,72(2):157-164.
[11] Kumar K V,Singh N,Behl H,etal.Influence of plant growth promoting bacteria and its mutant on heavy metal toxicity inBrassicajunceagrown in fly ash amended soil[J].Chemosphere,2008,72(4):678-683.
[12] 钟传青,黄为一.磷细菌P17对不同来源磷矿粉的溶磷作用及机制[J].土壤学报,2004,41(6):931-937.
[13] Subhashini D.Effect of N、P、K fertilizers and co-inoculation with phosphate-solubilizing arbuscular mycorrhizal fungus and potassium-mobilizing bacteria on growth,yield,nutrient acquisition,and quality of tobacco(NicotianatabacumL.)[J].Communications in Soil Science and Plant Analysis,2016,47(3):328-337.
[14] 李凤霞,张德罡,姚拓.高寒地区燕麦根际高效PGPR菌培养条件研究[J].甘肃农业大学学报,2004,39(3):316-320.
[15] 舒健虹,王普昶,李显刚,等.无机磷溶解菌的分离筛选及其对扁穗雀麦生长的影响[J].草业学报,2017,26(5).
[16] 吴发莉.不同区域和季节对高寒天然牧草品质的影响[D].雅安,四川农业大学,2014.
[17] 韩华雯,姚拓,王国基,等.不同根际促生菌肥复合载体对燕麦产量的影响[J].草原与草坪,2013,33(4):39-44.
[18] 石庆华,李木英.水稻根系特征与地上部关系的研究初报[J].江西农业大学学报,1995,17(2):110-115.
[19] Narang R A,Altmann T.Phosphate acquisition heterosis inArabidopsisthaliana:a morphological and physiological analysis[J].Plant & Soil,2001,234(1):91-97.
[20] Williamson L C,Ribrioux S P,Fitter A H,etal.Phosphate availability regulates root system architecture inArabidopsis[J].Plant Physiology,2001,126(2):875-882.
[21] 郭再华,贺立源,徐才国.不同耐低磷水稻基因型秧苗对难溶性磷的吸收利用[J].作物学报,2005,31(10):1322-1327.
[22] 陈娟丽,师尚礼,祁娟.磷肥与菌肥配施对青藏高原高寒区苜蓿草地生产力的影响[J].草原与草坪,2016,33(2):27-33.
[23] 黄晓东,季尚宁,Glick B,等.植物促生菌及其促生机理[J].现代化农业,2002(6):7-7.
[24] He L Y,Zhang Y F,Ma H Y,etal.Characterization of copper-resistant bacteria and assessment of bacterial communities in rhizosphere soils of copper-tolerant plants[J].Applied Soil Ecology,2010,44(1):49-55.
[25] 薛玉侠.果树根腐病恰选药物方奏效[J].农业机械,2015(14):55.
[26] Chan C W,Wohlbach D J,Rodesch M J,etal.Transcriptional changes in response to growth ofArabidopsisin high external calcium[J].Febs Letters,2008,582(6):967-976.
[27] 申屠文月,袁灵芝,张纯大.钙对高羊茅草坪草耐热性的影响[J].草原与草坪,2007(1):49-51.
[28] 赵雪莱.土壤钙磷比对油蒿群落稳定性的影响[D].天津:南开大学,2012.
Effects of phosphate-solubilizing bacteria on the growth and quality ofBromuscartharticus
LI Xiao-dong1,WANG Pu-chang1,LI Xian-gang2,WANG Xiao-li1,SHU Jian-hong1
(1.GuizhouInstituteofPrataculture,Guiyang550006,China;2.QiannanForageStation,Duyun55800,China)
Six strains of phosphate-solubilizing bacteria (Br7,Br8,Br13,Br17,Br20,Br24)isolated from the rhizosphere soil of rescuegrass (Bromuscartharticus) were applied to rescuegrass in order to test their promotion effect on productivity with pot experiment.The result indicated that phosphorus-solubilizing bacteria can promote root biomass,of which,Br24,Br7 and Br17 were the best.The promotion effect of phosphorus-solubilizing bacteria on plant height and yield was better in the early stages.Br24 and Br7 were the best strains.Phosphorus-solubilizing bacteria could significantly increase the plant total phosphorus content,and reduce the content of total calcium and neutral detergent fiber (except Br8 and Br17).The strains with better growth promoting effect slightly decreased the crude protein content (P>0.05).The rpomising strains were Br24 and Br7.
phosphate-solubilizing bacteria;Bromuscartharticus;yield;forage quality
2016-06-20;
2017-03-21
贵州省科技计划(黔科合NY字[2016]3004号),贵州省社会发展攻关(黔科合NY字[2011]3104号),农业科学院自主创新科研专项(黔农科院自主创新科研专项字[2014]010号)和贵州省农业科技攻关(黔科合NY字[2010]3045号)资助
李小冬(1972-),湖南邵阳人,博士,副研究员,主要从事牧草遗传育种与分子生物学研究。 E-mail:lixiaodongzl@163.com 舒健虹为通讯作者。
S 543
A
1009-5500(2017)03-0036-06
——黔南扁穗雀麦

