骨形态蛋白9诱导干细胞骨向分化与环氧酶-2及PI3K/Akt的关系研究
李 洋,陈前昭,邵 英,曾于桦,任文艳,刘荣兴,何百成
(1. 重庆医科大学药学院,2. 重庆市生物化学与分子药理学重点实验室,重庆 400016)
◇论 著◇
骨形态蛋白9诱导干细胞骨向分化与环氧酶-2及PI3K/Akt的关系研究
李 洋1,2,陈前昭1,2,邵 英1,2,曾于桦1,2,任文艳1,2,刘荣兴1,2,何百成1,2
(1. 重庆医科大学药学院,2. 重庆市生物化学与分子药理学重点实验室,重庆 400016)
目的 研究骨形态蛋白9(BMP9)诱导干细胞成骨分化过程中对PI3K/Akt信号的激活与环氧酶-2(COX-2)的关系。方法 利用组织化学染色法、化学发光法或定量PCR检测碱性磷酸酶(ALP)的水平,Western blot检测骨桥素(OPN)、骨钙素(OCN)、COX-2、Akt1/2和磷酸化Akt1/2(p-Akt1/2)水平,RT-PCR检测COX-2的表达,用免疫组化或免疫荧光分别检测COX-2的表达水平以及Akt1/2的磷酸化水平,用茜素红染色检测钙盐沉积。结果 BMP9在C2C12细胞中明显增加ALP活性,促进OPN和OCN表达以及钙盐沉积;BMP9对Akt1/2总蛋白无明显影响,能明显增加Akt1/2磷酸化水平, PI3K抑制剂呈浓度依赖性减弱BMP9诱导ALP活性增加。BMP9在C2C12细胞中促进COX-2表达,抑制COX-2明显减弱BMP9在C2C12细胞中诱导ALP活性增加和钙盐沉积的作用。外源性过表达COX-2促进BMP9诱导p-Akt1/2水平增加,而抑制COX-2则明显减弱BMP9诱导Akt1/2磷酸化水平增加。结论 BMP9在诱导干细胞成骨化过程中对PI3K/Akt信号的激活可能与其促进COX-2表达有关。
骨形态蛋白9;干细胞;成骨分化;成骨标志物;PI3K/Akt;环氧酶-2
1 材料与方法
1.1 试剂及细胞培养 C2C12细胞购自美国ATCC(American Type Culture Collection)。NS-398购自Sigma,采用DMSO作为溶媒。实验所用一抗均购自Santa Cruz biotechnology公司。PI3K抑制剂LY294002(S1105)购自赛力克公司(Selleck)。用DMEM培养基(含10%胎牛血清、100 kU·L-1青霉素和0.1 g·L-1链霉素)培养细胞,条件为5% CO2及37 ℃。
1.2 BMP9重组腺病毒载体构建 本研究所用的重组腺病毒载体采用AdEasy系统进行构建[11]。方法简述如下:以BMP9的编码序列(CDS)EST克隆为模板,利用高保真Taq酶经PCR将目的基因的编码序列扩增并克隆到穿梭质粒中。然后,线性化穿梭质粒后与骨架质粒进行同源重组,再将重组正确的质粒线性化后转染到HEK-293细胞中进行病毒包装,即得到目的基因的重组腺病毒载体。重组腺病毒载体以绿色荧光蛋白(GFP)进行标记。所获得的重组病毒载体包括BMP9重组腺病毒载体(AdBMP9)和绿色荧光蛋白重组腺病毒载体(AdGFP,作为载体对照)。
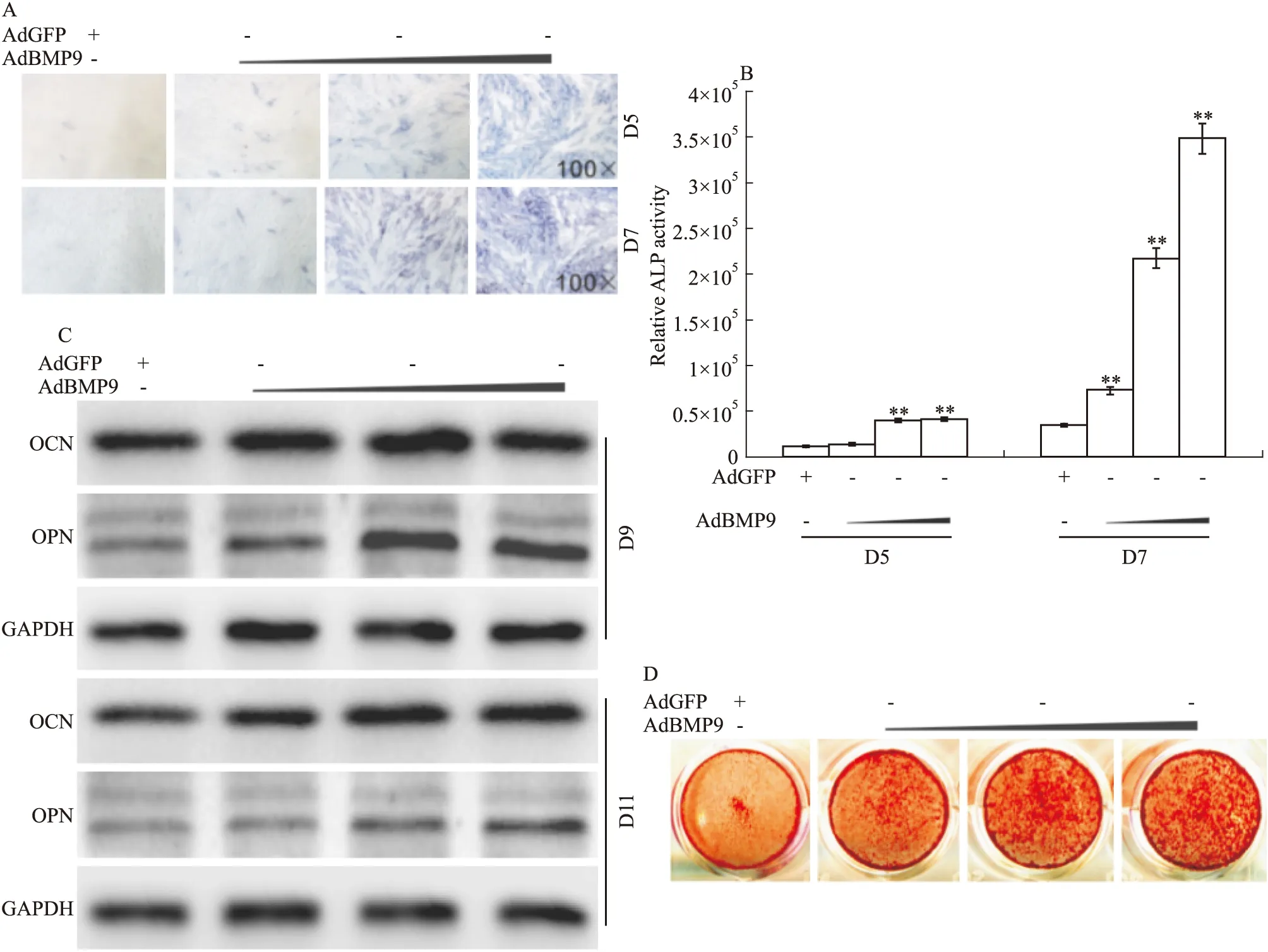
Fig 1 Effects of BMP9 on different osteogenic markers in C2C12 cells
A:Histochemical staining results showed the effect of BMP9 on the ALP activities in C2C12 cells; B: Chemiluminescent assay results showed the effect of BMP9 on the ALP activities in C2C12 cells,**P<0.01vscontrol group;C: Western blot assay results showed the effect of BMP9 on the level of OPN and OCN in C2C12 cells;D:Alizarin red staining results showed the effect of BMP9 on minerlization in C2C12 cells(D14)
1.3 碱性磷酸酶(alkaline phosphatase, ALP)活性测定 采用染色法检测ALP活性,BCIP/NBT是进行ALP检测的常用底物。在ALP的催化下,BCIP被水解后其产物与NBT发生反应,生成不溶性的深蓝色至蓝紫色的甲臜,颜色深浅反映ALP的活性强弱;或采用化学发光法测定ALP的活性(BD Clontech,#631738),具体操作按试剂盒说明书进行。每组实验重复3次实验。
1.4 RT-PCR和real-time PCR检测 将细胞种于T25培养瓶中,贴壁后按实验设计加入相应的处理因素。采用异硫氰酸胍-酚-氯仿法提取总RNA,通过逆转录反应(reverse transcription, RT)制备cDNA,然后用PCR或real-time PCR检测目的基因表达情况。实验所用PCR引物如下:GAPDH, 上游5′-GGCTGCCCAGAACATCAT-3′,下游 5′- CGGACACATTGGGGGTAG-3′;COX-2,上游5′-AGAAGGAAATGGCTGCAGAAT-3′,下游5′-GCTCGGCTTCCAGTATTGAG-3′。ALP, 上游5′-TAACACCAAC GCTCAGGTCC-3′,下游5′-TGGATGTGACCTCATTGCCC-3′。
1.5 Western blot检测 将生长状态良好的细胞消化后种于6孔板中,待细胞完全贴壁后按实验设计加入相应处理因素。按实验设计在不同时间点提取各组总蛋白,采用BCA法测定各组总蛋白浓度。用10%的聚丙烯酰胺凝胶进行电泳,按常规方法进行Western blot操作。最后采用ECL化学发光法显影,用凝胶成像仪成像。每组实验重复3次。
1.6 茜素红染色实验 茜素红染色参照文献报道进行操作[2]。将细胞种于24孔板,待细胞贴壁后加入相应的处理因素,于给药后d 14进行检测。方法简述如下:弃培养基后用PBS小心洗清1次,用2.5%戊二醛固定10 min,吸去固定液后再用PBS(pH值为4.2)清洗2次。用2%茜素红染液处理细胞20 min,最后用PBS(pH值为4.2)清洗2次。每组实验重复3次。
1.7 细胞免疫组化实验 将细胞均匀种于24孔板中,贴壁后按实验分组加入相应处理因素。48 h后,将细胞用4%甲醛固定,经PBS清洗后用0.3% Triton X-100处理10 min。PBS清洗后用H2O2孵育20 min, 再用PBS清洗。一抗(COX-2) 孵育过夜(4 ℃),用PBS清洗后再孵二抗,最后用DAB试剂盒显色并在显微镜下采集图像。每组实验重复3次。
为了考察此观点的可信度,笔者选取了著名女性作者祝庆英,男性译者黄源深的译本《简·爱》作为参照,以实例对比研究,探讨男性译者到底能否与女性感同身受。
1.8 细胞免疫荧光实验 将细胞均匀种于24孔板中,贴壁后按实验分组加入相应处理因素。48 h后,将细胞用4%甲醛固定,经PBS清洗后用0.3% Triton X-100处理10 min。PBS清洗后用山羊血清封闭20 min,然后用一抗(p-Akt1/2) 孵育过夜(4 ℃)。用PBS清洗后再孵二抗(罗丹明标记)。用PBS清洗后加DAPI(100 ng·L-1)孵育8 min。PBS清洗后封片,荧光显微镜下采集图像。每组实验重复3次。
2 结果
2.1 BMP9对C2C12细胞骨向分化的影响 BMP9不但能明显诱导间充质干细胞骨向分化,而且也能诱导肌源性干细胞(C2C12)成骨分化,但确切机制仍不十分清楚。本研究拟利用C2C12细胞进一步分析BMP9诱导干细胞骨向分化的可能机制。首先,验证BMP9对肌源性干细胞C2C12成骨分化的影响。 组织化学染色及化学发光法检测结果显示,在C2C12细胞中BMP9明显增加ALP活性(Fig 1A、1B);同时,BMP9也明显增加OPN和OCN蛋白表达水平(Fig 1C);茜素红染色结果显示,BMP9明显诱导钙盐沉积(Fig 1D)。以上结果证实,BMP9能诱导C2C12细胞骨向分化。
2.2 PI3K/Akt对BMP9诱导C2C12细胞ALP活性增加的影响 PI3K/Akt信号参与细胞的增殖与分化调控。Western blot分析结果显示,BMP9能呈浓度依整性增加C2C12细胞中Akt1/2磷酸化水平(Fig 2A)。这一结果提示,PI3K/Akt信号对BMP9诱导干细胞骨向分化可能具有调控作用。因此,本研究采用PI3K/Akt抑制剂进一步分析。结果显示,抑制PI3K/Akt对C2C12细胞ALP活性没有影响,但能明显降低BMP9诱导C2C12细胞ALP活性增加的作用(Fig 2B)。以上结果提示, PI3K/Akt信号可能参与调节BMP9诱导干细胞骨向分化,但BMP9激活该信号的机制尚不清楚。
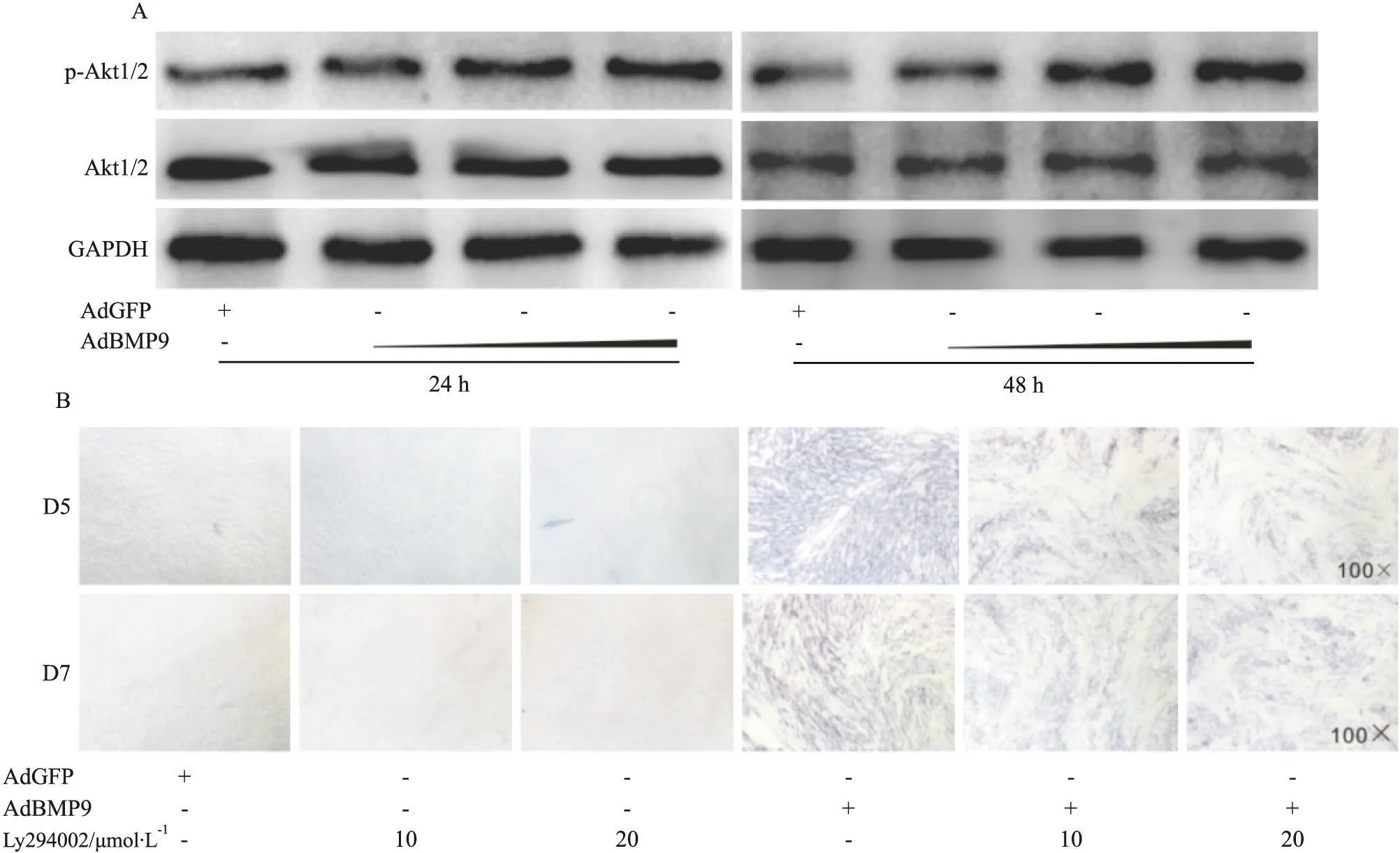
Fig 2 Effects of PI3K/Akt on BMP9-induced ALP activities in C2C12 cells
A: Western blot assay results showed the effect of BMP9 on the level of total Akt1/2 and phosphorylated Akt1/2 in C2C12 cells (48 h); B: Histochemical staining results showed the effect of PI3K/Akt inhibitor on BMP9-induced ALP activities in C2C12 cells. Ly294002: PI3K/Akt inhibitor
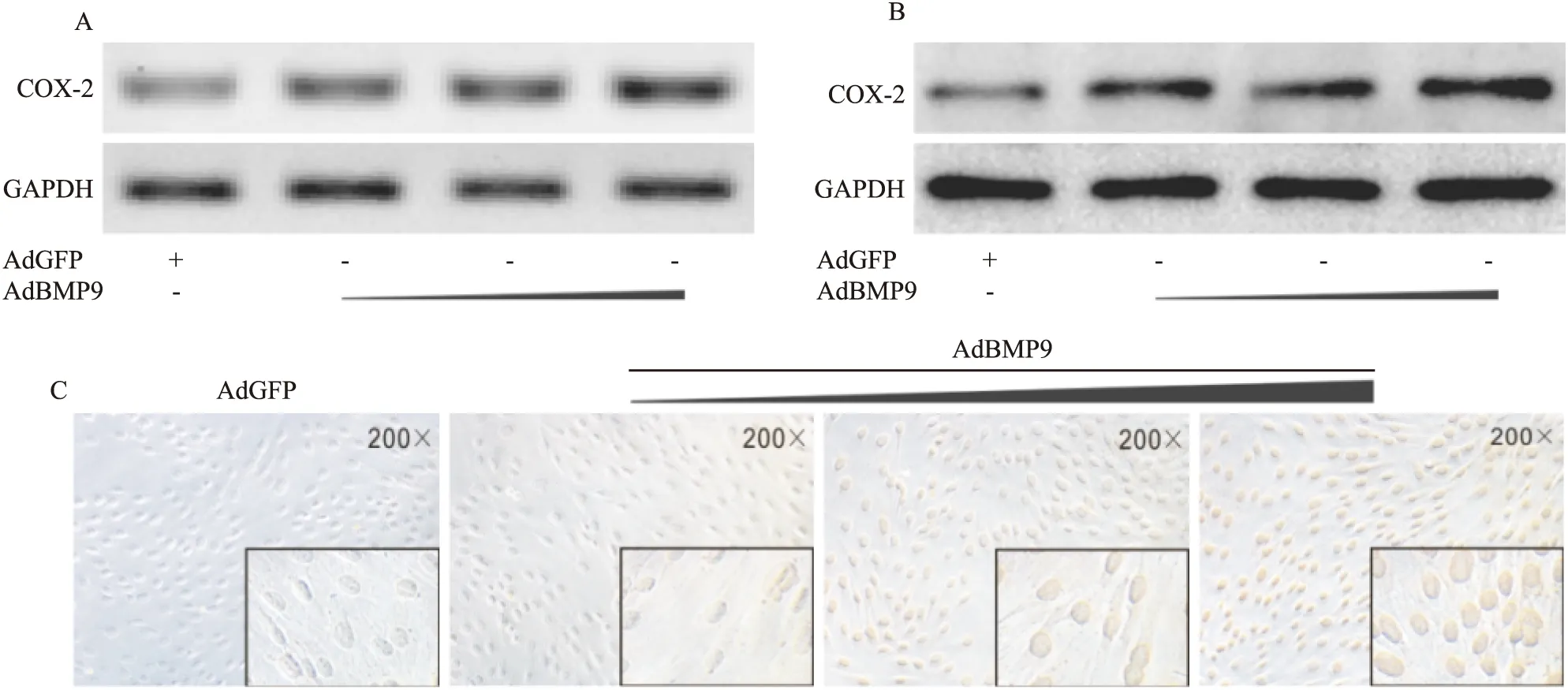
Fig 3 Effects of BMP9 on the expression of COX-2 in C2C12 cells
A: RT-PCR assay results showed the effect of BMP9 on the expression of COX-2 in C2C12 cells(48 h);B:Western blot assay results showed the effect of BMP9 on the expression of COX-2 in C2C12 cells(48 h);C:Immunocytochemical staining results showed the effect of BMP9 on the expression of COX-2 in C2C12 cells(48 h).The images in the rectangle showed the detail of the staining results
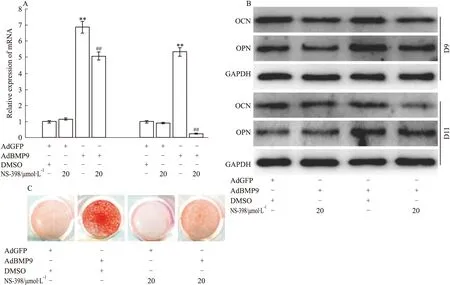
Fig 4 Effects of COX-2 on BMP9-induced osteogenic markers in C2C12 cells
A: Real-time PCR assay results showed the effect of COX-2 inhibitor on the mRNA expression of ALP induced by BMP9 in C2C12 cells.**P<0.01vscontrol group;##P<0.01vsBMP9 treated group. B: Western blot assay results showed the effect of COX-2 inhibitor on the protein level of OPN and OCN induced by BMP9 in C2C12 cells. C: Alizarin red staining results showed the effect COX-2 inhibitor on BMP9-induced mineralization in C2C12 cells(D14).NS-398: COX-2 inhibitor
2.3 BMP9在C2C12细胞中对COX-2表达的影响 COX-2抑制剂虽然因胃肠道反应较小而在临床被广泛使用,但仍具有潜在的心脏和明显延迟骨折愈合等不良反应。由于,COX-2对干细胞成骨分化可能具有促进作用。因此,本研究进一步分析BMP9在C2C12细胞中对COX-2表达的影响。PCR、Western blot和细胞免疫组化结果均显示,在C2C12细胞中,BMP9能明显促进COX-2的mRNA表达和增加COX-2的蛋白水平(Fig 3A、B、C)。以上结果证实,BMP9在C2C12细胞中能促进COX-2表达。 提示,COX-2可能参与BMP9诱导C2C12细胞骨向分化。
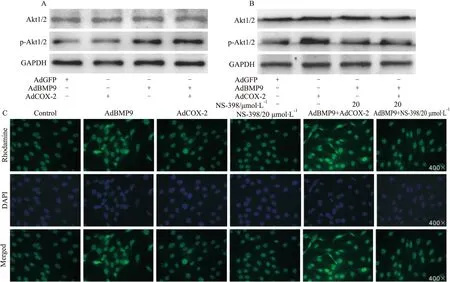
Fig 5 Effects of COX-2 on BMP9-induced phosphorylation of Akt1/2 in C2C12 cells
A: Western blot assay results showed the effect of exogenous COX-2 on the level of Akt1/2 and phosphorylated Akt1/2 affected by BMP9 in C2C12 cells(48 h); B: Western blot assay results showed the effect of COX-2 inhibitor on the level of Akt1/2 and phosphorylated Akt1/2 affected by BMP9 in C2C12 cells (48 h); C: Immunofluorescent staining results showed the effect of COX-2 inhibitor on the level of phosphorylated Akt1/2 affected by BMP9 in C2C12 cells(48 h). NS-398: COX-2 inhibitor
2.4 COX-2对BMP9诱导C2C12细胞成骨分化的影响 由于BMP9在C2C12细胞中也能诱导COX-2表达,所以本研究进一步分析和确证在该细胞中COX-2对BMP9诱导干细胞骨向分化的影响。Real-time PCR分析结果显示,在C2C12细胞中,BMP9促进ALP 的mRNA表达,但NS-398能明显降低BMP9对ALP mRNA表达的促进作用(Fig 4A)。Western blot分析结果显示,NS-398能抑制BMP9在C2C12细胞中对OPN和OCN表达的促进作用(Fig 4B)。茜素红染结果显示,BMP9明显诱导钙盐沉积,但这种作用能被NS-398抑制(Fig 4C)。以上结果提示,COX-2参与调节BMP9诱导C2C12细胞骨向分化的调控,但机制尚不清楚。
2.5 COX-2对BMP9在C2C12细胞激活PI3K/Akt信号的影响 BMP9在C2C12细胞中明显促进Akt1/2磷酸化,同时也促进COX-2表达。研究报道,PI3K/Akt信号活化能促进COX-2表达,即COX-2受PI3K/Akt信号调控,但目前还不清楚COX-2是否能影响PI3K/Akt信号活化。Western blot分析结果显示,BMP9及BMP9合并COX-2过表达虽然对总Akt1/2的水平无明显影响,但均能增加Akt1/2的磷酸化水平; COX-2本身并不能增加Akt1/2的磷酸化水平,但能增强BMP9对Akt1/2磷酸化的促进作用(Fig 5A)。COX-2抑制剂(NS-398)则明显减弱BMP9对Akt1/2磷酸化的促进作用,同时对总Akt1/2的水平也无明显影响(Fig 5B)。进一步通过免疫荧光分析,结果显示BMP9增加Akt1/2磷酸化水平,外源性过表达COX-2能增强BMP9对Akt1/2磷酸化的促进作用,而NS-398则减弱BMP9的这种作用(Fig 5C)。 结果提示,BMP9在干细胞中上调COX-2表达可能是其激活PI3K/Akt信号的重要途径之一。
3 讨论
BMP9作为目前诱导干细胞成骨分化能力最强的因子之一,具有很好的临床应用前景。课题组前期结果显示,BMP9在诱导干细胞成骨分化过程中明显激活PI3K/Akt信号,但机制尚不清楚[2]。本研究发现,BMP9在诱导C2C12细胞成骨分化过程中不但增加Akt1/2磷酸化水平,同时COX-2表达明显增加;抑制COX-2则明显减弱BMP9对Akt1/2磷酸化的促进作用。提示,BMP9在诱导干细胞成骨分化过程中激活PI3K/Akt信号可能与其促进COX-2表达有关,但COX-2调节PI3K/Akt信号的确切机制还不清楚。
BMPs属于转化生长因子β(transforming growth factor-β,TGF-β)超家族,目前已发现近20种BMPs成员。BMPs具有多种生物学功能,不仅参与调节诱导干细胞成骨分化,也与机体某些疾病的发生与发展密切相关[12]。BMPs作为配体与相应受体(BMPⅠ型和Ⅱ型受体)结合,通过经典或非经典BMPs/Smads信号通路调节靶基因表达, 如Runx2、Osterix和Dlx-5等[12-13]。研究发现[1],除传统的BMP2和BMP7外,BMP4、BMP6和BMP9也能诱导干细胞成骨分化。其中,BMP9诱导干细胞成骨分化的能力明显较其他几种成骨性BMPs成员强。因此,BMP9在组织骨工程中具有很好的临床应用前景。
多种信号参与调控BMP9诱导干细胞成骨分化,如Wnt/β-catenin和Notch信号等[2,4]。本研究发现,在BMP9诱导干细胞成骨分化过程中PI3K/Akt信号也明显被激活,而该信号对细胞的增殖、分化和凋亡等功能具有重要调节作用,肿瘤的发生与PI3K/Akt信号异常激活密切相关[6];抑制PI3K/Akt明显减弱BMP9诱导干细胞成骨分化的能力(Fig 2B)。提示,该信号也参与BMP9诱导干细胞成骨分化过程的调控。PI3K/Akt信号本身受多种因子调节,如胰岛素样生长因子(insulin-like growth factor, IGF)和生长激素(growth hormone, GH)等因子能激活该信号,而第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homolog deleted on chromosome ten, PTEN)则能抑制该信号。抑制PTEN能明显促进BMP9诱导干细胞成骨分化[14]。虽然BMP9在诱导C2C12细胞骨向分化过程中能促进Akt1/2磷酸化,但BMP9激活该信号的具体机制目前尚不清楚。
COX-2抑制剂具有多种药理作用,如镇痛、退热及抑制血小板聚集等,在临床被广泛应用[7]。研究表明COX-2抑制剂具有明显的骨胳系统毒性,能使骨折愈合明显延迟,并可导致骨不连接等不良反应[15]。研究发现,COX-1基因敲除对小鼠的骨折愈合无明显影响,但COX-2敲除则使小鼠的骨折愈合明显延迟,并且从COX-2敲除小鼠来源的骨髓基质细胞成骨分化能力也明显受到抑制[16]。课题组前期研究发现,BMP9在诱导干细胞成骨分化过程中明显促进COX-2表达,沉默或抑制COX-2均能减弱BMP9诱导干细胞成骨分化的能力[8,17]。因此,COX-2可能是BMP9诱导干细胞成骨分化所必需的重要因子之一。到目前为止,COX-2调节BMP9诱导干细胞成骨分化的机制还不清楚。
由于BMP9既能激活PI3K/Akt信号,又能促进COX-2表达,因此我们推测COX-2可能与PI3K/Akt信号激活有关。本研究结果显示,外源性过表达COX-2虽然不能直接提高Akt1/2的磷酸化水平,但能增强BMP9对Akt1/2磷酸化的促进作用,抑制COX-2则明显减弱BMP9对Akt1/2磷酸化水平影响。结果提示,BMP9对PI3K/Akt信号的激活可能与其促进COX-2表达有关。研究报道,PI3K/Akt信号能调节COX-2表达[18],抑制PTEN也能促进COX-2表达[14]。由于PI3K/Akt信号激活后可进一步激活Wnt/β-catenin信号,而COX-2又是Wnt/β-catenin信号的靶基因之一[10]。因此,PI3K/Akt对COX-2表达的调节可能与Wnt/β-catenin信号有关,因为在BMP9诱导干细胞成骨分化过程中Wnt/β-catenin信号也被明显激活[2]。本研究发现,在BMP9诱导干细胞成骨分化过程中,可能存在一种反馈性调节环路: PI3K/Akt调节 COX-2表达,而COX-2又反过来调节PI3K/Akt信号的转导,但这一反馈调节的详细机制还有待深入分析。
综上所述,本研究发现在BMP9诱导干细胞成骨分化过程中,PI3K/Akt信号转导活性的增加可能与BMP9促进COX-2表达有关,但COX-2参与调节PI3K/Akt信号的具体机制尚需进一步研究。
(致谢:本研究在重庆市生物化学与分子药理学重点实验室完成,感谢芝加哥大学医学中心何通川教授为本研究提供所需的重组腺病毒载体;同时,也感谢博士生张然熙及硕士生吴念对本课题的帮助。)
[1] Luu H H, Song W X, Luo X, et al. Distinct roles of bone morphogenetic proteins in osteogenic differentiation of mesenchymal stem cells[J].JOrthopRes, 2007, 25(5):665-77.
[2] Liu Y, Liu Y, Zhang R, et al. All-trans retinoic acid modulates bone morphogenic protein 9-induced osteogenesis and adipogenesis of preadipocytes through BMP/Smad and Wnt/β-catenin signaling pathways[J].IntJBiochemCellBiol, 2014, 47:47-56.
[3] Lamplot J D, Qin J, Nan G, et al. BMP9 signaling in stem cell differentiation and osteogenesis[J].AmJStemCells, 2013, 2(1):1-21.
[4] Li L, Dong Q, Wang Y, et al. Hedgehog signaling is involved in the BMP9-induced osteogenic differentiation of mesenchymal stem cells[J].IntJMolMed, 2015, 35(6):1641-50.
[5] Zhang W, Deng Z L, Chen L, et al. Retinoic acids potentiate BMP9-induced osteogenic differentiation of mesenchymal progenitor cells[J].PLoSOne, 2010, 5(7):e11917.
[6] Yang S X, Polley E, Lipkowitz S. New insights on PI3K/AKT pathway alterations and clinical outcomes in breast cancer[J].CancerTreatRev, 2016, 45:87-96.
[7] Boban A, Lambert C, Hermans C. Is the cardiovascular toxicity of NSAIDS and COX-2 selective inhibitors underestimated in patients with haemophilia?[J].CritRevOncolHematol, 2016, 100:25-31.
[8] Wang J H, Liu Y Z, Yin L J, et al. BMP9 and COX-2 form an important regulatory loop in BMP9-induced osteogenic differentiation of mesenchymal stem cells[J].Bone, 2013, 57(1): 311-21.
[9] 黄 军,刘映孜,袁霜雪,等. 环氧酶-2在骨形态蛋白9诱导间充质干细胞骨向分化中的作用研究[J]. 中国药理学通报, 2014, 30(7):1006-11.
[9] Huang J, Liu Y Z, Yuan S X, et al. Study on the role of COX-2 in BMP9 induced osteogenic differentiation in mesenchymal stem cells[J].ChinPharmacolBull, 2014, 30(7):1006-11.
[10]Yun K, Im S H. Lef1 regulates COX-2 transcription in chondrocytes[J].BiochemBiophysResCommun, 2007, 364(2):270-5.
[11]Luo J, Deng Z L, Luo X,et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J].NatProtoc, 2007, 2(5):1236-47.
[12]Kim M, Choe S. BMPs and their clinical potentials[J].BMBRep, 2011, 44(10):619-34.
[13]Akahashi K, Ogura N, Aonuma H, et al. Bone morphogenetic protein 6 stimulates mineralization in human dental follicle cells without dexamethasone[J].ArchOralBiol, 2013, 58(6):690-8.
[14]Huang J, Yuan S X, Wang D X, et al. The role of COX-2 in mediating the effect of PTEN on BMP9 induced osteogenic differentiation in mouse embryonic fibroblasts[J].Biomaterials, 2014, 35(36):9649-59.
[15]Wang Z, Bhattacharyya T. Trends of non-union and prescriptions for non-steroidal anti-inflammatory drugs in the United States, 1993-2012[J].ActaOrthop, 2015, 86(5):632-7.
[16]Zhang X, Schwarz E M, Young D A, et al. Cyclooxygenase-2 regulates mesenchymal cell differentiation into the osteoblast lineage and is critically involved in bone repair[J].JClinInvest, 2002, 109(11):1405-15.
[17]周龙洋,杨秋珺,牟钰钦,等.美洛昔康对骨形态发生蛋白9诱导间充质干细胞骨向分化的抑制作用[J].中国药理学与毒理学杂志,2012,26(3):321-6.
[17]Zhou L Y, Yang Q J, Mou Y Q, et al. The inhibitory effect of meloxicam on bone morphogenetic protein 9 induced osteogenic differentiation in mesenchymal stem cells[J].ChinJPharmToxicol, 2012, 26(3):321-6.
[18]Chien P T, Lin C C, Hsiao L D, et al. c-Src/Pyk2/EGFR/PI3K/Akt/CREB-activated pathway contributes to human cardiomyocyte hypertrophy: Role of COX-2 induction[J].MolCellEndocrinol,2015, 409:59-72.
Study on relationship between BMP9-induced osteogenic differentiation and COX-2/PI3K/Akt in stem cells
LI Yang1,2, CHEN Qian-Zhao1,2, SHAO Ying1,2, ZENG Yu-hua1,2, REN Wen-yan1,2,LIU Rong-xing1,2, HE Bai-cheng1,2
(1.SchoolofPharmacy,ChongqingMedicalUniversity,Chongqing400016,China;2.ChongqingKeyLabofBiochemistryandMolecularPharmacology,Chongqing400016,China)
Aim To investigated the possible effect of COX-2 on the BMP9-induced activation of PI3K/Akt signal in progenitor cells.Methods The activity of alkaline phosphatase(ALP) was measured using histochemical staining or chemiluminescence. The mRNA level of ALP was determined using real-time PCR assay. The protein levels of osteopontin(OPN), osteocalcin(OCN), COX-2, Akt1/2 and phosphorylated Akt1/2 were detected by Western blot. The mRNA level of COX-2 was assayed with RT-PCR, and the mineralization was measured with Alizarin Red staining.Results The ALP activity was apparently increased by BMP9 in C2C12 cells, as well as the protein level of OPN and OCN. The mineralization was also markedly induced by BMP9 in C2C12 cells. BMP9 increased the level of phosphorylated Akt1/2 greatly, although no substantial effect was observed on total protein level of Akt1/2. The BMP9-induced ALP activity was dramatically decreased by the inhibitor of PI3K. The mRNA and protein level of COX-2 were both increased by BMP9 in C2C12cells, and the BMP9-induced ALP activity and mineralization were greatly attenuated by the inhibitor of COX-2. The BMP9-induced phosphorylation level of Akt1/2 was increased by the exogenous expression of COX-2, but decreased by the inhibitor of COX-2.Conclusion Activation of PI3K/Akt signaling may be a critical event in BMP9-induced osteogenic differentiation, and this process may be mediated by the BMP9-upregulated COX-2 in stem cells at least.
bone morphogenetic protein 9; stem cell; osteogenic differentiation; osteogenic marker; PI3K/Akt; cycloxygenase 2
2017-03-18,
2017-04-20
国家自然科学基金资助项目(No 81372120)
李 洋(1987-),女,硕士生,研究方向:分子药理学,E-mail:506739201@qq.com; 何百成(1972-),男,博士,教授,研究方向:分子药理学和干细胞生物学,通讯作者,E-mail: hebaicheng99@yahoo.com
时间:2017-6-7 19:04 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170607.1904.012.html
10.3969/j.issn.1001-1978.2017.07.006
A
1001-1978(2017)07-0908-08
R341;R329.2;R329.24;R345.4;R977.3

