苹果树腐烂病菌活性物质的提取分离及结构鉴定
甄 伟,袁艮霞,王 惠,黄丽丽
(1.西北农林科技大学 理学院, 陕西杨凌 712100; 2.西北农林科技大学 植物保护学院,陕西杨凌 712100;3.西北农林科技大学 旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
苹果树腐烂病菌活性物质的提取分离及结构鉴定
甄 伟1,3,袁艮霞1,3,王 惠1,黄丽丽2,3
(1.西北农林科技大学 理学院, 陕西杨凌 712100; 2.西北农林科技大学 植物保护学院,陕西杨凌 712100;3.西北农林科技大学 旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
为探索苹果树腐烂病菌(Valsamali) 野生型菌株03-8产生的活性物质及其与致病性的关系,在以蔗糖为碳源的MS液体培养基中25 ℃静置培养20 d,利用大孔树脂吸附、二氯甲烷萃取、薄层层析和高效液相色谱等手段分离纯化,1H-NMR、13C-NMR、DEPT135、HMQC谱对纯化合物进行结构鉴定,并测定其生物活性。最终分离得到一个化合物D-2;结构鉴定为1-(3′-乙烯基-苯基)-1,2-乙二醇;该化合物1 mg/mL的丙酮水[V(丙酮)∶V(水)=1∶4]溶液不能在烟草和苹果叶片上引起坏死斑,但对枯草芽孢杆菌有抑制作用。
苹果树腐烂病菌;提取分离;鉴定;抑菌活性
苹果树腐烂病(Apple valsa canker)是由苹果黑腐皮壳属真菌Valsamali引起的苹果病害[1-2]。目前,控制苹果腐烂病害主要是采用刮除受感染树皮和涂抹杀菌剂的方法[3-4]。但是,效果不佳,主要原因是目前对该病菌的致病机理了解甚少。因此,探究苹果树腐烂病菌生长过程中产生的活性物质及其与致病性的关系具有重要意义。
关于苹果树腐烂病菌活性代谢产物的研究主要集中在果胶酶方面[5-8]。关于小分子的活性物质,目前只有Okuno等从该病菌的MS培养发酵液中提取分离出五种异香豆素物质[9]。关于其他结构类型的小分子物质当前尚未见报道。本研究采用蔗糖为碳源的液体培养基对野生型苹果树腐烂病菌03-8的发酵滤液进行提取分离和纯化,对纯物质进行结构鉴定,并对其生物活性进行测定,旨在获得新的活性相关物质,为进一步了解苹果树腐烂病菌提供依据。
1 材料与方法
1.1 菌种与培养基
供试菌种:苹果树腐烂病菌(Valsamali)野生型菌株03-8和枯草芽孢杆菌(EDR4),均由西北农林科技大学植物病害综合治理实验室提供,4 ℃保存。
液体培养基:参照Okuno等[9]的MS培养基的配制方法,以蔗糖(质量浓度5 g/L)代替其中的淀粉(质量浓度10 g/L),其他成分不变。
1.2 试剂与仪器
仪器:WD-9403A型荧光-紫外分析仪,北京市六一仪器厂; AVANCE III型核磁共振仪(500 MHz),瑞士Bruker BioSpin 公司;高效液相色谱仪(JYD07J308),日本岛津公司;柱色谱层析硅胶,青岛海洋化工有限公司;硅胶G,青岛海洋化工有限公司;XAD-2型大孔吸附树脂,美国Sigma Aldrich公司。
试剂:氯仿、甲醇、乙酸乙酯、石油醚等均购自天津市富宇精细化工有限公司,均为分析纯;氘代氯仿购自美国Sigma Aldrich公司。
1.3 发酵滤液制备
将苹果树腐烂病菌野生型菌株03-8接种于PDA平板培养基上,在25 ℃培养3 d,于菌落边缘的幼嫩菌丝处打菌饼(6 mm),将菌饼接种于配好的液体培养基中,每330 mL培养液放置15个菌饼。接种后将三角瓶置于25 ℃恒温室静置培养20 d,每隔12 h手动摇动1次。将培养好的菌液进行离心,上清依次用滤纸、0.45微米滤膜、0.22微米滤膜抽滤去除菌体,所得滤液即为发酵滤液。
1.4 提取分离
将预处理的大孔树脂XAD-2与发酵滤液混合,体积比为1∶3,在20 ℃、120 r/min摇床振摇10 h,使发酵滤液充分吸附于树脂上。将上述吸附后的大孔树脂装柱,依次以V(水)∶V(甲醇)(100∶0、75∶25、50∶50、25∶75、0∶100)为洗脱剂洗脱,洗脱剂体积用量为树脂体积的3倍,流速约1 mL/min,得5个馏分段(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ),通过称量确定各馏分段的含量,以含量较高的馏分段进行进一步分离纯化。
对馏分Ⅳ的水溶液用二氯甲烷进行萃取,浓缩得到二氯甲烷相,对二氯甲烷相进行硅胶制备薄层层析分离,展开剂为氯仿+甲醇[V(氯仿)∶V(甲醇)=9∶1],得到10个组分(A、B、C、D、E、F、G、H、I、J);D组分进一步用制备液相色谱分离,得到物质D-2。
1.5 生物活性测定
1.5.1 致病活性测定 分别在烟草叶片和苹果叶片上对化合物D-2进行致病活性检测。在烟草叶片上采用注射接种法。将1 mg/mL的D-2丙酮水[V(丙酮)∶V(水)=1∶4]溶液20 μL从烟草叶片背面注入,放置 2 d 后观察致病情况。每处理重复3次,设置丙酮水[V(丙酮)∶V(水)=1∶4]对照。在苹果叶片上采用针刺法。选取枝条前端完全展开的叶片,用无菌水冲洗晾干,用灭菌脱脂棉包裹叶柄基部,脱脂棉上滴加无菌水保湿,接种针刺伤,伤口处滴加1 mg/mL的D-2丙酮水[V(丙酮)∶V(水)=1∶4]溶液20 μL,保鲜膜密封保湿,放置 2 d 后观察致病情况。每处理重复3次,设置丙酮水[V(丙酮)∶V(水)=1∶4]对照。
1.5.2 抑菌活性测定 以枯草芽孢杆菌EDR4为指示菌对化合物D-2进行抑菌活性检测。取1 mg/mL 的D-2丙酮溶液20 μL加入50 mL的LB培养基中,以丙酮作对照;在5 mL的LB培养基中加入50 μL的枯草芽孢杆菌EDR4种子液,28 ℃、180 r/min摇培,4、8和12 h后分别检测其OD值,并利用统计软件Spass进行统计分析。
2 结果与分析
2.1 化合物D-2的结构鉴定
化合物D-2:紫外254 nm下有荧光吸收。1H-NMR(500 MHz,CDCl3-d6) δ:3.73 (1H,dd,J = 11.2,8.2 Hz),3.83 (1H,dd,J = 11.2,3.5Hz), 4.89 (1H,dd,J = 8.2,3.7 Hz),5.32 (1H,d,J = 10.7 Hz),5.82 (1H,d,J = 17.6 Hz),6.77 (1H,dd,J = 17.5,11.0 Hz),7.25(1H,d,7.4),7.38 (1H,d,J = 7.4,7.6 Hz),7.40(1H,d,J = 7.6 Hz),7.47 (1H,s);13C-NMR(500 MHz,CDCl3-d6)δ:68.09 (C-1*),74.63(C-2*),114.32 (C-8),123.91 (C-2),125.50 (C-4),125.89 (C-6),128.76 (C-5),136.61 (C-7),137.98 (C-3),140.84 (C-1); Dept135 δ:正峰:74.63,123.91,125.50,125.89,128.76,136.61;负峰:68.09,114.32。
对上述数据进行分析可知,化学位移在114.32,123.91,125.50,125.89,128.76,136.61,137.98,140.84的碳原子,表明该化合物含有苯环结构以及1个碳碳双键;7.25(1H,d,7.4),7.38 (1H,d,J = 7.4,7.6 Hz),7.40(1H,d,J=7.6 Hz),7.47 (1H,s)表明苯环为1,3双取代,5.32 (1H,d,J = 10.7 Hz),5.82 (1H,d,J=17.6 Hz),6.77 (1H,dd,J = 17.5,11.0 Hz)表明存在1个-CH=CH2。根据Dept135及13C-NMR可知化学位移74.63,123.91,125.50,125.89,128.76,136.61为伯碳和叔碳,68.09,114.32 为仲碳,137.98,140.84碳为季碳。综上所述化合物D-2为1-(3′-乙烯基-苯基)-1,2-乙二醇(图1)。
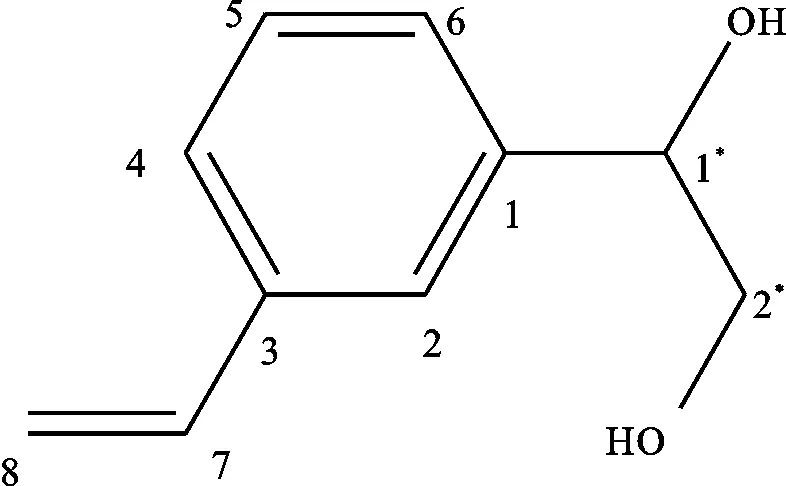
图1 1-(3′-乙烯基-苯基)-1,2-乙二醇Fig.1 1-(3′-ethenylphenyl)-1,2-ethanediol
2.2 化合物D-2的生物活性
2.2.1 化合物D-2的致病活性 对化合物D-2在烟草叶片上进行的生物活性测定试验发现,样品组和对照组无明显差异。表明化合物D-2对烟草叶片没有明显致病活性;采用针刺法检测化合物D-2对苹果叶片的致病活性试验中,样品组和对照组的个别处理虽然表现出微小差异,但统计分析结果差异不显著,表明化合物D-2对苹果叶片没有致病活性。分析认为虽然化合物D-2分离自苹果树腐烂病菌的发酵液中,但并非是该病菌的直接致病活性物质。
2.2.2 化合物D-2的抑菌活性 以丙酮为对照,将化合物D-2加入接有枯草芽孢杆菌的培养液中,对化合物D-2进行抑菌活性检测的结果见图2。由图2可见,化合物D-2在与枯草芽孢杆菌接触4 h时与对照组现象一样,枯草芽孢杆菌均未生长。而在接触8 h后,对照发酵液的OD值明显高于加有D-2发酵液的OD值,12 h两者的区别更加明显,表明化合物D-2对枯草芽孢杆菌有抑制作用。枯草芽孢杆菌是对苹果树腐烂病菌有抑制作用的生防菌,本试验分离到的D-2源于野生型苹果树腐烂病菌的发酵液,对其生防菌有抑制作用,推测这是苹果树腐烂病菌在生长过程中代谢产生的抵抗逆境的防御性活性物质。
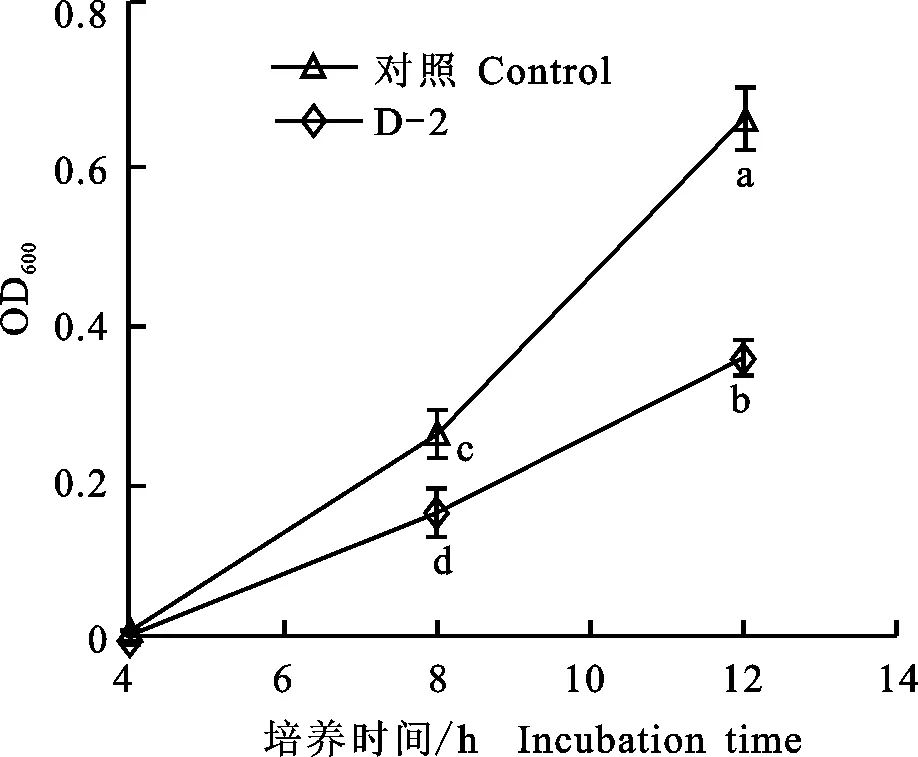
误差线为标准偏差,不同小写字母表示差异显著性(P<0.05)。
Error bars represent SD,and different letters indicate significant difference (P<0.05).
图2 D-2对枯草芽胞杆菌的活性曲线
Fig.2 Antibacterial activities of D-2 to Bacillus subtilis
3 讨 论
本研究首次在苹果树腐烂病菌的发酵液中分离得到化合物D-2,结构分析确定为1(3′-乙烯基-苯基)-1,2-乙二醇。查阅资料发现,以前在树木病害的致病菌中尚未见报道。该化合物存在1个手性碳原子,试验中尚未确定该手性碳原子的构型。
关于1-(3′-乙烯基-苯基)-1,2-乙二醇曾有文献报道在担子菌中存在。 (1S)-(3-乙烯基-苯基)-1,2-乙二醇于2007年在牛肝菌发酵液中发现[10];(1R)-(3-乙烯基-苯基)-1,2-乙二醇于2013年在木蹄菌的子实体中发现[11],但对其生物学功能并不清楚。
研究发现1-(3′-乙烯基-苯基)-1,2-乙二醇对烟草叶片和苹果叶片没有致病活性,表明其不是该病菌的直接致病活性物质,但其对枯草芽胞杆菌EDR4有抑制作用,文献[11]也报道(1R)-(3-乙烯基-苯基)-1,2-乙二醇对枯草芽胞杆菌(ATCC 6633)有抑制作用。
枯草芽孢杆菌是对苹果树腐烂病菌有抑制作用的生防菌[12-13],从苹果树腐烂病菌发酵液中分离得到的乙二醇对其有一定抑制作用,推测可能是苹果树腐烂病菌在进化过程中,为适应环境,保护自身生存,与其他生物竞争而产生的物质。这种物质的存在可能是苹果树腐烂病菌能顺利侵染寄主而致病的原因。因此可以推测,在苹果树腐烂病的防治中如果增加抑制该物质产生的途径,应该能增强枯草芽孢杆菌的防治效果。
由于试验分离得到的活性物质量的限制,尚未对该化合物进行其他生物活性检测,该化合物是否在苹果树腐烂病菌代谢过程中还有其他作用有待进一步研究。
Reference:
[1] WANG X L,WEI J L,HUANG L L,etal.Re-evaluation of pathogens causing Valsa canker on apple in China[J].Mycologia,2011,103(2):317-324.
[2] KE X W,HUANG L L,HAN Q M,etal.Histological and cytological investigations of the infection and colonization of apple bark byValsamalivar.mali[J].AustralasianPlantPathology,2012,42(1):85-93.
[3] YIN Z Y,LIU H Q,LI ZH P,etal.Genome sequence ofValsacanker pathogens uncovers a potential adaptation of colonization of woody bark[J].TheNewphytologist,2015,208(4):1202-1216.
[4] YIN Z Y,KE X W,KANG ZH SH,etal.Apple resistance responses againstValsamalirevealed by transcriptomics analyses[J].PhysiologicalandMolecularPlantPathology,2016,93:85-92.
[5] 王 娟,马 强,庒 霞,等.苹果树腐烂病病原菌分泌物中果胶酶的测定[J].内蒙古农业科技,2009(4):39-40.
WANG J,MA Q,ZHUANG X,etal.Determination of pectinase in fungi secretion of apple tree canker[J].InnerMongoliaAgricultural,2009(4):39-40(in Chinese with English abstract).
[6] 何媛媛,于 哲,王海英,等.不同碳氮源对苹果树腐烂病菌胞外果胶酶活性的影响[J].西北农林科技大学学报(自然科学版),2014,42(11):81-86.
HE Y Y,YU ZH,WANG H Y,etal.Effects of different carbon and nitrogen sources on activity of extracellular pectinase ofValsamalivar.mali[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2014,42(11):81-86(in Chinese with English abstract).
[7] 刘福昌,李美娜,王永洤.苹果树腐烂病菌致病因素—果胶酶的初步探讨[J].中国果树,1980(4):45-48.
LIU F CH,LI M N,WANG Y Q.Apple tree canker’s pathogenic factors: preliminary discuss to pectinase[J].ChinaFruits,1980(4):45-48(in Chinese).
[8] KE X W,YIN Z Y,SONG N,etal.Transcriptome profiling to identify genes involved in pathogenicity ofValsamalion apple tree[J].FungalGeneticsandBiology,2014,68:31-38.
[9] OKUNO T,OIKAWA S,GOTO T,etal.Structures and phytotoxicity of metabolites fromValsaceratosperma[J].AgriculturalandBiologicalChemistry,1986,50(4):997-1001.
[10] YANG W Q,QIN X D,SHAO H J,etal.New phenyl-ethanediols from the culture broth ofBoletusedulis[J].JournalofBasicMicrobiology,2007,47(2):191-193.
[11] ZHAO J Y,DING J H,LI ZH,etal.Three new phenyl-ethanediols from the fruiting bodies of the mushroomFomesfomentarius[J].JournalofAsianNaturalProductsResearch,2013,15(3):310-314.
[12] 王卫雄,徐秉良,薛应钰,等.苹果树腐烂病拮抗细菌鉴定及其抑菌作用效果测定[J].中国生态农业学报,2014,22(10):1214-1221.
WANG W X,XU B L,XUE Y Y,etal.Identification and antifugla activity of the antagonistic bacteria ofCytosporaspp[J].ChineseJournalofEco-Agriculture,2014,22(10):1214-1221(in Chinese with English abstract).
[13] 杨阿丽,陈佰鸿,毛 娟,等.生物药剂和化学药剂对苹果树腐烂病菌的抑制效应[J].中国农学通报,2015,31(16):173-181.
YANG A L,CHEN B H,MAO J,etal.Inhibition effect of chemicals and biological fungicides on theValsaceratosperma[J].ChineseAgriculturalScienceBulletin,2015,31(16):173-181(in Chinese with English abstract).
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
Isolation and Structural Identification of Pathogenic Substance fromValsamali
ZHEN Wei1,3,YUAN Genxia1,3,WANG Hui1and HUANG Lili2,3
(1.College of Science,Northwest A&F University,Yangling Shaanxi 712100,China; 2.College of Plant Protection,Northwest A&F University,Yangling Shaanxi 712100,China; 3.State Key Laboratory of Crop Stress Biology in Arid Areas,Northwest A&F University,Yangling Shaanxi 712100,China)
In order to explore the bioactive substances of the wide typeValsamali03-8 and its effects in pathogenic process,the pathogen was fermented in sucrose-carbon-source liquid media for 20 days at 25 ℃. Cultural filtrate obtained by filtration was adsorbed to the macroporous resin and eluted by different ratio of methanol and water. Then,the fractions were extracted by dichloromethane. The dichloromethane phase was separated and purified by thin layer chromatography and HPLC. The structure was elucidated by1H-NMR,13C-NMR,DEPT135 and HMQC spectra. Its biological activities were tested. Finally,a compound D-2 identified as 1-(3′-ethenylphenyl)-1,2-ethanediol was obtained.1 mg/mL of this compound in acetone water solution [V(acetone)∶V(water)=1∶4]showed antibacterial activities to Bacillus subtilis,but had no bioactivity to tobacco leaves and apple leaves.
Valsamali;Extraction and separation;Identification;Antimicrobial activity
2016-04-25 Returned 2016-06-30
National Special Fund for Agro-scientific Research in the Publich Interests(No.201203034).
ZHEN Wei,male,master student.Research area:natural products.E-mail:zhenweiwy@163.com
WANG Hui,female,professor,master supervisor.Research area:natural products.E-mail:wanghuiab@sina.com
日期:2017-06-05
2016-04-25
2016-06-30
国家公益性行业(农业)科研专项(201203034)。 第一作者:甄 伟,男,在读硕士,从事天然产物的研究。E-mail:zhenweiwy@163.com 通信作者:王 惠,女,教授,硕士生导师,主要从事天然产物研究。E-mail:wanghuiab@sina.com
S436.611.1+1
A
1004-1389(2017)06-0946-04
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170605.1728.038.html

