茉莉酸甲酯和油菜素内酯减轻苹果叶片光抑制的生理机制研究
张 弦,王志博,聂雅婷,王荣花,郭延平,赵政阳,梅立新
(西北农林科技大学 园艺学院,陕西省苹果工程技术研究中心,陕西杨凌 712100)
茉莉酸甲酯和油菜素内酯减轻苹果叶片光抑制的生理机制研究
张 弦,王志博,聂雅婷,王荣花,郭延平,赵政阳,梅立新
(西北农林科技大学 园艺学院,陕西省苹果工程技术研究中心,陕西杨凌 712100)
以3 a生苹果为试材,研究茉莉酸甲酯(MeJA)和油菜素内酯(BR)对苹果叶片光合生理的影响,初步探究其减轻光抑制的机制。结果表明,MeJA和BR处理后Pn升高,叶片光合效能增强,但与气孔运动无关。在引入PSⅡ修复抑制剂林可霉素(LinC)后,MeJA和BR对光抑制的缓解受阻,说明2种生长调节剂对叶片光抑制的减轻是通过促进受损PSⅡ修复来实现的。另外,MeJA和BR处理后活性氧积累减少,抗氧化酶活性升高也证实了这一结论。综合分析认为,MeJA和BR处理可以促进强光下受损PSⅡ的修复,维持较高的光化学活性,减少过剩激发能,避免光抑制现象的加剧。
茉莉酸甲酯;油菜素内酯;苹果叶片;光抑制;活性氧
苹果(MalusdomesticaBorkh.)是重要的经济植物[1],一直以来,提高产量和品质是苹果生产的主要目标。光合作用作为苹果生理代谢中重要的生化反应,与苹果产量、果实品质和树体的抗逆能力关系密切。因此,研究苹果光合生理具有重要的理论意义。
光是植物进行光合作用的原初动力,光能不足会限制光合作用;光能太强超过植物叶片光合碳同化所能利用的范围时,过剩的激发能会使光合电子传递能力下调,并诱导产生更多的活性氧,进一步损伤光合机构,加剧植物的光抑制[2-4]。在苹果植株生长的夏季阶段(6-8月),正午光强超过1 800 μmol·m-2·s-1,光抑制现象普遍存在,严重影响苹果叶片光合作用的效率,因此寻找减轻光抑制的有效途径和方法在生产上具有重要的现实意义。
植物激素在植物的生长发育及响应环境胁迫的应激反应中都起着重要的作用,其中,茉莉酸甲酯(MeJA)和油菜素内酯(BR)近年来受到广泛的关注。前人研究指出,茉莉酸甲酯作为信号分子能够增强植物的抗氧化能力,从而提高植物对逆境的耐受力[5];在干旱[6]、高温[7]和高盐[8]条件下,油菜素内酯则被认为具有缓解逆境胁迫的作用。在光合作用方面,有关这2种植物生长调节剂的研究主要集中在不同逆境下它们对光合作用的影响,而对其是否能够缓和强光下的光抑制鲜有报道。
本研究选用3 a生盆栽嘎啦苹果植株为试材,通过测定苹果叶片气体交换参数、叶绿素荧光参数、快速诱导动力学曲线、活性氧积累、抗氧化酶活性,并引入光系统Ⅰ循环电子流抑制剂抗菌素A (Anti A)[9]和光系统Ⅱ(PSⅡ) 核心蛋白D1合成抑制剂林可霉素(LinC)[4], 分析苹果叶片光合机构的运转状况,旨在阐明不同浓度的外源MeJA和BR减轻苹果叶片强光下光抑制的生理机制。
1 材料与方法
1.1 材 料
以3 a生盆栽‘嘎啦’(MalusdomesticaBorkh.) /‘M26’(MaluspumilaMill.)自根苹果苗为试材。
1.2 试验设计
试验于2014年3月至2015年3月在西北农林科技大学进行。2014年3月初,选取生长状况一致的3 a生‘嘎啦’苹果植株,栽于盆高28 cm×直径21 cm的塑料盆中,基质为园地表层壤土与草炭的混合土(体积比2∶1),pH 7.0±0.2,每盆基质质量为12 kg。栽后和生长期间灌水,以防水分亏缺,同时预防病虫害发生。
分别在9:00和16:00喷洒浓度为0(蒸馏水)、0.01、0.02、0.05、0.1、0.2 μmol·L-1的茉莉酸甲酯(MeJA)和油菜素内酯(BR)溶液于树冠。每处理3盆,并标记植株中部枝条叶2片。 次日测定已标记叶片的气体交换参数(11个处理 × 每个处理6片叶)。
另选取健康成熟苹果叶片(每组12片)置于0、0.01、0.02、0.05、0.1、0.2 μmol·L-1MeJA 溶液和BR溶液中,并在20 μmol·m-2·s-1光强下保持蒸腾过夜。24 h后从每组处理随机选取6片叶置于800 μmol·m-2·s-1光强下,剩余6片叶置于1 200 μmol·m-2·s-1光强下,处理4 h后测定叶绿素荧光参数和快速诱导动力学曲线。
再次取健康成熟苹果叶片(CK、M、B、MB每组60片叶,其余每组12片叶)迅速置于溶液(表1)处理。24 h后从每组处理中随机选取6片叶置于800 μmol·m-2·s-1光强下,其余6片置于1 200 μmol·m-2·s-1光强下,分别处理0、1、2和3 h后测定叶绿素荧光参数。并保留处理CK、M、B及MB 4组叶片进行活性氧含量和抗氧化酶活性测定。

表1 林可霉素、抗菌素A与油菜素内酯、茉莉酸甲酯的处理组合Table 1 Treatment combinations of LinC, Anti A and BR,MeJA
上述光强控制和确定均通过使用人工镝灯和Li-188B(Li-Cor, USA)光照仪完成。
1.3 测定项目及方法
1.3.1 气体交换参数 用便携式光合测定系统(LI-6400T,Li-Cor,USA)测定,于晴天的8:30-10:00 测定叶片净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci)等参数,开放式气路下设定CO2摩尔分数为400 μmol·mol-1,内置红蓝光源,设定光合有效辐射(PAR)为1 000 μmol·m-2·s-1,同时打开风扇,使叶室温度控制在(28±1)℃。
1.3.2 叶绿素荧光参数 叶片暗适应20 min后,用便携式脉冲调制式叶绿素荧光仪(PAM-2500,Walz,Germany)测定Fv/Fm、Fv’/Fm’、qP、NPQ、qN、ΦPSⅡ等参数,测定方法参照Genty等[10],数据分析使用PAMWin 3.0软件,其中测量光(<0.1 μmol·m-2·s-1)、饱和脉冲光(>8 000 μmol·m-2·s-1)以及作用光(538 μmol·m-2·s-1)。
1.3.3 快速叶绿素荧光诱导动力学(OJIP曲线) 仍采用PAM-2500在叶片暗适应20 min后,参考Li等[11]方法进行测定,并从0JIP 曲线直接得到以下原始参数:Fo(照光20 μs时测定的荧光强度),F300 ms(照光300 ms时测定的荧光强度),FJ(照光2 ms时测定的荧光强度),FI(照光30 ms时测定的荧光强度),Fm(O-J-I-P曲线中的最大荧光处强度)。将这些参数按Stirbet等[12]的公式计算,OJIP曲线的初始斜率Mo=4×(F300ms-Fo)/(Fm-Fo),J点的相对荧光强度VJ=4×(FJ-Fo)/(Fm-Fo),I点的相对荧光强度VI=4×(FI-Fo)/(Fm-Fo),TRo/ABS(最大光化学效率)=[ 1-(Fo/Fm)],光合电子经QA传递至QB的效率ETo/TRo=(1-VJ),光合电子传递至PSⅠ受体的效率REo/TRo=(1-VI),光合电子经QB传递至PSⅠ受体的效率REo/ETo=(1-VI)/(1-VJ),单位PSⅡ反应中心捕获的光能ABS/RC=Mo×(1/VJ)[1/(1-(Fo/Fm)],单位PSⅡ反应中心捕获的用于电子传递的能量TRo/RC=Mo×(1/VJ),单位PSⅡ反应中心内用于热耗散的能量DIo/RC=ABS/RC-TRo/RC。

H2O2测定方法:100 μL上清液用100 mmol·L-1Tris-HCl 缓冲液(pH 7.5)定容至 0.5 mL,室温下反应10 min后加入 0.5 mL 显色液,显色液成分为0.3 mmol·L-1草酸钛钾和 0.3 mmol·L-14-(2-吡啶偶氮)间苯二酚单钠盐按体积比1∶1混合,避光显色10 min后于波长508 nm测定吸光度。以加入20 U过氧化氢酶(CAT)作为对照。

1.3.5 抗氧化酶活性测定 参照Li等[14]的方法,提取并测定过氧化氢酶(CAT, EC 1.11.1.6)、超氧化物歧化酶(SOD, EC 1.15.1.1)、抗坏血酸过氧化物酶(APX, EC 1.11.1.1)、单脱氢抗坏血酸还原酶(MDHAR, EC 1.6.5.4)、脱氢抗坏血酸还原酶(DHAR, EC 1.8.5.1)和谷胱甘肽还原酶(GR, EC 1.6.4.2)等的活性。
1.4 数据处理与分析
采用Excel 2007处理试验数据,用SPSS 19.0软件进行Duncan’s 显著性分析,采用Origin 7.5软件绘图。
2 结果与分析
2.1 不同浓度的MeJA和BR对苹果叶片气体交换参数的影响
由图1可见,随着2种植物生长调节剂处理浓度的上升,苹果叶片Pn也逐渐升高,当MeJA和BR溶液浓度达到0.2 μmol·L-1后,上升趋势变缓。然而,发现不同浓度的MeJA和BR溶液处理并未使苹果叶片Gs、Tr、Ci显著升高,说明2种植物生长调节剂对苹果叶片光合作用的促进与气孔的开放程度无关。
2.2 MeJA和BR对苹果叶片叶绿素荧光参数的影响
表2显示,在2种光强下,0.2 μmol·L-1MeJA和BR溶液处理对苹果叶片的叶绿素荧光参数产生显著性影响,其中反映光合机构光化学效率的Fv/Fm、Fv’/Fm’、qP、ΦPSⅡ呈上升趋势,且1 200 μmol·m-2·s-1光强下差异更显著;而反映热耗散的NPQ和qN显著降低,同时1 200 μmol·m-2·s-1光强下降低更多。
2.3 MeJA和BR对快速叶绿素荧光诱导动力学曲线及参数的影响
图2为不同浓度MeJA和BR溶液处理对苹果叶片快速叶绿素荧光诱导动力学曲线(OJIP曲线)的影响。ETo/TRo、REo/TRo、REo/ETo反映光合电子传递链中不同组分间电子传递能力,在表3中,0.2 μmol·L-1MeJA和 BR溶液处理使ETo/TRo显著高于对照,且1 200 μmol·m-2·s-1光照下,其与对照的差异大于800 μmol·m-2·s-1。处理组中REo/TRo的值也高于对照,然而,这种变化趋势并未在REo/ETo上发现。ABS/RC、TRo/RC、DIo/RC反映单位PSⅡ反应中心内光能吸收和能量分配的情况,对照组ABS/RC和DIo/RC均显著高于0.2 μmol·L-1MeJA和BR处理组,在1 200 μmol·m-2·s-1光照下,对照与处理组的差异大于800 μmol·m-2·s-1,然而,2种光强下,处理组TRo/RC的值与对照组均无显著差异。
2.4 MeJA和BR及引入LinC或Anti A后对苹果叶片光合机构的影响
通过引入林可霉素(LinC)和抗菌素A(Anti A)2种抑制剂,探究MeJA和BR减轻苹果叶片光抑制的原因。结果表明(图3),在引入PSⅡ修复抑制剂LinC后,MeJA和BR处理与对照组Fv/Fm无显著差异,均随光照时间的增加和光照强度的增强逐渐降低。但在引入PSⅠ 循环电子流抑制剂Anti A之后,MeJA和BR处理的Fv/Fm在不同光照时间和2种光强下仍显著高于对照组。综上表明,MeJA和BR减轻苹果叶片光抑制的机制都在于能够改善受损PSⅡ的修复,从而维持较高的光合性能。
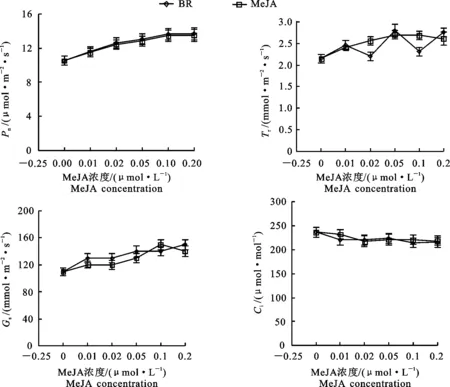
图1 不同浓度的茉莉酸甲酯和油菜素内酯溶液处理后苹果叶片气体交换参数的变化Fig.1 Changes of gas exchange parameters in apple leaves with different concentrated MeJA and BR solution
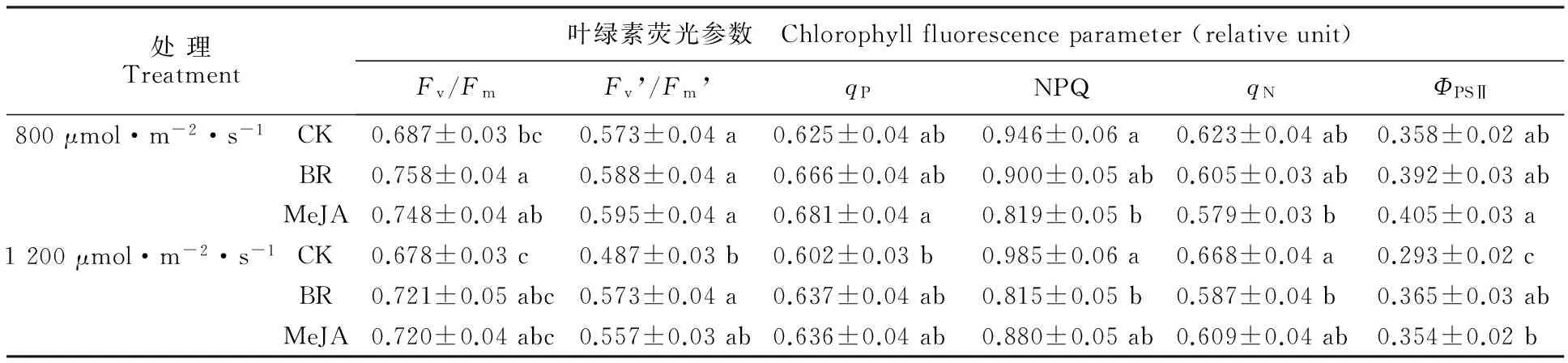
处理Treatment叶绿素荧光参数 Chlorophyllfluorescenceparameter(relativeunit)Fv/FmFv’/Fm’qPNPQqNΦPSⅡ800μmol·m-2·s-1CK0.687±0.03bc0.573±0.04a0.625±0.04ab0.946±0.06a0.623±0.04ab0.358±0.02abBR0.758±0.04a0.588±0.04a0.666±0.04ab0.900±0.05ab0.605±0.03ab0.392±0.03abMeJA0.748±0.04ab0.595±0.04a0.681±0.04a0.819±0.05b0.579±0.03b0.405±0.03a1200μmol·m-2·s-1CK0.678±0.03c0.487±0.03b0.602±0.03b0.985±0.06a0.668±0.04a0.293±0.02cBR0.721±0.05abc0.573±0.04a0.637±0.04ab0.815±0.05b0.587±0.04b0.365±0.03abMeJA0.720±0.04abc0.557±0.03ab0.636±0.04ab0.880±0.05ab0.609±0.04ab0.354±0.02b
注:同列数据后不同字母表示处理间差异达5%显著水平。下表同。
Note:Values followed by different letters within a column are significantly different among treatments at 5% level.The same as below.
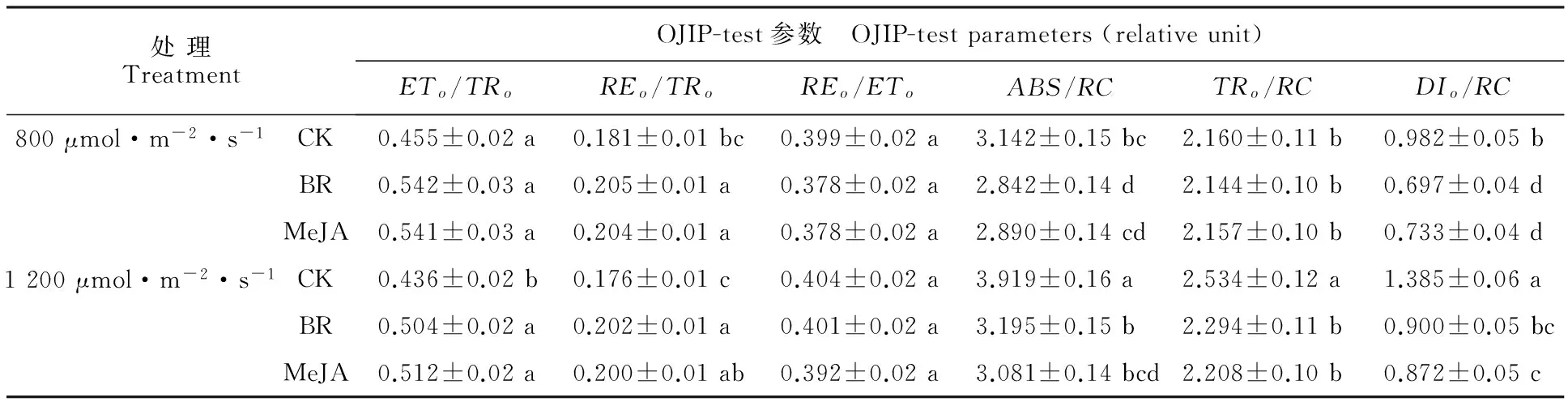
表3 茉莉酸甲酯和油菜素内酯在0.2 μmol·L-1时对苹果叶片OJIP-test参数的影响Table 3 Effects of 0.2 μmol·L-1 BR and 0.2 μmol·L-1 MeJA on OJIP-test parameters in apple leaves

图中横坐标为对数时间 Horizontal ordinate is logarithm of time
2.5 MeJA和BR对活性氧积累和抗氧化酶活性的影响

图5显示,处理组CAT、SOD、APX、MDHAR、DHAR、GR活性均高于对照组,且随着光照时间的增加和光照强度的增强,与对照组的差异有增大趋势。但MeJA和BR共同处理与MeJA或BR单独处理对上述抗氧化酶活性的影响无显著差异。由此可见,MeJA和BR处理使得苹果叶片抗氧化酶活性升高,清除活性氧的能力增强。
3 讨 论
MeJA和BR作为2种重要的植物生长调节剂,在植物抗逆性上已有广泛研究[5-8,15]。但是MeJA和BR是否影响植物的光抑制现象尚不清楚。本研究通过对苹果叶片喷施不同浓度的MeJA和BR溶液,发现叶片的Pn随着生长调节剂浓度的升高而上升,说明外源MeJA和BR有助于光合能力的增强,且促进苹果光合作用最佳浓度为0.2 μmol·L-1;而Gs、Tr和Ci却无显著变化,暗示苹果叶片光合能力增强与气孔运动无关。
在叶绿素慢相荧光参数中,Fv/Fm被广泛地用于评估植物光化学性能的强弱,本研究发现,0.2 μmol·L-1MeJA和BR溶液处理后,在800 μmol·m-2·s-1和1 200 μmol·m-2·s-12种光强下,Fv/Fm均显著高于对照,且1 200 μmol·m-2·s-1光强下,处理组与对照的差异大于800 μmol·m-2·s-1光强下的。反映PSⅡ反应中心光化学活性和光合电子传递能力的另3个参数Fv’/Fm’、qP、ΦPSⅡ表现出与Fv/Fm相似的趋势。另一方面,分别基于叶黄素循环和跨膜质子梯度的2个热耗散参数NPQ和qN的值却在MeJA和BR组中显著降低。强光下光抑制现象的发生源于光能不能被光合碳同化过程充分利用,使得激发能过剩,虽有多种保护机制耗散过剩激发能,但当光强超过一定范围,最终会导致光合机构的损伤[2-4]。同时研究结果表明,外源MeJA和BR处理能够增强PSⅡ光化学活性,与对照相比,能够吸收利用更多的光能,从而免于强光的伤害。
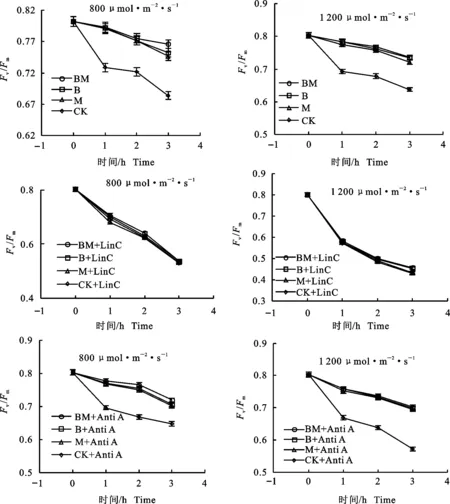
图3 在800 μmol·m-2·s-1和1 200 μmol·m-2·s-1条件下, MeJA和BR处理及引入LinC或Anti A后Fv/Fm随时间的变化Fig.3 Changes of Fv/Fm in apple leaves with MeJA and BR application in presence of LinC or Anti A under condition of 800 μmol·m-2·s-1and 1 200 μmol·m-2·s-1
通过分析叶绿素荧光诱导动力学曲线和荧光参数等,发现不同浓度的MeJA和BR溶液处理与对照组苹果叶片的OJIP曲线差异明显。进一步分析发现,反映光合电子传递链QA至QB传递能力的ETo/TRo在MeJA和BR处理后显著升高,而反应QA至PSⅠ 受体和QB至PSⅠ受体的REo/TRo和REo/ETo则与在2种植物生长调节剂处理后与CK无显著差异。由此表明QA至QB光合电子传递为MeJA和BR影响光合机构的关键位点。对照组中ABS/RC显著增加,在光强一致的条件下,可能是由于对照组中仍具有光化学活性的PSⅡ反应中心数量低于MeJA和BR处理组,导致单位PSⅡ反应中心吸收了更多的光能[16]。相应地,对照组单位PSⅡ反应中心的热耗散值DIo/RC也高于MeJA和BR处理组。快速叶绿素荧光诱导动力学的试验结果进一步表明,MeJA和BR处理能够增强光合电子传递,利用更多的光能避免强光对光合机构的损伤。

图4 在800 μmol·m-2·s-1和1 200 μmol·m-2·s-1条件下,0.2 μmol·L-1茉莉酸甲酯和油菜素内酯对苹果叶片内活性氧积累的影响Fig.4 Effects of 0.2 μmol· L-1 BR and 0.2 μmol·L-1 MeJA on accumulation of ROS in apple leaves under conditions of 800 μmol·m-2·s-1and 1 200 μmol·m-2·s-1
PSⅡ的修复和PSⅠ循环电子流在减轻植物光抑制中都起着重要的作用,LinC能够抑制PSⅡ的修复[4],Anti A则能抑制PSⅠ循环电子流[9],因此二者被广泛应用于光合作用研究。然而,MeJA和BR是否通过上述2个生化途径减轻光抑制尚未见报道。在本研究中,引入PSⅡ修复抑制剂LinC后,MeJA和BR处理组与对照组Fv/Fm变化均随光照时间的增加逐渐降低,且1 200 μmol·m-2·s-1光强下下降幅度更大。光抑制的严重程度由PSⅡ损伤和修复的速率共同决定,但是本研究发现,在引入LinC后, MeJA和BR对光抑制现象的缓解作用并不显著,这说明MeJA和BR处理缓解光抑制现象在于改善PSⅡ的修复而与减轻光损伤无关。但在引入Anti A后,MeJA和BR处理的Fv/Fm在不同的光照时间和2种光强下仍高于对照组。这表明PSⅠ循环电子流被抑制并不会影响MeJA和BR处理对光抑制的缓解作用。也就是说,MeJA和BR减轻苹果叶片光抑制的机制都在于能够改善受损PSⅡ的修复而非增强PSⅠ的循环电子流。
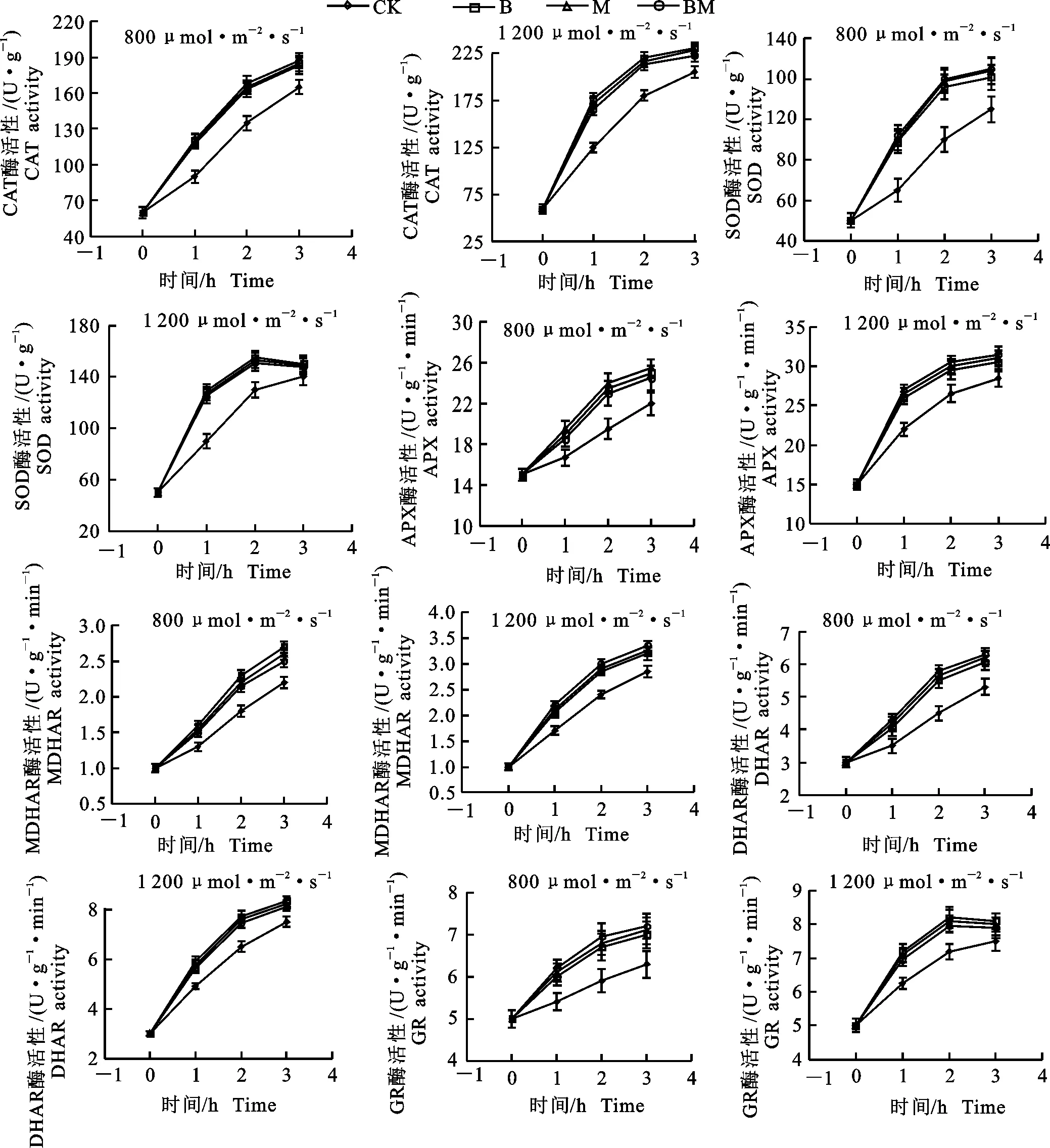
图5 在800 μmol·m-2·s-1和1 200 μmol·m-2·s-1条件下,0.2 μmol·L-1茉莉酸甲酯和油菜素内酯处理下苹果叶片内抗氧化酶活性的变化Fig.5 Changes of antioxidant enzymes activities in apple leaves with application of 0.2 μmol·L-1 BR and 0.2 μmol·L-1 MeJA under conditions of 800 μmol·m-2·s-1and 1 200 μmol·m-2·s-1
综上, MeJA和BR处理可以促进强光下受损PSⅡ的修复,从而维持较高的光化学活性,减少过剩激发能,避免光抑制现象的加剧。
Reference:
[1] GUO Y,ZHOU Z,YUAN Y,etal.Survey of patulin in apple juice concentrates in Shaanxi(China) and its dietary intake [J].FoodControl,2013,34(2):570-573.
[2] GUO Y P,GUO D P,ZHOU H F,etal.Photoinhibition and xanthophylls cycle activity in bayberry(Myricarubra) leaves induced by high irradiance[J].Photosynthtica,2006,44(3):439-446.
[3] GUO Y P,ZHOU H F,ZHANG L C.Photosynthetic characteristics and protective mechanisms against photooxidation during high temperature stress in two citrus species[J].ScientiaHorticulturae,2006,108(3):260-267.
[4] TAKAHASHI S,MURATA N.How do environmental stresses accelerate photoinhibition[J].TrendsinPlantScience,2008,13(4):178-182.
[5] DONALD F C,AHNYA M R.Age-Dependent effects of jasmonic acid treatment and wind exposure on foliar oxidase activity and insect resistance in tomato[J].JournalofChemicalEcology,1999,25(2):271-281.
[6] YUAN G F,JIA C G,ZHEN L,etal.Effect of brassinosteroids on drought resistance and abscisic acid concentration in tomato under water stress[J].ScientiaHorticulturae,2010,126(2):103-108.
[7] 耶兴元,仝胜利,张 燕.油菜素内酯对高温胁迫下猕猴桃苗耐热性相关生理指标的影响[J].西北农业学报,2011,20(9):113-116.
YE X Y,TONG SH L,ZHANG Y.Effects of brassinolide on physiological indicators related to thermal tolerance of kiwifood seedlings under high temperature stress[J].ActaAgriculturaeBoreali-occidentalisSinica,2011,20(9):113-116(in Chinese with English abstract).
[8] 吴雪霞,査丁石,朱宗文,等.外源24-表油菜素内脂对盐胁迫下茄子种子萌发和幼苗生理特性的影响[J].植物生理学报,2011,47(6):607-612.
WU X X,ZHA D SH,ZHU Z W,etal.Effects of exogenous 24-epibrassinolide on seed germination,physiological characteristics of eggplant seedlings under NaCl stress[J].PlantPhysiologyJournal,2011,47(6):607-612(in Chinese with English abstract).
[9] DAVID A M,DEREK S B.Cycle electron transport in chloroplasts the q-cycle and the site of action of antimycin[J].BiochimicaetBiophysicaActa,1984,767(3):389-395.
[10] GENTY B,BRIANTAIS J M,BAKER N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J].BiochimicaetBiophysicaActa,1989,990(1):87-92.
[11] LI P M,MA F W.Different effects of light irradiation on the photosynthetic electron transport chain during apple tree leaf dehydration[J].PlantPhysiologyandBiochemistry,2012,55(2):16-22.
[12] STIRBET A,GOVINDJEE.On the relation between the Kautsky effect(chlorophyll a fluorescence induction) and photosystem Ⅱ:Basics and applications of the OJIP fluorescence transient[J].JournalofPhotochemistryandPhotobiologyB:Biology,2011,104(1/2):236-257.
[13] CHEN C,LI H,ZHANG D,etal.The role of anthocyanin in photoprotection and its relationship with the xanthophyll cycle and the antioxidant system in apple peel depends on the light conditions[J].PlantPhysiology,2013,149(3):354-366.
[14] LI P,CHENG L.The shaded side of apple fruit becomes more sensitive to photoinhibition with fruit development[J].PlantPhysiology,2008,134(6):282-292.
[15] 张永平,杨少军,陈幼源.2,4-表油菜素内脂对高温胁迫下甜瓜幼苗抗氧化酶活性和光合作用的影响[J].西北植物学报,2011,31(7):1347-1354.
ZHANG Y P,YANG SH J,CHEN Y Y.Effects of 2,4-Epibrassinolide on antioxidant enzyme activities and photosynthesis in melon seedlings under high temperature stress[J].ActaBotanicaBoreali-occidentaliaSinica,2011,31(7):1347-1354(in Chinese with English abstract).
[16] CHEN C,ZHANG D,LI P,etal.Partitioning of absorbed light energy differed between the sun-exposed side and the shaded side of apple fruits under high light conditions[J].PlantPhysiologyandBiochemistry,2012,60(3):12-17.
[17] GARG N,MANCHANDA G.ROS generation in plants:boon or bane[J].PlantBiochemistrySystems,2009,143(1):81-96.
[18] HASANUZZAMAN M,FUJITA M.Selenium pretreatment upregulates the antioxidant defense and methylglyoxal detoxification system and confers enhanced tolerance to drought stress in rapeseed seedlings[J].BiologicalTraceElementResearch,2014,143(3):1758-1776.
[19] DIAO M,MA L,LIU H Y.Selenium promotes the growth and photosynthesis of tomato seedlings under salt stress by enhancing chloroplast antioxidant defense system[J].JournalofPlantGrowthRegulation,2014,33(3):671-682.
(责任编辑:潘学燕 Responsible editor:PAN Xueyan)
Alleviation of Photoinhibition by Methyl Jasmonate and Brassinolide under Strong Light in Apple Leaves
ZHANG Xian, WANG Zhibo, NIE Yating, WANG Ronghua, GUO Yanping, ZHAO Zhengyang and MEI Lixin
(College of Horticulture, Northwest A&F University,Apple Engineering Research Center of Shaanxi Province, Yangling Shaanxi 712100,China)
In this study, we investigated effects of Methyl Jasmonate (MeJA) and Brassinolide (BR) on photosynthetic physiology and preliminarily explore its mechanism in alleviating photoinhibition in apple leaves. The results demonstrated thatPnincreased, photochemistry efficiency and photosynthetic electron transport capacity were improved after treated by MeJA and BR, but it had nothing to do with stomatal movement. However, such increase was inhibited by the application of PSⅡ inhibitor LinC,The remission of MeJA and BR photoinhibition was blocked. This results showed that MeJA and BR alleviated photoinhibiton through facilitating the repair of PSⅡ. Subsequent reactive oxygen species (ROS) antioxidant enzymes trials confirmed the study. With MeJA and BR application, antioxidant enzymes activities improved and ROS accumulated less. As a consequence, the depression of PSⅡ repair could be reduced and apple leaves would maintain better photochemistry efficiency compared with control and protect photosynthetic apparatus from the damage of excess excitation and avoid the acceleration of photoinhibition.
MeJA; BR; Apple leaves;Photoinhibition; ROS
2016-05-05 Returned 2016-06-10
National Science-technology Support Plan (No.2014BAD16B06); Special Fund for Constructing Technology System of Modern Agricultural Industry (Apple) (No.CARS-28);National Research and Development Plan(No.2016YFD0201131).
ZHANG Xian, female, master student.Research area:pomology physiology and ecology.E-mail:zhangxian8889@163.com
GUO Yanping, male,professor,doctoral supervisor.Research area:pomology physiology and molecular biochemistry, environmental biology. E-mail: ypguo_nwsuaf@163.com
日期:2017-06-05
2016-05-05
2016-06-10
国家科技支撑计划(2014BAD16B06);国家苹果产业体系(CARS-28);国家重点研发计划(2016YFD0201131)。 第一作者:张 弦,女,硕士研究生,研究方向为果树生理生态。E-mail:zhangxian8889@163.com 通信作者:郭延平,男,教授,博士生导师,从事果树生理与分子生物学、果树环境生物学的研究。E-mail:ypguo_nwsuaf@163.com
Q945.1;S661.1
A
1004-1389(2017)06-0906-10
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170605.1728.028.html

