草鱼肠道细菌CD-17的鉴定和生防活性研究
杨敬辉,王敬根,张玉军,庄义庆
(江苏丘陵地区镇江农业科学研究所,江苏句容 212400)
草鱼肠道细菌CD-17的鉴定和生防活性研究
杨敬辉,王敬根,张玉军,庄义庆
(江苏丘陵地区镇江农业科学研究所,江苏句容 212400)
为筛选新的生防菌种,采用平板对峙培养法测定分离自草鱼肠道细菌CD-17菌株对常见植物病原真菌的抑菌谱。通过菌株形态学扫描电镜观察、平板培养生理生化特性和分子辅助分类法确定其分类地位,同时对其活菌制剂(BCA)进行温室防效试验。结果表明,CD-17对供试植物病原真菌均有不同程度的抑制作用;温室控制条件下,BCA与炭疽病菌分生胞子悬浮液(GC)同时接种正常草莓叶片和接种GC 48 h后再用BCA的控制效果分别为100%和55.68%;BCA与GC同时接种有微伤口的草莓叶片和接种GC 48 h后再用BCA的控制效果分别仅为76.94%和37.82%。根据菌株形态观察、生理生化特征、16Sr DNA 基因和gyrB基因序列比对分析,鉴定该菌株为解淀粉芽胞杆菌(Bacillusamyloliquefaciens)。
草鱼肠道细菌;生防活性;菌种鉴定
炭疽病菌(Glomerellaspp.)侵染引发的病害是江苏省夏季草莓露天育苗和冬季塑料大棚移栽早期的主要病害。草莓炭疽病主要采用化学药剂防控,近年来常用的杀菌剂有多菌灵(Carbendazim)、嘧菌酯(Azoxystrobin)、咪鲜胺(Prochloraz)、吡唑嘧菌酯(Pyraclostrobin)和咯菌腈(Fludioxonil)等。江苏丘陵地区镇江农业科学研究所通过连续3 a对江苏省多地大棚草莓和葡萄炭疽病菌对常规使用化学药剂的敏感性检测结果表明,草莓炭疽病菌对多菌灵和嘧菌酯已产生抗药性,且抗性菌株种群占比逐年上升,尤其关注的是炭疽病菌对特效新药剂吡唑醚菌酯也产生抗药性[1]。
在草莓生产全程中完全可以通过系统的农业、物理和生物防控措施来控制草莓病害,而生防措施中使用活性芽胞类制剂是主要手段。目前,国内外还没有成功登记用于防治草莓炭疽病的生物农药专用制剂。研究大多集中于防治草莓再植病害,报道的有木霉菌属真菌(Trichodermaspp.)[2-4]、芽胞杆菌属细菌(Bacillusspp.)[5-10]、假单胞菌属细菌(Pseudomonasspp.)[11-12]和酵母菌属[13-15]等。
草莓是即采即食的应时鲜果,加之田间交替开花采果,所以对采收期化学药剂的选择和安全使用有很大的局限性。因此,筛选研制有效、安全的生物菌剂,对设施高效经济作物有很大必要性。笔者先后从杜鹃、牛胃和草鱼肠道微生物菌群中筛选得到一批适宜于中温生长、对植物病原真菌具广谱抑菌活性的菌株。本研究用分子分类的方法对分离自草鱼肠道的CD-17菌株进行确定,并在温室条件下研究其发酵活菌制剂对草莓炭疽病的生防活性,旨在为该菌株的后续研究与开发奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 指示病原真菌 梨黑星病菌(Venturiapiritna),草莓炭疽病菌(Glomerellafragariae),草莓灰霉病菌(Botrytiscinerea),葡萄炭疽病菌(Glomerellacingulata),葡萄房枯病菌(Physalosporabaccae),葡萄穗轴褐腐(枯)病菌(Altednariaviticola),葡萄黑痘病菌(Elsinaeampelina),葡萄白腐病菌(Coniothyriumdiplodiella),稻纹枯病菌(Thanatephoruscumumeris),稻恶苗病菌(Gibberellafujikurio),稻瘟病菌(Magnaporthegrisea),小麦赤霉病菌(Gibberellazeae), 小麦纹枯病菌(Rhizoctoniacereal),棉花黄萎病菌(Verticilliumdahliae),苹果轮纹病菌(Botryosphaeriadothidea),油菜菌核病菌(Sclerotiniasclerotiorum)。
1.1.2 供试培养基 PDA培养基:用于植物病原指示菌的培养。R2A培养基:每1 000 mL蒸馏水中含酵母粉0.5 g、酪蛋白胨0.25 g、肉蛋白胨0.25 g、水解酪蛋白0.5 g、葡萄糖0.5 g、淀粉0.5 g、丙酮酸钠0.3 g、磷酸氢二钾0.3 g、水合硫酸镁0.024 g、琼脂15 g、pH 7.2,用于细菌的分离和纯化。WA培养基:每1 000 mL蒸馏水中含蛋白胨5 g、葡萄糖10 g、酵母提取物3 g、NaCl 5 g、琼脂20 g,用于颉颃细菌的筛选。FM培养基:20 L 水中含大豆粉100 g、马铃薯淀粉200 g、蔗糖25 g、酵母粉25 g、CaCO320 g、MnSO41 g,用于菌种上罐发酵。
1.2 CD-17菌株抑菌谱的测定
采用“平板对峙培养法”测定抑菌谱。先将CD-17菌株接种于含25 mL WA培养基的平板(d=9 cm)正中心,同一平板上再接种事先在PDA平板上长好的指示植物病原菌菌片(d=4 mm),每个平板内接种3片,使接种的3片植物病原菌中心到CD-17菌株的中心均为2 cm。对照不接种CD-17菌株,每菌株设4个重复,待对照长满平板时测量抑菌圈半径并计算出平均抑菌半径,抑菌半径用“平均数±标准差”表示。
1.3 CD-17菌株的鉴定
1.3.1 扫描电镜观察 扫描电镜观察委托扬州大学中心实验室完成。
1.3.2 菌株生理生化特征 生理生化特征参照东秀珠等[16]的方法测定。
1.3.3 菌株16S rDNA基因序列测定 CD-17菌株基因组DNA的提取及16S rDNA序列测定方法参照杨敬辉等[17]的方法。
1.3.4gyrB基因序列测定及序列的系统发育进化分析 参照喻国辉等[18]的方法。
1.4 CD-17菌剂的加工
1.4.1 菌液的获得 挑取事先在R2A培养基上划线培养好的CD-17菌株单菌落斑,接种于装有5 mL PDA液体培养液的三角瓶(V=20 mL)中,于30 ℃、200 r/min振荡培养16 h;将所得培养液5 mL全部接种于装有400 mL PDA培养液的三角瓶(V=1 000 mL)中,30 ℃、200 r/min振荡培养16 h;所得400 mL培养液接种于装有20 L FM培养液的发酵罐(V=30 L,镇江东方GUS-30)中,设置发酵条件为:溶氧100%,搅拌速度为350 r/min,发酵温度33 ℃,发酵时间30 h,自动酸碱流加控制pH为6.6~7.0。
1.4.2 菌剂加工工艺 将“1.4.1”中的发酵液离心(8 000 r/min)后用φ=20 %丙三醇溶液(溶液用无菌水配制)重新悬浮,测定悬浮液的活芽胞含量,根据测定结果用φ=20 %丙三醇溶液调节悬浮液的活芽胞数至1.0×1010cfu/mL,并按5 g/L的用量加入黄原胶搅拌均匀,得成品悬浮剂的浓度约为1.0×1010cfu/mL(BCA),置4 ℃保存,备用。
1.5 BCA对草莓炭疽病的温室防治试验
1.5.1 参试草莓苗的准备 挑选同一生育期、无病、大小一致的草莓苗(每株苗只留3个茎枝),移栽于装有550 gw(灭菌土)∶w(细沙) ∶w(无菌基质)= 5∶4∶1的黑色塑料盆钵(钵体h=8 cm,钵口d=10 cm,钵底d=8 cm),移栽定植14 d 后用于试验。
1.5.2 接种用炭疽病菌分生孢子悬浮液(GC)的制备 用φ=1%吐温20的无菌水,分别将事先在PDA平板上培养好的炭疽病菌桔黄色分生孢子堆洗下,充分振荡混匀,在显微镜下用血球计数板计数,调整胞子密度,本研究中实际用于接种的炭疽病菌分生孢子贮藏液的密度为2.67×105mL-1(GC)。
1.5.3 草莓炭疽病菌的防治试验 试验共设5个处理,即处理A用无菌水将上述BCA制剂稀释成芽胞浓度约为1.0×107cfu/mL,喷雾于16钵草莓苗,待菌液风干后再用喷雾接种GC,保湿培养箱培养48 h后置于温室,设16钵接种GC但不喷雾BCA的对照(CK1);处理B用00#号昆虫针在草莓叶片的正中心刺6个微伤口后,立即喷雾BCA于16钵草莓苗,待菌液风干后再喷雾接种GC,保湿培养箱培养48 h后置于温室,设16钵带伤口草莓且接种GC但不喷雾BCA的对照(CK2);处理C用00#号昆虫针在每片叶子的正中心刺6个微伤口后,立即用GC接种16钵草莓苗,保湿培养箱培养48 h后再喷雾BCA,风干后置于温室,对照同CK2;处理D用GC接种16钵草莓苗,保湿培养箱培养48 h后再喷雾BCA,风干后置于温室,对照同CK1;处理E分别设不接种GC也不喷雾BCA的16钵草莓健苗(CK3)和带微伤口的草莓苗(CK4)。
1.5.4 防效计算 于病原菌接种7 d后记录各处理病害严重度并计算出病情指数。发病叶片分级标准:0级,叶片无病斑;1级,病斑直径<5 mm;2级,病斑直径6~10 mm;3级,病斑直径11~15 mm;4级,病斑直径>15 mm。每钵草莓记录3个茎枝(共9个叶片),新长出的叶片不计入总叶片数,同一叶片上有多个病斑时只记录最大病斑的直径。病情指数按下列公式计算:病情指数=∑(各级叶片数×级值)/(调查总叶片数×最高病级)×100。
1.6 试验条件
保湿培养箱条件:光照7 500 lx,28 ℃,湿度95% RH,光暗比为12 h∶12 h。
温室条件: 光照10 000 lx,温度白天控制在26~28 ℃,晚上控制在20~22 ℃,光暗比为12 h∶12 h。
1.7 说 明
文中的菌种及其制剂的加工方法已申请专利保护。
2 结果与分析
2.1 CD-17菌株的抑菌谱
对峙培养法测定结果表明,CD-17菌株对所有指示病原菌都有较强的颉颃活性(表1)。其中对水稻稻瘟病菌、纹枯病菌、核盘病菌和草莓炭疽病菌的抑菌半径超过15 mm。抑菌测定结果明确CD-17菌株具有生防潜力。
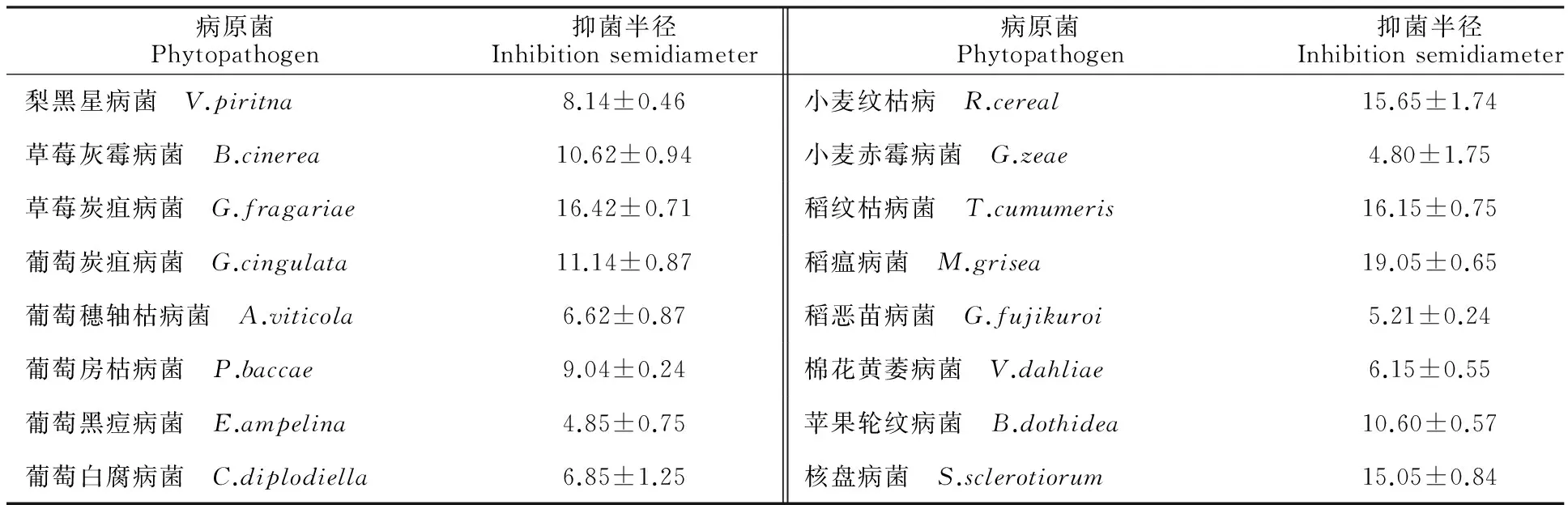
表1 CD-17菌株对植物病原菌的抑菌活性Table 1 Inhibition activity of strain CD-17 against phytopathogens mm
2.2 CD-17菌株的鉴定
扫描电镜观察表明,CD-17菌株的细胞形态为近圆柱体、杆状,菌体大小为(1.0~1.3)μm×(2.7~3.2) μm(图1)。生理生化测定结果显示,CD-17菌株为好氧、产芽胞(表2),不能在50 ℃条件下生长,V-P试验为阳性,可利用葡萄糖、木糖、L-阿拉伯糖、甘露醇和乳糖,还原硝酸盐,水解淀粉,发酵葡萄产气、不产酸。结合CD-17菌株16S rDNA基因序列的BLAST比对结果,选择序列比对相似度在99%~100%的12个报道菌株构建系统发育树(图2),以E.coli菌株的16S rDNA基因序列为外参。16S rDNA基因序列分析结果可将CD-17明确的归类为芽胞杆菌属。同样的方法以gyrB基因序列比对结果构建系统发育树,将CD-17进一步归类为Bacillusamyloliquefaciens(图3)。综合扫描电镜、菌株生理生化和分子生物学辅助鉴定结果,把CD-17菌株鉴定为解淀粉芽胞杆菌。
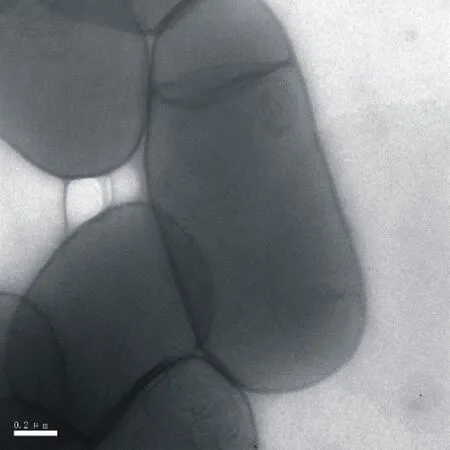
图1 CD-17菌株扫描电镜图Fig.1 Scanning electron microscope images of strain CD-17
2.3 温室防治
在温室控制条件下,当炭疽病菌分生孢子与BCA同时接种时,7 d的防治效果为100%,但当病原菌分生孢子先接种48 h后再用BCA的防治效果为55.68%。当草莓叶片在人工给予微伤口时,病原菌分生孢子与BCA同时接种7 d的防治效果为76.94%,当病原菌分生孢子先接种48 h后再防治时的防治效果为37.82%(表3)。

表2 CD-17菌株的细胞形态及理化特征Table 2 Physiological and biochemical characteristics of strain CD-17

图2 基于16S rDNA基因序列BLAST结果构建菌株CD-17的系统发育树Fig.2 Phylogenetic tree of strain CD-17 based on BLAST results of 16S rDNA gene sequence
3 讨 论
炭疽病菌分生孢子在接种24 h后,接种前给予微伤口的草莓叶片上有典型的病斑,且有伤口的嫩叶发病重于老叶,在48 h保温保湿后有伤口的草莓植株全部发病,而没有伤口的依然未表现出明显的侵染症状,接种5 d后没有伤口的草莓叶片才开始有典型的病斑,在接种7 d后有伤口植株的病斑进一步扩大,但无伤口植株的病斑没有显著扩大,接种 14d 后,有伤口植株的叶片上病斑严重度极显著高于无伤口的植株。以上病程观察结果说明:微伤口有利于草莓炭疽病菌分生孢子的快速侵入,炭疽病菌侵入无伤口的正常草莓植株叶片的显症时间为5~7 d,在高温高湿且有伤口的条件下炭疽病菌能快速侵染草莓植株。综上得出,在草莓苗床或田间管理期间造成的微伤口,或自然风吹、虫啃等造成的微伤口是炭疽病菌快速暴发流行的促进因子,这也同时解释为什么在夏天暴雨和每次摘除老叶过后,露天草莓苗床极易暴发炭疽病的原因。
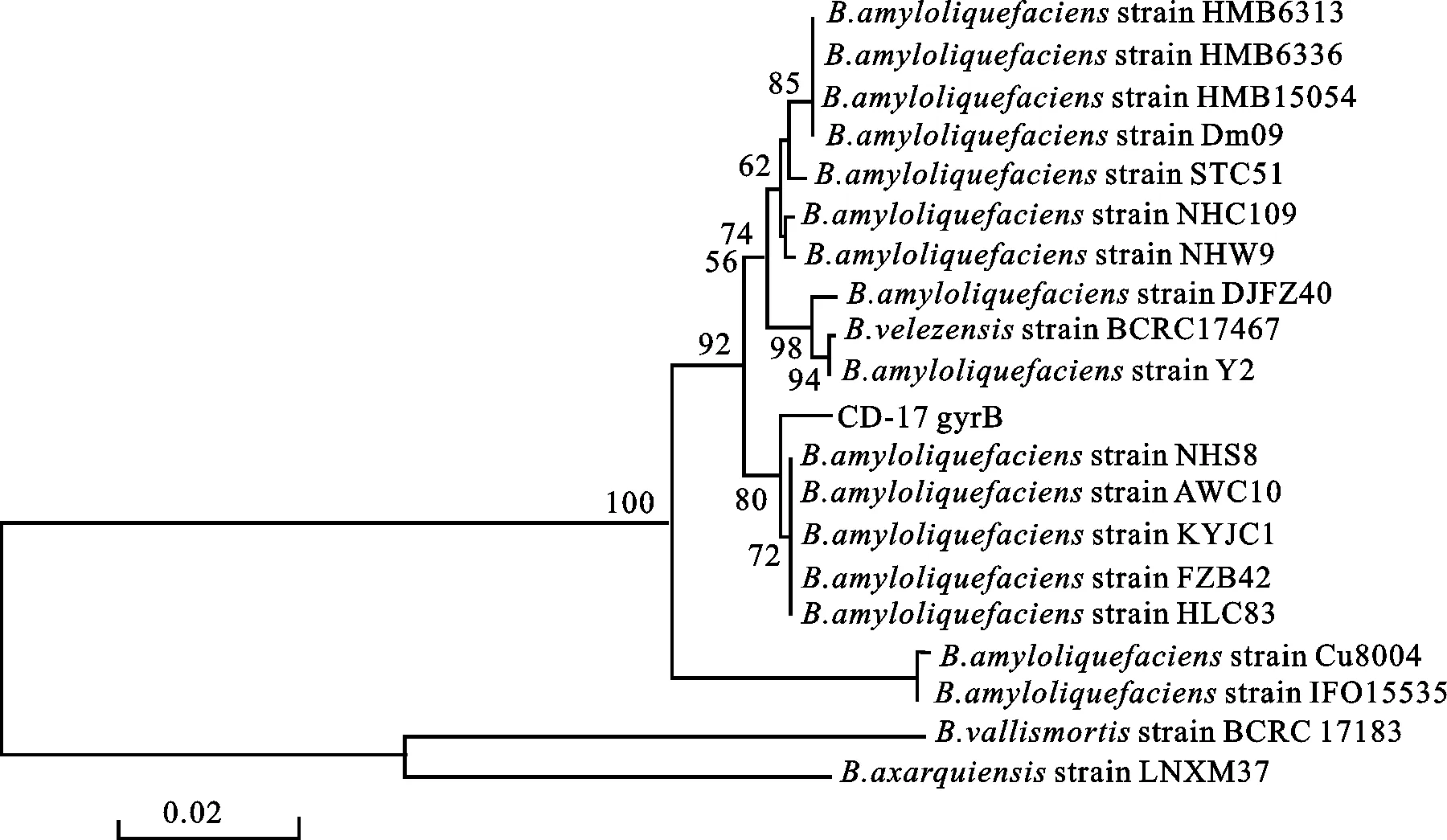
图3 基于gyrB基因序列BLAST结果构建菌株CD-17的系统发育树Fig.3 Phylogenetic tree of strain CD-17 based on BLAST results of gyrB gene sequence

处理Treatment草莓叶片无伤口 NormalleafBCA+GCGC48h+BCACK1草莓叶片有微伤口 LeafwithslightwoundBCA+GCGC48h+BCACK2病情指数 Diseaseindex018.9242.7115.4541.6767.01防效/% Controlefficacy10055.68-76.9437.82-
注:BCA指CD-17菌株加工而成的制剂(施用浓度为1.0×107cfu/mL); GC指草莓炭疽菌分生孢子悬浮液(施用密度为2.67×105mL-1);BCA+GC指喷雾BCA晾干后紧接着接种草莓炭疽病菌分生悬浮液;GC 48 h+BCA指先接种草莓炭疽病菌分生孢子悬浮液并在温室培养48 h后再喷雾BCA。
Note: BCA represents biocontrol agent prepared from CD-17 strain (Concentration of 1.0×107cfu/mL); GC represents spore suspension of strawberry anthracnose (Concentration of 2.67×105spore/mL); BCA+GC represents BCA and GC inoculated at the same time on strawberry leaf;GC48 h+BCA presents BCA spraying after 48 h inoculation with GC on strawberry leaf.
在江苏地区,决定露天草莓育苗成功与否的关键是控制草莓炭疽病。本研究结果表明,当炭疽病菌侵入草莓叶片后再用生防菌防治的效果仅为37.82%,而未侵入时,即使炭疽病菌的分生孢子接种密度达到105mL-1,保护性防治效果也为100%,说明CD-17能强烈的抑制炭疽病分生孢子的萌发,同时也指出草莓炭疽病的防治重在预防,且防治时间应提前到每次去除老叶前5~7 d左右,而且在去除老叶后还需即时防治1次,该田间防控措施可同时兼治草莓灰霉病和白粉病。按上述方法辅以农业和物理方法集成防治,完全能控制好大棚草莓病害,保证草莓果品安全。本研究中CD-17菌株的菌落形态和平板培养时的菌体颜色、抑菌谱和笔者先前报道的DJ-6菌株(枯草芽胞杆菌)相似,所以为准确确定CD-17菌株的分类地位,参用一些目前常用的分子生物学方法来辅助鉴定。笔者认为,利用芽胞杆菌16S rDNA基因加gyrB基因序列构建菌种亲缘关系系统进化树的方法[18],能很好确认芽胞杆菌种或种下分类单元。
Reference:
[1] 杨敬辉,陈宏州,肖 婷,等.14种杀菌剂对葡萄炭疽病菌的毒力测定[J].江苏农业科学,2014,42(12):163-166.
YANG J H,CHEN H ZH,XIAO T,etal.Toxicity test of 14 fungicides toColletotrichumgloeosporioides[J].JiangsuAgriculturalSciences,2014,42(12):163-166(in Chinese).
[2] 张 雪,张志宏,刘月学,等.木霉菌剂提高“红颜”草莓炭疽病抗性的效应[J].西北农业学报,2010,19(8):153-156.
ZHANG X,ZHANG ZH H,LIU Y X,etal.Effect of trichoderma on improving resistance of strawberry to anthracnose[J].ActaAgriculturaeBoreali-occidentalisSinica,2010,19(8):153-156(in Chinese with English abstract).
[3] BANKOLE S A,ADEBANJO A.Biocontrol of brown blotch of cowpea caused byColletotrichumtruncatumwithTrichodermaviride[J].CropProtection,1996,15 (7): 633-636.
[4] BEGUM M M,SARIAH M,PUTEH A B,etal.Field performanceof bio-primed seeds to suppressColletotrichumtruncatumcausing damping-off and seeding stand of soybean[J].BiologicalControl,2010,53(1):18-23.
[5] KUPPER K C,CORREA F E,AZEVEDO F A,etal.Bacillussubtilisto biological control of post bloom fruit drop caused byColletotrichumacutatumunder field conditions[J].ScientiaHorticulturae,2012,134(1):139-143.
[6] PYOUNG K,CHUNG K C.Production of an antifungal protein for control ofColletotrichumlagenariumbyBacillusamyloliguefaciensMET0908[J].FEMSMicrobiologyLetters,2004,234(1):177-183.
[7] HIRADATE S,YOSHIDA S,SUGIE H,etal.Mulberry anthracnose antagonists (iturins) produced byBacillusamyloliquefaciensRC-2[J].Phytochemistry,2002,61(6): 693-698.
[8] 臧超群,赵奎华,刘长远,等.葡萄炭疽病有益微生物筛选及控病效果研究[J].中国农学通报,2011,27(9):387-390.
ZANG CH Q,ZHAO K H,LIU CH Y,etal.Screening of beneficial microorganisms to grape anthracnose and research of its control efficiency[J].ChineseAgriculturalScienceBulletin,2011,27(9):387-390(in Chinese with English abstract).
[9] JI M X,YANG J H,WU X,etal.Biocontrol of strawberry anthracnose caused byColletotrichumfragariae[J].AgriculturalScienceandTechnology,2012,28(6):1498-1500.
[10] 骆焱平,王兰英,谢 颕,等.内生细菌BYG2-5的鉴定及其对芭蕉炭疽病的防效[J].华中农业大学学报,2011,30(4):470-473.
LUO Y P,WANG L Y,XIE Y,etal.Biological control and identification of an endophytic bacterial strain BYG2-5 antagonistic againstColletotrichummusae[J].JournalofHuazhongAgriculturalUniversity,2011,30(4):470-473(in Chinese with English abstract).
[11] VISWANATHAN R,SAMIYAPPAN R.Antifungal activity of chitinases produced by some fluorescent pseudomonads againstColletotrichumfalcatumwent causing red rot disease in sugarcane[J].MicrobiologicalResearch,2001,155(4):309-314.
[12] 石晶盈,刘爱媛,李雪萍,等.番木瓜果实内生细菌MGP3 菌株的鉴定及拮抗作用[J].微生物学报,2011,51(9):1240-1247.
SHI J Y,LIU A Y,LI X P,etal.Identification and antagonistic activities of an endophytic bacterium MGP3 isolated from papaya fruit[J].ActaMicrobiologicaSinica,2011,51(9):1240-1247(in Chinese with English abstract).
[13] NANTAWANIT N,CHANCHAICHAOVIVAT A,PANIJPAN B,etal.Induction of defense response againstColltotrichumcapsiciin chili fruit by the yeastPichiaguilliermondiistrain R13[J].BiologicalControl,2010,52(2):145-152.
[14] ZHANG H Y,ZHENG X D,YU T.Biological control of post-harvest diseases of peach withCryptococcuslaurentii[J].FoodControl,2007,18(4):287-291.
[15] 王亦佳,李建龙,刚诚成,等.利用拮抗菌常温保鲜凤凰水蜜桃效果系统研究[J].食品工业科技,2012,33(2):384-387.
WANG Y J,LI J L,GANG CH CH,etal.Systematic study on antagonist application to the preservation of juicy peach fruits at room temperature [J].ScienceandTechnologyofFoodIndustry,2012,33(2):384-387(in Chinese with English abstract).
[16] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京: 科学出版社,2001.
DONG X ZH,CAI M Y.Handbook of Common Bacterial System Identification [M].Beijing: Science Press,2011(in Chinese).
[17] 杨敬辉,文平兰,陈宏州,等.放线菌NF0919的鉴定及生防活性[J].西北农业学报,2013,22(1):201-206.
YANG J H,WEN P L,CHEN H ZH,etal.Biocontrol activity and taxonomy of actinomyces strain NFo919[J].ActaAgriculturaeBoreali-occidentalisSinica,2013,22(1):201-206(in Chinese with English abstract).
[18] 喻国辉,牛春艳,陈远凤,等.利用16S rDNA结合gyrA和gyrB基因对生防芽胞杆菌R31的快速鉴定[J].中国生物防治,2010,26(2):160-166.
YU G H,NIU CH Y,CHEN Y F,etal.Use of 16S rDNA,gyrAandgyrBgene sequence to identify a biocontrolBacillussp.strain R31[J].ChineseJournalofBiologicalControl,2010,26(2):160-166(in Chinese with English abstract).
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Biocontrol Activity and Taxonomy of Grass Carp Intestine Bacteria CD-17
YANG Jinghui, WANG Jinggen, ZHANG Yujun and ZHUANG Yiqing
(Zhenjiang Institute of Agricultural Sciences, Hilly Region of Jiangsu, Jurong Jiangsu 212400,China)
To discover new biological control agents, the biocontrol activity of grass carp intestine bacteria strain CD-17 was interpreted by dual-cultural plate method and greenhouse effect test of CD-17 biocontrol agent (BCA).Based on the morphological, chemical and molecular taxonomy methods, the strain CD-17 was identified.The results showed that the strain CD-17 displayed a broad-spectrum inhibitive activity.Data from greenhouse experiments under the control condition revealed the control efficacy of BCA and spores suspension of strawberry anthracnose (GC) inoculated at the same time and BCA spray after 48 h inoculation with GC on the normal strawberry leaf were 100% and 55.68%, respectively.However, the control efficacy of BCA and GC inoculated at the same time and BCA sprayed after 48 h inoculation with GC on the slight wound strawberry leaf were only 76.94% and 37.82%,respectively.According to the morphological, physiological, biochemical characteristics, 16S rDNA andgyrBgene sequence, the strain CD-17 was identified asBacillusamyloliquefaciens.
Grass carp intestine bacteria; Biocontrol activity; Taxonomic identification
2016-03-04 Returned 2016-03-22
Independent Innovation Foundation of Jiangsu Province[No.cx(13)3062]; Agricultural Science Foundation of Zhenjiang (No.NY2013014,NY2015019);Agricultural Science Foundation of Jiangsu Province(No.BE2013407,BE2015364).
YANG Jinghui, male, Ph.D, Research fellow.Research area: bio-control of plant disease and fungicides resistance.E-mail: yjhnn32@126.com
ZHUANG Yiqing,male, Ph.D, Research fellow.Research area: bio-control of plant disease.E-mail: yqzhuang@sina.com
日期:2017-06-05
2016-03-04
2016-03-22
江苏省自主创新基金[cx(13)3062];镇江市科技支撑(NY2013014,NY2015019);江苏省农业支撑(BE2013407,BE2015364)。
杨敬辉,男,研究员,博士,从事植物病害生物防治及植物病原菌抗药性研究。E-mail: yjhnn32@126.com
庄义庆,男,研究员,博士,主要从事植物病害生物防治研究。E-mail: yqzhuang@sina.com
S432.44;S476.8
A
1004-1389(2017)06-0932-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170605.1728.034.html

