油菜种子次生休眠遗传多样性的研究
席 坤,李爱军,杨其东,董军刚,董振生
(1.西北农林科技大学 农学院,陕西杨凌 712100;2.富平县种子技术推广中心,陕西富平 711700)
油菜种子次生休眠遗传多样性的研究
席 坤1,李爱军2,杨其东1,董军刚1,董振生1
(1.西北农林科技大学 农学院,陕西杨凌 712100;2.富平县种子技术推广中心,陕西富平 711700)
种子因生理代谢改变继而诱导产生次生休眠。研究选育次生休眠性特强和特弱的品种,对防治产区中大量长期存在的地下油菜种子库、田间混杂以及油菜自生苗的泛滥,均具有重要意义。采取实验室聚乙二醇6000诱导次生休眠和4种不同大田埋藏处理相结合的方法,比较甘、白、芥3类油菜共计54个品种(系)在次生休眠特性方面的遗传多样性。结果显示:在大田埋藏处理中休眠特性差异表现显著,次生休眠特性的变异为 0~96.75%,广义遗传率为87.56%~92.56%。所用54个品种(系)中休眠率大于45%的占14.81%,休眠率处于20%~45%的占14.81%,休眠率处于5%~20%的占29.63%,休眠率处于1%~5%的占31.48%,休眠率小于1%的占14.81%。经聚乙二醇6000诱导的种子次生休眠特性的广义遗传率为92.73%。相关性分析表明:田间4种处理方法两两之间均呈极显著相关,与其休眠率结果表现一致;在聚乙二醇诱导法与埋藏处理中,除6个月25 cm处理外的其余3种处理均表现出极显著相关特性。综合比较不同品种(系)类型的休眠率为芥菜型>白菜型>甘蓝型,休眠性受遗传因素的影响程度为白菜型>芥菜型>甘蓝型。
油菜;次生休眠;广义休眠率;埋藏; PEG诱导
油菜主要分为甘蓝型(Brassicanapus)、白菜型(Brassiarapa或者B.campestris)、芥菜型(Brassicajuncea)3大类型,是中国重要的油料作物,对农业生产和国民经济具有重大战略意义和深远影响。甘蓝型油菜是中国油菜的主要栽培种,但白菜型和芥菜型由于很强的适应性和早熟性在部分地区仍在广泛种植,而且其中的特异性遗传资源有待进一步开发利用。油菜种子角果易开裂,加之机械化的收获方式,会造成严重的落粒现象,研究表明油菜落粒量为10~1 600 kg·hm-2,平均值为300~500 kg·hm-2,相当于约10 000粒·m-2[1-3]。一般收获油菜时产生的落粒量可达到播种量的7~56倍。输入地下后,只要不翻耕,油菜种子在地下平均可存活5~10年,成为未来多年内油菜自生苗连续泛滥的潜在源头[4-7]。落粒的存活涉及到种子的初生休眠和次生休眠问题。某些白菜型、芥菜型油菜的新收获种子存在初生休眠,但持续时间仅数十天至4个月[8],而大量研究显示,落粒后的油菜种子如在深埋、低温等不适宜萌发的自然条件下诱发次生休眠,仍具有生活力,但不发芽,当遇到适宜发芽的环境条件,又破除休眠逐渐恢复发芽继而引发自生苗。在油菜产区,大量的自生苗不仅会降低种子品质和污染纯系种子,造成田间生物学混杂,同时不利于育种工作开展;而在非产区会作为竞争性杂草,与当季作物竞争水肥,增加控制杂草的工作量[9-11]。因此,针对次生休眠特性,在不同油菜种子之间进行综合比较研究,揭示其可能的影响因素,对控制油菜自生苗的发生、防止田间作物生物学混杂、优势品种的进一步选育均具有重要意义。研究表明,油菜种子的休眠特性受土壤渗透压、含氧量、光照、温度等多种因素影响[12-15]。与此同时,一些对作物的耕作方式与不同油菜籽自身的理化特性因素都会造成其次生休眠现象的发生和自生苗大量出现[16-19]。因此,针对次生休眠特性,在不同油菜种子之间进行综合比较,揭示其可能的影响因素,对控制油菜自生苗的发生、防止田间作物生物学混杂、优势品种的进一步选育均具有重要意义。本试验采用聚乙二醇(polyethylene glycol,PEG)6000诱导和在不同时间、不同深度的大田埋藏处理的方法,比较研究甘、白、芥3类油菜种子次生休眠特性。针对油菜自生苗泛滥、基因漂移等潜在环境风险问题,结合大田深埋和PEG 6000诱导处理的方法,探究中国甘、白、芥3类油菜种子次生休眠特性的遗传多样性规律,依据其休眠能力挖掘一些休眠性特别强和特别弱的品种(系),并针对目前油菜种子次生休眠特性的检测方法和其表现规律进行初步探讨。
1 材料与方法
1.1 材 料
本试验用种除了一些特别品种(如‘陕油2014’‘陕油2013’)为当年生种,其余种子均为2012年收获种子,试验前一直于4 ℃避光冷藏保存。大部分种子材料均由西北农林科技大学农学院收集提供,部分甘蓝型种子由荣华公司提供。包括白菜型品种(系)14份,芥菜型品种(系)14份,甘蓝型品种(系)26份,总计54份(表1)。对所有收集种子先进行初步筛选,剔除残破、不饱满的种子,然后抽样进行生活力鉴定,保证所有种子都是具有生活力的健康种子。
1.2 PEG 6000诱导油菜种子次生休眠处理
按照Pekrun等[10]的方法对油菜种子进行诱导次生休眠处理:在直径为9 cm的培养皿底垫上2层中速滤纸,放置100粒种子,每个品种重复4次。加入8 mL的PEG 6000溶液在温度为20 ℃、闭光条件下对种子处理14 d。然后取出种子,洗净附着在种子表皮残留的PEG 6000,由于芥菜型种子过小,可放于细胞筛中反复冲洗,将冲洗净的种子再放入垫有双层中速滤纸的新培养皿中,等量加入8 mL蒸馏水,进行发芽试验,20 ℃处理7 d,然后对发芽种子数进行统计。为方便数据分析,将PEG 6000诱导法处理记为T1处理。
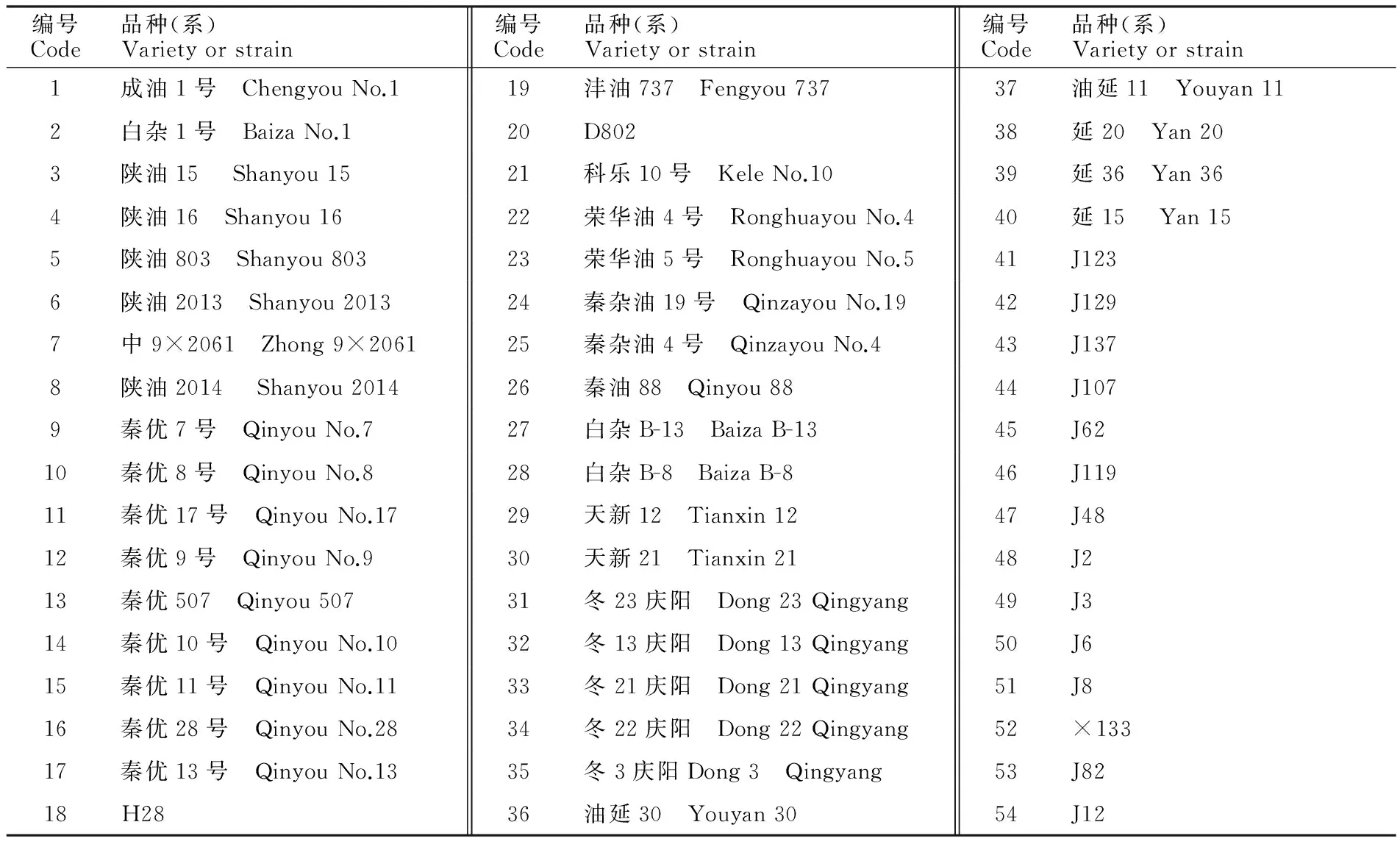
表1 试验材料Table 1 Experimental materials
注:1~26为甘蓝型油菜品种(系);27~40为白菜型油菜品种(系);41~54为芥菜型油菜品种(系)。
Note: 1-26.Brassicanapus;27-40.Brassiacampestris;41-54.Brassicajuncea.
1.3 埋藏处理
采用54个品种(系),每种处理4次重复。 在每个200目的尼龙网种子袋中(可透气)装入100粒油菜种子,按不同深度(5 cm/25 cm)埋入土壤,处理不同时长(6个月/9个月),试验用地共计1.5 m×1.5 m,均分为4个小区。每个小区共54个品种,4次重复,共216袋种子,于2015年9月将全部种子统一埋入地下,次年2月和5月分批次取出,分别做发芽试验,统计发芽率。其中6个月、5 cm记为T2处理,6个月、25 cm记为T3处理, 9个月、5 cm记为T4处理, 9个月、25 cm记为T5处理。具体参照Pekrun等[10]的方法。埋藏试验在西北农林科技大学试验田进行, 试验地点年平均气温约为12.6 ℃, 年降雨量约为650 mm。
1.4 破眠处理及休眠率计算
将上述进行1周发芽试验后仍不发芽的种子进行破眠处理。在12 h,30 ℃,光照/12 h,3 ℃,黑暗交替的环境条件下,加入8 mL 200 mg/L的赤霉素打破种子的休眠,对种子发芽数进行统计,将破眠后的发芽种子参与到次生休眠率的计算当中;没有发芽则视为死亡种子,不参与休眠率的计算。次生休眠率=100%×(1周发芽种子数+破眠发芽种子数)/100(种子数)。
1.5 统计分析
每种处理收集数据后,取平均数进行统计分析。采用 SPSS 13.0计算平均数、标准差以及不同性状的相关性分析,再依据随机模型中期望均方模型分别对表型方差(σp2)、遗传方差(σg2)和广义遗传率(hb2)进行统计计算。其中hb2=σg2/σp2×100%。
2 结果与分析
2.1 方差分析
对所有品种(系)种子大田埋藏4种处理及PEG 6000诱导处理的种子次生休眠的数据进行方差分析,结果见表2。
由表2可知,4种不同的田间处理方法及PEG诱导法检测得到的种子次生休眠性均显示品种(系)间差异达到极显著水平,F值表现为29.664~54.902,显示种子次生休眠特性主要由其基因型影响和控制。田间4种处理方式计算得到的广义遗传率为87.56%~92.56%。说明油菜种子次生休眠特性受所设置环境条件因素影响不大,主要受基因型控制。PEG诱导法检测的次生休眠性广义遗传率为92.73%,大于田间处理得到的最大广义遗传率92.56%,说明PEG检测法更能反映不同品种的基因型差异,受环境的影响更小。
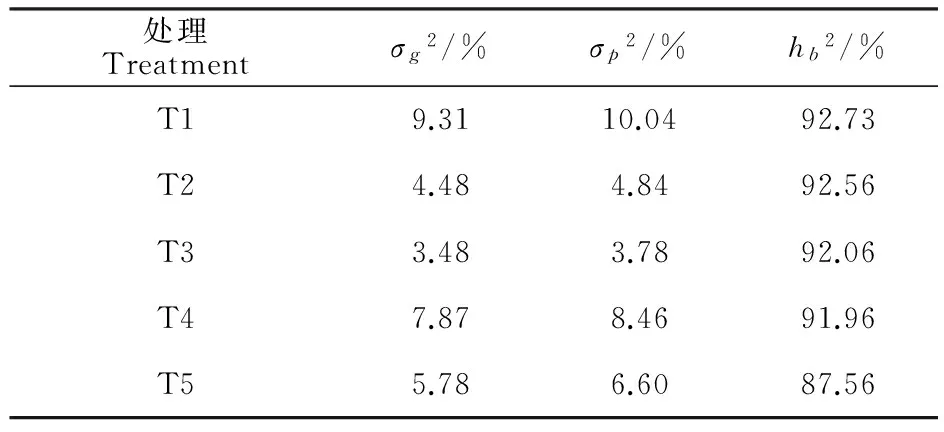
表2 不同处理间种子次生休眠数据Table 2 Analysis of variance in seed dormancy
注:不同处理间的方差分析检验极显著(P<0.01)。
Note:The variance was very significant difference between different treatmeants(P<0.01).
对甘、白、芥3类油菜种子分别进行方差分析,表3显示,油菜种子品种(系)间的差异显著性为白菜型>芥菜型>甘蓝型。(其F值分别为16.59>14.97>6.54),其变化趋势与广义遗传率计算结果表现一致,其中白菜型92.39%>芥菜型89.70%>甘蓝型88.68%。
2.2 相关分析
对田间不同埋藏处理与PEG 6000诱导休眠处理所得休眠数据统计分析,得到其休眠率之间的相关系数见表4。
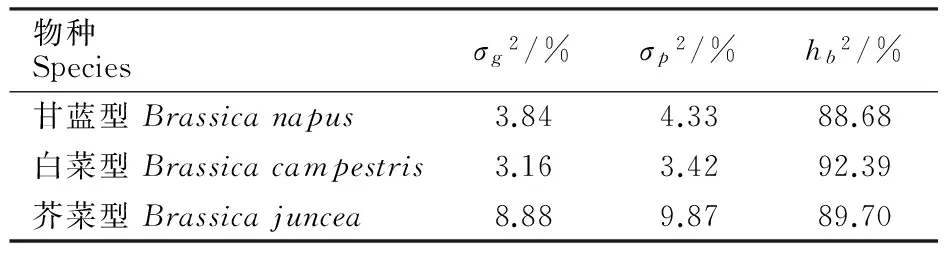
表3 3大类型油菜种子次生休眠数据Table 3 Analysis of variance in seed dormancy of 3 oilseed rape types
注:不同种间的方差分析检验显著(P<0.05)。
Note:The variance was significant difference between different species(P<0.05).

表4 不同处理方法诱导种子次生休眠数据的相关性分析Table 4 Correlation analysis among different treatment-induced seed dormancy dates
注:*表示成对性状在P<0.05水平显著相关; **表示成对性状在P<0.01水平显著相关。
Note: * indicates paired traits were significantly correlated (P<0.05); ** indicates paired traits were significantly correlated (P<0.01).
表4显示,通过4种不同的大田埋藏处理得到的种子次生休眠率统计分析,结果呈现一致性,4种埋藏处理方法两两之间均达到极显著相关。T2、T3、T4、T5与T1处理的相关分析中,除T3处理外,与其余3种处理均表现出极显著的相关特性。说明所用几种方法所得结果一致性比较好,都是可以采用的模拟诱导次生休眠的方法,据此可进一步探讨诱导次生休眠的影响因素和适宜方法。
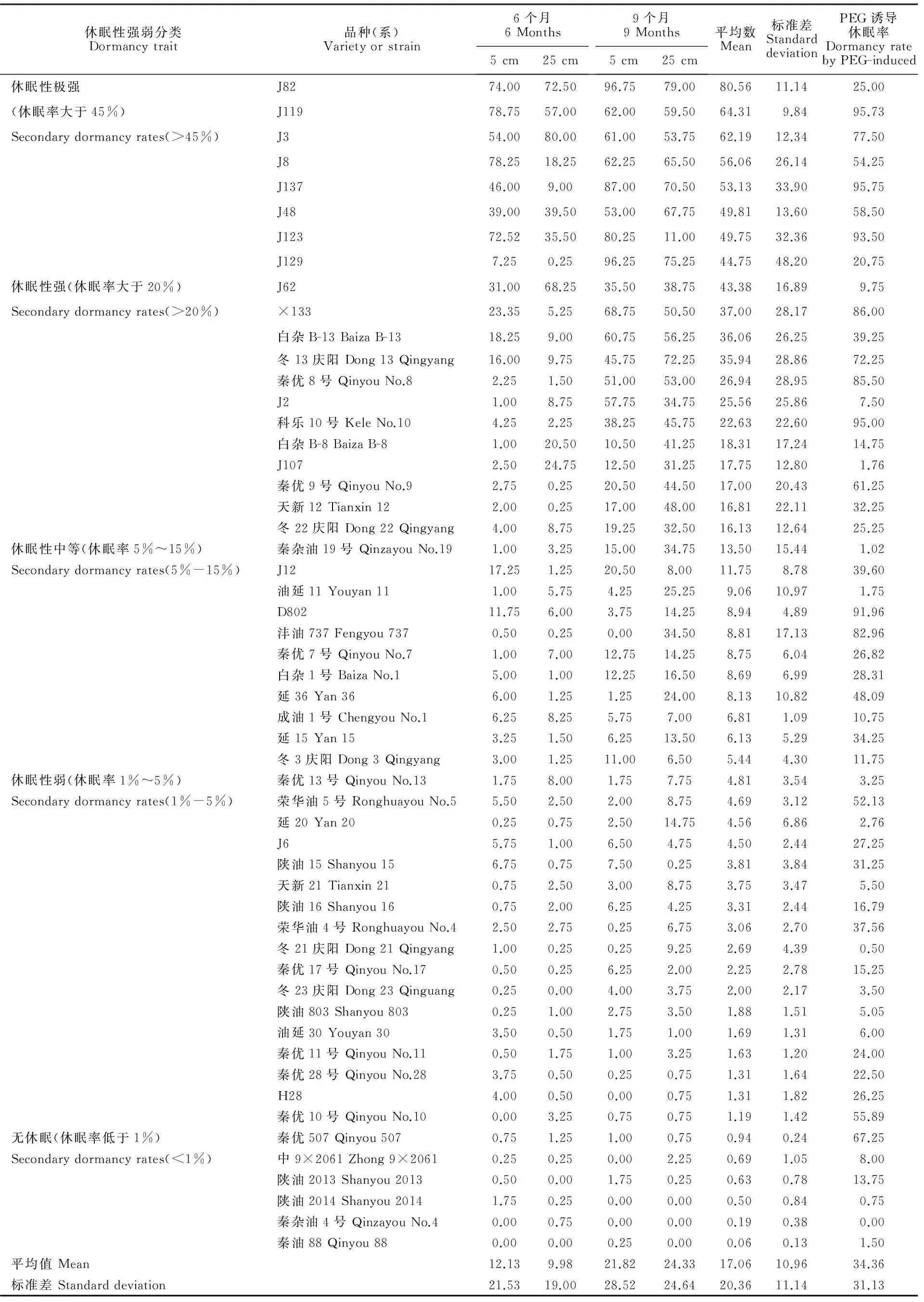
表5 不同深埋时间和程度及PEG诱导处理下的种子休眠率Table 5 Oil seed dormancy under different burial times and depths and PEG methods %
2.3 种子埋藏试验品种的整体休眠情况
试验结果显示,不同品种(系)种子次生休眠率差异较大,变幅为0~96.75%。表5为油菜种子共计54个品种(系)在不同埋藏深度和时间下,设置4次重复,计算得到休眠率的平均数及标准差。 结果显示:54个品种(系)的平均休眠率变幅是0~80.56%,依据其休眠率高低进行分类,参考油清波等[20]的分类数据。其中表现出休眠性极高的品种(系)有(平均休眠率超过45%):‘J82’(80.56%±11.14%)‘J119’(64.31%±9.84%)‘J3’(62.19%±12.34%)‘J8’(56.06% ±26.14%)‘J137’(53.13%±33.90%)‘J48’(49.81%±13.60%)‘J123’(49.75% ±32.36%)‘J129’(44.75%±48.20%)。
休眠性强(休眠率大于20%)有:‘J62’ ‘×133’ ‘白杂B-13’ ‘冬13庆阳’ ‘秦优8号’‘J2’ ‘科乐10号’‘白杂B-8’‘J107’ ‘秦优9号’ ‘天新12’‘冬22庆阳’。
休眠性中等(休眠率5%~15%)有:‘冬3庆阳’‘J12’‘白杂1号’‘油延11’‘延15’‘成油1号’‘D802’‘秦优7号’‘秦杂油19’‘延36’‘沣油737’。
休眠性弱(休眠率1%~5%)的品种(系)有:‘H28’‘油延30’‘冬21庆阳’‘秦优13号’‘延20’‘天新21’‘荣华油4号’‘冬23庆阳’‘陕油803’‘秦优11号’‘陕油15’‘荣华油5号’‘秦优28号’‘秦优10号’‘J6’‘秦优17号’‘陕油16’。
无休眠(休眠率低于1%)的品种(系)有:‘秦优507’‘中9×2061’‘陕油2013’‘陕油2014’‘秦杂油4号’‘秦油88’。
将试验用种经过田间4种不同的埋藏方式处理后,在20 ℃恒温下进行发芽试验,仍不能发芽的这部分种子再用赤霉素进行破眠处理。发芽的油菜种子表现深度休眠特性。经6个月、9个月大田深埋处理中表现休眠程度深的种子见图1(图中所选的品种和品系的破眠粒数≥13粒)。其中‘J123’、‘J129’、‘J137’、‘J48’、‘J6’、‘x113’、‘J12’和‘J119’这8个芥菜型油菜品系在6个月和9个月处理中均有深度休眠的种子出现。
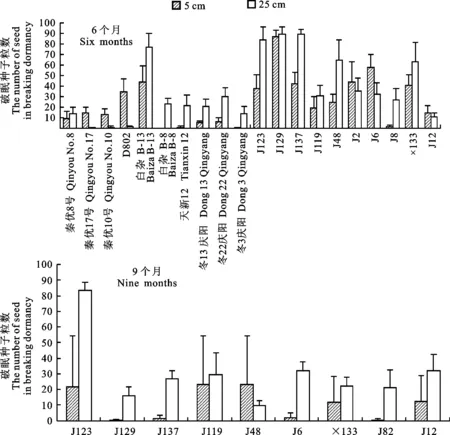
图1 大田深埋处理中表现出休眠程度较深的品种(系)Fig.1 Varieties or strains of depth dormant in burial process
2.4 PEG诱导处理检测
54个油菜品种(系)经PEG 6000诱导,结果显示其休眠率普遍较高,平均休眠率达到34.36%,只有2个品种‘陕油2014’和‘秦杂油4号’的休眠率低于1%,17个品种(系)的休眠率极强(大于45%),其中大于85%的有:‘J119’‘J123’‘J137’‘X133’‘D802‘‘科乐10号’。PEG诱导的平均休眠率:芥菜型为49.49%,白菜型为21.27%,甘蓝型为33.26%。
5种不同的处理方式中,芥菜型均表现极高的休眠性,4种埋藏处理中,油菜种子休眠率为芥菜型>白菜型>甘蓝型。而在PEG 6000诱导处理中油菜种子休眠率:芥菜型>甘蓝型>白菜型(图2)。计算得平均差距倍数:芥菜型为白菜型的4.8倍,为甘蓝型的8.53倍。
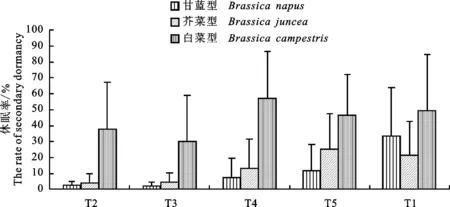
图2 3种类型油菜种子休眠性的对比
Fig.2 Comparison of seed dormancy rates of 3 oilseed rape types
3 讨 论
目前国内外进行油菜种子次生休眠特性的测定方法主要有2类:大田深埋处理和实验室PEG 6000诱导休眠。其中,PEG诱导只能从水分缺失一个角度来反映种子次生休眠特性的情况,品种间差异主要表现为基因型差异。田间埋藏处理可以模拟油菜种子落粒后的自然生长条件,综合温度、光照、水分、土壤含氧量、理化性质等多个方面因素,在不同的深埋时间和深埋程度的处理中,休眠程度特性表现不同。
本研究显示,在田间埋藏和实验室PEG诱导这2种不同处理方法之间,白菜型和甘蓝型均表现出与全部试验整体相似的显著性差异规律,除T3外其他处理均达到显著或极显著差异。而芥菜型的表现规律不同,除了T2的田间处理外,相关性均未达到显著。Gruber等[21]通过对转基因和常规油菜品种(系)的休眠性进行研究,相关性分析表明埋藏和PEG诱导之间达到极显著水平。油清波等[20]发现在甘蓝型油菜品种中,T1处理只与6个月的深埋时间处理之间呈现显著相关,在9个月深埋处理中相关性未达到显著水平。在环境条件中,随着时间的变化,不管是种皮还是胚部分的物理结构及化学成分都会发生变化,比如毕辛华等[8]研究表明种子休眠期随单宁含量的升高而变长。这些不同结果表明油菜的休眠特性复杂,可能受品种类型以及不同品种选材的影响大,说明要谨慎评估不同品种种子休眠特性的不同检测方法,对大田的处理条件(时间、深度)也应根据不同的试验目的进行调整,这样在评估不同油菜种子的休眠特性时能更有针对性。
白菜型油菜和芥菜型油菜不是中国粮油的主要栽培品种,作为蕴藏大量潜在优良基因的丰富种质资源库,在休眠特性的深入研究中也鲜有报道。本研究选取的54份油菜种子来源广泛,除了甘蓝型、还选取28种白菜型、芥菜型油菜资源。不同品种(系)的休眠率埋藏处理结果显示油菜休眠性芥菜型>白菜型>甘蓝型,这与张锦芳等[22]在针对四川省地方品种的研究结果相似。本研究筛选出一批种子无论在田间还是PEG诱导中都表现休眠性极强的品种有(均为芥菜型):‘J119’‘芥3’‘芥8’‘J137’‘J48早’‘J123’。‘陕油2014’‘秦杂油4号’‘秦油88’几乎没有休眠性(均为甘蓝型)。这些品种具有优良的农艺性状,为深入挖掘优良种质提供巨大基因库。同时,育种工作者可以有目的性和针对性地选择一些休眠性低的品种,在提高产量和保障品质的同时可以大大降低自生苗带来的管理成本和基因扩散风险[23-24]。本研究中大田深埋和PEG 6000诱导法计算分析所得的平均广义遗传率分别为91.04%和 92.73%,说明油菜种子次生休眠特性的可遗传性强,基因型效应大,可以在生产上进行育种改良。
试验中一些种子经过破眠处理才能发芽,表现极强的深度休眠特性,可以在土壤中常年存活,短则两三年,长则10年以上[25],存在基因漂移的潜在隐患,具有不可估量的环境风险。
4 结 论
研究通过广义遗传力的计算分析,综合采取大田深埋和实验室聚乙二醇6000诱导2种处理方法,比较研究3大类型油菜籽的次生休眠特性,结果显示:
(1)筛选出一批种子无论在田间还是PEG诱导中都表现休眠性极强的品种有:‘J119’‘芥3’‘芥8’‘J137’‘J48早’‘J123’均为芥菜型。另外‘秦油88’‘秦杂油4号’‘陕油2014’3个甘蓝型品种几乎不表现休眠性。
(2)油菜的休眠特性复杂,受品种间不同基因型的影响大。说明评估种子休眠特性的不同检测方法要谨慎而为,针对不同油菜品种选择不同方法检测。
(3)综合比较不同品种类型的休眠率,结果显示休眠性芥菜型>白菜型>甘蓝型,但在休眠性这一性状中,受遗传因素的影响程度为:白菜型>芥菜型>甘蓝型。
Reference:
[1] BOWERMAN P.Comparison of harvesting methods of oilseed rape[J].AspectsofAppliedBiology,1984(6):157-165.
[2] VERA C L,MC GREGOR D I,DOWNEY R K.Detrimental effects of volunteerBrassicaon production of certain cereal and oilseed crops[J].CanadianJournalofPlantScience,1987,67(4):983-995.
[3] LUTMAN P J W.The occurence and persistence of volunteer oilseed rape (BrassicanapusL.) [J].AspectsofAppliedBiology,1993(35):29-36.
[4] ZHU Y M,LI Y D,COLBACH N,etal.Seed losses at harvest and seed persistence oilseed rape (Brassicanapus) in different conditions in Chinese farming systems[J].WeedResearch,2012,52(4):317-326.
[5] GUDEN R H,SHIRTLIFFE S J.Harvest losses of canola (BrassicanapusL.) cause large seedbank input[J].WeedScience,2003,51(1):83-86.
[6] BROWN J,ERICKSON D A,DAVIS J B.Effects of swathing on yield and quality of spring canola (BrassicanupusL.) in the Pacific Northwest[C]//GCIRC,Cambridge:Proceedings of the 9th International Rapeseed Congress,1995:339-341.
[7] PRICE J S,HOBSON R N,NEALE M A,etal.Seed losses in commercial harvesting of oilseed rape[J].JournalofAgriculturalEngineeringResearch,1996,65(3):183-191.
[8] 毕辛华,戴心维.油菜种子休眠特性的研究[J].种子世界,1987(7):12-16.
BI X H,DAI X W.Research of the secondary dormancy in oilseed[J].SeedWorld,1987(7):12-16(in Chinese).
[9] LUTMAN P J,PEKRUN C,ALBERTINI A.Dormancy and Persistence of Volunteer Oilseed Rape[R].Search and Development Project Report OS32,Home-Grown Cereals Authority,London,1998.
[10] PEKRUN C,LUTMAN P J W,BAEUMER K.Germination behaviour of dormant oilseed rape seeds in relation to temperature[J].WeedResearch,1997,37(6):419-431.
[11] CHADOEUF R,DARMENCY H,MAILLET J.Survival of buried seeds of interspecific hybrids between oilseed rape,hoary mustard and wild radish[J].FieldCropsResearch,1998,58(3):197-204.
[12] SQUIRE R G.Temperature and heterogeneity of emergence time in oilseed rape[J].AnnalsofAppliedBiology,1999,135(1):439-447.
[13] MOMOH E J J,ZHOU W J.Variation in the development of secondary dormancy in oilseed rape genotypes under conditions of stress[J].WeedResearch,2002,42(6):446-455.
[14] PEKRUN C,LUTMAN P J W.Induction of secondary dormancy in rape seeds (BrassicanapusL.) by prolonged imbibition under conditions of water stress or oxygen deficiency in darkness [J].EuropeanJournalofAgronomy,1997,6(3/4):245-255.
[15] BEWLEY J D,BLACK M.Dormancy and the Control of Germination [M].New York:Plenum Press,1994:199-267.
[16] PEKRUN C,HEWITT J D J.Cultural control of volunteer oilseed rape (BrassicanapusL.)[J].JournalofAgriculturalScience,1998,130(2):155-163.
[17] BOWERMAN P.Effects of cultivation upon volunteer oilseed rape[J].AspectsofAppliedBiology,1993(35):163-166.
[18] MOHLER C L,CALLOWAY M B.Effects of tillage and mulch on the emergence and survival of weeds in sweet corn[J].JournalofAppliedEcology,1992,29(1):21-34.[19] DYER W E.Exploiting weed seed dormancy and germination requirements through agronomic practices[J].WeedScience,1995,43(3):498-503.
[20] 油清波,刘 燕,曾新华,等.甘蓝型油菜种子次生休眠遗传多样性[J].科学通报,2013,58(27):2795-2802.
YOU Q B,LIU Y,ZENG X H,etal.Genetic diversity of secondary dormancy in rapeseed accessions (Brassicanapus)[J].ChineseScienceBulletin,2013,58(27):2795-2802(in Chinese with English abstract).
[21] GRUBER S,PEKRUN C,CLAUPEIN W,etal.Population dynamics of volunteer oilseed rape (BrassicanapusL.) affected by tillage[J] .EuropeanJournalofAgronomy,2004,20(4):351-361.
[22] 张锦芳,蒲晓斌,李浩杰,等.四川甘蓝型油菜地方种和推广品种休眠特性的比较研究[J]中国农学通报,2005,21(12):135-137.
ZHANG J F,PU X B,LI J H,etal.The comparing study on dormancy characterization of Sichuan rape (BrassicanapusL.)[J].ChineseAgriculturalScienceBulletin,2005,21(12):135-137(in Chinese with English abstract).
[23] SCHEFFLER J A,PARKINSON R,DALE P J.Evaluating the effectiveness of isolation distances for field plots of oilseed rape(B.napus) using a herbicide-resistance transgene as a selectable marker[J].PlantBreeding,1995,114(4):317-321.
[24] CHADOEUF R,DARMENCY H,MAILLET J.Survival of buried seeds of interspecific hybrids between oilseed rape,hoary mustard and wild radish[J].FieldCropsResearch,1998,58(3):197-204.
[25] SCHLINK S.10 years survival of rape seed (BrassicanapusL.) in soil[J].JournalofPlantDiseasesandProtection,1998(Special Issus):169-172.
(责任编辑:成 敏 Responsible editor:CHENG Min)
Study of Genetic Diversity of Secondary Dormancy in Three Types of Oilseed Rape
XI Kun1,LI Aijun2,YANG Qidong1, DONG Jungang1and DONG Zhensheng1
(1.College of Agronomy, Northwest A&F University, Yangling Shaanxi 712100, China;2.Seed Technology Promotion Center of Fuping County,Fuping Shaanxi 711700,China)
Secondary dormancy is induced by certain metabolism changes.To breed new rapeseed variety with high and low secondary dormancy trait is meaningful to control the long-standing underground seed pool, varietal complexity, and widespread of volunteer seedlings in the field.In this study, genetic diversity of secondary dormancy was evaluated in 54 oilseed varieties using four burial depths in soil or PEG 6000 treatment.In burial treatment, significant differences in secondary dormancy were observed among different varieties of rapeseed.Secondary dormancy varied from 0 to 96.75% based on values was obtained using four burial methods, with broad sense heritability ranging from 87.56% to 92.56%.Varieties exhibiting more than 45% secondary dormancy accounted for 14.81% of the 54 varieties, with 14.81% of the varieties having secondary dormancy rates of 20%-45% and 29.63%,31.48% with secondary dormancy rates of 5%-20% and 1%-5%, and 14.81% with secondary dormancy rates of less than 1%.Broad sense heritability obtained under PEG treatment was 92.73%.Using correlation analysis, we found a significant positive correlation between different periods and depths in the burial treatments.For the PEG-induced seed secondary dormancy data, significant correlations were also found within three of the burial treatments except for 6 month-25 cm depth.The results showed that the secondary dormancy is stronger in the type ofBrassicajunceathen followed byBrassiacampestrisandBrassicanapussuccessively.But the comparative analysis of broad sense heritability data showed that the genetic effect of seed secondary dormancy is sequenced inBrassiacampestris,Brassicajuncea, andBrassicanapusin a descending order.
Oilseed rape; Secondary dormancy; Broad sense heritability; Burial treatment; PEG treatment
2016-10-12 Returned 2016-11-30
Science and Technology Innovation Project of Shaanxi Province(No.2011KTZB02-01-03).
XI Kun, female, master student.Research area:theory and application of heterosis in crops.E-mail: 18700807118@163.com
DONG Zhensheng, male, research fellow,master supervisor.Research area:genetic breeding of rapeseed.E-mail: dzs05319@163.com
日期:2017-06-05
2016-10-12
2016-11-30
陕西省科技统筹创新工程计划项目(2011KTZB02-01-03)。 第一作者:席 坤,女,在读硕士,从事作物杂种优势理论与应用研究。E-mail:18700807118@163.com 通信作者:董振生,男,研究员,硕士生导师,主要从事油菜遗传育种研究。E-mail:dzs05319@163.com
S634.3
A
1004-1389(2017)06-0865-08
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170605.1715.020.html

