IMPDH基因克隆、生物信息学分析及在牦牛卵巢不同时期中的差异表达
熊显荣,兰道亮,胡嘉嘉,李 键,字向东
(1.西南民族大学 生命科学与技术学院,成都 610041; 2.西南民族大学 青藏高原研究院,成都 610041)
IMPDH基因克隆、生物信息学分析及在牦牛卵巢不同时期中的差异表达
熊显荣1,兰道亮2,胡嘉嘉1,李 键1,字向东1
(1.西南民族大学 生命科学与技术学院,成都 610041; 2.西南民族大学 青藏高原研究院,成都 610041)
旨在获得牦牛IMPDH基因序列并进行生物信息学分析,同时分析其在卵巢组织中的时序表达谱,为进一步研究卵巢生长发育及排卵机制奠定基础。通过RT-PCR技术克隆牦牛的IMPDH基因,并运用生物信息学方法分析不同物种序列进化关系,利用荧光定量qRT-PCR技术检测IMPDH基因在不同发育时期牦牛卵巢组织中的表达情况。结果显示,克隆得到牦牛1 623 bp 的IMPDH基因cDNA 序列,内含1 545 bp开放阅读框序列,编码514个氨基酸残基。与野牦牛的相应序列具有很高的同源性(99.4%),表明IMPDH基因在进化过程中相对保守。实时定量RT-PCR检测结果显示IMPDH基因的表达随年龄的增加而呈现上升趋势。荧光定量qRT-PCR检测结果显示IMPDH基因在卵巢卵泡期表达最强,显著高于红体形成期。结果表明IMPDH参与牦牛卵巢组织的生长发育,并在卵巢活动中有明显的表达规律,表明IMPDH基因在牦牛繁殖周期具有重要作用,为进一步研究牦牛IMPDH基因功能奠定基础。
牦牛;克隆;IMPDH;序列分析;差异表达
牦牛(Bosgrunniens) 是一个特有且珍贵的畜种,主要分布于青藏高原及其毗邻地区,中国约占世界牦牛总数的95%[1]。在长期的人工选择和自然选择作用下,牦牛对高寒草地生态环境具有较强的适应能力,能在严寒、低氧、强紫外线辐射的恶劣环境条件下生存和繁衍后代,成为当地牧民赖以生存的生产和生活资料,也是主要经济来源之一[2]。此外,牦牛是中国动物遗传资源中宝贵的基因库和珍稀的物种。但是牦牛存在生长速度慢、繁殖速率低、生产性能差,成为牦牛产业发展及生态保护的主要瓶颈之一[3]。加快牦牛的选育育种进程,解析繁殖机制,提高牦牛生产性能,对牦牛养殖业具有重要意义。因此,随着牦牛基因组测序工作的完成,开展牦牛生长发育、繁殖性能等方面的研究,有助于挖掘牦牛优良特性和促进民族地区发展[2]。
卵巢组织是决定哺乳动物繁殖效率的重要器官之一,主要生理功能包括合成相关的生殖激素与排出成熟的卵母细胞,而其功能的维持和发挥主要依赖于多种信使的传递和调控[4]。卵巢组织的生长发育和成熟是一个极其复杂的调控过程,除了需要具有较好发育能力的卵母细胞外,还需要许多信号分子的参与,如内分泌激素、免疫和代谢信号以及来自体细胞分泌的各种调控因子[5]。哺乳动物卵巢组织的生长发育主要经历四个阶段:发生期——主要发生于胎儿期,由原始生殖细胞分化形成初级卵原细胞,停滞于减数分裂前期,出生后不再产生新的卵母细胞;发展期——随着中枢神经系统-垂体-下丘脑-卵巢轴的形成,第一波优势卵泡进入排卵程序,随后逐渐成熟;成熟期——进入成年后每个周期有一个(单胎动物)优势卵泡发育成熟并排卵,整个卵泡发育过程中伴随大量卵泡的凋亡闭锁;衰退老化期——由于卵巢储备的不可再生性,生育能力逐渐下降,直至完全丧失生育能力[6]。卵巢的生长发育与排卵过程是受旁分泌、内分泌和自分泌等作用共同协调的。因此,利用现代分子生物学技术,从分子水平和基因水平等方面解析哺乳动物卵巢组织的生长发育和排卵过程,旨在为进一步理解卵巢发育和排卵过程的分子调控机制提供重要的理论基础,为动物繁殖的调控、家畜繁殖力的提高、濒危珍贵动物的拯救和卵巢功能老龄化疾病的治疗等提供新思路。
前期研究表明,次黄嘌呤核苷酸脱氧酶(IMPDH)在哺乳动物卵巢生长发育和卵母细胞减数分裂成熟中起重要作用[7]。IMPDH是生物嘌呤从头合成途径的关键酶,在NAD的环境下将次黄嘌呤核苷酸(IMP)氧化合成黄嘌呤核苷酸(XMP)。在硫唑嘌呤代谢过程中,IMPDH是催化生成鸟嘌呤核苷酸的限速酶,其活性与鸟嘌呤核苷酸浓度可能存在负相关[8]。此外,IMPDH是细胞内嘌呤代谢的活性物质,活性与细胞增殖、恶性转化相关,因此该酶可以作为治疗实体器官移植的潜在靶点[9]。IMPDH表型由IMPDH基因型决定。IMPDH有两种亚型:IMPDHⅠ和IMPDHⅡ,分别由位于染色体7和染色体3的基因 IMPDH1和 IMPDH2编码,具有84%的同源性,大小相似且分子质量均为56 ku,共由514个氨基酸残基组成[9]。在免疫激活的情况下,IMPDH基因表达明显上调[10]。IMPDHⅠ结构性表达于所有细胞,而IMPDHⅡ表达于部分细胞,与细胞的增殖和恶性转化有关[9, 11]。
目前关于IMPDH基因的研究主要集中在小鼠、猪、斑马鱼等动物[4,6,12],在牦牛上还未见报道。IMPDH在物种进化中相对保守,但也存在种间差异性。因此,本研究以牦牛卵巢组织为研究对象,采用RT-PCR技术克隆得到IMPDH基因序列,运用生物信息学软件对牦牛IMPDH基因特征进行分析,利用实时定量RT-PCR检测IMPDH基因在不同发育阶段的牦牛卵巢组织中的表达差异,利用荧光定量qRT-PCR分析IMPDH基因在成年空怀牦牛卵巢组织不同活动期的表达。研究结果为探讨IMPDH基因在牦牛卵巢组织的生长发育和排卵机制中的生物学作用提供重要的理论依据,为建立有效可靠的分子遗传标记等奠定基础,对改善牦牛的遗传资源和繁殖技术具有重要的参考价值。
1 材料与方法
1.1 主要试剂与仪器
TRIZOL试剂购自Invitrogen公司,反转录试剂盒购自Ferments公司;TaqDNA聚合酶购自天根公司; pMD-20T载体和2×SYBR Green premix购自TAKARA公司;感受态DH5ɑ和DNA片段回收纯化试剂盒购自AXYGEN公司;荧光定量PCR仪、普通PCR仪、电泳仪、琼脂糖凝胶成像系统均购自美国Bio-Rad公司;高速冷冻离心机购自Eppendorf公司;引物由生工生物工程上海(股份)有限公司合成。
1.2 试验动物
牦牛组织样品均采集于四川成都青白江区屠宰场,试验动物为健康的空怀期成年母牦牛,屠宰后以牙齿和年轮为依据,分别采集2岁、3岁和6岁的卵巢组织。此外,以胎牛臂长为依据,分别采集3月龄、6月龄和9月龄的胎牛卵巢组织。所有样品经过PBS清洗后迅速放入液氮罐中带回实验室,保存,备用。
1.3 总RNA的提取及反转录
利用Trizol试剂盒提取卵巢组织样本的总RNA。并用RNase-free的DNaseⅠ处理,以去除DNA污染。RNA的质量和含量通过Nanodrop ND-1000检测吸光度A260 nm/A280 nm进行判定,完整性通过15 g/L琼脂糖凝胶电泳进行检测。取2 μL(1 g/L)RNA,0.5 μL M-MLV反转录酶,0.5 μL oligo(dT)18,2 μL Buffer,及ddH2O加至10 μL,反转录成cDNA。
1.4 牦牛IMPDH基因的克隆与测序
以牦牛卵巢组织cDNA为模板,引物为IMPDH-p(表1),扩增体系为25 μL,预期扩增片段为1 623 bp。反应条件:94 ℃预变性5 min;94 ℃变性1 min,57 ℃退火1 min,72 ℃延伸45 s,35个循环,72 ℃延伸7 min。所有PCR产物经10 g/L琼脂糖凝胶电泳观察扩增结果,用Axygen的凝胶回收试剂盒回收纯化PCR产物,取适量纯化的PCR产物与克隆载体pMD-20T进行连接,转化DH5a感受态细胞,至少挑取3个阳性克隆。经过PCR鉴定后,将阳性克隆送往生工生物工程上海(股份)有限公司进行测序。
1.5 牦牛IMPDH基因生物信息学分析
采用ORF Finder在线程序确定牦牛IMPDH基因开放阅读框;利用MEGA和DNAMAN 6.0软件进行序列同源性分析、构建系统进化树;NCBI预测基因生物功能结构(http://www.ncbi.nlm.nih.gov/structure/cdd/wrpsb.cgi);利用在线软件ExPASy分析根据基因序列推导的蛋白质序列的等电点和分子质量等理化性质;利用Interpro在线预测网站预测蛋白质的结构域和功能位点;应用Hopfield和SWISSMODEL软件分别预测二级和三级结构。
1.6 实时定量RT-PCR检测IMPDH基因在不同发育阶段牦牛卵巢组织中的表达
采用实时定量RT-PCR检测IMPDH基因在不同发育阶段牦牛胎儿卵巢及成年卵巢组织中的表达情况。取不同时期胎儿卵巢(3月龄、6月龄和9月龄)和不同年龄的成年空怀卵泡期牦牛卵巢(2、3和6周岁)组织。总RNA的提取及反转录同“1.3”,IMPDH和GAPDH基因PCR扩增体系为25 μL,反应条件:2×TaqMaster Mix 12.5 μL,IMPDH-q和GAPDH-q上、下游引物(10 μmol/L)各1 μL,cDNA 1 μL,ddH2O加至25 μL。反应条件94 ℃ 5 min;94 ℃ 30 s;55 ℃ 30 s;72 ℃ 30 s;35个循环;72 ℃再延伸5 min。25 g/L琼脂糖凝胶电泳检测扩增产物。
1.7 qRT-PCR定量分析IMPDH基因在卵巢活动中的表达
以IMPDH为研究对象,以管家基因GAPDH为内参分析目的基因的相对表达水平。采用SYBR Green Ⅱ荧光定量qRT-PCR分析成年空怀母牛卵巢活动中的IMPDH基因mRNA相对表达丰度。所有反应均重复3次,20 μL反应体系:10 μL 2×SYBR Green premix,上、下游引物各0.8 μL (10 pmol/mL),模板2 μL 以及ddH2O 6.4 μL。反应条件为95 μC 30 s;95 μL 10 s;55 ℃ 10 s,72 ℃ 10 s,共40个循环。65~95 ℃每隔 0.5 ℃读板1次,绘制扩增和熔解曲线。分析各基因的熔解曲线并电泳鉴定PCR产物。结果采用2-△△Ct 法进行相对定量分析目的基因mRNA表达水平。
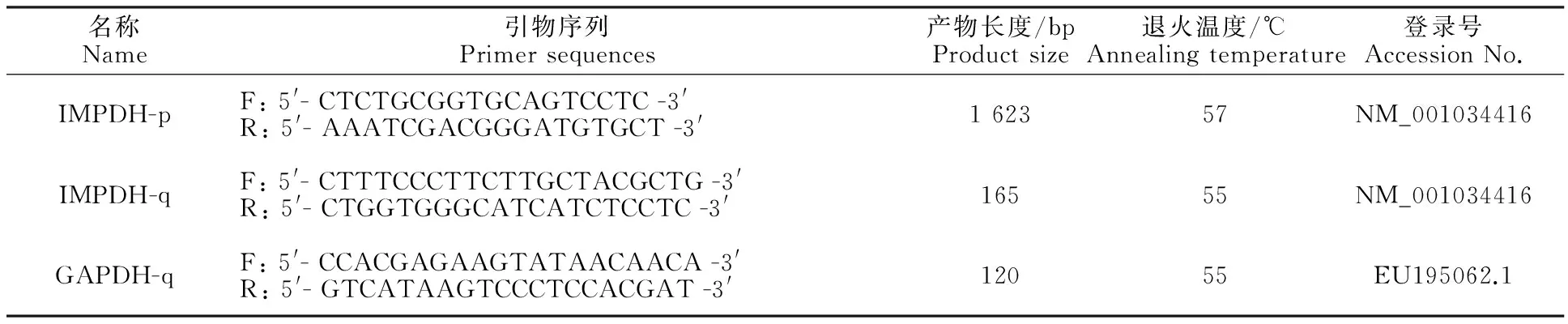
表1 引物序列及PCR反应条件Table 1 Primer sequences and PCR reaction conditions
注:p代表RT-PCR,q代表qRT-PCR;F为正义链引物,R为反义链引物。
Note: p and q represent RT-PCR and qRT-PCR, respectively; F and R represent forward and reverse primer, respectively.
1.8 统计与分析
所有组别的试验都至少重复3次。采用SPSS 19.0软件分析试验数据。mRNA相对表达丰度等采用ANOVA方差分析和Tukey’s LSD检验,所有结果当P<0.05时认为差异显著,当P<0.01时认为差异极显著。数据均采用“平均值±标准误”(mean ± SEM)表示。
2 结果与分析
2.1 牦牛IMPDH基因序列特征
经琼脂糖凝胶电泳检测,PCR扩增得到与预期大小一致的片段(图1)。进一步测序验证得到1 623 bp的牦牛IMPDH基因序列,其中ORF为1 545 bp,编码514个氨基酸残基。通过软件比对分析发现,牦牛IMPDH基因与野牦牛(XM_005909361.2)有7个碱基的差异,依次为第35位T→C、第46位C→T、第898位A→C、第1064位G→T、第1283位T→C、第1532位G→A和第1538位T→G,最终导致7个氨基酸发生突变。牦牛IMPDH的理论等电点分别为5.69,分子质量约为55.7 ku。

M.DNA相对分子质量标准DL2000 DNA marker DL2000; 1.空白对照组 Negative control; 2~4.PCR扩增产物 PCR amplification product
图1 牦牛卵巢组织中IMPDH基因的RT-PCR结果
Fig.1 RT-PCR amplification ofIMPDHgene from yak ovary
2.2IMPDH基因结构与功能分析
研究结果显示,牦牛IMPDH基因与野牦牛具有很高的同源性(99.4%),其次为黄牛(99.0%) (表2)。进化树显示,牦牛IMPDH基因在进化过程中较为保守,DNAMAN和MEGA软件分析结果显示,牦牛基因与野牦牛和黄牛的亲缘关系最为接近,位于同一进化分枝,与原鸡、斑马鱼等亲缘关系较远(图2)。ExPASy软件对牦牛IMPDH的亲疏水性预测结果显示最小亲水指数-2.833,最大亲水指数2.722,该基因编码的蛋白质为亲水性蛋白质。膜结构域分析结果显示,IMPDH编码的蛋白无跨膜结构。二级结构预测结果显示,牦牛IMPDH中存在41.83%α-螺旋,12.45%β-折叠,28.99% 无规则卷曲等结构(图3)。三级结构预测结果进一步验证二级结构的预测(图4)。
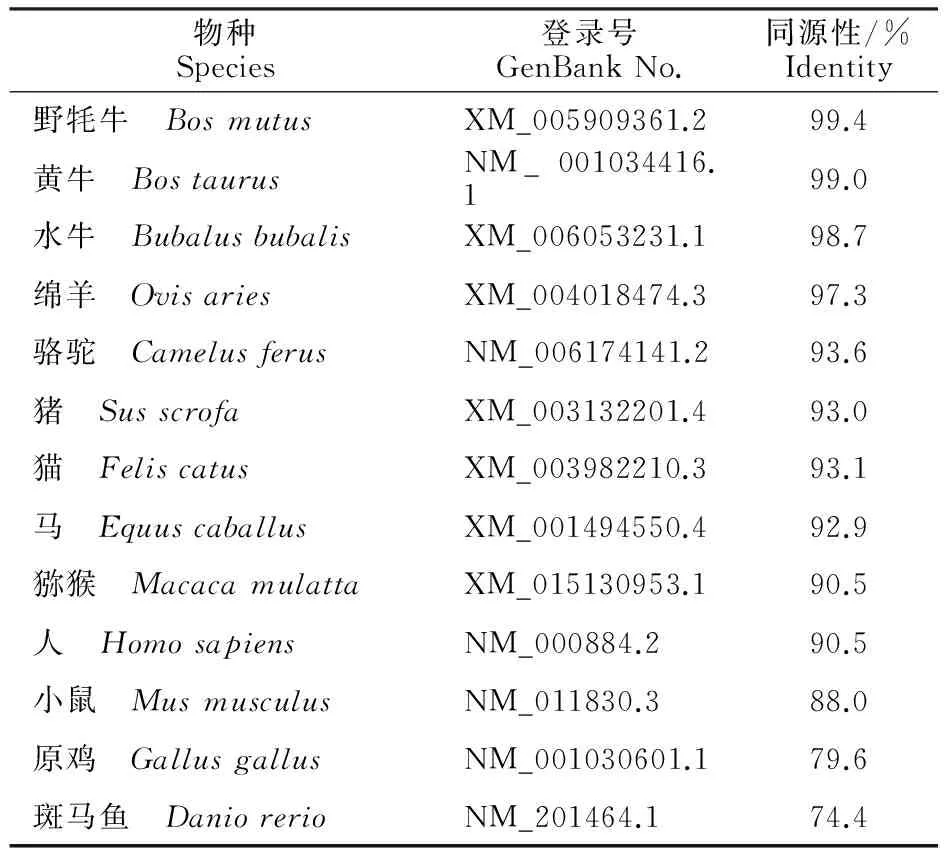
表2 牦牛和其他物种间IMPDH基因序列同源性分析Table 2 Homologous of nucleotide of yak IMPDH gene with other species
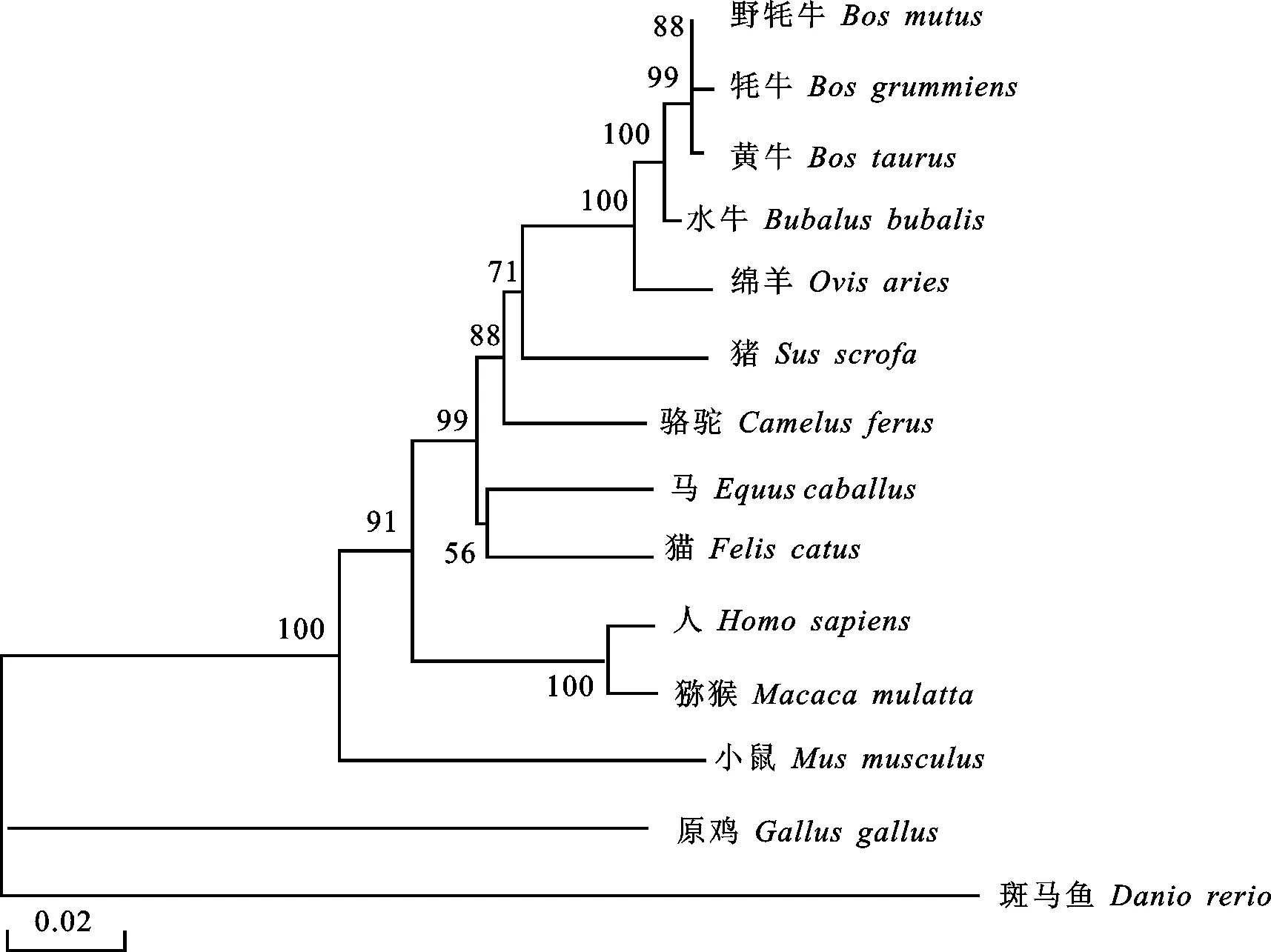
图2 牦牛IMPDH进化树分析Fig.2 Yak IMPDH evolutionary tree analysis
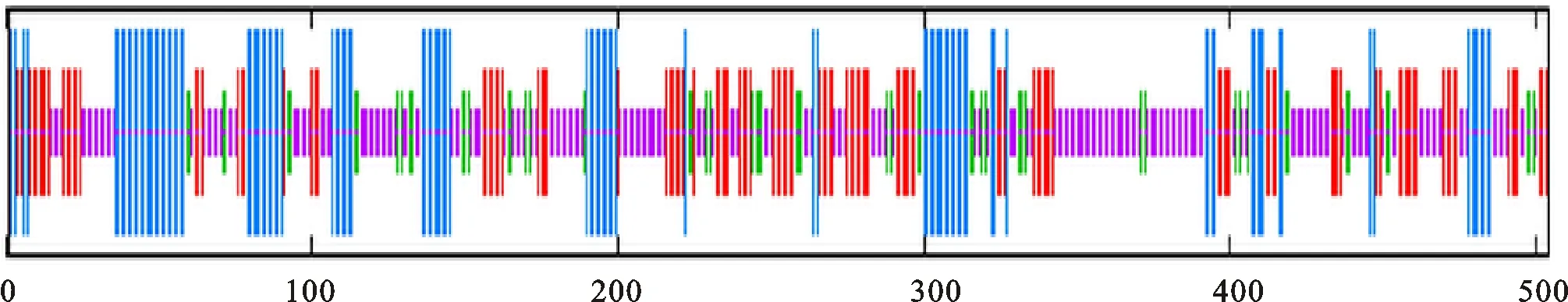
图中蓝色线代表α-螺旋 Blue lines representα-helix,绿色线代表β-折叠 Green lines representβ-sheet,紫色线代表无规则卷曲 Purple lines represent random coil,红色线代表延伸链 Red lines represent extended strand
图3 牦牛IMPDH氨基酸序列二级结构预测
Fig.3 Predicted secondary structure of amino acid sequence of yak IMPDH

图4 牦牛IMPDH氨基酸序列三级结构预测Fig.4 Predicted tertiary structure of amino acid sequence of yak IMPDH
2.3IMPDH基因的时序表达谱
实时定量RT-PCR结果显示,IMPDH基因在牦牛卵巢组织的表达丰度随牦牛胎龄和年龄的增长呈上升趋势,成年后空怀的牦牛表达显著高于胎儿期(图5),但是3岁和6岁牦牛间差异不显著。2.4IMPDH基因在牦牛卵巢活动中的表达
为进一步研究IMPDH基因在卵巢活动中的表达情况,以GAPDH为参照进行实时荧光定量分析。荧光定量的扩增曲线和熔解曲线见图6。结果表明,IMPDH在牦牛卵泡期卵巢中表达量显著高于排卵后的红体形成期及黄体形成期(P<0.05),其中在牦牛红体形成期的卵巢组织中表达量最低,与卵泡期卵巢组织中IMPDH的表达差异极显著(P<0.01)。
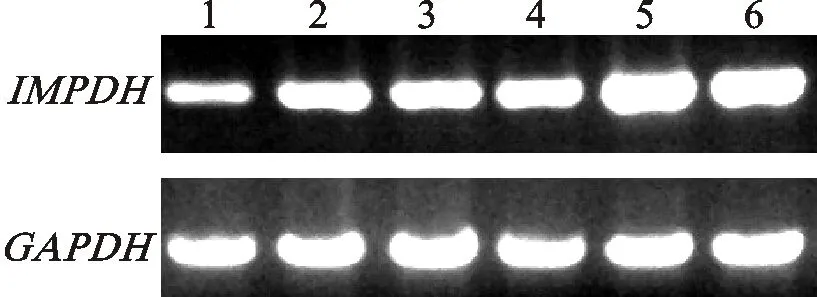
1~3泳道依次为3月龄、6月龄和9月龄胎牛, 4~6泳道依次为2岁、3岁和6岁成年牛卵巢组织 Line 1-3 represents ovaries of 3-month, 6-month and 9-month yak fetal, line 4-6 represents the ovaries of 2-year, 3-year and 6-year of adult yak, respectively
图5 RT-PCR检测不同发育阶段牦牛卵巢IMPDHmRNA表达量
Fig.5 RT-PCR analysis of yakIMPDHmRNA expression in yak fetal and adults ovaries of different developmental stages
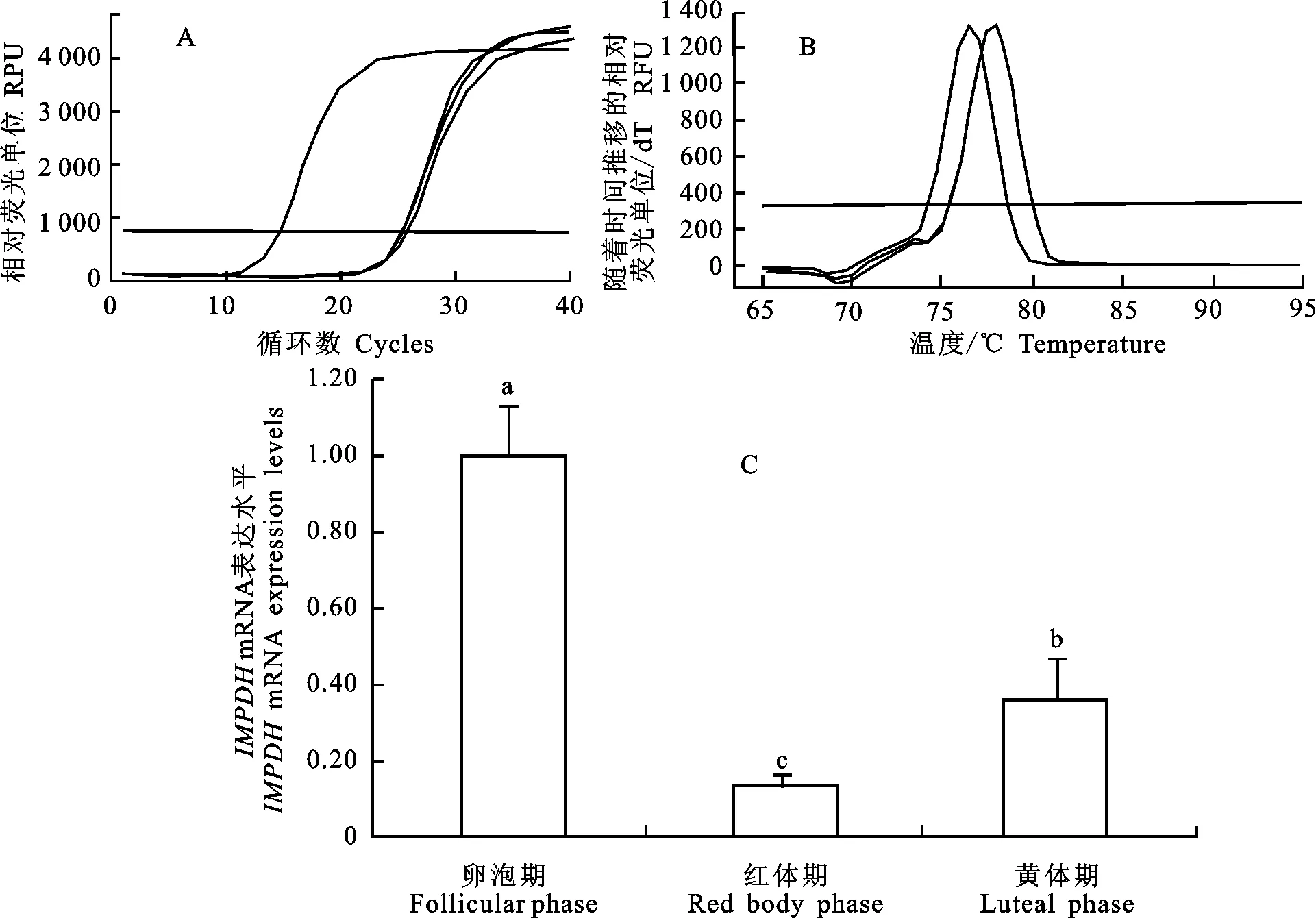
A.扩增曲线,B.熔解曲线,C.表达水平柱状图,不同字母(a-c)表示差异显著(P<0.05) A, B and C represent amplification curve, melting curve and histogram of expression, respectively; different letters show significant difference (P<0.05)
图6 牦牛IMPDH基因的qRT-PCR结果
Fig.6 qRT-PCR results ofIMPDHgene from yak ovary
3 讨 论
IMPDH是生物体内嘌呤核苷酸的从头生物合成途径的关键酶,被认为是癌症抑制剂的靶点[13],其在进化进程中相对保守。目前已报道的IMPDH有两种亚型,其中Ⅱ型最先是从肿瘤细胞中诱导出来的,通过对其晶体结构的分析,其后又分别在大鼠、三毛滴虫、肺炎链球菌和疏螺旋体中分离出来[9,14]。IMPDH通常以四聚体形式存在,是GTP经典合成途径的限速酶;这一反应依赖于NAD+的参加,对细胞增殖分化的影响十分重要[15]。IMPDH限制鸟嘌呤核苷酸的生物合成,且可阻断细胞功能,如DNA复制、RNA合成、和信号转导。这些效应伴有细胞周期中断、细胞分化和凋亡的诱导等[16]。IMPDH蛋白氨基酸序列存在较大的差异,但在哺乳动物中保守性较高[17],如人和鼠的同源性可达89%,但在细菌之间却存在较小的同源性仅为23%,本试验亦证实这种差异性。
IMPDH参与繁殖调控、卵泡发育及胚胎着床等生物学过程。IMPDH的研究主要集中在植物[18]、细菌[19]和癌症细胞上[20],关于IMPDH在哺乳动物卵巢组织中的资料报道较少。本研究以牦牛为研究对象,结果显示IMPDH在哺乳动物卵巢组织中表达,且在卵泡期表达量最高,表明IMPDH对卵泡生长发育有一定影响,可能与卵母细胞发育和排卵有关。雌性动物的繁殖能力主要取决于卵巢组织及其卵泡的协同发育。卵巢组织的生长发育与成熟是一个动态过程。成年雌性动物的每一个发情周期都需经历卵泡发育、红体及黄体的形成与退化的过程。这个过程由垂体、下丘脑、卵巢以及体细胞共同产生的许多生长因子和激素共同参与,形成复杂的调控网络。IMPDH通过从头合成途径对卵细胞的生长发育和成熟起重要作用,并可通过调节卵巢功能参与排卵、早期胚胎发育和胚泡着床等过程[21]。因此研究牦牛繁殖活动中IMPDH基因的表达,对研究其在卵泡生长发育过程中的作用具有重要意义。
IMPDH对卵巢的排卵及卵母细胞减数分裂阻滞具有重要作用。哺乳动物卵巢组织上存在数百万个各级卵泡,但在卵泡生长发育过程中,只有少量卵泡可以发育成熟并排卵,其余大部分卵泡都将闭锁退化。多数动物胎儿的原始卵泡、初级卵泡闭锁主要是由卵母细胞内cGMP水平引起的[4]。cGMP是由是由卵丘细胞以及卵泡壁颗粒细胞两者共同产生[22]。主要是通过卵泡壁颗粒细胞的利钠尿肽受体2(NPR2)将GTP转化为cGMP,从而抑制PDE3A的活性,导致卵母细胞减数分裂阻滞[4,22]。而GTP又是由从肌苷一磷酸(IMP)在IMPDH酶作用下,经一系列的生物合成反应产生的。IMP是从嘌呤代谢途径和HPRT补救途径,最终将次黄嘌呤转化而来。研究发现,在小鼠卵母细胞复合体中的IMP的主要来源是从头合成途径[21]。IMPDH在卵母细胞减数分裂阻滞中起相当重要作用,前期研究发现使用IMPDH抑制剂咪唑立宾和霉酚酸能诱导小鼠性早熟以及恢复卵母细胞减数分裂[23-24]。可能是由于这些抑制剂扰乱减数分裂进展和排卵的协调作用,从而影响卵母细胞的质量和生殖力[24]。这些结果表明,IMPDH具有维持卵母细胞减数分裂阻滞的功能,推测是通过调控鸟苷酸环化酶的活性影响cGMP的产生。因此,有关IMPDH调控卵巢及其卵母细胞维持减数分裂阻滞作用机制有待进一步深入研究。
本研究中,通过初步分析IMPDH基因在牦牛卵巢生长发育过程及繁殖周期中的表达情况,为研究IMPDH在卵泡发育和排卵机制奠定基础。前期大量研究表明IMPDH是一种与雌性哺乳动物生殖过程密切相关的生物酶[7]。本研究结果表明,IMPDH参与牦牛卵巢的发育,并在卵巢活动过程中有明显的表达规律,初步推测IMPDH在牦牛排卵、胚胎发育、胚胎着床及着床后的发育过程中起重要的调节作用。此外,可能与牦牛的低繁殖率与自然流产之间存在密切的关系[25]。然而,其作用机理目前尚不完全清楚,有必要进行深入的研究。是否由于IMPDH基因调控卵巢的发育和卵泡的形成,而间接性的调控牦牛繁殖性能还有待进一步挖掘。
4 结 论
本研究利用RT-PCR成功克隆牦牛IMPDH基因CDS序列,并发现该基因在卵巢组织中呈规律性表达。由此表明,IMPDH基因参与牦牛卵巢组织的生长发育及发情周期中卵巢的活动,为解析牦牛卵巢组织的生长发育及性激素分泌等重要生殖活动的分子机理提供新的依据,为研究IMPDH在卵泡发育与排卵中的作用机制奠定基础。
Reference:
[1] WIENER G,HAN J L,LONG R J.The Yak [M].2nd edition.FAO Regional Office for Asia and the Pacific,2003.
[2] QIU Q,ZHANG G J,MA T,etal.The yak genome and adaptation to life at high altitude [J].NatureGenetics,2012,44(8):946-949.
[3] XIONG X R,LI J,FU M,etal.Oocyte extract improves epigenetic reprogramming of yak fibroblast cells and cloned embryo development [J].Theriogenology,2013,79(3):462-469.
[4] ZHANG M J,SU Y Q,SUGIURA K,etal.Granulosa cell ligand NPPC and its receptor NPR2 maintain meiotic arrest in mouse oocytes [J].Science,2010,330(6002):366-369.
[5] BURKS D J,DE MORA,J F,SCHUBERT M,etal.IRS-2 pathways integrate female reproduction and energy homeostasis [J].Nature,2000,407(6802):377-482.
[6] DAS D,NATH P,PAL S,etal.Expression of two insulin receptor subtypes,insra and insrb,in zebrafish(Daniorerio) ovary and involvement of insulin action in ovarian function [J].GeneralandComparativeEndocrinology,2016,239(27):21-31.
[7] WIGGLESWORTH K,LEE K B,O’BRIEN M J,etal.Bidirectional communication between oocytes and ovarian follicular somatic cells is required for meiotic arrest of mammalian oocytes [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2013,110(39): E3723-E3729.
[8] ASADA A,NISHIDA A,SHIOYA M,etal.NUDT15 R139C-related thiopurine leukocytopenia is mediated by 6-thioguanine nucleotide-independent mechanism in Japanese patients with inflammatory bowel disease [J].JournalofGastroenterology,2016,51(1):22-29.
[9] SARA B,HELGE R,STEIN B.Real-time PCR determination of IMPDHl and IMPDH2 expression in blood cells [J].ClinicalChemistry,2007,53(6):1023-1029.
[10] JAIN J,ALMQUIST S J,FORD P J,etal.Regulation of inosine monophosphate typeⅠ and typeⅡ isoforms in human lymphocytes [J].BiochemicalPharmacology,2004,67(4):767-776.
[11] LOONEY R J,ANOLIK J,SANZ I.B cells as therapeutic targets for rheumatic diseases [J].CurrentOpinioninRheumatology,2004,16(3):180-185.
[12] ZHOU J M,ZHANG X H,HE K W,etal.Characterization and proteome analysis of Inosine 5-monophosphate dehydrogenase in epidemic streptococcus suis serotype 2 [J].CurrentMicrobiology,2014,68(5):663-669.
[13] BAIRAGYA H R,MUKHOPADHYAY B P,SEKAR K.An insight to the dynamics of conserved water molecular triad in IMPDH Ⅱ (human):recognition of cofactor and substrate to catalytic Arg 322 [J].JournalofBiomolecularStructure&Dynamics,2009,27(2):149-158.
[14] GOLDSTEIN B M,COLBY T D.IMP dehydrogenase:structural aspects of inhibitor binding [J].CurrentMedicinalChemistry,1999,6(6):519-536.
[15] COLBY T D.VANDERVEEN K,STRICKLER M D,etal.Crystal structure of human type Ⅱ inosine monophosphate dehydrogenase:implication of ligand binding and drug design [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,1999,96(7):3531-3536.
[16] PITALUGA A N,MOREIRA M E C,TRAUB-CSEK Y M.A putative role for inosine 5′ monophosphate dehydrogenase (IMPDH) inLeishmaniaamazonensisprogrammed cell death [J].ExperimentalParasitology,2015,149:32-38.
[17] COLLART F R,HUBERMAN E.Cloning and sequence analysis of the human and Chinese hamster inosine-5-monophosphate dehydrogenase cDNAs [J].JournalofBiologicalChemistry,1988,263(30):15769-15772.
[18] 周晨阳.肌苷-5′-单磷酸脱氢酶基因的克隆及与茶叶中咖啡因含量的关联分析[D].北京:中国农业科学院,2012.
ZHOU C Y.Molecular cloning of inosine-5′-monophosphate dehydrogenase gene and association analysis of the gene with caffeine content in tea plant [D].Beijing:Chinese Academy of Agricultural Sciences,2012(in Chinese with English abstract).
[19] 张雪寒,何孔旺,周俊明,等.猪链球菌2型次黄嘌呤核苷酸脱氢酶缺失株的构建[J].中国农业科学,2009,42(5):1789-1796.
ZHANG X H,HE K W,ZHOU J M,etal.Construction and identification ofStreptococcussuistype 2 deficient in IMPDH expression [J].ScientiaAgriculturaSinica,2009,42(5):1789-1796(in Chinese with English abstract).
[20] KIM H R,ROE J S,LEE J E,etal.A p53-inducible microRNA-34a downregulates Ras signaling by targeting IMPDH [J].Biochemical&BiophysicalResearchCommunications,2012,418(4):682-688.
[21] DOWNS S M.High performance liquid chromatography analysis of hypoxanthine metabolism in mouse oocyte-cumulus cell complexes:Effects of purine metabolic perturbants [J].BiologyofReproduction,1994,50(6):1403-1412.
[22] ROBINSON J W,ZHANG M J,SHUHAIBAR L C,etal.Luteinizing hormone reduces the activity of the NPR2 guanylyl cyclase in mouse ovarian follicles,contributing to the cyclic GMP decrease that promotes resumption of meiosis in oocytes [J].DevelopmentalBiology,2012,366(2):308-316.
[23] Pedro M,Mattia G,Tomas T,etal.Recent advances on the enantioselective synthesis of C-nucleosides inhibitors of inosine monophosphate dehydrogenase (IMPDH) [J].CurrentTopicsinMedicinalChemistry,2014,14(10):1212-1224.
[24] DOWNS S M.Induction of meiotic maturation in vivo in the mouse by IMP dehydrogenase inhibitors:effects on the developmental capacity of ova [J].MolecularReproduction&Development,1994,38(3):293-302.
[25] FULWILER A L,BOITZ J M,GILROY C,etal.IMP dehydrogenase deficiency in Leishmania donovani causes a restrictive growth phenotype in promastigotes but is not essential for infection in mice [J].Molecular&BiochemicalParasitology, 2011,180(2):123-126.
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
Cloning, Bioinformatics Analysis and Differential Expression ofIMPDHGene in Yak Ovary at Different Stages
XIONG Xianrong1, LAN Daoliang2, HU Jiajia1, LI Jian1and ZI Xiangdong1
(1.College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China; 2.Institute of Qinghai-Tibetan Plateau Research, Southwest University for Nationalities, Chengdu 610041, China)
The aim of this study is to obtain the information about sequence structure and bioinformatics analysis of yakIMPDHgene, analysis of sequential expression in ovarian tissue. It could provide information for further study of mechanism of ovarian development and ovulation. Yak IMPDH cDNA was cloned using reverse transcription polymerase chain reaction (RT-PCR), the sequences characteristics were analyzed, andIMPDHgene expression in ovary were examined by real time fluorescence quantitative PCR (qRT-PCR) at different stages of development and reproductive cycle. The study obtained a complete cDNA sequences of 1 623 bp ofIMPDHgene of yak with a deduced protein, which were consisted of 514 amino acids that are highly homologous with other species.The sequence similarity of IMPDH between yak and wild yak was 99.4%, this indicated thatIMPDHgene was conservative during evolution. The result of RT-PCR indicated that the expression of yak IMPDH increased with the increase of age. TheIMPDHgene in ovarian follicular phase was the strongest expression at other stages, and significantly higher than that of the red body phase.These results suggested thatIMPDHgene was probably related to the ovarian development, and there was a significantly expressed pattern during ovarian activity. These indicated that IMPDH played an important role during the reproductive cycle, and made a foundation for the further study of the function ofIMPDHgene in yak.
Yak;Cloning;IMPDH; Sequence analysis; Differential expression
2016-07-28 Returned 2016-09-26
The Sichuan Provincial Science and Technology Program(No.2014NZ0114);the Fundamental Research Funds for the Central Universities of Southwest Minzu University(No.2016NZYQN38).
XIONG Xianrong, male,master student.Research area:breeding and embryo engineering of yak.E-mail:xianrongxiong@163.com
LI Jian, male, professor. Research area: animal reproductive endocrine and embryo engineering.E-mail:jianli_1967@163.com
日期:2017-06-05
2016-07-28
2016-09-26
四川省科技支撑计划(2014NZ0114);西南民族大学中央高校基本科研业务费专项资金(2016NZYQN38)。 第一作者:熊显荣,男,硕士,从事牦牛繁殖与胚胎工程研究。E-mail: xianrongxiong@163.com 通信作者:李 键,教授,博士生导师,主要从事动物生殖内分泌和胚胎工程研究。E-mail: jianli_1967@163.com
S829.9
A
1004-1389(2017)06-0812-08
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170605.1714.004.html

