小鼠暴露式气管注射给药方式探索及对照组设置
王怒静,彭传鹏,郑爽,周玲萍,徐红蕾
(1.温州医科大学 第一临床医学院,浙江 温州 325035;2.温州医科大学附属第一医院 呼吸内科,浙江 温州 325015)
小鼠暴露式气管注射给药方式探索及对照组设置
王怒静1,彭传鹏1,郑爽1,周玲萍2,徐红蕾2
(1.温州医科大学 第一临床医学院,浙江 温州 325035;2.温州医科大学附属第一医院 呼吸内科,浙江 温州 325015)
目的:探索能使药物基本均匀、稳定地分布于肺部的暴露式气管注射给药方法,并科学设置其对照组。方法:以美蓝代替药物,暴露成年健康小鼠(体质量18~30 g)气管,从干预措施、给药体位、速度、所需的客观药物体积及小鼠主观可耐受体积考虑,予暴露式气管注射。继而以小鼠(体质量20~24 g)为实验对象,以水溶性药物脂多糖(LPS)为例,按上述方法予LPS(2 mg/mL)及0.9%氯化钠溶液建立LPS组及NS组,于3、8、14 h时处死,正常组小鼠无干预,予同时处死,ELISA法检测支气管肺泡灌洗液(BALF)中单核细胞趋化蛋白1(MCP-1)水平,BALF中沉淀的细胞予瑞氏-姬姆萨染色计算中性粒细胞百分比(PMN%),肺组织行病理HE染色及细胞间黏附分子1(ICAM-1)免疫组织化学检测,测定肺组织湿重/干重比(W/D比)。结果:美蓝基本均匀、稳定地分布于小鼠各肺叶;与正常组比,LPS组BALF中的MCP-1水平在3、8 h时明显增加(P<0.05),随时间的推移BALF中PMN%逐渐增加,肺组织炎症改变明显,ICAM-1表达明显增加,W/D比明显增加(P<0.05);与正常组比,NS组仅BALF中的MCP-1水平、W/D比在3 h时明显升高(P<0.05),余时间点各检测指标差异均无统计学意义(P>0.05)。结论:可采用本研究方法对小鼠暴露式气管注射水溶性药物。当研究8 h内的肺脏变化时对照组宜予等量0.9%氯化钠溶液;≥8 h时,可以设正常组为对照组。
小鼠;气管注射;水溶性药物;对照组
肺部疾病的动物模型能模拟临床疾病的演变过程,经气管给药时药物与肺脏直接接触,由此构建的某些肺部疾病效果可以优于静脉或腹腔注射等其他间接的给药方式[1-2]。经气管给药又分为非暴露式给药(雾化给药、经咽喉气管插管滴入、鼻内滴入等)以及暴露式给药(暴露式气管注射给药等)。由于鼻内滴入时鼻腔黏附、不自主吞咽等因素的明显干扰,实际给药剂量难以控制,因此不优先选择。在雾化给药、经咽喉气管插管滴入、暴露式气管注射这3种气管给药途径中,雾化给药效果最好[3],其次是暴露式气管注射给药[4]。由于雾化装置未全面普及,简单、快捷、可视的暴露式气管注射给药成为了更多研究者的选择。然而,有2大缺陷制约着暴露式气管注射给药的流行:①给药体位、咳嗽反射等因素会影响药物在肺部的分布,从而导致肺部疾病模型的不稳定性;②不同的药物溶剂对肺脏的损伤性大小不一,当气管注射水溶性药物时,即使对照组予能被肺脏快速转运吸收的0.9%氯化钠溶液[5],过多的0.9%氯化钠溶液仍可能对肺部造成损害,因而多时间点动态研究时,不同于经静脉注射0.9%氯化钠溶液,此时严格的对照组应该是经气管注射0.9%氯化钠溶液后对应的相同几个时间点。
针对上述问题的存在,本研究试图摸索出一种暴露式气管注射给药方法使药物基本均匀、稳定地分布于肺部,继而以水溶性药物脂多糖(lipopolysaccharide,LPS)为例,按上述方法分别予LPS及0.9%氯化钠溶液建立LPS组及NS组,通过多时间点动态检测相应指标检验该方法造模的有效性,同时科学设置经暴露式气管注射水溶性药物的小鼠模型对照组,以达到节约实验动物资源、科研试剂及人力资源的目的。
1 材料和方法
1.1 材料
1.1.1 实验动物:健康成年Balb/c小鼠30只(清洁级,体质量18~30 g),健康雄性Balb/c小鼠42只(SPF级,体质量20~24 g),均购自上海斯莱克实验动物有限责任公司,饲养于温州医科大学实验动物中心层流架。动物合格证号:SCXK(沪)2012-0002。
1.1.2 主要试剂:LPS(L2880,美国Sigma公司);小鼠单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)ELISA试剂盒(DKW12-2739,上海达科为生物技术有限公司);快速瑞氏-姬姆萨复合染色液(D010,南京建成生物工程研究所);兔抗小鼠细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)抗体(PB0054,武汉博士德生物工程有限公司)。
1.2 方法
1.2.1 暴露式气管给药:以30只健康成年Balb/c小鼠为实验对象,以美蓝为可视性药物,参考小鼠暴露式气管给药的相关文献[6],综合考虑干预措施、给药体位、速度、所需的客观药物体积与小鼠主观可耐受体积这些可能影响肺组织药物分布的因素,具体造模方法如下:小鼠适度麻醉后仰卧头上位固定于45°斜面,丝线经门牙固定颈部使其过伸位,暴露气管,药物总体积(μL)=5×体质量(g);药物均分4份,用药物润洗过的1 mL注射器每次预先吸入300 μL空气后吸取一份药物,经环甲膜刺入气管0.5~1 cm后缓慢注射药物,紧接着快速注入预先吸入的空气,以及重复吸取800 μL空气快速注入,间隔1 min后继续第2份药物注射,直至4份药物注射完成后体位保持20 min。过量麻醉处死,观察药物在肺脏的分布情况。
1.2.2 分组:42只健康雄性Balb/c小鼠随机分为正常组(6只)、LPS组(18只)和NS组(18只)。正常组不接受任何损伤性处理,随机时间处死;LPS组(LPS,2 mg/mL)和NS组(0.9%氯化钠溶液),采用上述给药方式,分别于给药后3、8、14 h过量麻醉处死,每次处死6只。
1.2.3 标本采集和指标检测:开胸腔,取4 ℃ 0.9%氯化钠溶液400 μL分2次灌洗左肺,每次反复回吸6次后,回收支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)(回收率大于80%),4 ℃保存,2 h内离心(4 ℃,1 500 r/min,10 min)后取上清液-80 ℃保存,ELISA法测MCP-1水平,BALF中沉淀的细胞于30 μL 0.9%氯化钠溶液中重悬,尽快行瑞氏-姬姆萨染色,计算中性粒细胞百分比(polymorphonuclear neutrophil percentage,PMN%);右肺上叶予病理HE染色,免疫组织化学法检测ICAM-1表达情况;余肺0.9%氯化钠溶液漂洗后放入铝纸内,称得净肺湿重(W),放60 ℃烘箱72 h后称得净肺干重(D),计算W/D比。
1.3 统计学处理方法 采用SPSS17.0统计软件进行数据分析。计量资料符合正态分布,以±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 给药结果 小鼠20 min内存活率为100%,药物基本均匀、稳定地分布于肺脏,见图1。
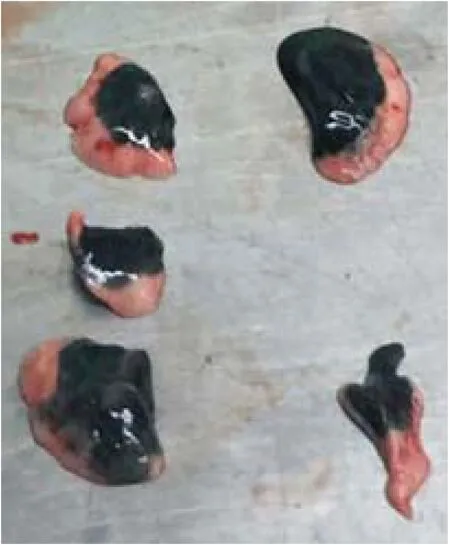
图1 药物在各肺叶的分布情况
2.2 BALF中MCP-1水平变化 与正常组比,NS组BALF中的MCP-1水平仅3 h时一过性明显升高(P<0.05),8 h及14 h时与正常组比较差异均无统计学意义(P>0.05)。与正常组比,LPS组BALF中的MCP-1水平在3 h时明显升高达到峰值(P>0.05),与NS组比差异无统计学意义(P>0.05),8 h时则明显高于NS组(P<0.05)。见表1。
表1 各组小鼠BALF中的MCP-1水平(n=6,±s,pg/mL)
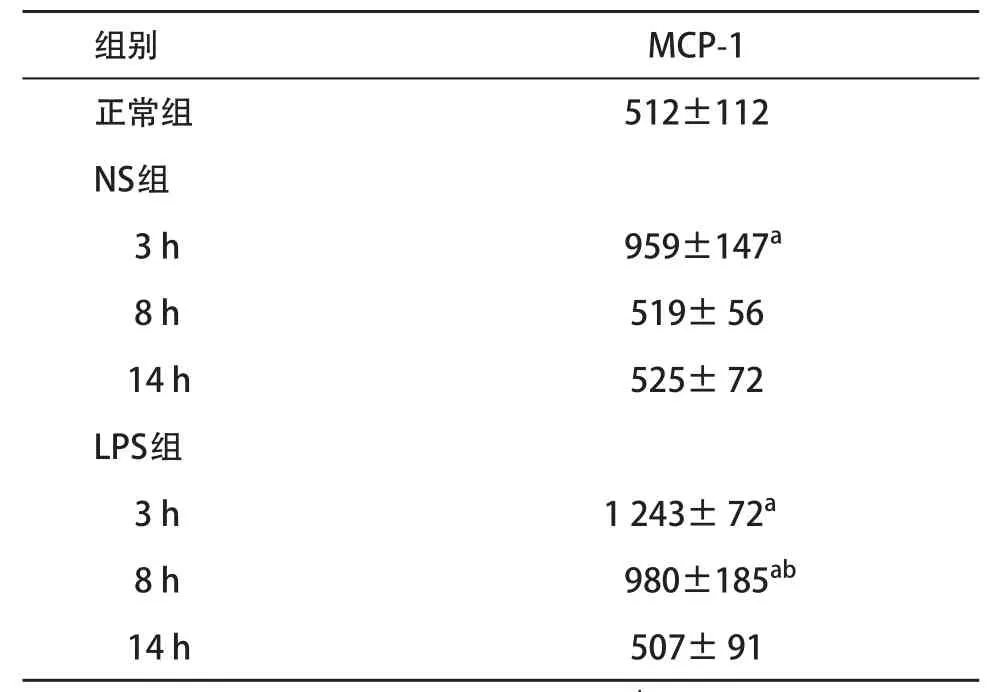
表1 各组小鼠BALF中的MCP-1水平(n=6,±s,pg/mL)
与正常组比:aP<0.05;与NS组相同时间点比:bP<0.05
组别MCP-1正常组512±112 NS组3 h959±147a8 h519± 56 14 h525± 72 LPS组3 h1 243± 72a8 h980±185ab14 h507± 91
2.3 BALF中PMN%变化 正常组与NS组BALF中的PMN%均稳定于低值水平(PMN%<5%),而且两者间比较差异无统计学意义(P>0.05);与NS组比,LPS组8、14 h时BALF中的PMN%分别为(54%±7%)和(71%± 13%),均明显升高(P<0.05)。见图2。
2.4 肺组织形态学变化 正常组肺泡结构完整,肺泡腔清晰,肺泡壁薄,毛细血管无明显充血,未见红细胞渗出,未见明显炎细胞浸润。与正常组比,NS组仅可见极轻度的肺泡壁血管充血;LPS组3 h时肺泡壁即轻度增厚,肺泡明显充血,可见间质炎细胞及红细胞轻度渗出,8、14 h时肺泡壁明显增厚,大量炎细胞及红细胞渗出于间质和肺泡腔。见图3。

图2 各组小鼠BALF中沉淀细胞的瑞氏-姬姆萨染色结果(×200)
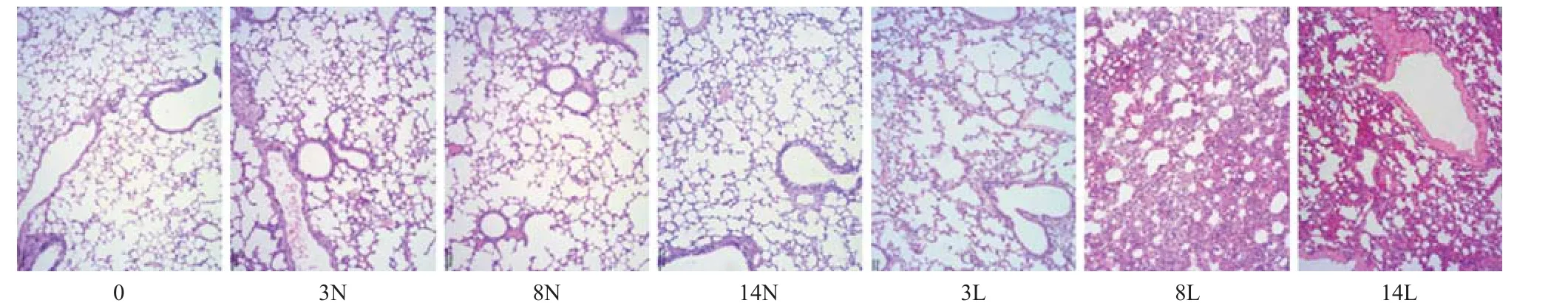
图3 各组小鼠的病理组织形态学变化(HE,×100)
2.5 免疫组织化学法检测肺组织ICAM-1表达 正常组与NS组的气管上皮细胞膜及血管内皮细胞膜膜呈现轻微特染的棕色,而LPS组随造模时间的延长上述部位特染的棕色明显加深。见图4。2.6 肺水肿情况 与正常组比,NS组W/D比仅3 h时升高(P<0.05),8 h及14 h的W/D比与正常组比较差异均无统计学意义(P>0.05)。与NS组比,LPS组3、8、14 h各时间点W/D比均升高(P<0.05),14 h时的W/D比达到峰值(P<0.05)。见表2。
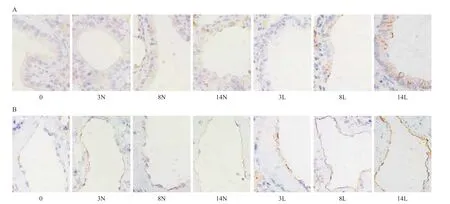
图4 免疫组织化学法检测各组小鼠肺组织的ICAM-1表达(×400)
表2 各组肺W/D比(n=6,±s)
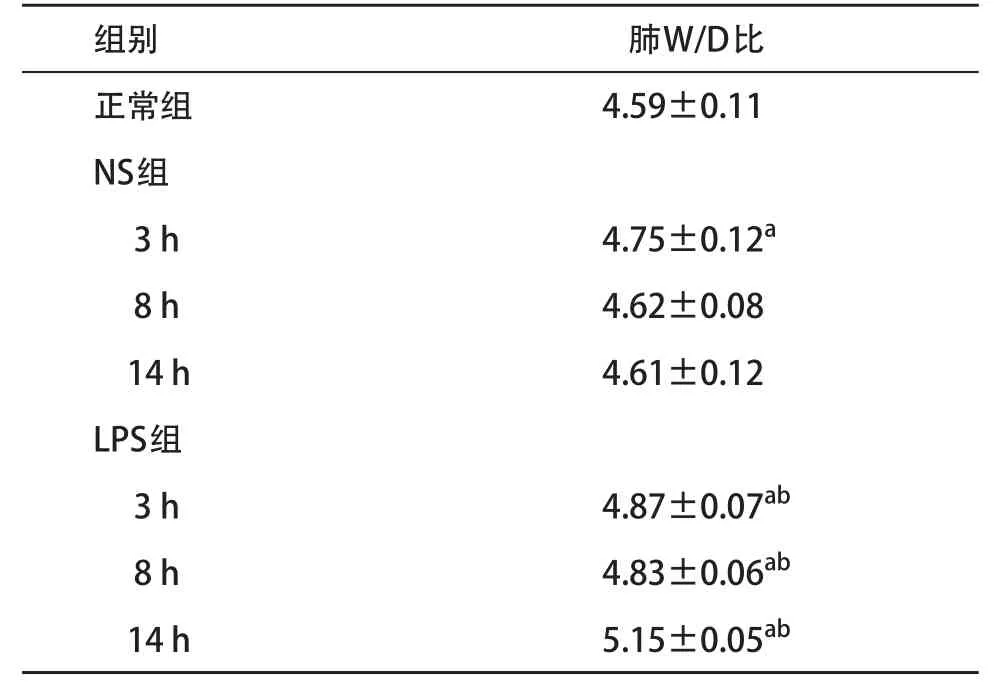
表2 各组肺W/D比(n=6,±s)
与正常组比:aP<0.05;与NS组相同时间点比:bP<0.05
组别肺W/D比正常组4.59±0.11 NS组3 h4.75±0.12a8 h4.62±0.08 14 h4.61±0.12 LPS组3 h4.87±0.07ab8 h4.83±0.06ab14 h5.15±0.05ab
3 讨论
近年来,暴露式气管注射给药的相关模型研究并不多见,但经气管插管滴注药物的研究有所进展。刘梅等[7]报道的小鼠改良式颈透视下气管内插管的给药方法中,由于小鼠颈部光源的照射,经口气管插管时可见光亮开合的声门,因此大大提高了插管的成功率;姜宝珍等[8]进一步通过暴露颈部气管及调节气管内导管的具体位置,实现了单侧左肺的精确药物滴注。然而,气管插管给药的成功不可避免都要经过较长的气管插管学习摸索阶段。
与气管插管和雾化给药相比,暴露式气管注射虽然有操作过程简便省时、造模设备简单易得的明显优势,但很多因素都能影响药物在肺脏分布的范围及稳定性。由于适度麻醉的小鼠既能耐受暴露气管的手术过程,经气管注射药物后又能促发明显的深快呼吸,而润洗注射器、采用移液枪移液或者进样针移液及注射均能提高给药体积的精确度。因此,本研究在适度麻醉、精确给药的前提下,通过严格控制干预措施、给药体位、给药速度、给药总体积及分次给药体积,使得小鼠生存率100%的同时,美蓝基本均匀稳定地分布在小鼠各肺叶,而LPS作用后的肺组织病理HE染色切片亦表明肺组织炎症改变全面而均匀。因此,本研究的暴露式气管注射方法保障了相关肺脏疾病模型的稳定性及成功率。但其不足之处有以下两点:①暴露式气管开放增加了感染的可能性,尤其是在反复多次气管给药的慢性肺部模型中;②滴注的药物在肺内的分布范围有其局限性,因此取材时应优先选择药物预期浸润最稳定的相同部位。
为了进一步科学设置对照组,本研究按照上述暴露式气管注射方法分别予以2 mg/mL的LPS及0.9%氯化钠溶液构建3、8、14 h的LPS组及NS组。MCP-1是炎症因子,能定向趋化单核细胞[9]、中性粒细胞[10]等多种炎细胞进入炎症部位;W/D比反映肺部水肿情况;ICAM-1既能介导肺内血管中活化的PMN牢固贴壁进而穿过血管内皮进入肺部[11],又能介导巨噬细胞[12]黏附于上皮细胞。与正常组相比,NS组肺组织病理炎症改变、ICAM-1表达水平以及BALF中的PMN%在各个时间点均无明显差别,而BALF中的MCP-1水平、W/D比在3 h时一过性明显增加。由于MCP-1主要由巨噬细胞及内皮细胞表达[13],因此本研究NS组BALF中早期明显增加的MCP-1可能是由于肺巨噬细胞受0.9%氯化钠溶液刺激而大量分泌所致,而NS组BALF中的MCP-1在8 h时已恢复至正常组水平,肺内的NS基本上已吸收转运完全,表明小鼠经本研究方法气管注射0.9%氯化钠溶液后无明显的肺脏炎症性损伤,但在短时间内(如3 h时)导致了BALF中一过性急剧增加的MCP-1水平以及可逆性肺水肿。
综上所述,可采用本研究方法对小鼠暴露式气管注射水溶性药物,当研究8 h内的肺脏变化时对照组宜予等量0.9%氯化钠溶液;≥8 h时,可以设正常组为对照组。
[1] 陈英华, 吕嘉文, 翟启良, 等. LPS直接及间接作用致小鼠急性肺损伤模型的建立[J]. 中国临床解剖学杂志, 2015, 33(4): 439-443.
[2] 黄建华, 李理, 袁伟峰, 等. 脂多糖经不同给药方式致急性肺损伤小鼠模型的比较研究[J]. 中国呼吸与危重监护杂志, 2013, 12(3): 264-268.
[3] 苑少欣, 孔雅娴, 李蕊, 等. 气管滴注法与雾化吸入法建立小鼠急性肺损伤模型及其效果比较[J]. 中华实验和临床感染病杂志(电子版), 2014, 8(2): 8-12.
[4] 苗雨丹, 董春玲, 刘玲, 等. 暴露式与非暴露式气管滴注方法建立小鼠急性肺损伤模型及其效果比较[J]. 吉林大学学报: 医学版, 2012, 38(3): 414-418.
[5] 李彬, 崔纪云, 龙成凤, 等. 肺泡上皮在肺液体平衡中的作用[J]. 国际呼吸杂志, 2007, 27(12): 916-918.
[6] 原铭贞, 高广媛, 李波, 等. 滴注空气在脂多糖诱导的小鼠急性肺损伤模型建立过程中的作用[J]. 吉林大学学报: 医学版, 2013, 39(6): 1089-1093.
[7] 刘梅, 李波, 汪隆旺, 等. 改良式小鼠颈透视下插管滴定脂多糖制备急性肺损伤模型的研究[J]. 中国医师杂志, 2012, 14(9): 1161-1164.
[8] 姜宝珍, 刘泽玉, 刘星, 等. 单侧肺精确滴注法制作小鼠单侧急性肺损伤模型的研究[J]. 安徽医科大学学报, 2016, 51(8): 1221-1224.
[9] XIAO M, ZHU T, ZHANG W, el al. Emodin ameliorates LPS-induced acute lung injury, involving the inactivation of NF-κB in mice[J]. Int J Mol Sci, 2014, 15(11): 19355-19368.
[10] AGGARWAL A, BAKER C S, EVANS T W, el al. G-CSF and IL-8 but not GM-CSF correlate with severity of pulmonary neutrophilia in acute respiratory distress syndrome [J]. Eur Respir J, 2000, 15(5): 895-901.
[11] WYMAN T H, BJORNSEN A J, ELZI D J, el al. A two-insult in vitro model of PMN-mediated pulmonary endothelial damage: requirements for adherence and chemokine release [J]. Am J Physiol Cell Physiol, 2002, 283(6): 1592-1603.
[12] MENG Y, CHEN C, TIAN C, el al. Angiotensin II-induced Egr-1 expression is suppressed by peroxisome proliferatoractivated receptor-γ ligand 15d-PGJ2 in macrophages[J]. Cell Physiol Biochem, 2015, 35(2): 689-698.
[13] BRUNS B, HONLE T, KELLERMANN P, el al. Divergent effects of neutrophils on Fas-induced pulmonary infl ammation, apoptosis, and lung damage[J]. Shock, 2017, 47(2):225-235.
(本文编辑:赵翠翠)
Instilling water-soluble drugs through the exposed trachea in mice and designing the control group
WANG Nujing1, PENG Chuanpeng1, ZHENG Shuang1, ZHOU Lingping2, XU Honglei2. 1.The First Clinical Medical College, Wenzhou Medical University, Wenzhou, 325035; 2.Department of Respiratory Medicine, the First Affi liated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective:To make water-soluble drugs instilled through the exposed trachea a stable and roughly equal distribution in the lungs of mice and to design the control group scientifi cally.Methods:Intervention measure, mouse position, instillment speed, minimum volume that requires and maximum volume that tolerates were all taken into consideration to make the distribution of the drug (Methlene Blue instead) in lung lobes in mice (weighting from 18 g to 30 g) stable and roughly equal. Then taking lipopolysaccharide (LPS) as example, the LPS group and normal saline (NS) group were treated with LPS (2 mg/mL) and normal saline (NS) respectively in the way above mentioned in mice weighting from 20 g to 24 g. The normal group was with no pretreatment. After modeling for 3 h, 8 h, 14 h, the level of monocyte chemoattractant protein-1 (MCP-1) in bronchoalveolar lavage fl uid (BALF) detected by enzyme-linked immunoabsorbent assay (ELISA), the polymorphonuclear neutrophil percentage (PMN%) in BALF tested with Wright-Giemsa stain, histopathological changes assayed by HE staining, the expression of intercellular adhesion molecule 1 (ICAM-1) assayed by immunohistochemical staining and the lung wet weight/dry weight ratio (W/D ratio) in lung tissue would be tested.Results:Using the process developed above, the distribution of Methlene Blue in lung lobes was stable and roughly equal. Compared with the normal group, the level of MCP-1 in BALF in the LPS group increased at 3 h, 8 h, and as time went by, the PMN% in BALF increased and histopathological changes appeared obvious, and both the expression level of ICAM-1 and the W/D ratio increased (P<0.05) in LPS group. Compared with the normal group, only the level of MCP-1 in BALF and the W/D ratio increased signifi cantly (P<0.05) in the NS group at 3 h, and all measurements had no difference at 8 h and 14 h.Conclusion:The process developed here to instill water-soluble drugs through exposed trachea is successful. The control group should be treated with NS for the same time if researching the lung changes within 8 h, or just the normal mice instead if at least 8 hours.
mice; intratracheal instillation; water-soluble drug; control group
R332
A
10.3969/j.issn.2095-9400.2017.06.003
2016-10-02
温州市科技局科研基金资助项目(Y20140680);浙江省卫生厅科研基金资助项目(2015RCB018);浙江省自然科学基金资助项目(LY12H01001)。
王怒静(1991-),女,浙江台州人,硕士生。
徐红蕾,教授,硕士生导师,Email:xfhl2000@163.com。

